Parenterální léčivé přípravky – správné ředění a podávání
Souhrn:
Murínová I, Cihlo J, Dvířková L, Kroutilová K, Langmaierová K, Linhartová A, Polášková L, Vedrová J, Vodička M. Parenterální léčivé pří-pravky – správné ředění a podávání. Remedia 2019; 29: 300–304.
Správné ředění a bezpečné podávání parenterálních léčivých přípravků je základním předpokladem pro zajištění maximální účinnosti a bezpečnosti terapie. Předložený text shrnuje dosavadní výstupy činnosti Pracovní skupiny pro ředění a podávání léčiv ČOSKF ČLS JEP. Těmito výstupy jsou jednak přehledná tabulka sumarizující předepsané postupy ředění a podávání parenterálních léčivých přípravků, jednak výsledky projektu zaměřeného na kritické zhodnocení důvodů, proč některé přípravky mají být dle souhrnu údajů o přípravku (SPC) ředěny výhradně fyziologickým roztokem nebo výhradně 5% glukózou. V článku je poukázáno na data, která rozšiřují u některých léčivých přípravků spektrum nosných roztoků nad rámec SPC, jejichž použití v klinické praxi je však off label postupem. Současně je dis-kutována problematika přenosu informací ze zahraničních stabilitních studií do podmínek praxe v České republice.
Summary:
Murinova I, Cihlo J, Dvirkova L, Kroutilova K, Langmaierova K, Linhartova A, Polaskova L, Vedrova J, Vodicka M. Parenteral medicinal products – right dilution and administration. Remedia 2019; 29: 300–304.
Right dilution and safe administration of parenteral medicinal products are basic prerequisites for ensuring maximum effectiveness and safety of therapy. The presented text summarizes the current results of the work of the Drug Dosing and Drug Administration Working Group ČOSKF ČLS JEP. These outputs are 1) a table summarizing the prescribed procedures of dilution and administration for parenteral medicinal products, and 2) the results of the project aimed at critical assessment of the reasons why certain products should be diluted exclusively with either physiological saline or 5% glucose according to the SPC. The article shows data that extend the range of carrier solutions beyond SPC for some medicinal products but whose use is off label in clinical practice. At the same time, the question of in-formation transfer from foreign stabilization studies into local practice in the Czech Republic is discussed.
Key words: drug administration – drug dilution – parenteral medicinal products – clinical pharmacy.
Autoři:
PharmDr. Irena Murínová1,2; PharmDr. Jan Cihlo, Ph.D.3; PharmDr. Lenka Dvířková4; Mgr. Kateřina Kroutilová5; PharmDr. Kateřina Langmaierová2,6; PharmDr. Alena Linhartová7; Mgr. Lucie Polášková1; Mgr. Jana Vedrová8; Mgr. Martin Vodička9
1 Oddělení klinické farmacie, ÚVN Praha; 2 Ústav aplikované farmacie, Farmaceutická fakulta VFU, Brno; 3 Oddělení přípravy cytostatik, Lékárna Multiscan Pharma, s.r.o., Pardubice; 4 Klinická farmacie Bory, Lékárna, FN Plzeň; 5 Pracoviště klinické farmacie, Ústavní lékárna, Masarykův onkologický ústav Brno; 6 Oddělení klinické farmacie KZ, a.s., – pracoviště Nemocnice Teplice; 7 Oddělení klinické farmacie, Lékárna, TN Praha; 8 Oddělení klinické farmacie, Ústav hematologie a krevní transfuze Praha; 9 Pracoviště klinické farmacie, Lékárna, Krajská nemocnice T. Bati Zlín
Úvod
Řada parenterálních léčivých přípravků (LP) musí být před
podáním pacientovi upravena. Správné ředění a podávání těchto léčiv je
základním předpokladem pro zajištění maximální účinnosti a bezpečnosti
terapie.
Jedním z úkolů
klinického farmaceuta, jako člena multidisciplinárního týmu zdravotníků, je
zajistit správné (tj. účinné, a přitom bezpečné a účelné)
podávání léčiv. Česká odborná společnost klinické farmacie ČLS JEP (dále jen ČOSKF)
proto podpořila vznik pracovní skupiny, která se této problematice věnuje.
Cílem Pracovní skupiny pro ředění a podávání léčiv (dále jen PS ŘPL) je
systematicky se zabývat touto problematikou a ve spolupráci
s dalšími farmaceutickými odborníky postupně vytvářet materiály shrnující
hlavní zásady zacházení s parenterálními LP v klinické praxi [1].
Tabulka ředění a podávání léčiv
Pracovní skupina pro ředění a podávání léčiv vznikla
v prosinci 2016 a jejím prvním počinem bylo zpracování materiálu
k ředění a způsobu podávání LP [2]. Dokument obsahuje informace
o tom, zda je možné podat přípravek bolusově, jakými roztoky jej lze
rekonstituovat/ředit (0,9% roztok chloridu sodného, tj. tzv. fyziologický
roztok [FR], 5% glukóza [G5] či voda na injekci [Aqua pro injectione, Aq.
pro inj.]), postup rekonstituce/ředění, informace o délce aplikace injekce
či infuze a o stabilitě přípravku po otevření/naředění.
Informace o inkompatibilitách tabulka v současné době neobsahuje.
Zdrojem dat jsou hlavně souhrny údajů o přípravcích (Summary of Product
Characteristics, SPC) [3], případně informace z publikace Handbook on
injectable drugs [4] (údaj označen v tabulce přídavkem „Trissel“). Zatím
je tabulka dostupná pouze v pdf formátu, v průběhu tohoto roku
se počítá i s online verzí s vyhledáváním.
Tabulka byla předložena široké zdravotnické veřejnosti
a prezentována na různých odborných fórech. Je v plánu materiál
pravidelně aktualizovat (jednou za dva roky) a podle potřeby
rozšiřovat. Nyní je zpracováno 115 léčivých látek ve 156 LP (březen
2019).
Limitací tabulky je skutečnost, že držitelé rozhodnutí
o registraci LP (Marketing Authorisation Holder, dále jen MAH) ani Státní
ústav pro kontrolu léčiv zatím otevřeně neinformují odbornou veřejnost
o změnách v článku 6 SPC, Farmaceutické údaje (např. přidání dalšího
nosného roztoku, inkompatibility atd.). V možnostech PS ŘPL tak není tyto
informace získat dříve než během aktualizace.
Ředění některých léčivých přípravků výhradně jen jedním
nosným roztokem?
Jedním z dalších kroků PS ŘPL bylo vyřešit, proč lze
dle SPC ředit některé přípravky výhradně jen jedním nosným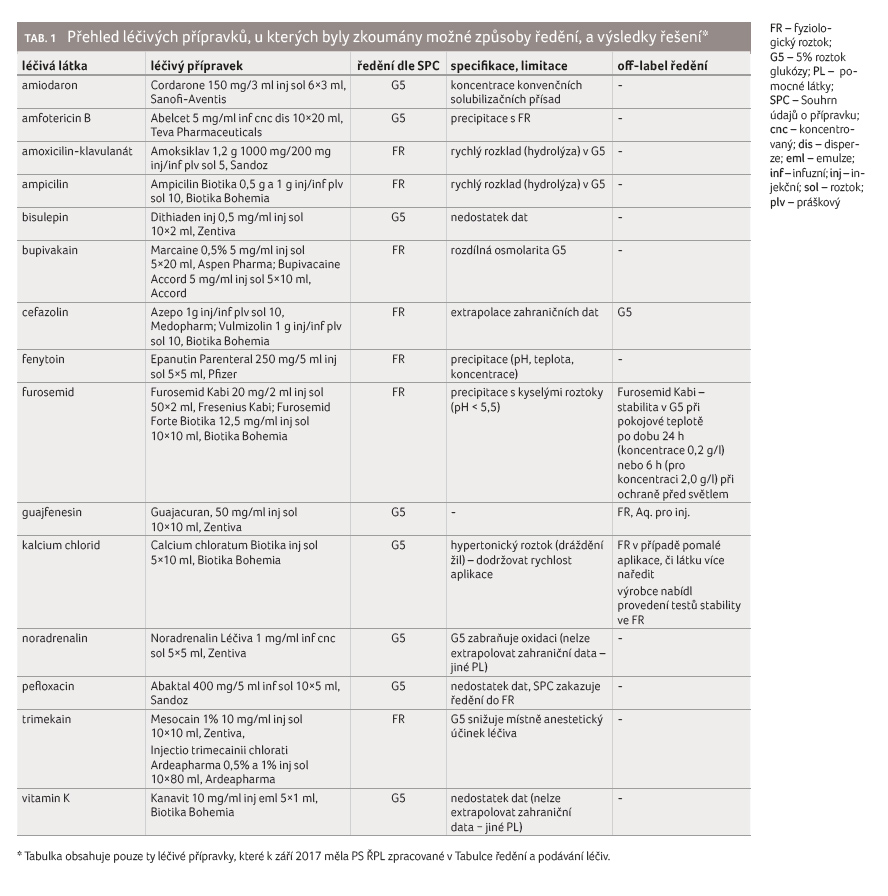 roztokem (FR nebo
G5). Při zpracování této problematiky si členové PS ŘPL položili otázku,
do jaké míry je nutné takové omezení dodržovat, respektive zda je
podloženo konkrétními důvody (např. inkompatibilita/nestabilita v jiných
roztocích), nebo zda je pouze důsledkem nedostatku údajů o ředění jinými
vehikuly v rámci předregistračních studií. Vedlejším důvodem hledání byla
též snaha o zjednodušení práce zdravotnickému personálu tak, aby nebylo
třeba pamatovat si rozsáhlou řadu LP, které je nutné, na rozdíl
od majoritního ředění do FR, upravovat jinak. Cílem byla i snaha
o eliminaci chyb při preskripci LP ve zdravotnických zařízeních.
Přehled dotčených přípravků uvádí tabulka 1.
roztokem (FR nebo
G5). Při zpracování této problematiky si členové PS ŘPL položili otázku,
do jaké míry je nutné takové omezení dodržovat, respektive zda je
podloženo konkrétními důvody (např. inkompatibilita/nestabilita v jiných
roztocích), nebo zda je pouze důsledkem nedostatku údajů o ředění jinými
vehikuly v rámci předregistračních studií. Vedlejším důvodem hledání byla
též snaha o zjednodušení práce zdravotnickému personálu tak, aby nebylo
třeba pamatovat si rozsáhlou řadu LP, které je nutné, na rozdíl
od majoritního ředění do FR, upravovat jinak. Cílem byla i snaha
o eliminaci chyb při preskripci LP ve zdravotnických zařízeních.
Přehled dotčených přípravků uvádí tabulka 1.
Metodika práce
Potřebné informace byly získány formou literární rešerše či
přímo od MAH. V rámci rešerše byly postupně procházeny tyto zdroje:
- SPC léčivých přípravků (schválené v ČR, EMA, FDA),
- knihy Handbook on injectable drugs [4], Injectable Drugs Guide [5] a Minimum Infusion Volumes [6],
- databáze Stabilis [7], Lexi‑comp [8], UpToDate [9], Medscape − oddíl Drugs & Diseases [10],
- ASHP’s Interactive Handbook on Injectable Drugs (mobilní aplikace) [11],
- bibliografická databáze PubMed (vyhledávací strategie: („anglický název léčivé látky“[Mesh]) AND (((((((„Drug Stability“[Mesh]) OR „Drug Storage“[Mesh]) OR „Adsorption"[Mesh]) OR „Drug Packaging“[Mesh]) OR „Drug Incompatibility“[Mesh]) OR „Drug Compounding“[Mesh]) OR „Solutions“[Mesh]).
U 16 z 20 sledovaných LP se při prohledávání
literárních zdrojů podařilo najít odpověď na otázku a argumentaci pro
to, proč je nutné ředit předepsaným vehikulem, nebo naopak proč je možné použít
(s vědomím postupu off‑label) i jiný nosný roztok. Pouze u čtyř
LP se nepodařilo najít dostatek informací, kterými by bylo možno výhradní
doporučení pro volbu vehikula potvrdit nebo vyvrátit. Vždy jde o léčiva
používaná dlouhou dobu, k jejichž registraci dříve stačilo mnohem méně
dokumentace.
Ve 12 z 18 případů (u dvou LP nebyl
dotaz vznesen) nepřinesla spolehlivou odpověď ani komunikace s MAH.
Naproti tomu MAH u dvou LP předložili data i pro použití jiného
rozpouštědla (Zentiva – off‑label ředění guajfenesinu pomocí FR; Fresenius
Kabi – off‑label ředění furosemidu pomocí G5 – podrobněji viz níže).
Farmaceutická firma Biotika Bohemia nabídla provedení stabilitních testů
u svých LP, na které byla dotazována.
Zásadním zjištěním vyplývajícím z rešerše zahraniční
literatury je fakt, že tato data nelze bezvýhradně extrapolovat
do podmínek klinické praxe v ČR. Důvodem je použití LP s jinými
koncentracemi léčivých látek, jinými pomocnými látkami (dále jen PL) nebo
jejich množství, příp. neuvedení PL v provedených studiích, chybějí údaje
o pH roztoků, často jsou používány i jiné dávky/koncentrace léčiv v klinické
praxi.
Pozoruhodností některých SPC bylo nalezení informace, že lze
dané LP ředit „do běžně používaných základních infuzních roztoků“, aniž by
byla uvedena bližší specifikace, které konkrétní nosné roztoky jsou tímto
myšleny. Odpověď PS ŘPL nepředložili ani MAH.
Výsledky
Amiodaron
Cordarone inj sol patří mezi tzv. konvenční přípravky
s amiodaronem, tj. přípravky obsahující pomocné látky (PL) benzylalkohol
a polysorbát 80. Souhrn údajů o přípravku předepisuje ředit tento
přípravek výhradně pomocí G5.
Literární údaje o kompatibilitě amiodaronu s FR
jsou konfliktní. Pokud jsou v přípravku využity konvenční solubilizační
přísady, pak zřejmě záleží na jejich koncentraci v roztoku
po naředění [4]. Bez provedení potřebných upřesňujících zkoušek je tedy nutné
dodržovat doporučení výrobce a ředit tento LP výhradně pomocí G5.
Poznámka: Novější formule, které neobsahují konvenční
kosolventy, jsou kompatibilní jak s G5, tak s FR [10]. V ČR
bohužel nejsou v současné době dostupné.
Amfotericin B
V ČR je registrován pouze jeden LP s obsahem
amfotericinu B, a to ve formě komplexu lipidů (Amphotericin B Lipid
Complex, ABLC).
Souhrn údajů o přípravku obsahuje poučení, že LP nesmí
být ředěn FR či mísen s jinými elektrolyty, neboť kompatibilita přípravku
nebyla s těmito látkami stanovena [3,12]. V literatuře lze však
nalézt studii zkoumající kompatibilitu ABLC při podání Y‑spojkou s dalšími
LP, u nichž byl jako nosný roztok použit FR [4]. Výsledkem byla
inkompatibilita ve formě precipitace roztoků. Další zdroje informací
o inkompatibilitě ABLC s FR se přenesly na další lékové formy
amfotericinu B (tj. konvenční, lipozomální) [4,5,7].
Jasnější výsledky neposkytla ani databáze Medline – zde
se objevila limitace ve formě nemožnosti jednoznačně určit, o kterou
lékovou formu amfotericinu B se jedná či zda byly pro sledování kompatibility
použity jiné formulace než ABLC. Jako příklad lze uvést neregistrovaný LP
Fungisone (konvenční amfotericin B), kdy pro nebulizaci či instilaci
do močového měchýře lze použít Aq. pro inj.
Závěrem lze shrnout, že pro riziko precipitace ve FR či
v jiných elektrolytech je jediným možným nosným roztokem pro ABLC právě
G5.
Amoxicilin‑klavulanát
Dle SPC LP Amoksiklav 1,2 g
inj/inf plv sol byla chemická a fyzikální stabilita připravených roztoků
prokázána v přípravku Aq. pro inj. a FR po dobu 4 hodin při
pokojové teplotě [3]. Snížená stabilita byla doložena v roztocích
obsahujících glukózu, dextran nebo hydrogenuhličitan [3]. Toto potvrzují
i další zdroje [4,5,7,13,14]. Amoxicilin‑klavulanát podléhá v roztoku
rychlejší degradaci (hydrolýza) ve srovnání se samotným amoxicilinem.
Stabilita roztoku také souvisí s výslednou koncentrací, kdy za méně
stabilní jsou považovány vyšší koncentrace [5].
V souvislosti s pH je klavulanát stabilnější
v neutrálním prostředí, proto v G5 dochází k rychlejší degradaci
[15].
Stabilita v G5 je udávána po dobu 30 minut [4,5].
V nemocniční praxi je takovéto podání časově i logisticky náročné
a nelze vyloučit prodlevu od naředění roztoku a následného
podání spojeného s rizikem rozkladu antibiotika a nižšího léčebného
efektu. Takto upravený LP by bylo možné podat ihned po naředění
intravenózním (i.v.) bolusem (v průběhu 3−4 min.), což ale není
standardním postupem podání antibiotik v klinické praxi. Z těchto
důvodů nelze ředění tohoto LP do G5 doporučit.
Ampicilin
Sodná sůl ampicilinu (dále jen ampicilin) je na českém
trhu dostupná v podobě prášku pro injekční/infuzní roztok, který
neobsahuje PL, a před podáním je potřeba jej rekonstituovat v Aq. pro
inj. (intramuskulární podání) nebo ve FR (intravenózní podání) [3].
Výsledné pH roztoku se pak v závislosti na koncentraci ampicilinu
a na použitém rozpouštědle pohybuje v rozmezí 8−10 [4].
Stabilita ampicilinu v roztoku je dána zejména těmito faktory: koncentrací
účinné látky, a to nepřímo úměrně; teplotou, kdy se vzrůstající teplotou
klesá stabilita v důsledku rychlejší degradace (méně než 0 °C se rovněž nedoporučuje);
hodnota pH ampicilinu v roztoku se má optimálně pohybovat kolem 7 [4].
Poslední zásadní determinantou stability je použitý nosný roztok. Výsledky
stabilitních studií provedených s G5 a FR lze shrnout do závěru,
že hydrolytické degradační procesy ampicilinu v G5 jsou takového rozsahu
a začínají prakticky ihned po naředění, že se jedná
o inkompatibilitu [4].
Souhrn údajů o přípravku zahraničního ampicilinu (též
prášek pro injekční/infuzní roztok bez PL) umožňuje jeho ředění pomocí G5
a deklaruje stabilitu po dobu jedné hodiny při pokojové teplotě
a koncentraci ampicilinu 10−20 mg/ml
[16]. Další zdroj uvádí inkompatibilitu s G5, ale připouští kompatibilitu
při podání výsledného roztoku rychlou infuzí během 3−4 minut [5]. Je třeba si
uvědomit, jaké koncentrace ampicilinu se pacientům podávají (jednotlivá dávka
250 mg až 3 g), obvyklé cesty
a rychlosti podání (intramuskulárně, intravenózní bolus, intravenózní
infuze), a dále je třeba vzít v potaz, při jaké teplotě se roztok
podává (25 °C).
S ohledem na výše zmíněné determinanty, na studie provedené
s ampicilinem v G5 a FR, na další zahraniční zdroje
a na logistickou náročnost v nemocniční praxi byl učiněn závěr,
že ředění ampicilinu do G5 je rizikové a není doporučováno vzhledem
k okamžitému nástupu rozkladných procesů s rizikem snížení
terapeutického efektu, obdobně jako u amoxicilin‑klavulanátu [3−5,7−10].
Bisulepin
Dithiaden inj sol lze ředit dle SPC pouze pomocí G5 [3].
V dostupných databázích a zdrojích nebyly o tomto LP nalezeny
žádné informace. Při dotazování MAH se nepodařilo získat žádná doplňující data
o ředění jinými infuzními roztoky, protože se jedná o produkt, který
je již mnoho let na trhu a při registraci byl pravděpodobně testován
pouze jen v G5 [17]. Nové stabilitní studie a hodnocení kompatibility
se neplánují.
Bupivakain
V SPC přípravků registrovaných v ČR je bupivakain
uveden pro ředění jen FR [3]. V zahraničí jsou dostupné LP ve více
koncentracích, proto se tamní literatura o ředění bupivakainu nezmiňuje
[8,9,18]. Výjimkou je zmínka o stabilitě roztoků v elastomerické
pumpě, ve které výrobce pumpy deklaruje stabilitu roztoku
o koncentraci 0,6 mg/ml
ve FR i G5 [4]. Dle společnosti Aspen Pharma se G5 liší svou
osmolaritou od FR, a z tohoto důvodu se nedoporučuje použít
k ředění G5 [19]. Na základě těchto informací nelze doporučit použití
jiného roztoku než FR.
Cefazolin
Rekonstituovaný cefazolin pro injekční a infuzní podání
lze dle SPC konkrétních LP ředit pomocí FR, směsí FR a G5 nebo roztokem
Ringer laktátu [3]. Jelikož pH výsledného roztoku může být ovlivněno parametry
úpravy (dávka, objem či pH nosného roztoku), není dle názoru PS ŘPL
v českých SPC příprava do G5 jmenovitě uvedena. Zahraniční literatura
tuto možnost nicméně připouští [7,11,20]. Jelikož je v ČR cefazolin
dostupný rovněž ve formě prachové substance bez dalších PL, lze provést
extrapolaci těchto dat do našich podmínek. Mimo ČR existují navíc LP, kde
je glukóza v různých koncentracích jako nosný roztok povolena nebo je
přímo součástí dvoukomorového vaku „Duplex“ společnosti B. Braun [21,22].
Fenytoin
Hlavní determinantou stability roztoku sodné soli fenytoinu
je pH, potažmo koncentrace. Dalším určujícím faktorem je teplota. Při poklesu
pH pod 11,5 anebo při snížené teplotě dochází k precipitaci léčiva
z roztoku. Pokles hodnoty pH může být způsoben jednak použitím
kyselého rozpouštědla (např. G5), jednak naředěním na nízkou koncentraci.
Doba, za kterou dojde k precipitaci, je přitom variabilní
a obtížně predikovatelná [11]. Použití vhodného, resp. co nejméně
rizikového vehikula (FR) je tedy jedním ze základních opatření, kterými
lze riziko precipitace omezit.
Furosemid
Souhrny údajů o LP dostupných v ČR nedoporučují
z důvodu rizika precipitace mísení se silně kyselými roztoky (s pH
nižším než 5,5) [3]. Konkrétně je povoleno ředění s neutrálními
a slabě alkalickými roztoky s hodnotou pH v rozmezí 7−10 [3]; pH
G5 je uváděno v rozmezí 3,5−5,5 [3]. Vědecké databáze nicméně připouštějí
ředění G5 s kontrolou a úpravou pH výsledného roztoku, což je
v klinické praxi nereálné [4].
Vstřícným krokem je poskytnutí rozšířených stabilitních dat
přípravku Furosemid Kabi, ke kterému byly PS ŘPL předloženy údaje
o stabilitě v G5 při pokojové teplotě po dobu 24 hodin
(koncentrace 0,2 g/l)
nebo 6 hodin (pro koncentraci 2,0 g/l)
při ochraně před světlem [23].
Guajfenesin
Data o parenterálním podávání guajfenesinu jsou velmi
omezená (více používány jsou spíše perorální formy); mimo ČR je i.v. forma
využívána ve veterinární medicíně (svalové relaxans užívané v úvodu
anestezie u koní). U veterinárního použití byly testovány jako možný
solvent Aq. pro inj., FR nebo G5. Ideálním roztokem byla v tomto případě
Aq. pro inj. [24]. Guajfenesin je relativně stabilní v prostředí kyselém
(ředěná kyselina chlorovodíková), zásaditém (ředěný hydroxid sodný), relativně
stabilní v prostředí zředěného peroxidu [25].
Na základě zjištěných dat byl vznesen dotaz na MAH
na možné použití a stabilitu jiného nosného roztoku než G5. Dle
informací zaslaných PS ŘPL byla sledována kompatibilita také s FR
a Aq. pro inj. a byly monitorovány tyto
parametry − vizuální hodnocení, hodnota pH, obsah guajfenesinu,
čistota TLC (chromatografie na tenké vrstvě). Porovnávána byla data
po 6 hodinách od naředění a potom po jednom týdnu. Závěrem
bylo konstatováno, že nedošlo k výrazným změnám sledovaných parametrů,
a je tedy možné připustit kompatibilitu s FR (off‑label). Zároveň
však MAH upozornil na informace v aktuálně platném SPC (tj. lze ředit
pouze do G5) [17].
Kalcium chlorid
Dostupné informace i obecné fyzikální a chemické
znalosti potvrzují kompatibilitu dostupných injekčních roztoků chloridu
vápenatého s FR i G5 [7]. Kalcium jako prvek je chemicky stabilní.
Výrobce LP Calcium chloratum Biotika inj sol v SPC
uvádí, že intravenózní vápníkové přípravky dráždí žíly, proto je nutno je ředit
50–100 ml G5 [3]. Tato
informace je v konfliktu s vlastním SPC, který doporučuje standardní
podávání dospělým pacientům velmi pomalou intravenózní injekcí po dobu
3−10 minut.
Calcium chloratum Biotika inj sol je hypertonický roztok
(tedy dráždí žíly). Pro bezpečné podání je tedy významné dodržení rychlosti
aplikace. Protože G5 je vzhledem k FR méně osmolární, nelze považovat FR
z hlediska dráždění žil za roztok zcela rovnocenný G5. Ten je
bezpečnější a PS ŘPL se domnívá, že v případě ředění do FR je
potřeba zvolit pomalejší rychlost infuze, respektive látku více naředit.
Výrobce nabídl provedení testů stability ve FR.
Noradrenalin
V SPC LP Noradrenalin Léčiva inf cnc sol je doporučeno
ředit léčivo pomocí G5, příp. G5 ve FR, kde glukóza zabraňuje oxidaci,
která by snížila účinnost přípravku [3]. Stejná informace se vyskytuje
i ve většině použitých zdrojů [4,5,10]. Mezi determinanty rozkladu patří
zejména alkalické pH, dále světlo, teplo, kyslík a stopové prvky (např.
měď, železo). Současně však byly nalezeny studie, které stabilitu noradrenalinu
ve FR dokládaly [26−28]. Například Tremblay a kol. prezentovali
stabilitu noradrenalinu po naředění G5 nebo FR až po sedm dnů při
koncentracích 4, 16, 64 µg/ml,
uchovávání v PVC na světle a při pokojové teplotě [27]. Walker
a kol. došli k závěru, že jediným významným faktorem ovlivňujícím
stabilitu noradrenalinu v G5 nebo FR je světlo, zatímco teplota a nosný
roztok nemají na stabilitu žádný vliv [28]. Problémem přenosu těchto
výsledků ze zahraničí do naší klinické praxe je ovšem to, že
ve studiích byly použity LP s jinými PL, než jsou ty, které obsahuje
u nás obchodovaný LP, příp. PL nebyly vůbec uvedeny. Další limitací je, že
v běžné klinické praxi v ČR se používají jiné (vyšší) koncentrace
noradrenalinu než koncentrace testované v zahraničních studiích.
Pefloxacin
V SPC LP přípravku Abaktal se připouští ředění pouze
pomocí G5 [3]. Přímo je pak uvedeno, že nesmí být ředěn FR. Literární zdroje
neposkytují o fyzikální a chemické stabilitě pefloxacinu ve FR
informace natolik dostatečné, aby umožňovaly modifikovat v praxi postup
doporučený MAH.
Trimekain
Trimekain je českou specialitou. Informace o této účinné
látce tak nejsou v zahraničních zdrojích k dispozici. Dle SPC obou
MAH (Zentiva, Ardeapharma) se připouští možnost ředění pouze pomocí FR [3].
V článku 4.5 SPC (Interakce s jinými léčivými přípravky a jiné
formy interakce) je uvedeno, že glukóza snižuje místně anestetický účinek
léčiva. Na základě výše uvedených informací nelze doporučit použití jiného
nosného roztoku než FR.
Vitamin K
Parenterální vitamin K (fytomenadion) je na českém
trhu dostupný pouze ve formě injekční emulze. Dle SPC je potřeba tuto
emulzi před intravenózním podáním ředit pomocí Aq. pro inj. nebo G5 [3].
Pro intramuskulární podání není potřeba emulzi upravovat. Zahraniční zdroje
možnost ředění FR připouštějí, nicméně jejich data vycházejí z LP
obsahujících jiné PL, než které jsou v LP registrovaném v ČR
[4,5,29]. I přes shodnou koncentraci účinné látky ve všech LP nelze
tato data převzít a učinit závěr, že Kanavit je možné ředit pomocí FR.
Závěr
Po kritickém zhodnocení dostupných informací dospěla
PS ŘPL u studovaných LP k následujícím závěrům:
Z důvodu inkompatibility (precipitace, nestabilita
v daném roztoku, snížení účinnosti léčiva) lze podávat LP s obsahem
amiodaronu, amfotericinu B, bupivakainu, fenytoinu a trimekainu pouze
v roztocích uvedených v SPC.
I přes data podporující ředění pomocí G5 nelze tento
postup doporučit pro amoxicilin‑klavulanát a ampicilin, jelikož tyto
roztoky vykazují omezenou stabilitu – dochází k rychlému rozkladu
účinných látek a k riziku snížení terapeutického efektu.
Nelze extrapolovat zahraniční data potvrzující kompatibilitu
noradrenalinu a vitaminu K v jiných nosných roztocích, než které
doporučují české SPC, neboť tyto LP mají jiné složení (jiné PL, rozdílné
koncentrace léčivých látek používaných v klinické praxi).
S vědomím off‑label postupu lze u čtyř LP (kalcium
chlorid, guajfenesin, furosemid, cefazolin; u některých z nich pouze
za určitých okolností) použít i jiný nosný roztok, než který udává
SPC.
Seznam použité literatury
- [1] ČOSKF, [Online]. Available: http://www.coskf.cz/spolecnost/pracovni skupiny/pracovni skupina pro redeni a podavani leciv/. [Přístup získán 3. 1. 2019].
- [2] ČOSKF, [Online]. Available: https://www.coskf.cz/spolecnost/pracovni skupiny/pracovni skupina pro redeni a podavani leciv/tabulka redeni a podavani leciv/. [Přístup získán 3. 1. 2019].
- [3] SÚKL, Databáze léků, [Online]. Available: http://www.sukl.cz/modules/medication/search.php. [Přístup získán 3. 1. 2019].
- [4] Trissel L. Handbook on injectable drugs, 16th edition, 2011.
- [5] Gray J, Wright V, Goodey A, et al. Injectable drugs guide, Royal Pharmaceutical Society of Great Britain, 2011.
- [6] Minimum infusion volumes, For fluid restricted critically ill patients, Fourth Edition. United Kingdom Clinical Pharmacy Association, December 2012.
- [7] Stabilis, [Online]. Available: https://www.stabilis.org/index.php?codeLangue=CZ cz. [Přístup získán 3. 1. 2019].
- [8] Lexicomp, Wolters Kluwer Health, [Online]. Available: https://online.lexi.com/lco/action/home. [Přístup získán 21. 1. 2019].
- [9] UpToDate, Wolters Kluwer Health, [Online]. Available: https://www uptodate com.ezproxy.is.cuni.cz/contents/search. [Přístup získán 3. 1. 2019].
- [10] Medscape, Drugs&Diseases, WebMD, [Online]. Available: https://reference.medscape.com. [Přístup získán 3. 1. 2019].
- [11] ASHP’s Interactive Handbook on Injectable Drugs (mobilní aplikace), American Society of Health System Pharmacists, 2018.
- [12] Teva Pharmaceuticals, SPC Abelcet, [Online]. Available: https://www.tevauk.com/mediafile/id/42339.pdf. [Přístup získán 21. 1. 2019].
- [13] Carlier M, Verstraete A, De Waele J, et al. Stability of amoxicillin and amoxicillin/clavulanic acid reconstituted in isotonic saline. J Chemother 2017; 29: 54−56.
- [14] Vahdat L, Sunderland V. Kinetics of amoxicillin and clavulanate degradation alone and in combination in aqueous solution under frozen conditions. Int J Pharm 2007; 342: 95−104.
- [15] Bersanetti P, Almeida R, Barboza M, et al. Kinetic studies on clavulanic acid degradation. Biochem Eng J 2005; 23: 31−36.
- [16] FRESENIUS KABI, Alphabetical Product Listing, [Online]. Available: http://products.fresenius kabi.us/product 6.html. [Přístup získán 11. 1. 2019].
- [17] Hányš R. Interviewee, Sanofi Aventis. [Interview]. 19. 1. 2018.
- [18] FDA, U.S. Food and Drug Administration. [Online]. Available: https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/ 016964s077lbl.pdf. [Přístup získán 21. 2. 2019].
- [19] AspenPharma, Interviewee, [Interview]. 25. 4. 2018.
- [20] Galanti L, Hecq J, Vanbeckbergen D, et al. Long term stability of cefuroxime and cefazolin sodium in intravenous infusions. J Clin Pharm Ther 1996; 21: 185−189.
- [21] Braun B. 1G Cefazolin for Injection USP and Dextrose Injection USP. [Online]. Available: https://www.bbraunusa.com/en/products/b0/1g cefazolin forinjectionuspanddextroseinjectionusp.html. [Přístup získán 28. 2. 2019].
- [22] Drugs.com, Ancef. [Online]. Available: https://www.drugs.com/pro/ancef.html#s 34069 5. [Přístup získán 28. 2. 2019].
- [23] Veselý M. Interviewee, Fresenius Kabi. [Interview]. 13. 8. 2018.
- [24] Grandy J, McDonell W. Evaluation of concentrated solutions of guaifenesin for equine anesthesia. J Am Vet Med Assoc 1980; 176: 619−622.
- [25] Shervington L, Shervington A. Guaifenesin. Analytical Profiles of Drug Substances and Excipients. San Diego, Academic Press 1998; 25: 121−164.
- [26] Baumgartner T, Knudsen A, Dunn A, et al. Norepinephrine stability in saline solutions. Hosp Pharm 1988; 23: 49−59.
- [27] Tremblay M, Lessard M, Trépanier C, et al. Stability of Norepinephrine Infusions Prepared in Dextrose and Normal Saline Solutions. Can J Anaesth 2008; 55: 163−167.
- [28] Walker S, Law S, Garland J, et al. Stability of norepinephrine solutions in normal saline and 5% dextrose in water. Can J Hosp Pharm 2010; 63: 113−118.
- [29] FDA, DRUGS, AQUAMEPHYTON. [Online]. Available: https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/012223s041lbl.pdf. [Přístup získán 11. 1. 2019].