Přehled lékových interakcí specifických léků používaných u roztroušené sklerózy
Souhrn:
Suchopár J, Prokeš M, Suchopár Š. Přehled lékových interakcí specifických léků používaných u roztroušené sklerózy. Remedia 2022; 32: 179–190.
Od roku 2015 bylo registrováno dalších devět léčivých látek pro terapii roztroušené sklerózy. Interakční potenciál těchto léčiv je velmi rozdílný. Jeho znalost může napomoci k bezpečnější terapii pacientů. S lékovými interakcemi souvisejí také vymývací periody, které je nezbytné dodržet při přechodu z jednoho léčiva na druhé. Nelze rovněž pominout bezpečnost a účinnost vakcinace pacientů léčených přípravky používanými k terapii roztroušené sklerózy, neboť řada těchto léčiv má imunosupresivní účinek nebo jejich podávání vede k depleci lymfocytů. Přehled uvádí stupeň poznání lékových interakcí léčiv používaných k terapii roztroušené sklerózy k březnu 2022.
Summary:
Suchopar J, Prokes M, Suchopar S. Overview of drug interactions of specific drugs used in the treatment of multiple sclerosis. Remedia 2022; 32: 179–190.
Since 2015, another 9 drugs have been registered for treating multiple sclerosis. The interaction potential of these drugs is very different. However, the knowledge may help to treat patients safer. Drug interactions are also associated with washout periods, which must be observed when switching from one drug to another. The safety and efficacy of vaccination in patients treated with drugs for multiple sclerosis cannot be overlooked, as many of them have an immunosuppressive effect or lead to lymphocyte depletion. The review shows the degree of knowledge of drug interactions of drugs for multiple sclerosis as of March 2022.
Key words: multiple sclerosis – drug interactions – peginterferon β1a – cladribine – ocrelizumab – ofatumumab – siponimod – ozanimod – ponesimod – diroximel fumarate – monomethyl fumarate.
Úvod
V roce 2015 jsme napsali, že se
paleta léčiv používaných při terapii roztroušené sklerózy
„v poslední době rozšířila“. Již v té
době bylo zřejmé, že tento trend bude dále pokračovat, neboť
řada potenciálních léčiv se nacházela ve fázi II nebo III
klinického hodnocení. Tehdy jsme popsali lékové interakce celkem
devíti léčivých látek používaných při terapii roztroušené
sklerózy [1]. Aktuálně je v klinické praxi používán již
dvojnásobný počet léčiv (tab. 1) v indikaci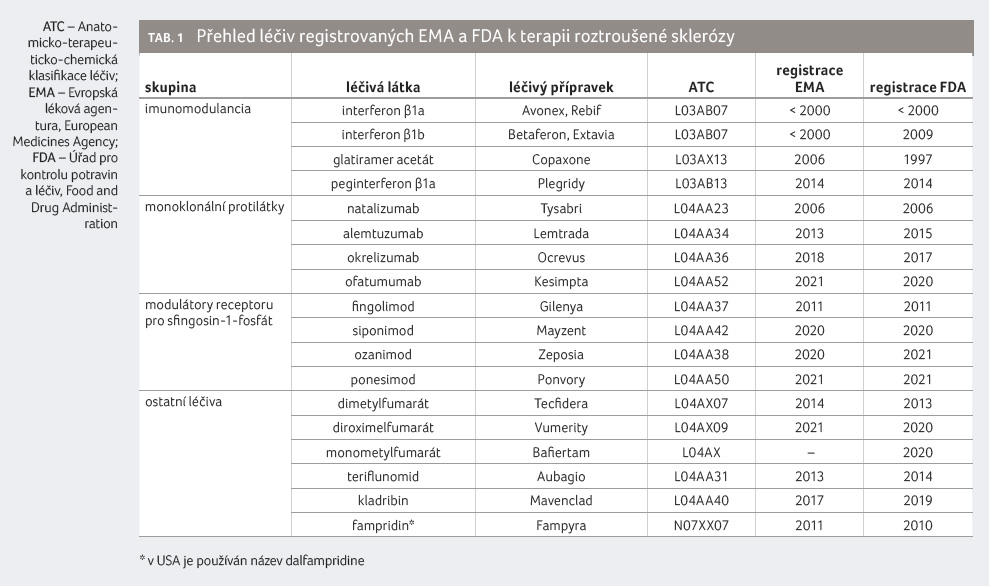 roztroušená skleróza, a proto nastal vhodný čas
na předložení aktualizovaných informací o jejich
lékových interakcích.
roztroušená skleróza, a proto nastal vhodný čas
na předložení aktualizovaných informací o jejich
lékových interakcích.
Z uvedených devíti nových léčiv
bylo osm registrováno v Evropské unii a ve Spojených
státech amerických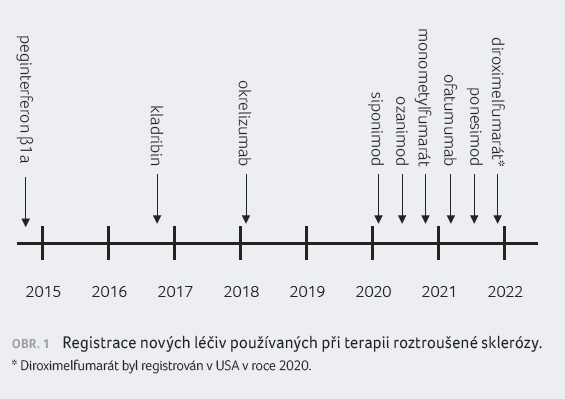 (peginterferon β1a, kladribin, okrelizumab,
ofatumumab, siponimod, ozanimod, ponesimod a diroximelfumarát)
a jedna zatím byla registrována pouze v USA
(monometylfumarát), obr. 1. Celkem šest léčivých
přípravků se podává perorálně a tři se pak aplikují
parenterálně. Peginterferon β1a byl logickým vyústěním hledání
terapie stejně účinné jako interferon β1a umožňující
prodloužení intervalu mezi dávkami, což může omezit počet dnů
s flu like syndromem. Kladribin, jehož parenterální
aplikace byla již řadu let předtím používána k terapii
trichocelulární leukemie, navozuje po intermitentním
perorálním podávání „resetování“ imunokompetentních
buněk. Je proto určen k terapii relabující roztroušené
sklerózy, kde se podává ve dvou pulzech. Jeden pulz
představuje užívání tablet v jedné denní dávce po dobu
prvních čtyř až pěti dnů prvního a druhého měsíce
léčebného roku, tento léčebný cyklus se zopakuje ve druhém
léčebném roce.
(peginterferon β1a, kladribin, okrelizumab,
ofatumumab, siponimod, ozanimod, ponesimod a diroximelfumarát)
a jedna zatím byla registrována pouze v USA
(monometylfumarát), obr. 1. Celkem šest léčivých
přípravků se podává perorálně a tři se pak aplikují
parenterálně. Peginterferon β1a byl logickým vyústěním hledání
terapie stejně účinné jako interferon β1a umožňující
prodloužení intervalu mezi dávkami, což může omezit počet dnů
s flu like syndromem. Kladribin, jehož parenterální
aplikace byla již řadu let předtím používána k terapii
trichocelulární leukemie, navozuje po intermitentním
perorálním podávání „resetování“ imunokompetentních
buněk. Je proto určen k terapii relabující roztroušené
sklerózy, kde se podává ve dvou pulzech. Jeden pulz
představuje užívání tablet v jedné denní dávce po dobu
prvních čtyř až pěti dnů prvního a druhého měsíce
léčebného roku, tento léčebný cyklus se zopakuje ve druhém
léčebném roce.
Z perorálních léčiv se paleta modulátorů receptoru pro sfingosin 1 fosfát (rS1P) rozšířila o tři nová léčiva (siponimod, ozanimod a ponesimod), což jistě souvisí se snahou nalézt co nejselektivněji působící terapii vzhledem k tomu, že rS1P je známo celkem pět typů. Ozanimod a ponesimod jsou určeny k terapii relabující roztroušené sklerózy a siponimod k terapii sekundárně progredující roztroušené sklerózy. Podávají se v jedné denní dávce, kterou je nezbytné při zahájení terapie titrovat. Okrelizumab a ofatumumab pak představují nové cíle biologické terapie, jedná se o monoklonální protilátky namířené proti povrchové determinantě CD20. Na ni shodně cílí rituximab, i když léčiva nemají zcela totožné klinické použití. Ofatumumab je určen k terapii relabující roztroušené sklerózy, zatímco okrelizumab je navíc určen také k terapii pacientů s primárně progresivní roztroušenou sklerózou. Po nasycovacích dávkách se aplikují buď jednou měsíčně (ofatumumab), nebo jednou za 6 měsíců (okrelizumab) s tím, že v případě okrelizumabu je nezbytné pacienta premedikovat metylprednisolonem a vhodným antihistaminikem, případně antipyretikem. Pro úplnost doplňujeme, že rituximab je chimérická (myší/lidská) monoklonální protilátka, okrelizumab je humanizovaná a ofatumumab plně humánní monoklonální protilátka.
Z dimetylfumarátu vycházel vývoj jeho „derivátů“, přičemž monometylfumarát je jedním z jeho metabolitů. Diroximelfumarát je chemicky 2 (2,5 dioxopyrrolidin 1 yl)ethyl methyl fumarát, tedy látka vycházející z monometylfumarátu. Monometylfumarát [2] i diroximelfumarát [3] mají oproti dimetylfumarátu významně zlepšenou gastrointestinální toleranci.
Z hlediska obecných aspektů lékových interakcí byly od roku 2015 detailně popsány mechanismy vlivu monoklonálních protilátek nebo cytokinů na expresi (aktivitu) enzymů účastnících se biotransformace či transportu léčiv. Jen pro zajímavost uvádíme, že zájem o tuto problematiku „probudila“ zejména pandemie COVID 19, neboť se ukázalo, že tato infekce v souvislosti s tzv. cytokinovou bouří vede ke změně aktivity enzymů podílejících se na metabolismu léčiv [4]. Bylo to logickým potvrzením bezprostředně předtím publikovaného zjištění stejného autorského kolektivu, že provedení chirurgického zákroku vede k poklesu aktivity většiny izoenzymů cytochromu P450 [5]. Zájemci o podrobné informace si mohou prostudovat bezkonkurenčně kompletní systematický přehled mapující ovlivnění exprese enzymů působením cytokinů, včetně interferonů [6]. Pro interferony a peginterferony z něj vyplývá, že sice ovlivňují aktivitu CYP1A2, CYP2D6 a CYP2C19, avšak klinicky významné lékové interakce obecně nevyvolávají, s výjimkou citlivých substrátů CYP1A2.
Na tomto místě je nezbytné připomenout, že glatiramer acetát patří k léčivům, které nemají popsané žádné lékové interakce, což se od roku 2015 nezměnilo. Z tohoto hlediska lze glatiramer acetát považovat za velmi bezpečné léčivo.
V případě léčiv modulujících rS1P (fingolimod, siponimod, ozanimod a ponesimod) bylo publikováno značné množství informací, které mohou napomoci při výběru optimálního farmaka pro konkrétního pacienta, přičemž umožňují vzít v úvahu také jinou medikaci pacienta tak, aby mohla být terapie náležitě individualizována a aby bylo zajištěno co nejmenší riziko lékových interakcí a nežádoucích účinků.
Konečně se prokázalo, že monoklonální protilátky proti CD20 a deriváty dimetylfumarátu představují z hlediska farmakokinetických lékových interakcí poměrně značně bezpečná léčiva.
Lékové interakce modulátorů rS1P
Mezi modulátory rS1P patří
fingolimod, siponimod, ozanimod a ponesimod. Tato léčiva mají
odlišnou afinitu k jednotlivým typům receptorů (obr. 2).
Siponimod a ponesimod interagují s receptorem přímo,
fingolimod interaguje s receptorem prostřednictvím svého
aktivního metabolitu, ozanimod působí přímo na receptor,
stejně jako jeho dva aktivní metabolity.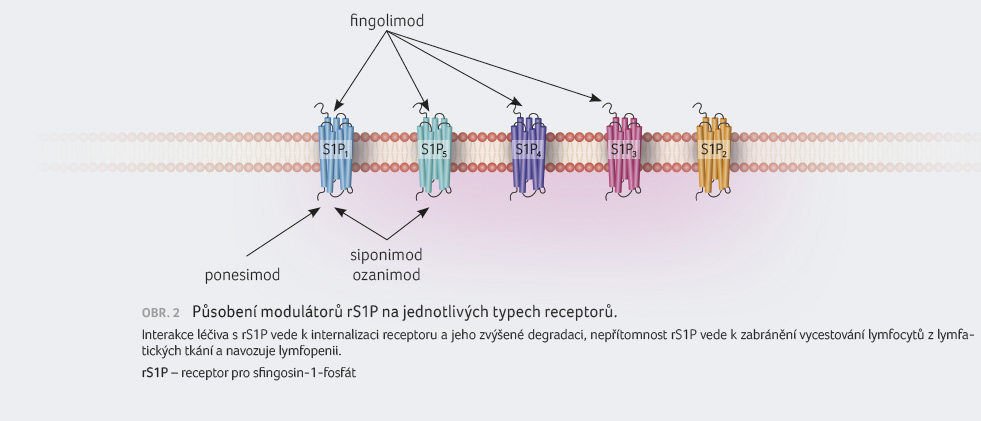
Modulátory rS1P se významně liší v délce působení i v řadě dalších farmakokinetických vlastností (tab. 2) [7].
Ovlivnění biotransformace
O fingolimodu jsme
v původním sdělení uvedli [1], že je substrátem CYP4F2
(> 80 %) a z menší časti též CYP2D6 (< 10 %),
CYP2E1 (< 10 %) a dále je malým podílem
biotransformován (< 1 %) CYP3A4, CYP4F3B a CYP4F12.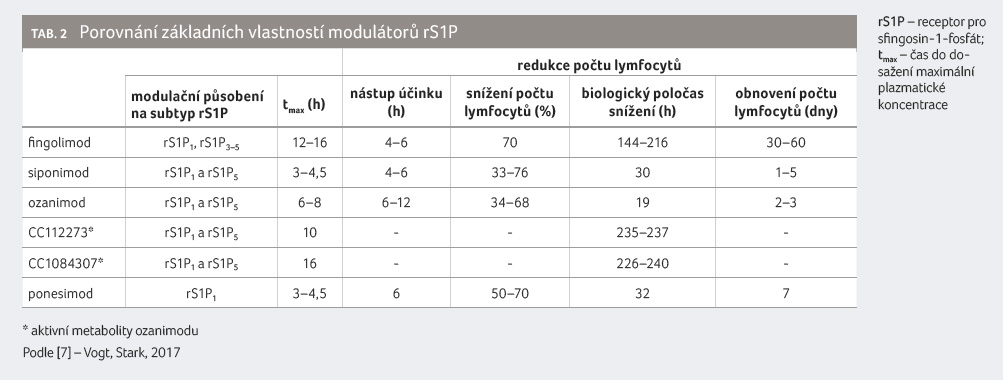
Také siponimod je v organismu extenzivně metabolizován [8], avšak cestou CYP2C9 (79,3 %) a CYP3A4 (18,5 %). Vysoký podíl metabolismu siponimodu cestou CYP2C9 vedl k potřebě ověřit, zda účinnost a bezpečnost siponimodu jsou ovlivněny genetickým polymorfismem CYP2C9, což se potvrdilo již při vývoji léčiva. Terapii siponimodem je proto možné zahájit pouze u pacientů se statusem rychlých a intermediárních metabolizátorů CYP2C9 a je kontraindikována u pacientů, kteří jsou pomalými metabolizátory CYP2C9 (tedy nositeli alely CYP2C9*3*3). Z toho logicky plyne, že před zahájením terapie siponimodem je nezbytné vyšetření genetického polymorfismu CYP2C9. Nabízí se otázka, zda v případě siponimodu dochází ke klinicky významným lékovým interakcím právě na základě inhibice či indukce jeho metabolismu cestou CYP2C9 a CYP3A4. Odpověď je vcelku jednoduchá, ano. Dokládají to výsledky klinických studií zaměřených na lékové interakce na podkladě inhibice [9–11] i indukce [12] CYP2C9. Zcela jednoznačně to pak potvrzuje vyjádření držitele rozhodnutí o registraci, který uvádí, že „vzhledem k významnému zvýšení expozice siponimodu se nedoporučuje současné užívání siponimodu a léčivých přípravků, které způsobují středně silnou inhibici CYP2C9 a středně silnou nebo silnou inhibici CYP3A4. Tento souběžný lékový režim se může skládat ze středně silného duálního inhibitoru CYP2C9/CYP3A4 (např. flukonazol) nebo středně silného CYP2C9 inhibitoru v kombinaci se samostatným středně silným nebo silným inhibitorem CYP3A4.“ [13] Souběžná inhibice CYP2C9 a CYP3A4 flukonazolem vedla ke zvýšení expozice siponimodu na dvojnásobek a k prodloužení jeho, již tak dlouhého, biologického poločasu o zhruba 50 % [11]. Fyziologické modelování pak potvrdilo rozdíly v důsledcích interakce u různých genotypů CYP2C9. U pacientů s genotypem CYP2C9*1/*1 by se expozice zvýšila o 120 %, u pacientů s genotypem CYP2C9*1/*2 o 131 %, u pacientů s genotypem CYP2C9*2/*2 o 191 %, u pacientů s genotypem CYP2C9 *1/*3 o 72 % a u pacientů s genotypem CYP2C9*2/*3 o 98 % [14]. Podávání rifampicinu jako induktoru CYP2C9 a CYP3A4 pak způsobilo snížení expozice siponimodu o 59 % [12].
Ozanimod je dalším extenzivně metabolizovaným modulátorem rS1P [15], přičemž jeho metabolismus je značně komplikovaný tím, že má dva aktivní metabolity. Oba tyto metabolity násobně převyšují expozici mateřské látce a mohou tak klinicky významně interagovat při své další biotransformaci či transportu [16]. První aktivní metabolit (CC112273) vzniká v prvním kroku cestou CYP1A1 a CYP3A4 za vzniku neaktivního metabolitu RP101075, ve druhém pak cestou monoaminooxidázy B (MAO B). Druhý aktivní metabolit (CC1084037) vzniká z prvního aktivního metabolitu cestou karbonylreduktázy nebo je tento aktivní metabolit dále biotransformován na neúčinné metabolity cestou CYP2C8. Neúčinné metabolity pak vznikají např. cestou aldehyddehydrogenázy a/nebo alkoholdehydrogenázy. Jak již bylo uvedeno, biologická aktivita v plazmě je dána mateřskou látkou jen minimálně (6 %), majoritně ji představuje CC112273 (73 %) za spoluúčasti CC1084037 (15 %). Pro závažnost lékových interakcí je tak klíčovou aktivita CYP3A4, CYP1A1, CYP2C8, MAO B, aldehyddehydrogenázy a alkoholdehydrogenázy. Inhibice CYP2C8 silným inhibitorem gemfibrozilem vedla ke zvýšení expozice účinným metabolitům o 47 %, respektive 69 %. Indukce CYP2C8 středně silným induktorem rifampicinem naopak vedla ke snížení jejich expozice o 60 %. Důsledky inhibice CYP1A1, CYP3A4 nebo MAO B nejsou známy. Držitel rozhodnutí o registraci v případě inhibice MAO B uvádí, že souběžné podání s inhibitory MAO B může snížit expozici majoritním aktivním metabolitům a může mít za následek sníženou klinickou odpověď [17]. Aktivní metabolity ozanimodu představují in vitro inhibitory MAO B [16] se střední inhibiční koncentrací IC50 ve výši 5,72 nM (CC112273), respektive 58 nM (CC1084037). In vivo se však inhibiční efekt ozanimodu neprojevuje, o čemž svědčí absence klinicky významné lékové interakce ozanimodu s pseudoefedrinem [16].
Též biotransformace ponesimodu je extenzivní a podílí se na ní řada enzymových systémů, zejména CYP2J2, CYP3A4, CYP3A5, CYP4F3A a CYP4F12, a dále pak enzymy účastnící se II. fáze biotransformace, zejména UDP glukuronosyltransferázy UGT1A1 a UGT2B7. Žádný z izoenzymů cytochromu P450 nemá převažující podíl na biotransformaci ponesimodu, i když CYP2J2 je odpovědný za tvorbu 74 % metabolitu M32, 3,4 % metabolitu M12 a 3,8 % metabolitu M13, přičemž M12 a M13 představují hlavní metabolity ponesimodu cirkulující v plazmě [18]. Celkově ale izoenzymy cytochromu P450 hrají v metabolické clearance ponesimodu jen omezenou roli.
Vedle farmakokinetických lékových interakcí jsou také velmi významné farmakodynamické lékové interakce.
Vliv na vakcinaci
Jejich první skupinou jsou interakce
s očkovacími látkami. Jedná se o významné informace,
a to zejména ve vztahu k aktuálnímu očkování
proti COVID 19. Ukázalo se, že pacienti léčení modulátorem
rS1P fingolimodem (a podle očekávání i pacienti léčení
anti CD20 monoklonálními protilátkami) mají výrazně nižší
sérokonverzi, přičemž typ vakcíny byl významným prediktorem
sérokonverze, nikoliv však u pacientů léčených anti CD20
monoklonálními protilátkami. Pozitivní informací bylo, že kolem
40 % séronegativních subjektů mělo měřitelné odpovědi T
buněk proti COVID 19 [19]. Držitelé rozhodnutí o registraci
uvádějí v souhrnech údajů o přípravcích (SPC)
vcelku jednoznačné pokyny pro očkování [13,17,20,21]. Tyto
pokyny shrnujeme do tabulky 3.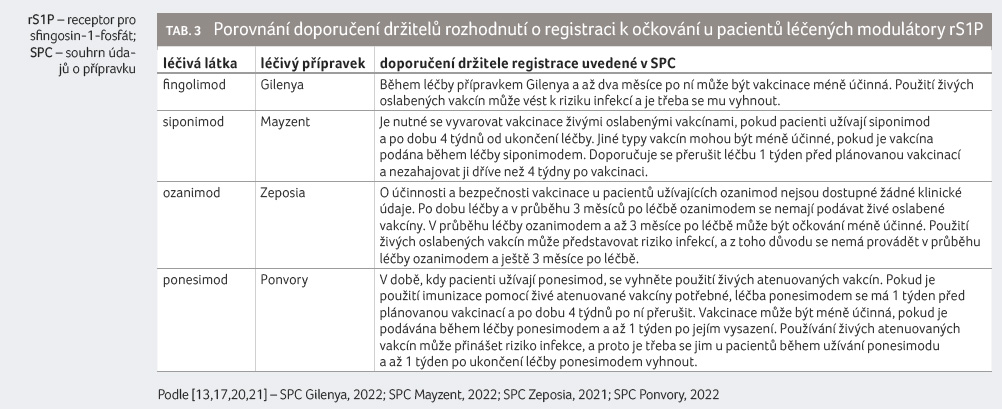
Riziko bradykardie
Další farmakodynamické lékové interakce mohou vznikat na podkladě schopnosti modulátorů rS1P navozovat bradykardii.
Jednorázové podání fingolimodu vede ke statisticky i klinicky významnému poklesu tepové frekvence [22], přičemž maxima poklesu tepové frekvence je průměrně dosaženo za 5 hodin a přetrvává zhruba 72 hodin. Po více než roční terapii fingolimodem je pak hodnota tepové frekvence stále částečně snížena oproti výchozí hodnotě (85,0 ± 9,8 tepů/min vs. 75,3 ± 16,2 tepů/min, p = 0,002). Zdá se, že některé léky (např. duloxetin nebo tolterodin) mohou míru navození bradykardie do určité míry eliminovat [23]. Incidence klinicky závažné bradykardie je poměrně nízká (1–2 %), může však být závažná [24].
Také podávání ponesimodu je spojeno se zvýšeným výskytem bradykardie, jak vyplývá z modelování [25], ale i z klinických studií [26]. Podle držitele rozhodnutí o registraci ponesimodu dochází ke snížení tepové frekvence během hodiny po podání první dávky a nejnižší hodnoty je dosaženo během 2–4 hodin. Tepová frekvence se pak obvykle vrací na výchozí hodnoty za 45 hodin po podání. Střední hodnota poklesu tepové frekvence první den dávkování (po dávce 2 mg) byla 6 tepů/min [21].
Ozanimod také přechodně snižuje tepovou frekvenci, přičemž podle držitele rozhodnutí o registraci byl po podání jednorázové dávky (0,23 mg) ozanimodu pokles tepové frekvence patrný ve 4. hodině, s největším průměrným snížením v 5. hodině a s návratem směrem k výchozí hodnotě v 6. hodině [17]. S pokračující eskalací dávky nebyly zaznamenány žádné klinicky relevantní poklesy tepové frekvence.
Siponimod snižuje, jak uvádí držitel rozhodnutí o registraci [13], tepovou frekvenci během jedné hodiny po podání první dávky, přičemž nejvyšší efekt lze pozorovat po dobu přibližně 3–4 hodin. Při pokračování titrace pokles srdeční frekvence přetrvává v následujících dnech, přičemž maximálního poklesu vzhledem ke dni 1 (výchozí hodnota) je dosaženo ve dnech 5–6. Největší pokles tepové frekvence je patrný po podání první dávky a průměrně činí 5–6 tepů/min. Pokles po podání dalších dávek je méně výrazný. Při pokračujícím podávání začíná srdeční frekvence stoupat po dni 6 a dosahuje úrovně placeba během 10 dnů od zahájení léčby.
Výskyt kardiovaskulárních nežádoucích účinků u jednotlivých modulátorů rS1P není shodný a patrně ani obdobný. Analýza 15 randomizovaných klinických studií [27] ukázala, že riziko kardiovaskulárních nežádoucích účinků spojené s podáváním modulátorů rS1P spočívalo zejména v navození bradykardie (poměr rizik [risk ratio, RR] 2,92; 1,91–4,46 na 95% hladině spolehlivosti [confidence interval, CI]) a arteriální hypertenze (RR 2,00; 95% CI 1,49–2,65). Podávání ozanimodu bylo spojeno pouze s vyšším rizikem hypertenze (RR 1,76; 95% CI 1,10–2,82), zatímco podávání siponimodu bylo provázeno vyšším rizikem bradykardie (RR 2,75; 95% CI 1,75–4,31).
Riziko prodloužení intervalu QT
S navozením bradykardie souvisí také zvýšení rizika prodloužení intervalu QT.
V experimentální studii fingolimod inhiboval proud hERG (napěťově řízený K+ kanál) [28]. Výsledky dále naznačily, že modulace rS1P1 v myokardu by mohla být jedním z kandidátů na vysvětlení blokády atrioventrikulárního vedení vyvolaného fingolimodem.
Fingolimod podaný jednorázově jen mírně prodloužil interval QT u zdravých dobrovolníků [29] a u pacientů s roztroušenou sklerózou [30]. Kardiovaskulární bezpečnost fingolimodu při zahájení terapie byla hodnocena v podmínkách běžné klinické praxe v Německu [24]. Bylo ji možno hodnotit jako velmi dobrou, což bylo dáno vysokým stupněm respektování doporučení uvedených v SPC. Pouze 1,8 % pacientů mělo bradykardii s frekvencí méně než 45 tepů/min v období 6 hodin po podání první dávky. Tyto výsledky byly následně potvrzeny v mnohem robustnější studii provedené také v Německu [31]. Rovněž podání první dávky fingolimodu pacientům léčeným antidepresivy ze skupiny SSRI bylo z hlediska kardiovaskulárních nežádoucích účinků bezpečné [32].
Na druhou stranu systém farmakovigilance v USA (FAERS) k 31. 12. 2021 zaznamenal celkem 4 972 kardiovaskulárních nežádoucích účinků, z toho např. 1 090 případů klinicky významné bradykardie, 363 případů AV blokády 1. stupně a 262 případů AV blokády 2. stupně, 231 případů poruchy srdečního rytmu. Popsány byly také tři případy torsade de pointes, a to u dvou žen ve věku 42 a 45 let a u jednoho muže ve věku 58 let. Za významný lze považovat fakt, že všichni tři pacienti byli léčeni fingolimodem a neužívali žádné léky prodlužující interval QT.
Ponesimod neprodlužuje relevantním způsobem interval QT [33]. Stejně tak siponimod [34] a ozanimod [35]. V případě ozanimodu byla provedena další analýza [36], která též potvrdila jeho kardiovaskulární bezpečnost.
Přes všechny výsledky výše uvedených studií, které prokázaly, že modulátory rS1P neprodlužují klinicky významným způsobem délku intervalu QT, uvádějí držitelé rozhodnutí o registraci, že kardiologické konzilium je nezbytné „u pacientů s významným prodloužením intervalu QT (QTc delší než 500 ms) nebo u těch, kteří jsou již léčeni přípravky prodlužujícími interval QT se známými arytmogenními vlastnostmi (riziko torsades de pointes)“ nebo méně naléhavé: „Siponimod nebyl studován u pacientů s významným prodloužením QT intervalu (QTc > 500 ms) nebo u pacientů léčených přípravky prodlužujícími QT interval. Pokud je zvažována léčba siponimodem u pacientů s již existujícím významným prodloužením QT intervalu nebo u těch, kteří již jsou léčeni léčivými přípravky prodlužujícími QT interval se známými arytmogenními vlastnostmi, je před zahájením léčby nezbytná konzultace s kardiologem kvůli určení vhodného způsobu monitorování při zahájení léčby.“
Domníváme se, že na základě publikovaných informací lze siponimod, ozanimod a ponesimod řadit k bezpečným léčivům z hlediska jejich vlivu na délku intervalu QT. Mohly by však, nesmírně vzácně, nepřímo, v důsledku jimi navozené bradykardie, prohloubit prodloužení intervalu QT navozené jinou proarytmogenní terapií, např. antiarytmiky třídy Ia nebo III, některými antidepresivy nebo antipsychotiky. Předběžná opatrnost je tak namístě, jak ostatně nabádají držitelé rozhodnutí o registraci. Domníváme se také, že riziko je vyšší v případě fingolimodu, což vyjadřujeme v závěrečné tabulce, která uvádí přehled lékových interakcí.
Z bezpečnostního hlediska lze dále doplnit, že terapie modulátory rS1P není spojena se vznikem závislosti [37].
Lékové interakce monoklonálních protilátek proti CD20
Monoklonální protilátky proti CD20
nemají vliv na expresi enzymů nebo transportních systémů
a neovlivňují tak biotransformaci léčiv, a proto ani
nevyvolávají farmakokinetické lékové interakce. Monoklonální
protilátky proti CD20 výrazným způsobem zasahují na úrovni
lymfocytů B (a u pacientů s roztroušenou
sklerózou patrně i lymfocytů T), což bylo nedávno
velmi podrobně popsáno [38]. Obecně platí, že pacient by měl
být před zahájením terapie okrelizumabem nebo ofatumumabem
náležitě imunologicky vyšetřen a v případě potřeby
očkován (tab. 4) [39,40]. Po zahájení aplikace
okrelizumabu, ofatumumabu, ale i alemtuzumabu či natalizumabu
je aplikace živých oslabených očkovacích látek
kontraindikována.
Aplikace neživých očkovacích látek je možná, je však třeba počítat se sníženou odpovědí na očkování, jak bylo prokázáno v případě okrelizumabu [41], což s největší pravděpodobností platí i v případě ofatumumabu a aplikace tetanového toxoidu či polyvalentní pneumokokové vakcíny. Podobné výsledky byly získány také v případě aplikace vakcíny proti COVID 19 [19,42].
Podávání nebo aplikace imunosupresivních léčiv je při terapii monoklonálními protilátkami proti CD20 kontraindikována.
Lékové interakce derivátů dimetylfumarátu
Také dimetylfumarát a jeho deriváty nemají vliv na expresi nebo aktivitu enzymů nebo transportních systémů a neovlivňují tak biotransformaci léčiv, a proto ani nevyvolávají farmakokinetické lékové interakce.
Dimetylfumarát a jeho deriváty
vedou k depleci lymfocytů. Aplikace očkovacích látek by
proto měla být vždy pečlivě zvážena (tab. 5) [43,44].
Souběžné podávání dimetylfumarátu nebo jeho derivátů
a imunosupresiv dosud nebylo hodnoceno, takové kombinace jsou
podle držitelů rozhodnutí o registraci možné s opatrností.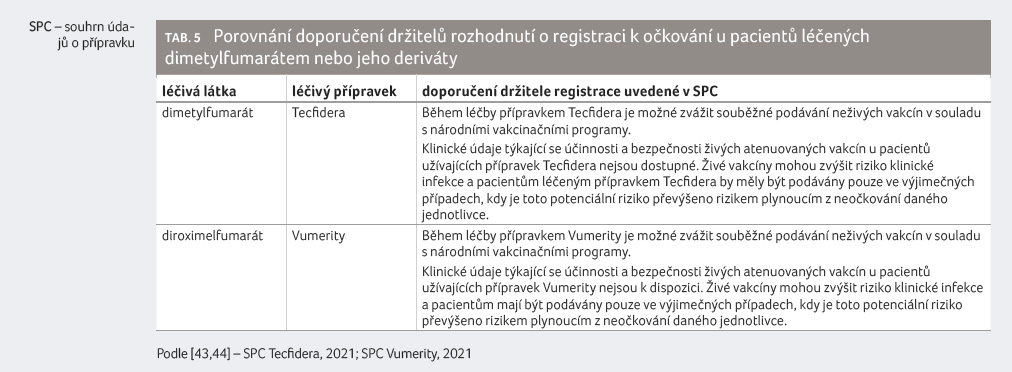
Vzájemné kombinace léčiv používaných při terapii roztroušené sklerózy
Léky používané při terapii
roztroušené sklerózy se vzájemně nekombinují. V případě
potřeby je možné terapii změnit s tím, že by měly být
reflektovány časy tzv. vymývacích period (tab. 6). Ty
v podstatě neplatí pro interferony. V případě přechodu
z terapie interferony na jinou léčbu se terapie jiným
léčivem může zahájit v den, kdy má být aplikována další
dávka interferonu (tab. 7) [45].
V případě
potřeby je možné terapii změnit s tím, že by měly být
reflektovány časy tzv. vymývacích period (tab. 6). Ty
v podstatě neplatí pro interferony. V případě přechodu
z terapie interferony na jinou léčbu se terapie jiným
léčivem může zahájit v den, kdy má být aplikována další
dávka interferonu (tab. 7) [45].
Po ukončení podávání léčiv
uvedených v tabulce 6 je možné zahájit podávání či
aplikaci jiného léčiva nejdříve v čase uvedeném
v tabulce. Uvedené vymývací periody platí také pro
případnou terapii léčivy s imunosupresivním účinkem
(s výjimkou glukokortikoidů aplikovaných při akutní atace
roztroušené sklerózy).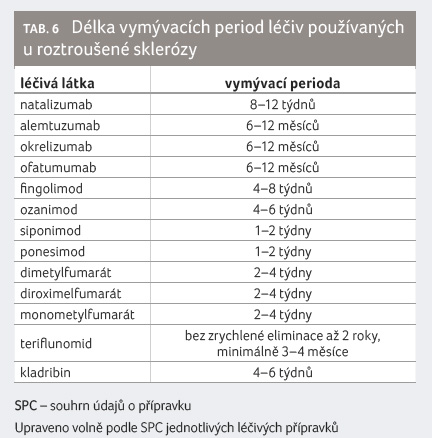
Závěr
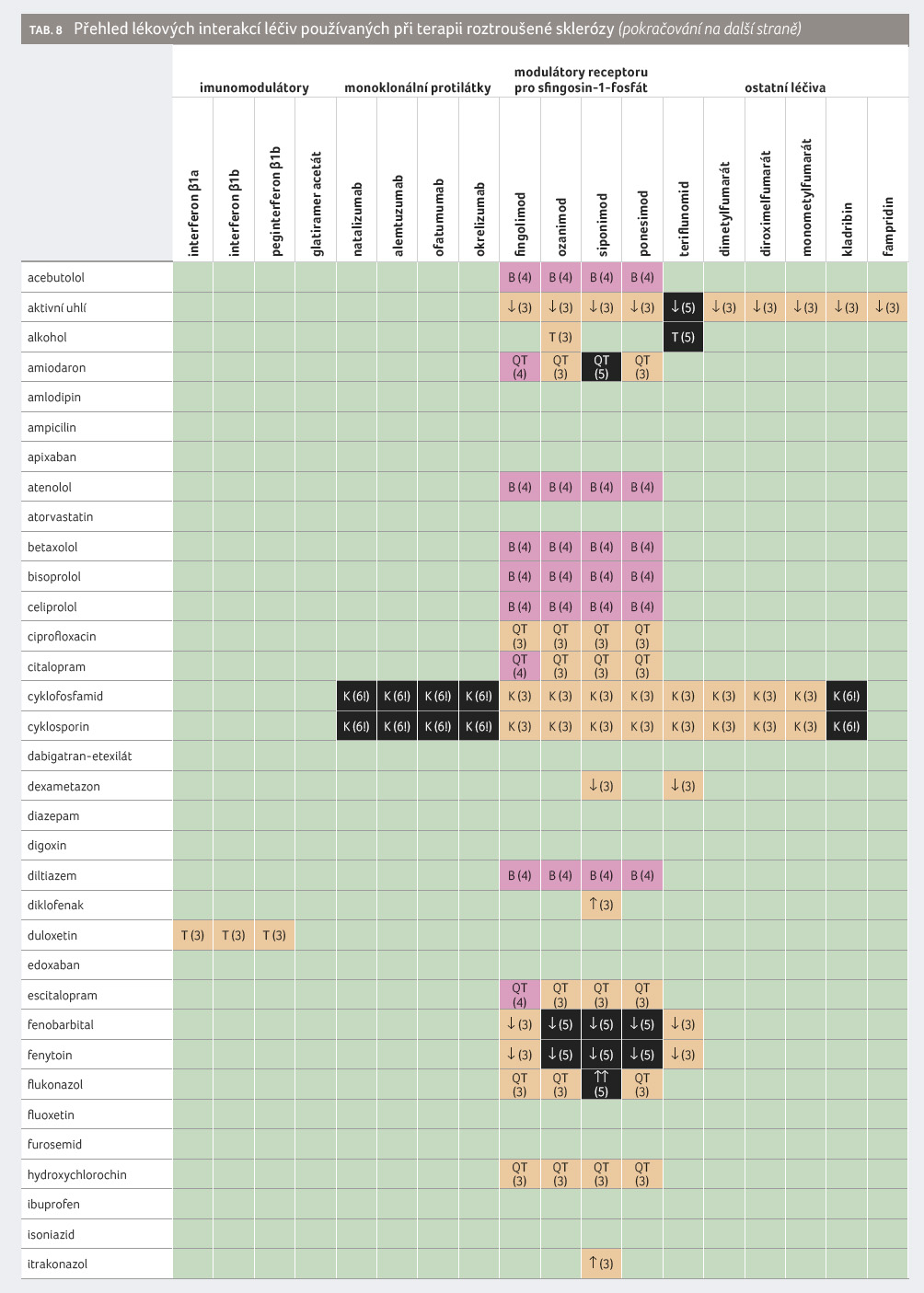
Některé lékové interakce léčiv používaných při terapii roztroušené sklerózy jsou klinicky významné (tab. 8). Například duální inhibice siponimodu metabolickými cestami CYP2C9 a CYP3A4 jedním inhibitorem (flukonazolem) nebo dvěma souběžně podávanými léčivy (tedy inhibitorem CYP2C9 a CYP3A4) je natolik riziková, že před ní držitel rozhodnutí o registraci důrazně varuje. Rizika lékových interakcí nejsou v případě modulátorů rS1P shodná, což je dáno jejich odlišným osudem v organismu.
Monoklonální protilátky proti CD20 nemají farmakokinetické lékové interakce, avšak mohou klinicky vysoce významně interagovat farmakodynamicky s imunosupresivy nebo s živými oslabenými očkovacími látkami. Také dimetylfumarát a jeho deriváty neposkytují farmakokinetické lékové interakce. Jejich kombinace s imunosupresivy nebyly zkoumány, a tak je namístě zachovávat opatrnost spočívající v častějším a důkladnějším monitorování pacienta a jeho laboratorních a zejména hematologických parametrů.
Pacienti s roztroušenou sklerózou užívají nejen léčiva, ale jak lze důvodně očekávat, také různé doplňky stravy. Některé z nich mohou účinnost a bezpečnost základní léčby roztroušené sklerózy ovlivnit, popravdě nevíme dosud, v jakém rozsahu. Například rozchodnice růžová je inhibitorem MAO B, což je ale cesta, kterou vzniká jeden z účinných metabolitů ozanimodu. Třezalka tečkovaná, šalvěj červenokořenná nebo i máta peprná patří k induktorům CYP3A4, a proto nelze vyloučit jejich lékové interakce s fingolimodem či siponimodem.

Zájemcům o další informace
doporučujeme navštívit Databázi lékových interakcí DrugAgency
[45].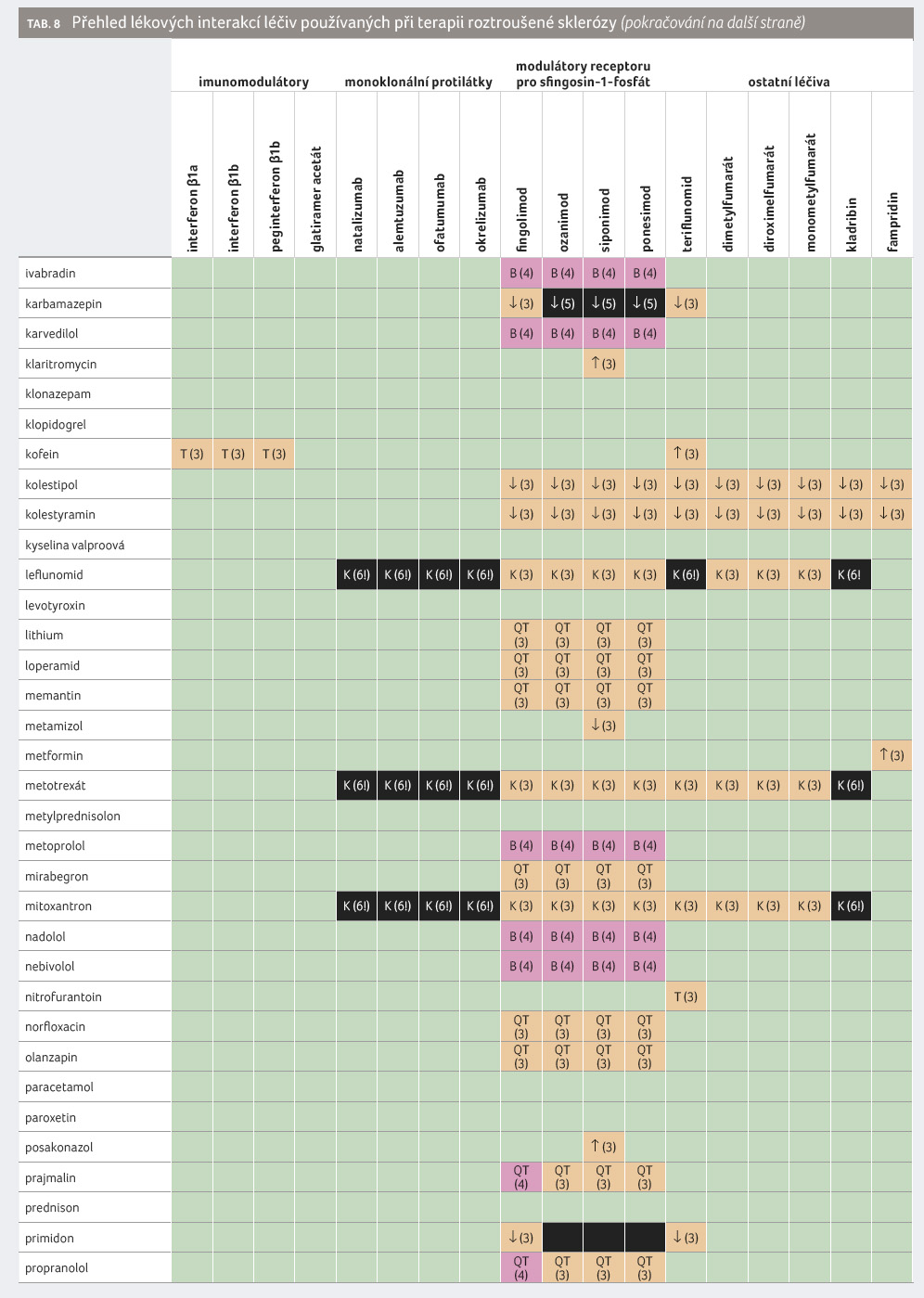
Seznam použité literatury
- [1] Suchopár J, Prokeš M, Suchopár O. Přehled lékových interakcí specifických léků používaných u roztroušené sklerózy. Remedia 2015; 25: 159–169.
- [2] Wynn D, Lategan TW, Sprague TN, et al. Monomethyl fumarate has better gastrointestinal tolerability profile compared with dimethyl fumarate. Mult Scler Relat Disord 2020; 45: 102335.
- [3] Naismith RT, Wundes A, Ziemssen T, et al.; EVOLVE‑MS‑2 Study Group. Diroximel Fumarate Demonstrates an Improved Gastrointestinal Tolerability Profile Compared with Dimethyl Fumarate in Patients with Relapsing‑Remitting Multiple Sclerosis: Results from the Randomized, Double‑Blind, Phase III EVOLVE‑MS‑2 Study. CNS Drugs 2020; 34: 185–196.
- [4] Lenoir C, Terrier J, Gloor Y, et al. Impact of SARS‑CoV‑2 Infection (COVID‑19) on Cytochromes P450 Activity Assessed by the Geneva Cocktail. Clin Pharmacol Ther 2021; 110: 1358–1367.
- [5] Lenoir C, Daali Y, Rollason V, et al. Impact of Acute Inflammation on Cytochromes P450 Activity Assessed by the Geneva Cocktail. Clin Pharmacol Ther 2021; 109: 1668–1676.
- [6] Lenoir C, Rollason V, Desmeules JA, Samer CF. Influence of Inflammation on Cytochromes P450 Activity in Adults: A Systematic Review of the Literature. Front Pharmacol 2021; 12: 733935.
- [7] Vogt D, Stark H. Therapeutic strategies and pharmacological tools influencing S1P signaling and metabolism. Med Res Rev 2017; 37: 3–51.
- [8] Glaenzel U, Jin Y, Nufer R, et al. Metabolism and Disposition of Siponimod, a Novel Selective S1P1/S1P5 Agonist, in Healthy Volunteers and In Vitro Identification of Human Cytochrome P450 Enzymes Involved in Its Oxidative Metabolism. Drug Metab Dispos 2018; 46: 1001–1013.
- [9] Jin Y, Borell H, Gardin A, et al. In vitro studies and in silico predictions of fluconazole and CYP2C9 genetic polymorphism impact on siponimod metabolism and pharmacokinetics. Eur J Clin Pharmacol 2018; 74: 455–464.
- [10] Gardin A, Ufer M, Legangneux E, et al. Effect of Fluconazole Coadministration and CYP2C9 Genetic Polymorphism on Siponimod Pharmacokinetics in Healthy Subjects. Clin Pharmacokinet 2019b; 58: 349–361.
- [11] Gardin A, Shakeri‑Nejad K, Feller A, et al. Siponimod pharmacokinetics, safety, and tolerability in combination with the potent CYP3A4 inhibitor itraconazole in healthy subjects with different CYP2C9 genotypes. Eur J Clin Pharmacol 2019; 75: 1565–1574.
- [12] Gardin A, Gray C, Neelakantham S, et al.Siponimod pharmacokinetics, safety, and tolerability in combination with rifampin, a CYP2C9/3A4 inducer, in healthy subjects. Eur J Clin Pharmacol 2018; 74: 1593–1604.
- [13] SPC Mayzent (siponimod), Novartis Europharm Limited, 2/2022. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/mayzent‑epar‑product‑information_cs.pdf
- [14] Huth F, Gardin A, Umehara K, He H. Prediction of the Impact of Cytochrome P450 2C9 Genotypes on the Drug‑Drug Interaction Potential of Siponimod With Physiologically‑Based Pharmacokinetic Modeling: A Comprehensive Approach for Drug Label Recommendations. Clin Pharmacol Ther 2019; 106: 1113–1124.
- [15] Surapaneni S, Yerramilli U, Bai A, et al. Absorption, Metabolism, and Excretion, In Vitro Pharmacology, and Clinical Pharmacokinetics of Ozanimod, a Novel Sphingosine 1‑Phosphate Receptor Modulator. Drug Metab Dispos 2021; 49: 405–419.
- [16] Tran JQ, Zhang P, Ghosh A, et al. Single‑Dose Pharmacokinetics of Ozanimod and its Major Active Metabolites Alone and in Combination with Gemfibrozil, Itraconazole, or Rifampin in Healthy Subjects: A Randomized, Parallel‑Group, Open‑Label Study. Adv Ther 2020; 37: 4381–4395.
- [17] SPC Zeposia (ozanimod), Bristol‑Myers Squibb Pharma EEIG, 12/2021. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/zeposia‑epar‑product‑information_cs.pdf
- [18] Lott D, Krause A, Dingemanse J, Lehr T. Population pharmacokinetics of ponesimod and its primary metabolites in healthy and organ‑impaired subjects. Eur J Pharm Sci 2016; 89: 83–93.
- [19] Tallantyre EC, Vickaryous N, Anderson V, et al. COVID‑19 Vaccine Response in People with Multiple Sclerosis. Ann Neurol 2022; 91: 89–100.
- [20] SPC Gilenya (fingolimod), Novartis Ireland Limited, 3/2022. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/gilenya‑epar‑product‑information_cs.pdf
- [21] SPC Ponvory (ponesimod), Janssen‑Cilag International NV, 3/2022. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/ponvory‑epar‑product‑information_cs.pdf
- [22] Akbulak RÖ, Rosenkranz SC, Schaeffer BN, et al. Acute and long‑term effects of fingolimod on heart rhythm and heart rate variability in patients with multiple sclerosis. Mult Scler Relat Disord 2018; 19: 44–49.
- [23] Ritter C, Svačina MK, Bobylev I, et al. Impact of Age and Polytherapy on Fingolimod Induced Bradycardia: a Preclinical Study. J Neuroimmune Pharmacol 2017; 12: 204–209.
- [24] Linker RA, Wendt G. Cardiac Safety Profile of First Dose of Fingolimod for Relapsing‑Remitting Multiple Sclerosis in Real‑World Settings: Data from a German Prospective Multi‑Center Observational Study. Neurol Ther 2016; 5: 193–201.
- [25] Lott D, Lehr T, Dingemanse J, Krause A. Modeling Tolerance Development for the Effect on Heart Rate of the Selective S1P(1) Receptor Modulator Ponesimod. Clin Pharmacol Ther 2018; 103: 1083–1092.
- [26] Brossard P, Scherz M, Halabi A, et al. Multiple‑dose tolerability, pharmacokinetics, and pharmacodynamics of ponesimod, an S1P1 receptor modulator: favorable impact of dose up‑titration. J Clin Pharmacol 2014; 54: 179–188.
- [27] Zhao Z, Lv Y, Gu ZC, et al. Risk for Cardiovascular Adverse Events Associated With Sphingosine‑1‑Phosphate Receptor Modulators in Patients With Multiple Sclerosis: Insights From a Pooled Analysis of 15 Randomised Controlled Trials. Front Immunol 2021; 12: 795574.
- [28] Yagi Y, Nakamura Y, Kitahara K, et al. Analysis of Onset Mechanisms of a Sphingosine 1‑Phosphate Receptor Modulator Fingolimod‑Induced Atrioventricular Conduction Block and QT‑Interval Prolongation. Toxicol Appl Pharmacol 2014; 281: 39–47.
- [29] Schmouder R, Serra D, Wang Y, et al. FTY720: placebo‑controlled study of the effect on cardiac rate and rhythm in healthy subjects. J Clin Pharmacol 2006; 46: 895–904.
- [30] Laiho A, Laitinen TM, Hartikainen P, et al. Cardiac repolarization during fingolimod treatment in patients with relapsing‑remitting multiple sclerosis. Brain Behav 2018; 8: e00925.
- [31] Limmroth V, Ziemssen T, Kleiter I, et al. A Comprehensive Monitoring Study on Electrocardiographic Assessments and Cardiac Events After Fingolimod First Dose‑Possible Predictors of Cardiac Outcomes. Front Neurol 2020; 11: 818.
- [32] Bermel RA, Hashmonay R, Meng X, et al. Fingolimod first‑dose effects in patients with relapsing multiple sclerosis concomitantly receiving selective serotonin‑reuptake inhibitors. Mult Scler Relat Disord 2015; 4: 273–280.
- [33] Hoch M, Darpo B, Brossard P, et al. Effect of ponesimod, a selective S1P1 receptor modulator, on the QT interval in healthy individuals. Basic Clin Pharmacol Toxicol 2015; 116: 429–437.
- [34] Shakeri‑Nejad K, Aslanis V, Veldandi UK, et al. Effects of Therapeutic and Supratherapeutic Doses of Siponimod (BAF312) on Cardiac Repolarization in Healthy Subjects. Clin Ther 2015; 37: 2489–2505.
- [35] Tran JQ, Hartung JP, Olson AD, et al. Cardiac Safety of Ozanimod, a Novel Sphingosine‑1‑Phosphate Receptor Modulator: Results of a Thorough QT/QTc Study. Clin Pharmacol Drug Dev 2018; 7: 263–276.
- [36] Briggs E, Chapel S, Zhang P, et al. Concentration‑QTc Modeling of Ozanimodʼs Major Active Metabolites in Adult Healthy Subjects. CPT Pharmacometrics Syst Pharmacol 2021; 10: 119–126.
- [37] Schoedel KA, Kolly C, Gardin A, et al. Abuse and dependence potential of sphingosine‑1‑phosphate (S1P) receptor modulators used in the treatment of multiple sclerosis: a review of literature and public data. Psychopharmacology (Berl) 2022; 239: 1–13.
- [38] Krejsek J. Možnosti cíleně modulovat poškozující zánět u nemocných s roztroušenou sklerózou biologiky cílícími na molekulu CD20 B lymfocytů se rozšiřují. Remedia 2020; 30: 596–601.
- [39] SPC Ocrevus (okrelizumab), Roche Registration GmbH, 2/2022. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/ocrevus‑epar‑product‑information_cs.pdf
- [40] SPC Kesimpta (ofatumumab), Novartis Ireland Limited, 3/2022. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/kesimpta‑epar‑product‑information_cs.pdf
- [41] Bar‑Or A, Calkwood JC, Chognot C, et al. Effect of ocrelizumab on vaccine responses in patients with multiple sclerosis: The VELOCE study. Neurology 2020; 95: e1999–e2008.
- [42] Money KM, Baber U, Saart E, et al. Blunted Post‑COVID‑19 Humoral Immunity in Patients With CNS Demyelinating Disorders on Anti‑CD20 Treatments. Front Neurol 2022; 13: 843081.
- [43] SPC Tecfidera (dimetylfumarát), Biogen Netherlands B.V., 2/2022. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/tecfidera‑epar‑product‑information_cs.pdf
- [44] SPC Vumerity (diroximelfumarát), Biogen Netherlands B.V., 11/2021. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/vumerity‑epar‑product‑information_cs.pdf
- [45] Databáze lékových interakcí DrugAgency, DrugAgency, 2022. Dostupné na: http://lekoveinterakce.cz