Působení léčiv na úrovni iontových kanálů a transportních bílkovin
V předcházejících číslech tohoto časopisu bylo probráno působení farmak na úrovni receptorů nebo enzymů. Tento článek je zaměřen na působení farmak na dalších dvou důležitých místech, a to na iontových kanálech a transportních bílkovinách (transportérech, přenašečích). V této oblasti je mnoho nových poznatků rozptýlených v mnoha časopisech, které dosud nebyly souborně, přehledně a srozumitelně publikovány z hlediska klinika. Článek o to usiluje. Probírá úlohu iontových kanálů a transportérů typu ABC nebo SLC v terapeutických účincích mnoha klinicky významných farmak (např. blokátorů vápníkových kanálů, lokálních anestetik, antiepileptik, digoxinu, inhibitorů protonové pumpy, antidepresiv, některých antidiabetik aj.).
Úvod
V předcházejících číslech časopisu Remedia byly probrány mechanismy působení farmak na úrovni receptorů [1] nebo enzymů [2]. Zde se stručně zaměříme na působení mnoha klinicky významných farmak na dalších dvou důležitých místech, a to na iontových kanálech a transportních bílkovinách (transportérech, přenašečích). Receptory, enzymy, iontové kanály, přenašeči představují čtyři nejčastější místa, cíle primárního působení většiny farmak. Všechny jsou bílkovinné povahy, často vzájemně spolupůsobí, takže primární zásah, působení léčiv např. na úrovni receptorů, může následně vést k ovlivnění iontových kanálů, enzymů apod.
Jde o velmi složité systémy, jejich výzkum intenzivně pokračuje s použitím molekulárněbiologických, biochemických, biofyzikálních a dalších náročných metodik. Díky tomu dnes existují tisíce nových poznatků o iontových kanálech a transportních bílkovinách z posledních let, které se nemohly objevit ani v nedávných učebnicích farmakologie. Co z těch tisíců poznatků uvést pro klinickou praxi? Zde si dovolíme upozornit jen na vybrané hlavní poznatky. Volba bude ovšem ovlivněn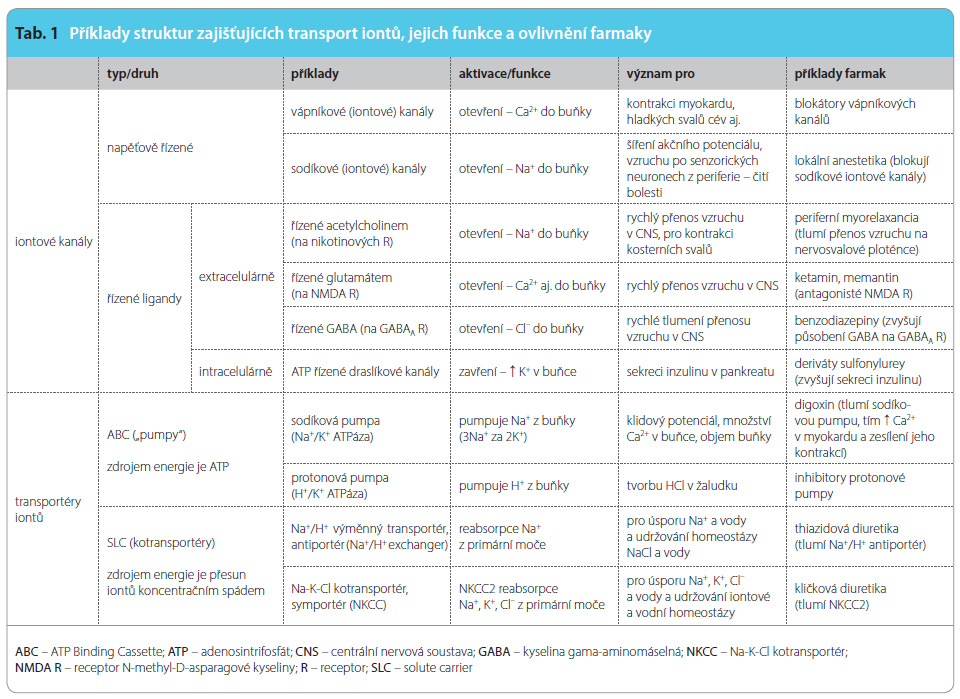 a naším současným pohledem a znalostmi.
a naším současným pohledem a znalostmi.
Přesuny iontů Na+, K+, Ca2+, Cl– skrz membrány buněk, případně i uvnitř buněk, zajišťují iontové kanály a některé transportní bílkoviny (transportéry typu ABC nebo SLC – viz dále). Podobné transportní bílkoviny slouží k přesunu molekul, např. neurotransmiterů, glukózy, aminokyselin nebo i cizorodých látek, obvykle mezi buňkou a extracelulárním prostředím. Struktura, lokalizace a funkce těchto bílkovin jsou velmi různorodé, podobně jako je tomu u receptorů nebo enzymů. V podstatě jde o aktivitu velmi komplexního systému na buněčné a mo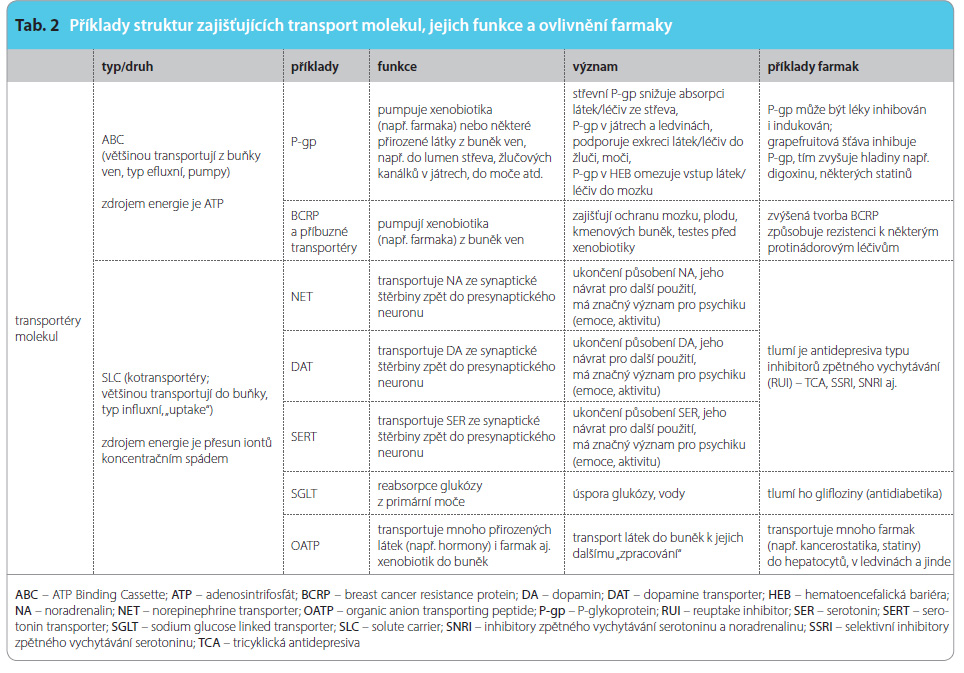 lekulární úrovni, která by se dala připodobnit ke koncertu obřího symfonického orchestru nebo k pestrému životu ve velkoměstě nebo na korálových útesech. Z tak pestrého komplexu uvádíme příklady struktur zajišťujících transport iontů nebo molekul, jejich funkci a ovlivnění farmaky pokud možno přehledným způsobem v tab. 1 a 2. Následující text je převážně komentářem k těmto tabulkám, které shrnují poznatky zatím rozptýlené v mnoha publikacích. Pokud je nám známo, dosud nebyly takto souborně publikovány.
lekulární úrovni, která by se dala připodobnit ke koncertu obřího symfonického orchestru nebo k pestrému životu ve velkoměstě nebo na korálových útesech. Z tak pestrého komplexu uvádíme příklady struktur zajišťujících transport iontů nebo molekul, jejich funkci a ovlivnění farmaky pokud možno přehledným způsobem v tab. 1 a 2. Následující text je převážně komentářem k těmto tabulkám, které shrnují poznatky zatím rozptýlené v mnoha publikacích. Pokud je nám známo, dosud nebyly takto souborně publikovány.
Hlavním cílem tohoto sdělení je přiblížit úlohu iontových kanálů a transportních bílkovin z hlediska farmakodynamiky, zejména v oblasti terapeutického působení léčiv. Doplňujícím cílem bude informace o úloze transportních bílkovin z hlediska farmakokinetiky, tj. o tom, jak ovlivňují pohyb léčiv v organismu. Článek je rozdělen do dvou částí, první pojednává o působení farmak na transport iontů, druhá o účinku farmak na transport molekul.
Transport iontů a působení farmak
Pro funkci buněk i tkání je rozhodující transport iontů sodíku, draslíku, chlóru a vápníku buněčnou membránou mezi extracelulárním a intracelulárním prostorem nebo i uvnitř buňky. Transport iontů buněčnou membránou umožňují jednak iontové kanály, jednak transportéry iontů (tab. 1).
Iontové kanály
Iontové kanály býva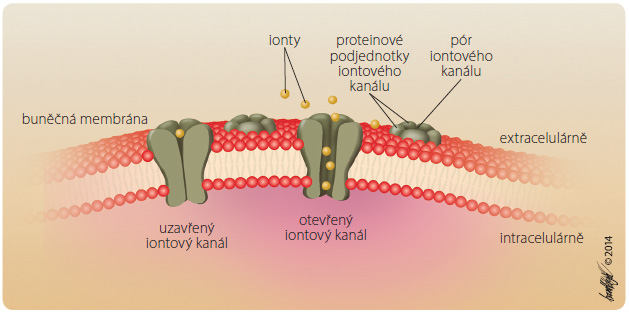 jí tvořeny několika transmembránovými proteiny, jejichž seskupení vytváří centrální kanál (obr. 1). Iontové kanály bývají obvykle tříděny podle toho, jakým podnětem jsou otvírány a řízeny: zda změnou napětí na buněčné membráně (napěťově řízené), nebo chemicky, látkami (řízené ligandy), viz tab. 1.
jí tvořeny několika transmembránovými proteiny, jejichž seskupení vytváří centrální kanál (obr. 1). Iontové kanály bývají obvykle tříděny podle toho, jakým podnětem jsou otvírány a řízeny: zda změnou napětí na buněčné membráně (napěťově řízené), nebo chemicky, látkami (řízené ligandy), viz tab. 1.
Napěťově řízené iontové kanály
Mezi napěťově řízené iontové kanály patří zejména mnohé sodíkové a vápníkové kanály. Otvírají se při poklesu napětí a depolarizaci buněčné membrány, čímž umožňují vstup Na+ nebo Ca2+ do buňky. Napěťově řízené sodíkové kanály [3] – náhlým vstupem velkého množství sodíkových iontů sodíkovými kanály dovnitř buňky dochází během milisekund k prudké změně napětí na buněčné membráně od záporného (–55 mV) ke kladnému (+40 mV), což umožňuje vznik a šíření akčního potenciálu. To má velký význam např. pro šíření nervového vzruchu po prvním neuronu dráhy bolesti z periferie do míchy nebo pro šíření vzruchu v mozku nebo v převodním systému v myokardu. Sodíkové iontové kanály blokují lokální anestetika, některá antiepileptika (fenytoin, karbamazepin, lamotrigin), antiarytmika (třídy I).
Napěťově řízené vápníkové kanály [4] – existuje několik podtypů napěťově řízených vápníkových kanálů. Z farmakologického hlediska jsou nejdůležitější vápníkové kanály typu L v cévách a srdci (významně ovlivňují dostupnost Ca2+ pro kontrakci hladkých svalů a myokardu) a typu N a P/Q na presynaptických nervových zakončeních v CNS (kde tlumí uvolňování neurotransmiterů a tím převod vzruchu). Blokátory vápníkových kanálů typu L se velmi často používají jako antihypertenziva, používají se též u některých srdečních arytmií, u anginy pectoris. Mezi blokátory vápníkových kanálů typu N patří některá antiepileptika (ethosuximid, valproát), k blokátorům vápníkových kanálů typu P/Q se řadí antikonvulziva gabapentin a pregabalin (blokují jejich podjednotky α2δ1).Blokátory napěťově řízených sodíkových kanálů (karbamazepin) nebo vápníkových kanálů typu N (zikonotid) nebo P/Q (gabapentin, pregabalin) se uplatňují u neuropatické bolesti.
Iontové kanály řízené ligandy
Iontové kanály řízené ligandy bývají tříděny na iontové kanály řízené extracelulárními nebo intracelulárními ligandy (tab. 1).
Mezi iontové kanály řízené extracelulárními ligandy patří zejména ty, které jsou řízeny hlavními neurotransmitery, a to acetylcholinem (aktivuje nikotinové receptory na extracelulární části 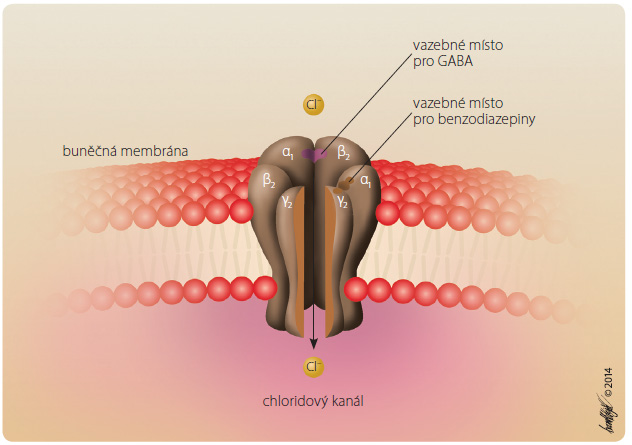 iontového kanálu; tím dojde k jeho otevření, což umožní vstup Na+ do buňky), kyselinou gama-aminomáselnou neboli GABA (aktivuje receptor GABAA na extracelulární části iontového kanálu, tím dojde k jeho otevření, což umožní vstup Cl– do buňky – obr. 2) a glutamátu (aktivuje receptor NMDA, receptor N-methyl-D-asparagové kyseliny) na extracelulární části iontového kanálu, tím dojde k jeho otevření, což umožní vstup většinou Ca2+ do buňky [5]).
iontového kanálu; tím dojde k jeho otevření, což umožní vstup Na+ do buňky), kyselinou gama-aminomáselnou neboli GABA (aktivuje receptor GABAA na extracelulární části iontového kanálu, tím dojde k jeho otevření, což umožní vstup Cl– do buňky – obr. 2) a glutamátu (aktivuje receptor NMDA, receptor N-methyl-D-asparagové kyseliny) na extracelulární části iontového kanálu, tím dojde k jeho otevření, což umožní vstup většinou Ca2+ do buňky [5]).
Aktivace nikotinových nebo glutamátových ionotropních receptorů je důležitá pro rychlý přenos nervových vzruchů, kdežto aktivace ionotropních receptorů GABAA je naopak důležitá pro rychlé tlumení přenosu vzruchu v CNS. Léčiva tlumící převod vzruchu na nikotinových receptorech na nervosvalové ploténce způsobují myorelaxaci příčně pruhovaného (kosterního) svalstva. Léčiva usnadňující působení GABA na receptoru GABAA – např. benzodiazepiny – působí anxiolyticky, sedativně, hypnoticky, antikonvulzivně. Antagonisté receptoru NMDA mohou mít různé účinky: ketamin způsobuje disociativní anestezii (analgezii při částečně zachovaném vědomí) a působí psychotogenně, memantin částečně zpomaluje průběh Alzheimerovy nemoci.
Mezi iontové kanály řízené intracelulárními ligandy patří např. draslíkové kanály řízené ATP (adenosintrifosfát) v beta-buňkách pankreatu. V klidu jsou otevřeny, po přívodu glukózy se zvýší tvorba ATP, což vede k uzavření KATP kanálu a následně ke zvýšení sekrece inzulinu. Podobně jako ATP zde působí antidiabetika deriváty sulfonylurey, jež tak mohou zvyšovat sekreci inzulinu.
Transportéry iontů
Transportní proteiny (transportéry, přenašeči) zajišťující transport iontů (nebo molekul, viz dále) jsou dvojího typu.
Prvním typem jsou transportéry ABC (ATP Binding Cassette) [6]. Jejich zdrojem energie je ATP a zajišťují tzv. primární aktivní transport (obr. 3). Obvykle pumpují ionty (nebo molekuly) z buňky ven, bývají proto též označovány jako „pumpy“. Z f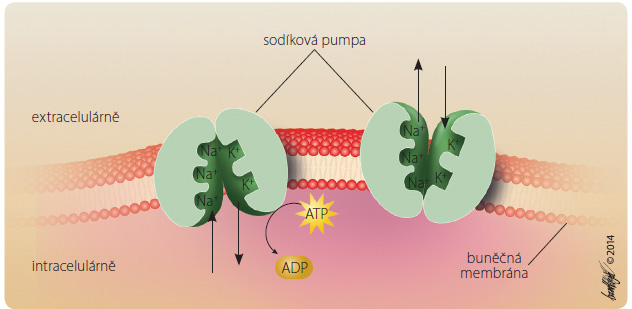 armakologického hlediska jsou důležité iontové transportéry typu ABC sodíková a protonová pumpa. Sodíková pumpa ( Na+/K+ ATPáza) „pumpuje“ Na+ ven z buňky, tlumí ji srdeční glykosidy, digoxin, což vede ke zvýšení hladiny Ca2+ v myokardu a k zesílení jeho kontrakcí.
armakologického hlediska jsou důležité iontové transportéry typu ABC sodíková a protonová pumpa. Sodíková pumpa ( Na+/K+ ATPáza) „pumpuje“ Na+ ven z buňky, tlumí ji srdeční glykosidy, digoxin, což vede ke zvýšení hladiny Ca2+ v myokardu a k zesílení jeho kontrakcí.
Protonová pumpa (H+/K+ ATPáza) „pumpuje“ H+ ven z parietální buňky sliznice žaludku, čímž zvyšuje tvorbu HCl v žaludku. Tlumí ji ireverzibilně inhibitory protonové pumpy, např. omeprazol.Druhým typem transportérů iontů (i molekul – viz dále) jsou transportéry SLC (solute carriers) [7]. J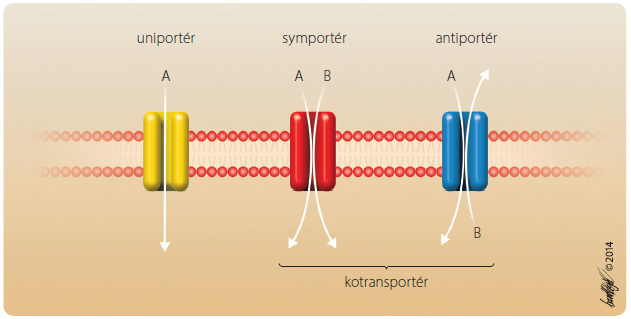 ejich zdrojem energie je přesun iontů koncentračním, elektrochemickým spádem, což jim umožňuje tzv. sekundární aktivní transport (obr. 4). Pokud je pohyb iontů stejnosměrný, bývají označovány jako symportéry, pokud je protichůdný, označují se jako antiportéry (obr. 4) nebo „exchangers“ (výměnné transportéry). Antiportéry i symportéry bývají souhrnně nazývány kotransportéry.
ejich zdrojem energie je přesun iontů koncentračním, elektrochemickým spádem, což jim umožňuje tzv. sekundární aktivní transport (obr. 4). Pokud je pohyb iontů stejnosměrný, bývají označovány jako symportéry, pokud je protichůdný, označují se jako antiportéry (obr. 4) nebo „exchangers“ (výměnné transportéry). Antiportéry i symportéry bývají souhrnně nazývány kotransportéry.
Příkladem antiportéru je výměnný transportér Na+/H+ (Na+/H+ exchanger), příkladem symportéru je kotransportér Na-K-Cl (NKCC). Oba jsou v nefronu a zajišťují reabsorpci Na+, K+, Cl– z primární moče.Výměnný transportér Na+/H+ tlumí thiazidová diuretika, kotransportér Na-K-Cl tlumí kličková diuretika.
Transport molekul a působení farmak
Transport molekul je zajišťován kromě pasivní difuze, endocytózy a exocytózy také transportéry molekul.
Transportéry molekul
Transportéry molekul mohou být opět typu ABC nebo SLC (tab. 2). Platí pro ně to, co bylo uvedeno výše u transportérů iontů typu ABC nebo SLC (obr. 3, 4). Zajišťují transport např. aminokyselin, glukózy, neurotransmiterů, hormonů, farmak a ovšem i jiných xenobiotik do buněk nebo z buněk. Mohou se tak významně podílet na farmakodynamice i farmakokinetice.
Z transportérů molekul typu ABC jsou farmakologicky významné zejména efluxní transportéry P-glykoprotein (P-gp) [8] a BCRP (breast cancer resistance protein) [9] (tab. 2); P-glykoprotein je efluxní pumpa transportující mnoho různých látek z buňky ven. V endocytech střeva snižuje P-gp absorpci látek/léčiv ze střeva, v hepatocytech a v nefronu podporuje P-gp exkreci látek/léčiv do žluči a moči, v hematoencefalické bariéře omezuje vstup látek/léčiv do mozku; podobně přispívá P-gp k bariéře, která má chránit plod v děloze nebo testes před působením xenobiotik.
P-glykoprotein může být léky indukován i inhibován, může být inhibován řadou léčiv či grapefruitovou šťávou, což může výrazně zvýšit biologickou dostupnost léčiv, substrátů P-gp. Nebezpečí hrozí u léčiv s úzkým terapeutickým oknem (např. u digoxinu, kdy se objevují arytmie) či u léčiv s nízkou biologickou dostupností, kdy se např. při podávání simvastatinu zvýší dostupnost více než desetinásobně a zvyšuje se riziko myopatií. Zvýšená aktivita BCRP v průběhu léčby cytostatiky může vést k nízké dostupnosti a k rezistenci vůči některým protinádorovým léčivům.
Z transportérů molekul typu SLC jsou farmakologicky významné zejména transportéry pro noradrenalin (NET, norepinephrine transporter), serotonin (SERT, serotonin reuptake transporter), případně i transportéry pro dopamin (DAT, dopamine transporter) [10]. Jde o sodíko-neurotransmiterové symportéry, které zprostředkovávají zpětné vychytávání uvedených neurotransmiterů ze synaptické štěrbiny zpět do presynaptického nervového zakončení a tak umožňují jejich recyklaci. Tlumí je antidepresiva typu inhibitorů zpětného vychytávání (reuptake inhibitors, RUI) – tricyklická antidepresiva (TCA, tricyclic antidepressants), selektivní inhibitory zpětného vychytávání serotoninu (SSRI, selective serotonin reuptake inhibitors), inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI, serotonin and noradrenaline reuptake inhibitors) aj.
SGLT (sodium-glucose linked transporter) je sodíko-glukózový symportér uplatňující se např. v absorpci glukózy ze střevního lumen do enterocytu nebo v reabsorpci glukózy z primární moče. V nefronu ho inhibují glifloziny – nový typ antidiabetik. Pro nás je zajímavý také tím, že tento typ symportní absorpce glukózy byl poprvé zveřejněn v Praze roku 1960 svým objevitelem R. K. Cranem [11].
Závěr
Iontové kanály i transportní bílkoviny jsou primárním místem působení mnoha klinicky významných léčiv. Tyto pestré bílkovinné jednotky vykazují rozmanitou činnost. Jejich existence a bezvadný chod jsou nepostradatelné pro zdraví, podobně jako je tomu u receptorů a enzymů. Zde jsme se snažili přehledně uvést aspoň ty hlavní iontové kanály a transportní bílkoviny, které jsou důležité pro farmakodynamiku nebo farmakokinetiku. Snad tento přehled napomůže základní orientaci v této rozsáhlé a složité problematice.
Práce byla podpořena programem PRVOUK P 34.
Seznam použité literatury
- [1] Bultas J. Působení léčiva na úrovni receptoru. Remedia 2014; 24: 189–193.
- [2] Bultas J. Působení léčiva na úrovni ovlivnění funkce enzymu. Remedia 2014; 24: 296–300.
- [3] Catterall WA. From ionic currents to molecular mechanisms: The structure and function of voltage-gated sodium channels. Neuron 2000; 26: 13–25.
- [4] Catterall WA. Structure and regulation of voltage-gated Ca2+ channels. Annual Review of Cell and Developmental Biology 2000; 16: 521–555.
- [5] Traynelis SF, Wollmuth LP, Mcbain CJ, et al. Glutamate Receptor Ion Channels: Structure, Regulation, and Function. Pharmacological Reviews 2010; 62: 405–496.
- [6] Higgins CF. ABC transporters: physiology, structure and mechanism – an overview. Research in Mikrobiology 2001; 152: 205–210.
- [7] Hediger MA, Romero MF, Peng JB, et al. The ABCs of solute carriers: physiological, pathological and therapeutic implications of human membrane transport proteins – Introduction. Pflugers Arch 2004; 447: 465–468.
- [8] Murakami T, Takano M. Intestinal efflux transporters and drug absorption. Expert Opin Drug Metab Toxicol 2008; 4: 923–939.
- [9] Higgins CF. Multiple molecular mechanisms for multidrug resistance transporters. Nature 2007; 446: 749–757.
- [10] Gether U, Andersen PH, Larsson OM, Schousboe A. Neurotransmitter transporters: molecular function of important drug targets. Trends Pharmacol Sci 2006; 27: 375–383.
- [11] http://en.wikipedia.org/wiki/Sodium-glucose_transport_proteins (navštíveno 15. 11. 2014)