Specifika farmakoterapie ve stáří
Souhrn:
Juřica J. Specifika farmakoterapie ve stáří. Remedia 2020; 30: 344–348.
Česká populace stárne a s rostoucím věkem pacientů roste i počet užívaných léčiv. Spolu s fyziologickými změnami, které se logicky promítnou do změny farmakokinetiky, se mnohdy mění i cílová místa působení léčiv, tedy farmakodynamika. Změny se projeví na úrovni absorpce, kde se zpomaluje peristaltika, klesá absorpční plocha, roste pH v žaludku a sliznice atrofují. Ve stáří se mění i distribuční poměry. U mnohých léčiv klesá rychlost eliminace, a to nejen na úkor změn metabolické aktivity enzymů cytochromu P450. U starších nemocných může také docházet na jedné straně ke snížené odpovědi na léčivo, na straně druhé (u početnější skupiny léčiv) naopak roste citlivost k některým jejich účinkům. Všechny uvedené faktory přispívají k větší zranitelnosti seniorů, co se týče nežádoucích účinků léčiv, či přímo toxicity. Tento přehledový článek shrnuje nejvýznamnější změny farmakokinetiky a farmakodynamiky u starších nemocných a uvádí příklady léčiv, která mohou být riziková pro starší populaci.
Summary:
Jurica J. Specifics of pharmacotherapy in the elderly. Remedia 2020; 30: 344–348.
The Czech population is ageing and the number of drugs used is growing with the age of patients. Along with physiological modifications, logically reflected in the change of pharmacokinetics, the target sites of drug action (i.e., pharmacodynamics) are often altered as well. Changes occur at the level of absorption – peristalsis slows down, the absorption area decreases, the pH in the stomach increases, and the gastric and intestinal mucosa atrophies. The distribution of drugs changes as well in the elderly. The elimination rate decreases for many drugs, not only due to the changes in the metabolic activity of cytochrome P450 enzymes. Elderly patients also have a reduced response to the drug on one hand, while on the other hand (in more numerous group of drugs), there is an increased sensitivity to some of their effects. All these factors together contribute to the greater susceptibility of the elderly to the adverse effects of drugs and drug‑related toxicity. This review article summarizes the most significant changes in pharmacokinetics and pharmacodynamics in the elderly and provides examples of drugs that may be risky for the elderly population.
Key words: pharmacotherapy, the elderly. pharmacokinetics, pharmacodynamics, polypharmacy
Úvod
Téma farmakoterapie ve stáří rezonuje v odborné literatuře i doporučených postupech odborných společností v posledních dekádách čím dál častěji. Je to dáno především faktem, že nejen v České republice, ale v celé Evropě stoupá průměrný věk populace − zatímco v roce 2001 byl v ČR 39 let, v roce 2017 již 42 let a do roku 2050 by se měl zvýšit na 46,3 roku (predikce Českého statistického úřadu, ČSÚ). S tím také roste podíl seniorů na celkovém počtu obyvatel. Dle ČSÚ byl v roce 2001 podíl seniorů na celkové populaci asi 14 %, ale v roce 2050 by měl představovat téměř 29 % (ČSÚ). S tím dále souvisí i spotřeba léčiv a ekonomické dopady na zdravotnické systémy. Při 15% podílu na české populaci spotřebovávají senioři až 35 % všech užívaných léků, při nárůstu tohoto podílu v příštích letech bude logicky stoupat i celková spotřeba léčiv a tím i náklady. Dle České geriatrické a gerontologické společnosti užívá ve věku 60–64 let alespoň jeden lék 83 % osob, ve věku 65–74 let již 89 % osob a nad 75 let 91–98 % osob. Současně s věkem roste i počet užívaných léků, a to o něco málo více u žen než u mužů. Český senior užívá denně průměrně 4–6 druhů léků, hospitalizovaní senioři a nemocní v dlouhodobé péči samozřejmě ještě více, a sice 5–8 druhů léčiv [1].
S počtem užívaných léčiv logicky stoupá i riziko lékových interakcí, a to i u mladší populace; za hranici, kdy se razantně zvyšuje riziko nevhodné lékové interakce, se pokládá již užívání čtyř léčiv současně [2]. Dle některých zdrojů dosahuje riziko interakce 7 % při užívání více než šesti léčiv, při užívání více než 10 léčiv již 15 %, ovšem při užívání více než 15 léčiv riziko přesahuje 40 % [3].
Mezi faktory zvyšující nebezpečnost farmakoterapie ve stáří patří zejména [1]:
- věkem podmíněné fyziologické změny orgánových funkcí,
- důsledky pro farmakokinetiku,
- důsledky pro farmakodynamiku,
- polymorbidita, atypické projevy onemocnění,
- polypragmazie, „preskripční kaskáda“,
- omezená soběstačnost (pokles kognice, zhoršená pohyblivost a obratnost, poruchy zraku),
- sociální faktory (osamělost, odloučení, ekonomické aspekty),
- nižší compliance.
Polymorbidita spojená s vyšším věkem s sebou nese vyšší počet užívaných léčiv, i když nemusí jít nutně vždy o polypragmazii. Jak již bylo zmíněno, vyšší počet léčiv představuje i vyšší riziko interakcí, ale také vyšší riziko chyby v užívání. Postupem času navíc četnost polypragmazie stoupá [4].
Ke změnám fyziologických funkcí a biochemických pochodů u starších nemocných samozřejmě dochází, nicméně v praxi není jednoduché odlišit, zda jde čistě o změny např. v aktivitě enzymů a transportérů, změny v receptorové denzitě, senzitivitě a signalizaci způsobené stárnutím, nebo je změna účinku léčiv dána spíše přítomností komorbidit a polypragmazie.
Sociální faktory, jako je osamělost, odloučení nebo nižší ekonomický status seniorů (nižší ochota a schopnost doplácet na léky), mohou také negativně ovlivnit compliance. Zhoršení kognitivních schopností, zraku a obratnosti pak může negativně ovlivnit schopnost zacházet správně s různými aplikačními pomůckami (např. inhalátory), popř. správně aplikovat subkutánní injekce nebo správně odměřit dávku léčiva. To vše může vyústit v selhání terapie, ale i ve vyšší toxicitu léčiv. Následující oddíly jsou věnovány především farmakologickým faktorům, přestože i ostatní vlivy mohou zásadně ovlivnit celkový účinek léčiva a je třeba brát tyto faktory při preskripci v potaz. Problematice preskripce u starších nemocných se věnuje hned několik iniciativ: STOPP (Screening Tool of Older Person’s Prescriptions), START (Screening Tool to Alert Doctors to Right Treatment criteria) [5,6], Inappropriate Prescribing in the Elderly Tool (IPET) [7], Beers list [8,9], EURO FORTA (Fit fOR The Aged) [10]. Cílem tohoto článku není sumarizovat, přednést seznam léčiv nevhodných v seniu; tato léčiva lze snadno dohledat v uvedených doporučeních. Cílem je tedy spíše snaha shrnout obecné změny ve farmakokinetice i farmakodynamice, k nimž ve stáří dochází a které přispívají k odlišné reaktivitě na farmakoterapii.
Změny farmakokinetiky
Absorpce
Ve stáří dochází k řadě
fyziologických změn, z nichž některé mohou ovlivnit
farmakokinetické děje, a tím potažmo i účinek léčiv
(tab. 1). Absorpce
některých léčiv začíná již v dutině ústní a například
snížené množství slin u seniorů může ovlivnit
solubilizaci lékové formy. Dilatace jícnu, relaxace dolního
sfinkteru jícnu, neefektivní kontrakce (nevypuzují sousto
distálně) mohou zkomplikovat polykání tablet a podobně jako
dilatace jícnu vést k nevolnosti až emezi, a tím
ke snížené absorpci léčiv. Senioři mají také sníženou
tvorbu žaludeční kyseliny až o 35 % v porovnání
s mladými dospělými, a tedy vyšší pH a prodloužené
žaludeční vyprazdňování [11−13].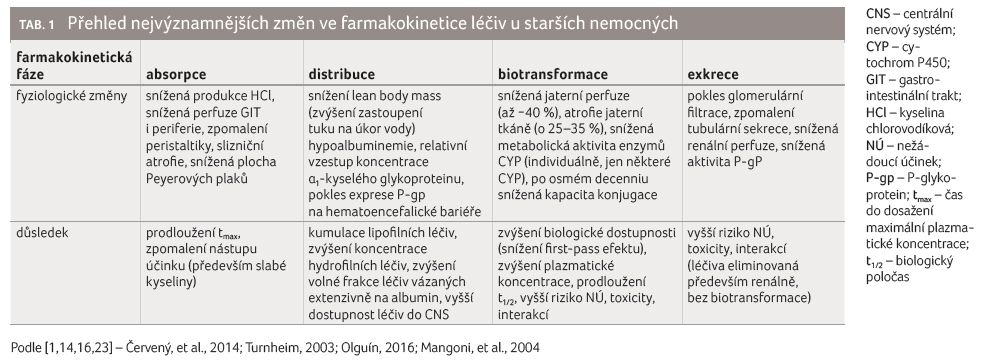
Tyto změny jsou však svou intenzitou menší než změny navozené farmakologicky [14] (anticholinergika, opioidy, konopí). Zvýšené pH v žaludku sníží logicky absorpci léčiv kyselé povahy, na druhou stranu může zvýšit absorpci léčiv zásaditých, jako je metyldopa, deriváty amfetaminů nebo celá řada alkaloidů [15].
U starších osob také klesá až o 50 % prokrvení splanchniku, na čemž se podílí snížený srdeční výdej. Ve stáří se rovněž zpomaluje motilita gastrointestinálního traktu (GIT) a prodlužuje se doba vyprazdňování žaludku. Sliznice obecně podléhá změnám – v průběhu celého GIT dochází k atrofii slizničního povrchu, snížené perfuzi, úbytku Peyerových plaků, fibrotizaci, proliferaci pojivové tkáně, atrofii střevních žláz, častěji také vznikají depozita amyloidu v submukóze. V důsledku výše uvedeného se snižuje absorpční plocha pro pasivní transport léčiv a klesá i počet přenašečů pro aktivní transport [11].
Na druhou stranu ve stáří klesá intenzita presystémové eliminace vlivem snížené metabolické aktivity intestinálních a jaterních biotransformačních enzymů [16,17], čímž dochází ke zvýšení biologické dostupnosti u řady léčiv.
Distribuce
Fyziologické změny spojené se stárnutím mají samozřejmě i důsledky pro distribuci léčiv. Podstatný vliv na distribuci mají jednak změny složení tělních tekutin, zastoupení proteinů, ale také aktivita některých transportérů a změny v aktivitě některých regulačních a homeostatických mechanismů [16]. Jak již bylo zmíněno, pokles minutového srdečního výdeje u starších se projeví zhoršenou perfuzí, a tím pádem distribucí a redistribucí léčiv pomalejší, než je tomu u mladých dospělých [14,16]. Podobný vliv má i nárůst periferní rezistence, ke kterému dochází jednak v důsledku změn pružnosti cévní stěny a dílem také kompenzatorním zvýšením tonu sympatiku v důsledku sníženého srdečního výdeje. Jednou z nejpodstatnějších změn, která se promítne do změn v distribuci léčiv, je snížení množství vody v těle o přibližně 10−15 %, a naopak podstatný vzestup podílu tělesného tuku: u žen ve věku mezi 15. a 65. rokem z 33 % na 48 %, u mužů z 18 % na 36 % [16]. Důsledkem toho je nižší obsah tzv. lean body mass (beztuková tělesná hmota) a narůstající koncentrace hydrosolubilních léčiv; naopak může dojít k redistribuci, a tím pádem k poklesu koncentrace (především maximální plazmatické koncentrace) lipofilních léčiv (amiodaron, cyklosporin, hydroxychlorochin). Dále u většiny starších lidí klesá plazmatická koncentrace albuminu, na čemž se podílí jednak nutritivní etiologie, jednak relativně menší fyzická aktivita seniorů. Naopak stoupá podíl gamaglobulinu i α1 kyselého glykoproteinu. Podstatný je především pokles plazmatické koncentrace albuminu a s ním úbytek vazebných míst léčiv povahy slabých kyselin (např. warfarin, nesteroidní antiflogistika, sulfonamidy, peniciliny) a spíše lipofilních léčiv (cyklosporin A, acitretin). Vážou se na něj však i některé bazické látky (benzodiazepiny) i neutrální léčiva a anionty. Literární údaje o vzestupu hodnoty α1 kyselého glykoproteinu ve stáří se různí, udává se nejen vzestup jeho koncentrace (z 0,6 na 0,7 g/l), ale také žádné změny; jisté je, že dochází ke vzestupu jeho hodnoty u různých typů onemocnění (až na 1,5 g/l). Největší vzestup je zaznamenáván u infekčních onemocnění nebo nádorového bujení; jedná se totiž o tzv. protein akutní fáze [18,19]. Případné změny v koncentraci plazmatického α1 kyselého glykoproteinu ovlivní vazbu především léčiva povahy slabých bází (kationty), jako jsou např. chlorpromazin, verapamil, dipyridamol, vinkristin, tricyklická antidepresiva, imatinib, betablokátory, digoxin nebo primachin.
Nicméně, jiné fyziologické změny, jako je snížení renální funkce, nárůst tukové hmoty, zpomalení jaterní eliminace a snížený srdeční výdej, obecně způsobují klinicky významnější změny ve farmakokinetice než změny navozené odlišnostmi vazby na plazmatické proteiny [20]. Mimo jiné proto se např. při potřebě rychlé digitalizace (nutnosti podat nárazovou dávku digoxinu) má tato dávka odvozovat od lean body mass (která je nižší v porovnání s mladými) [21]. Změny distribučního objemu v důsledku ovlivní i clearance − zvýšení distribučního objemu prodlouží i eliminaci léčiv.
Biotransformace
To, že u starších nemocných dochází ke zpomalení metabolismu léčiv, je všeobecně známý fakt. K tomuto zpomalení však nedochází u všech léčiv, nebo alespoň nikoliv ve stejné míře. Příčiny můžeme hledat v atrofii jaterní tkáně, ve snížené jaterní perfuzi, a dále také v poklesu metabolické aktivity některých enzymů, zejména cytochromu P450 (CYP) a po osmém decenniu života také v poklesu hodnot glukuronidáz.
Pokles celkového objemu a hmotnosti jater je patrný právě u osob starších 65 let, do té doby nedochází k podstatným změnám. Poté však klesá hmotnost jater každý rok o 0,3−1,5 % [16].
Ve věku 65 let činí snížení krevního toku přibližně 40 % [14]; snížená perfuze včetně v. portae se projeví více u léčiv s vysokým extrakčním poměrem/významným first pass efektem (betablokátory, statiny, benzodiazepiny, kalciové blokátory, opioidy). Extrakce těchto léčiv z krve bude tedy nižší a s ohledem na nižší plazmatickou koncentraci albuminu bude také volná frakce vyšší. U některých léčiv a citlivějších jedinců může dojít k pocitu nárazového, silnějšího účinku, zvlášť v období prvotního zavádění léčiva do terapie.
Na aktivitu enzymů CYP má také vliv vzestup koncentrace prozánětlivých cytokinů, jejichž hodnoty jsou ve stáří častěji zvýšené. Ke zpomalení biotransformace dochází u benzodiazepinů, barbiturátů, některých tricyklických antidepresiv, antagonistů kalciových kanálů, betablokátorů, teofylinu, cyklosporinu [1,22].
Co se týče změn u jednotlivých enzymů CYP, většina publikovaných studií je preklinických, efekt byl sledován nejčastěji na potkanech. Zatímco zastoupení některých izoforem, jako jsou CYP1A2 a CYP2C, zůstává v průběhu života víceméně stálé, celkový obsah P450, stejně jako CYP2E1 a CYP3A, je ve vyšším věku snížen [21]. Důležitější z hlediska praxe je však metabolická aktivita – ta je (měřeno ne vždy zcela selektivními substráty jednotlivých forem CYP) snížena v případě CYP1A2 a CYP2C19, snížena nebo nezměněna v případě CYP2C9, CYP3A4 a CYP2A a nezměněna v případě CYP2D6 [14,21]. Podobně i aktivita NADPH reduktázy je s rostoucím věkem také nižší. Inducibilita enzymů CYP může s věkem rovněž klesat, nicméně data nejsou zcela konzistentní [21].
Na druhou stranu v případě proléčiv může dojít k opačnému fenoménu, kdy vlivem sníženého first pass efektu nedochází k dostatečné bioaktivaci léčiva; příkladem jsou inhibitory angiotenzin konvertázy (perindopril, enalapril) [23,24].
Pokles aktivity konjugačních enzymů nebývá tak výrazný jako u enzymů fáze I, a pokud k poklesu dochází, tak až u velmi starých osob (po osmém decenniu života). Proto je v některých případech namístě nahradit léčiva intenzivně metabolizovaná enzymy CYP jinou alternativou, která prochází pouze II. fází biotransformace, např. oxazepam namísto diazepamu nebo alprazolamu. Přestože např. glutathion S transferáza je ve stáří podobně aktivní jako u mladých, může nedostatek substrátu glutathionu konjugaci zpomalit. K tomuto nedostatku nicméně může docházet z nutričních důvodů nejen u starých osob [25,26].
Exkrece
Patrně nejvíce je známo o poklesu
rychlosti eliminace renálně eliminovaných léčiv. Snížení
renálních funkcí u starších osob, zvláště pokles
glomerulární filtrace, ovlivňuje clearance mnoha léčiv,
především (ale nejen) těch, která nejsou metabolizována
a vylučují se v nezměněné formě. Největší klinický
dopad má toto snížení u léčiv s úzkým terapeutickým
oknem. Ve věku mezi 20. a 80. rokem dochází
k poklesu celkového objemu ledvin až o 20 %, ke ztrátě
až 35 % funkčních glomerulů a k poklesu počtu
nefronů o 30 %. Dohromady s poklesem renální perfuze
to znamená pokles glomerulární filtrace asi o 0,5−1 ml/min;
u osob starších 85 let je tak renální eliminační schopnost
ledvin ve srovnání s mladými dospělými přibližně
poloviční [16]. Ke změnám dochází jak u léčiv
vylučovaných tubulární sekrecí (betalaktamy), tak i glomerulární
filtrací (aminoglykosidy). Dalšími léčivy, která se vylučují
renálně jako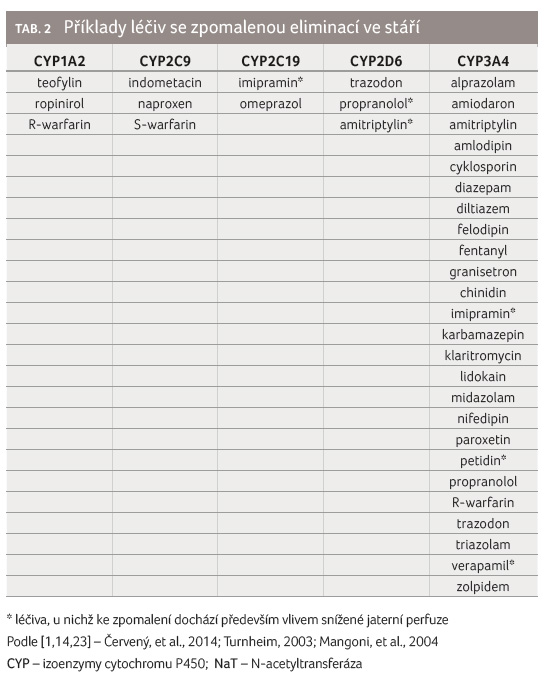 parentní molekuly, jsou některá diuretika,
nesteroidní antiflogistika, digoxin, hydrofilní antibiotika
(aminoglykosidy), hydrofilnější betablokátory nebo lithium [23].
parentní molekuly, jsou některá diuretika,
nesteroidní antiflogistika, digoxin, hydrofilní antibiotika
(aminoglykosidy), hydrofilnější betablokátory nebo lithium [23].
Exprese P glykoproteinu na hematoencefalické bariéře se s věkem snižuje, nicméně neznamená to nutně, že tomu tak je i na jiných místech organismu [27].
Účinky věku na exkreci žlučí
nebyly doposud prozkoumány tak podrobně jako změny renálních
eliminačních mechanismů, navíc se opět jednalo spíše o studie
se zvířecími modely, jejichž výsledky nemůžeme přímo
extrapolovat na lidi. U potkanů se exprese P glykoproteinu
v lymfocytech a játrech s věkem zvyšuje, naopak
v ledvinách se snižuje, ve střevě
a na hematoencefalické bariéře se nemění [28]. Nicméně
hlodavci obecně nejsou ideálním modelem pro výzkum vlivu stárnutí
na farmakokinetiku, nehledě na odlišnosti lidských
a potkaních/myších proteinů rodiny ABC.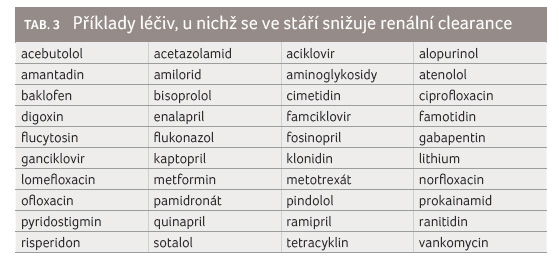
Především z důvodu poklesu
jaterních funkcí, stejně jako poklesu perfuze splanchniku
u starších lidí, je pravděpodobné, že se biliární
clearance s věkem rovněž snižuje. Přehled léčiv, u nichž
se prokázalo zpomalení eliminace, shrnuje tabulka 2, 3. Glukuronidace morfinu je ve stáří
zpomalená, nicméně je to především z důvodu sníženého
jaterního průtoku – aktivita konjugačních enzymů totiž
ve stáří příliš neklesá. Ze stejných důvodů se
zpomaluje i metabolismus amitriptylinu, imipraminu, verapamilu,
propranololu nebo petidinu [14]. Naopak v tabulce 4 jsou uvedena léčiva, u nichž nebyly pozorovány
prokazatelné změny v rychlosti eliminace. Výčet je
ilustrativní; u některých léčiv jsou v literatuře
k nalezení i protichůdné informace.
Změny farmakodynamiky
Některé změny v reaktivitě na léčivo mohou být u starších lidí způsobeny i změnami na úrovni cílových míst působení léčiv, tedy nikoliv jen prostou změnou v koncentraci v místě účinku. Zobecňovat v tomto případě také nelze, protože můžeme najít příklad zvýšené i snížené odpovědi. Aby bylo možné seriózně popsat tyto změny, je nutné vždy sledovat účinek v kontextu plazmatické koncentrace. Přesto se i tak můžeme dopustit mírné nepřesnosti − s ohledem na někdy špatnou korelaci plazmatická koncentrace−koncentrace v místě účinku [23].
U starších pacientů dochází u mozku (i u jiných orgánů) k poklesu objemu hmoty a současně i počtu neuronů. Množství šedé hmoty kontinuálně klesá s věkem, zatímco množství bílé hmoty se relativně nemění; klesá však počet synapsí [14,29].
Příkladem zvýšené odpovědi na léčivo (při nezměněných koncentracích) je deprese funkcí CNS spojená s expozicí sedativním léčivům (hypnotika, anxiolytika a anticholinergika). Tato deprese CNS je závažnější u starších pacientů ve srovnání s mladšími, a to právě i po korekci dávek s ohledem na změny farmakokinetiky zmiňované výše (tj. při nezměněné expozici ve srovnání s mladšími). Mechanismus těchto změn není plně objasněn, nicméně klinická zkušenost je vcelku konzistentní a přesvědčivá [14,30]. Známá je tak zvýšená citlivost k účinkům benzodiazepinů, starší pacienti jsou citlivější jak na celkový sedativní účinek, tak také na poruchy rovnováhy po podání benzodiazepinů [23]. Starší pacienti jsou rovněž citlivější k nežádoucím účinkům především starších neuroleptik (tato jsou méně selektivní, mají anticholinergní, antihistaminergní, α1 antiadrenergní a jiné složky účinku). Jedná se tedy především o extrapyramidovou symptomatologii, arytmie, delirium a posturální hypotenzi [23,31,32]. Zhoršení kognice po podání anticholinergik pronikajících do CNS je známo a představuje predikovatelný stav; situaci může zhoršovat i nižší vyplavování acetylcholinu u zdravých starších osob [33] a překvapivě také pokles GABA ergní signalizace v kortexu v CNS [34].
Zhoršení intelektových schopností bývá dáváno do souvislosti i s použitím periferně působících antihypertenziv (kalciové blokátory, kličková diuretika). Současně však neléčená hypertenze může zapříčinit totéž [14].
Prodloužení QT intervalu a riziko arytmií roste s věkem, mj. z důvodu „fyziologického“ prodlužování QT intervalu u starších (zdravých) osob [35]. Riziko arytmií hrozí obecně u léčiv prodlužujících QT interval (antipsychotika, některá antidepresiva, antiarytmika, chinolony, setrony, diuretika, anticholinergika, některé tyrozinkinázové inhibitory, azolová antimykotika). Na druhé straně například novější antipsychotika (multireceptoroví antagonisté − MARTA, antagonisté serotoninových a dopaminových receptorů − SDA), některá novější antidepresiva (léčiva inhibující zpětné vychytávání serotoninu − SARI, SSRI) mají riziko prodlouženého QT intervalu výrazně nižší než starší antipsychotika první generace nebo tricyklika [14].
Již dlouho je známa zvýšená senzitivita seniorů na gastrotoxicitu nesteroidních antiflogistik, kdy výskyt krvácivých komplikací je až trojnásobný oproti mladým dospělým [14].
Dalším takovým příkladem je zvýšená antihypertenzní účinnost diltiazemu nebo verapamilu (jistě i podíl farmakokinetiky), zvýšený antikoagulační účinek warfarinu. Příčina zvýšené antikoagulační odpovědi na warfarin při srovnatelné plazmatické koncentraci není známa; naproti tomu odpověď na heparin se s věkem nemění [14].
Naopak ve stáří je snížená odpověď na diuretický efekt furosemidu (a diuretik obecně). Podobně klesá i citlivost β adrenergních receptorů, a to jak na stimulaci (izoprenalin, salbutamol), tak i na jejich blokádu (betablokátory − antihypertenzní účinek) [23]. Tento efekt je však dán několika faktory – buď přímo down regulací a relativním nadbytkem noradrenalinu, nebo také sníženou aktivací/stimulací α2 adrenergních receptorů a zvýšeným vyplavováním noradrenalinu [14].
Diskutuje se také o vlivu na úrovni postreceptorového přenosu signálu, tedy snížení syntézy cyklického adenosin monofosfátu (cAMP) po stimulaci receptoru [36]. U α adrenergních receptorů podobný efekt pozorován nebyl [23,37], což je příčinou zvýšené incidence ortostatické hypotenze po antagonistech α1 adrenergních receptorů právě u starších pacientů. Obecně jsou senioři k ortostatické hypotenzi navozené léky citlivější a objevuje se u nich s frekvencí až 33 %, což může přispívat k synkopě a pádu. Údajně až 11 % případů synkopy může být navozeno léčbou [38].
Změny v reaktivitě cévního systému mohou být navozeny i změnami v uvolňování oxidu dusnatého, popř. jeho zrychleným rozkladem [14,39]. Zajímavé ale je, že odpověď na exogenně podané nitráty zůstává nezměněna [30]. U žen je možné postmenopauzální změny v endoteliální reaktivitě zvrátit hormonální substituční léčbou [40,41].
Přestože je pravda, že starší nemocní mají v průměru odlišné některé fyziologické proměnné ovlivňující účinek léčiv, nelze přímo zobecňovat všechna doporučení a brát v potaz jen kalendářní věk. V rámci stejné věkové kategorie jsou v populaci pacienti ve velmi odlišné fyzické kondici a stavu fyziologických funkcí, směrodatný je proto biologický věk. Starší nemocní tak vyžadují především individualizovaný přístup založený na komplexním posouzení stavu nemocného (fyziologických funkcí, komorbidit) a také lékových interakcí a kognitivních funkcí, schopností pacienta porozumět správnému užívání léku a zacházení s aplikačními pomůckami. Cílem by měla být individualizovaná, racionální, bezpečná a účinná farmakoterapie realizovaná s co nejnižším počtem léčiv. Současně by vyšší věk pacienta neměl být důvodem k neopodstatněným obavám z farmakoterapie a „podléčení“, nebo dokonce neléčení starších pacientů.
Seznam použité literatury
- [1] Červený R, Topinková E. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. In: Býma S, Fialová D, Jurašková B, Matějovská‑Kubešová H, eds: Centrum doporučených postupů pro praktické lékaře; 2014: 1−32.
- [2] Bjerrum L, Søgaard J, Hallas J, Kragstrup J. Polypharmacy: correlations with sex, age and drug regimen. A prescription database study. Eur J Clin Pharmacol 1998; 54: 197−202.
- [3] May FE, Stewart RB, Cluff LE. Drug interactions and multiple drug administration. Clin Pharmacol Ther 1977; 22: 322−328.
- [4] Wastesson JW, Morin L, Tan ECK, Johnell K. An update on the clinical consequences of polypharmacy in older adults: a narrative review. Expert Opin Drug Saf 2018; 17: 1185−1196.
- [5] Gallagher P, Ryan C, Byrne S, et al. STOPP (Screening Tool of Older Person's Prescriptions) and START (Screening Tool to Alert doctors to Right Treatment). Consensus validation. Int J Clin Pharmacol Ther 2008; 46: 72−83.
- [6] Topinková E, Mádlová P, Fialová D, Klán J. New evidence‑based criteria for evaluating the appropriateness of drug regimen in seniors. Criteria STOPP (screening tool of older person’s prescriptions) and START (screening tool to alert doctors to right treatment). Vnitr Lek 2008; 54: 1161−1169.
- [7] Barry PJ, O’Keefe N, O’Connor KA, O’Mahony D. Inappropriate prescribing in the elderly: a comparison of the Beers criteria and the improved prescribing in the elderly tool (IPET) in acutely ill elderly hospitalized patients. J Clin Pharm Ther 2006; 31: 617−626.
- [8] Swagerty D, Brickley R, Association AMD, Pharmacists ASoC. American Medical Directors Association and American Society of Consultant Pharmacists joint position statement on the Beers List of Potentially Inappropriate Medications in Older Adults. J Am Med Dir Assoc 2005; 6: 80−86.
- [9] Vingerhoets RW, van Marum RJ, Jansen PA, Geriatrie WKGvdNVvK. The Beers List as an aid to prevent adverse drug reactions in elderly patients. Ned Tijdschr Geneeskd 2005; 149: 2099−2103.
- [10] Pazan F, Weiss C, Wehling M, FORTA. The EURO‑FORTA (Fit fOR The Aged) List: International Consensus Validation of a Clinical Tool for Improved Drug Treatment in Older People. Drugs Aging 2018; 35: 61−71.
- [11] D’Souza AL. Ageing and the gut. Postgrad Med J 2007; 83: 44−53.
- [12] Evans MA, Triggs EJ, Cheung M, et al. Gastric emptying rate in the elderly: implications for drug therapy. J Am Geriatr Soc 1981; 29: 201−205.
- [13] Soenen S, Rayner CK, Horowitz M, Jones KL. Gastric Emptying in the Elderly. Clin Geriatr Med 2015; 31: 339−353.
- [14] Turnheim K. When drug therapy gets old: pharmacokinetics and pharmacodynamics in the elderly. Exp Gerontol 2003; 38: 843−853.
- [15] Merfeld AE, Mlodozeniec AR, Cortese MA, et al. The effect of pH and concentration on alpha‑methyldopa absorption in man. J Pharm Pharmacol 1986; 38: 815−822.
- [16] Olguín HJ, Medina RA, Asseff IL. The influence of oldness on pharmacokinetics and drug disposition. In: Juárez OH, Lares AI, eds. Optimization of Drug Prescribing in Elderly. Nova Science Publishers, Inc; 2016: 109−124.
- [17] Ljungberg B, Nilsson‑Ehle I. Pharmacokinetics of ciprofloxacin in the elderly: increased oral bioavailability and reduced renal clearance. Eur J Clin Microbiol Infect Dis 1989; 8: 515−520.
- [18] Paxton JW, Briant RH. Alpha 1‑acid glycoprotein concentrations and propranolol binding in elderly patients with acute illness. Br J Clin Pharmacol 1984; 18: 806−810.
- [19] Veering BT, Burm AG, Souverijn JH, et al. The effect of age on serum concentrations of albumin and alpha 1‑acid glycoprotein. Br J Clin Pharmacol 1990; 29: 201−206.
- [20] Grandison MK, Boudinot FD. Age‑related changes in protein binding of drugs: implications for therapy. Clin Pharmacokinet 2000; 38: 271−290.
- [21] Wauthier V, Verbeeck RK, Calderon PB. The effect of ageing on cytochrome p450 enzymes: consequences for drug biotransformation in the elderly. Curr Med Chem 2007; 14: 745−757.
- [22] Dostálek M, Juřica J, Janoštíková E, Pistovčáková J. Farmakokinetika. Vol 1. Praha: Grada, 2006.
- [23] Mangoni AA, Jackson SH. Age‑related changes in pharmacokinetics and pharmacodynamics: basic principles and practical applications. Br J Clin Pharmacol 2004; 57: 6−14.
- [24] Todd PA, Fitton A. Perindopril. A review of its pharmacological properties and therapeutic use in cardiovascular disorders. Drugs 1991; 42: 90−114.
- [25] Lang CA, Naryshkin S, Schneider DL, et al. Low blood glutathione levels in healthy aging adults. J Lab Clin Med 1992; 120: 720−725.
- [26] Erden‑Inal M, Sunal E, Kanbak G. Age‑related changes in the glutathione redox system. Cell Biochem Funct 2002; 20: 61−66.
- [27] Chiu C, Miller MC, Monahan R, et al. P‑glycoprotein expression and amyloid accumulation in human aging and Alzheimer's disease: preliminary observations. Neurobiol Aging 2015; 36: 2475−2482.
- [28] Warrington J, Greenblatt D, von Moltke L. The effect of age on P‑glycoprotein expression and function in the Fischer‑344 rat. J Pharmacol Exp Ther 2004; 309: 730−736.
- [29] Katzman R. Human nervous system. In: Masoro EJ, ed. Handbook of Physiology. Vol 11. Oxford University Press; 1995: 325−344.
- [30] Abernethy DR. Aging effects on drug disposition and effect. Geriatr Nephrol Urol 1999; 9: 15−19.
- [31] Gregory C, McKenna P. Pharmacological management of schizophrenia in older patients. Drugs Aging 1994; 5: 254−262.
- [32] Maixner S, Mellow A, Tandon R. The efficacy, safety, and tolerability of antipsychotics in the elderly. J Clin Psychiatry 1999; 60(Suppl 8): 29−41.
- [33] Kompoliti K, Goetz CG. Neuropharmacology in the elderly. Neurol Clin 1998; 16: 599−610.
- [34] Porges E, Woods A, Edden R, et al. Frontal Gamma‑Aminobutyric Acid Concentrations Are Associated With Cognitive Performance in Older Adults. Biol Psychiatry Cogn Neurosci Neuroimaging 2017; 2: 38−44.
- [35] Reardon M, Malik M. QT interval change with age in an overtly healthy older population. Clin Cardiol 1996; 19: 949−952.
- [36] Vestal RE, Wood AJ, Shand DG. Reduced beta‑adrenoceptor sensitivity in the elderly. Clin Pharmacol Ther 1979; 26: 181−186.
- [37] Pan HY, Hoffman BB, Pershe RA, Blaschke TF. Decline in beta adrenergic receptor‑mediated vascular relaxation with aging in man. J Pharmacol Exp Ther 1986; 239: 802−807.
- [38] Verhaeverbeke I, Mets T. Drug‑induced orthostatic hypotension in the elderly: avoiding its onset. Drug Saf 1997; 17: 105−118.
- [39] Taddei S, Virdis A, Mattei P, et al. Aging and endothelial function in normotensive subjects and patients with essential hypertension. Circulation 1995; 91: 1981−1987.
- [40] Herrington D, Braden G, Williams J, Morgan T. Endothelial‑dependent coronary vasomotor responsiveness in post menopausal women with and without estrogen replacement therapy. Am J Cardiol 1994; 73: 951−952.
- [41] Reis S, Gloth S, Blumenthal R, et al. Ethinyl estradiol acutely attenuates abnormal coronary vasomotor responses to acetylcholine in postmenopausal women. Circulation 1994; 89: 52−60.