Terapeutické monitorování léčiv – klinické poznámky k vybraným skupinám léčiv
Cílem tohoto článku je seznámit čtenáře s možnostmi a úskalími použití terapeutického monitorování léčiv (therapeutic drug monitoring, TDM) u některých skupin léčiv na základě zkušenosti podpořené uvedenými kazuistikami. Důraz je kladen na multidisciplinární spolupráci a velmi komplexní interpretaci výsledků měření koncentrace látek v daném biologickém vzorku. TDM je nástrojem racionální terapie, která by měla vést nejen ke zlepšení stavu, ale i k zabránění vzniku nežádoucích následků terapeutické intervence, nebo alespoň k jejich zmírnění.
Úvod
Terapeutické monitorování léčiv (TDM) je obvykle využíváno u léčiv s podloženými důvody pro použití TDM a praktickými zkušenostmi s nimi; přehled léčiv, při jejichž podávání se v našich podmínkách používá TDM, uvádí tab. 1.
TDM antibiotik
Většina z běžně používaných antibiotik (ATB) – betalaktamy, makrolidy a chinolony – má široký terapeutický index, a proto není třeba monitorovat jejich hladiny při podávání nemocným. Existuje ale celá skupina aminoglykosidů (AMG) a glykopeptidů (vankomycin a eventuálně teikoplanin), jejichž koncentrace v biologických tekutinách se při léčení infekčních chorob v indikovaných případech monitorují – na jednu stranu pro nebezpečí nedostatečného účinku a možnosti vzniku rezistence mikroorganismu při nízkých hladinách léčiva, na druhou stranu pro nebezpečí toxického poškození nemocného při předávkování.
V této kapitole se zaměříme pouze na terapeutické monitorování těch ATB, jejichž sledování se v našich podmínkách velmi dobře osvědčilo z hlediska racionální farmakoterapie. Pokud jde o monitorování ATB, věnujeme zatím velkou pozornost AMG (amikacin, gentamicin, tobramycin) a některým z glykopeptidových ATB (vankomycin).
Aminoglykosidy
Kritéria, podle kterých se doporučuje optimalizace terapie, nejsou neměnná. Již před lety bylo prokázáno, že baktericidní účinek aminoglykosidových ATB závisí na dosažené maximální koncentraci léčiva (tedy čím vyšší vrchol – peak, tím větší účinek), respektive na poměru této koncentrace a minimální inhibiční koncentrace inhibující 90 % testovaných kmenů mikroorganismů (MIC90), které vyvolaly příslušnou infekci. Podle relativně neaktuální publikace se dá optimální účinnost AMG očekávat při vrcholové koncentraci, která je 6–10násobkem MIC90 infekčního agens [1].
I délka postantibiotického efektu je důležitou součástí účinku některých ATB, přímo úměrně závisí na dosažené maximální koncentraci ATB. Hodnota MIC90 daného mikroorganismu je proto důležitá nejen při volbě ATB při empirické terapii, ale i při rozhodování o výši jednotlivé dávky a délce dávkovacího intervalu.Známá a obávaná nefrotoxicita a ototoxicita AMG naproti tomu závisí spíše na době expozice vysokým tkáňovým koncentracím těchto látek, ke kterým dochází se zpožděním za koncentracemi v séru. Ani snaha o udržení se v terapeutickém rozmezí sérových koncentrací např. gentamicinu (2–10 mg/l, s podmínkou nepřekročit hodnotu 2 mg/l na konci dávkovacího intervalu) při dávkování po 8 hodinách totiž nezaručila absenci toxických následků terapie.
Tyto poznatky umožnily přijmout dávkování v tzv. režimu once-daily, kdy se (za předpokladu normálních renálních funkcí) celá denní dávka léku aplikuje nemocnému v jediné i.v. infuzi. Je výhodné rychle docílit vysoké maximální sérové koncentrace nad horní hranicí terapeutického rozmezí (tzv. therapeutic range) trvající pouze krátkou dobu (≈ 1 hod.). Při relativně dlouhém postantibiotickém efektu u této skupiny ATB je pak správné doporučit takový režim dávkování, při kterém sérové koncentrace na konci dávkovacího intervalu klesají pod konvenční terapeutický limit. Při nízké sérové koncentraci ATB dochází k jakémusi očišťování ledvinných tubulů a endolymfy vnitřního ucha od toxicky působících AMG. Tento terapeutický přístup je antimikrobiálně účinný, pro nemocného bezpečnější a rovněž i levnější.
Způsob podávání AMG v režimu once-daily významně změnil předchozí zásady pro monitorování těchto léčiv a zpochybnil, ba dokonce znemožnil spoléhání se na jakési populační průměrné terapeutické rozmezí hladin, které nemá být při opakovaném podávání dávek léčiva nemocnému překročeno. U této skupiny léků jsme svědky posílení vlivu optimalizace dávkování na základě individuálních hladin, s použitím vhodného softwaru k výpočtu farmakokinetických parametrů.
Terapie AMG jednou denně má ale svá omezení. Při opakovaném podávání léčiva jeho koncentrace samozřejmě neustále kolísají mezi minimem (před podáním další dávky) a maximem (po aplikaci). Posuzuje se i doba expozice sérovým koncentracím AMG nad terapeutickým rozmezím. Několikahodinové období toxických sérových koncentrací AMG u nemocných se snížením renálních funkcí, kteří nedovedou rychle eliminovat léčivo, je důvodem, proč se u těchto nemocných nedoporučuje režim once-daily, ale redukce jednotlivých dávek.
Předpoklad citlivosti původce infekce je hlavním, ale nikoli jediným faktorem, který ovlivňuje rozhodování o výši jednotlivé dávky a délce dávkovacího intervalu. Další problém přináší značná interindividuální variabilita kinetických parametrů AMG, např. u těžce nemocných osob. Zaske a kol. [2, 3] publikovali své zkušenosti s podáváním gentamicinu chirurgickým pacientům: přestože jim zprvu podávali běžně doporučenou dávku 3,5 mg/kg/den,potřebovalo 47 % nemocných dávky vyšší, a naopak 14 % pacientů dávky nižší k tomu, aby se jejich sérové koncentrace nacházely v požadovaném terapeutickém rozmezí. Tyto rozdíly mezi jednotlivými nemocnými byly způsobeny obrovskými interindividuálními rozdíly v distribučním objemu léčiva (0,06–0,63 l/kg) v porovnání s literární normou 0,25 l/kg. Velikost distribučního objemu AMG zhruba odpovídá objemu extracelulární tekutiny, mění se např. s věkem (vyšší je u dětí, ve stáří klesá), ale především se mění za patolo![Graf 1 Stoupající sérová koncentrace kreatininu v průběhu léčby amikacinem v režimu once-daily a její pokles až po vysazení léku; podle [6] – Tesfaye, et al., 2007](https://www.remedia.cz/photo-a-29931---.jpg) gických stavů spojených s expanzí objemu extracelulární tekutiny (edémy nejrůznějšího původu a lokalizace). Zvýšení distribučního objemu bylo pozorováno rovněž při umělé plicní ventilaci, zhoršeném žilním návratu a při léčbě kortikoidy.
gických stavů spojených s expanzí objemu extracelulární tekutiny (edémy nejrůznějšího původu a lokalizace). Zvýšení distribučního objemu bylo pozorováno rovněž při umělé plicní ventilaci, zhoršeném žilním návratu a při léčbě kortikoidy.
Rychlost eliminace, další kinetický parametr AMG, zase velmi citlivě reaguje na sebemenší změny funkce ledvin. Jak již v minulosti potvrdili Hickling a kol. [4, 5], u septicky nemocných nekoreluje ani clearance kreatininu, ani (tím hůře) koncentrace sérového kreatininu spolehlivě s hodnotou clearance AMG. Z uvedených faktů vyplývá nespolehlivost odhadů dávkování podle populačních údajů, a naopak nutnost použít výpočet kinetických parametrů s![Graf 2 Počítačem asistovaná simulace oscilace a skutečně naměřené hladiny amikacinu při režimu once- -daily s hladinou stoupající do vysazení léku; podle [6] – Tesfaye, et al., 2007.](https://www.remedia.cz/photo-a-29932---.jpg) amotného léčiva a nutnost použít TDM k optimalizaci terapie AMG už na počátku léčení nemocných, především pak u nemocných v sepsi, s projevy polymorbidity nebo multiorgánového selhávání a nestabilního stavu.
amotného léčiva a nutnost použít TDM k optimalizaci terapie AMG už na počátku léčení nemocných, především pak u nemocných v sepsi, s projevy polymorbidity nebo multiorgánového selhávání a nestabilního stavu.
Na grafu 1 a 2 je uveden případ 70letého muže, kterému byl podán amikacin v režimu once-daily s typickou kumulací léčiva, extrémně toxickými hladinami a evidentním stoupáním sérové koncentrace kreatininu do doby, než byl lék zcela vysazen. Tento případ je důkazem toho, že ani režim once-daily není bezpečný pro všechny pacienty, není-li možnost včasného monitorování [6].
Kromě o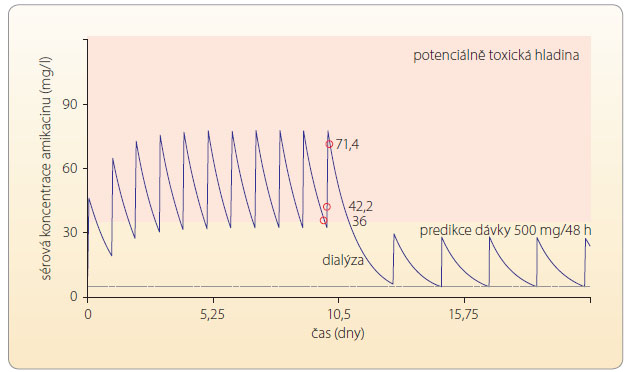 rgánově podmíněného onemocnění ledvin vedoucího k funkčnímu selhání je funkce ledvin sekundárně ohrožena snížením perfuze jak při významně nižší ejekční frakci při srdečním selhání, tak při septickém stavu vyvolaném i bakteriální infekcí. Také tyto stavy je nutno pečlivě monitorovat, aby nedošlo k dalším komplikacím vyžadujícím ještě komplikovanější intervenci, např. dialýzu v důsledku kumulace neurotoxického ATB, viz graf 3.
rgánově podmíněného onemocnění ledvin vedoucího k funkčnímu selhání je funkce ledvin sekundárně ohrožena snížením perfuze jak při významně nižší ejekční frakci při srdečním selhání, tak při septickém stavu vyvolaném i bakteriální infekcí. Také tyto stavy je nutno pečlivě monitorovat, aby nedošlo k dalším komplikacím vyžadujícím ještě komplikovanější intervenci, např. dialýzu v důsledku kumulace neurotoxického ATB, viz graf 3.![Graf 4 Úprava dávkování amikacinu na základě TDM; podle [7] – Tesfaye, et al., 2013. Při včasné determinaci hladiny amikacinu bylo možné předejít závažné kumulaci léčiva vedoucí ke zhoršení renálních funkcí u pacienta pokročilého věku.](https://www.remedia.cz/photo-a-29934---.jpg) V případě včasného monitorování a úpravy dávkovacího režimu lze do určité míry předejít problémům tak, jak demonstruje graf 4 u konkrétního pacienta léčeného amikacinem při relativní renální insuficienci i vzhledem k věku (víc než 70 let).
V případě včasného monitorování a úpravy dávkovacího režimu lze do určité míry předejít problémům tak, jak demonstruje graf 4 u konkrétního pacienta léčeného amikacinem při relativní renální insuficienci i vzhledem k věku (víc než 70 let).
V každém případě farmakokinetický servis vedený s TDM podle dosavadních zkušeností nejenže napomáhá efektivní eliminaci bakteriálního agens, ale má i farmakoekonomický význam, jak již bylo publikováno v zahraničí. Například podle práce Destache a kol. [8–10] farmakokinetický servis při léčbě AMG významně zkrátil délku hospitalizace a vedl v jedné studii dokonce k úsporám 2 220 540 amerických dolarů ročně u 500 pacientů, což by znamenalo úsporu kolem 4441 amerických dolarů ročně na pacienta [8–10]. Přestože zatím nejsou známy podobné studie u nás, lze obzvláště u hospitalizovaných pacientů očekávat přinejmenším podobnou situaci.
Vankomycin
Jiná situace je u dalšího monitorovaného ATB, vankomycinu, jehož postantibiotický efekt je relativně nevýznamný a při jehož monitorování se musíme řídit terapeutickým rozmezím po celou dobu dávkovacího intervalu.
Farmakodynamika vankomycinu je jiná, baktericidní efekt je spíše závislý na trvání hladin nad MIC90 příslušného mikroba. Jeho postantibiotický efekt je kratší, pokud vůbec nějaký, a panuje obecná shoda v tom, že nemůžeme doporuči![Graf 5 Počítačem asistovaná ukázka kumulace vankomycinu u pacienta se závažnou infekcí v průběhu terapie dávkou 500 mg/6 h; podle [11] – Tesfaye, 2012.](https://www.remedia.cz/photo-a-29935---.jpg) t takové dávkovací schéma, které by vedlo k oscilacím sérových hladin klesajících byť i na krátkou dobu pod minimální účinnou hodnotu (obvykle 5 mg/l). Nicméně variabilita kinetických parametrů vankomycinu je také značná, a doporučuje se proto monitorovat jeho hladiny. Jen tak můžeme posuzovat optimálnost terapie u konkrétního nemocného i při jeho variabilních nebo měnících se eliminačních schopnostech. Farmakokinetika vankomycinu se může v průběhu terapie měnit i u jednotlivce, který měl iniciálně normální eliminaci. Na grafu 5 je uveden případ pacienta s iniciální přijatelnou hladinou vankomycinu, u kterého došlo po několika dnech ke kumulaci, následkem čehož muselo být podávání léku přerušeno na dalších několik dní. Proto je důležité hladiny monitorovat v průběhu terapie, aby se dalo posuzovat, zda je terapie optimální u konkrétního nemocného vzhledem
t takové dávkovací schéma, které by vedlo k oscilacím sérových hladin klesajících byť i na krátkou dobu pod minimální účinnou hodnotu (obvykle 5 mg/l). Nicméně variabilita kinetických parametrů vankomycinu je také značná, a doporučuje se proto monitorovat jeho hladiny. Jen tak můžeme posuzovat optimálnost terapie u konkrétního nemocného i při jeho variabilních nebo měnících se eliminačních schopnostech. Farmakokinetika vankomycinu se může v průběhu terapie měnit i u jednotlivce, který měl iniciálně normální eliminaci. Na grafu 5 je uveden případ pacienta s iniciální přijatelnou hladinou vankomycinu, u kterého došlo po několika dnech ke kumulaci, následkem čehož muselo být podávání léku přerušeno na dalších několik dní. Proto je důležité hladiny monitorovat v průběhu terapie, aby se dalo posuzovat, zda je terapie optimální u konkrétního nemocného vzhledem![Graf 6 Ilustrace počítačem asistované simulace hladiny vankomycinu v programu MW/PHARM u staršího pacienta s rychle progredující změnou renální funkce; podle [12] – Tesfaye, et al., 2012. Záznam znázorňuje, jak lze v programu MW/PHARM na základě pozorovaných hodnot (červené kruhy) odhadnout optimální dávkovací režim.](https://www.remedia.cz/photo-a-29936---.jpg) k variabilním nebo měnícím se eliminačním funkcím. Zvláštní pozornost je nutno věnovat současnému podávání nefrotoxických léků, jako jsou AMG, kde se zvyšuje riziko toxicity. Je třeba brát ohled na určité části populace, jaké představuje zejména oblast geriatrie, pediatrie, a na zvláštní stavy, jako jsou sepse, popáleniny, neutropenie, endokarditida a cystická fibróza, kde je nutný individuální přístup. Graf 6 demonstruje kumulující se hladiny vankomycinu jako důkaz alterované eliminační funkce i po přerušení dávkování.
k variabilním nebo měnícím se eliminačním funkcím. Zvláštní pozornost je nutno věnovat současnému podávání nefrotoxických léků, jako jsou AMG, kde se zvyšuje riziko toxicity. Je třeba brát ohled na určité části populace, jaké představuje zejména oblast geriatrie, pediatrie, a na zvláštní stavy, jako jsou sepse, popáleniny, neutropenie, endokarditida a cystická fibróza, kde je nutný individuální přístup. Graf 6 demonstruje kumulující se hladiny vankomycinu jako důkaz alterované eliminační funkce i po přerušení dávkování.
Shrnutí problematiky TDM antibiotik
V této subkapitole je velmi stručně shrnut problém měnících se kritérií při monitorování zástupných parametrů terapeutické účinnosti některých ATB v souvislosti s novými poznatky farmakodynamiky a farmakokinetiky těchto látek u nemocných. Monitorování hladin aminoglykosidových a glykopeptidových ATB je nezbytné nejen během měnících se eliminačních schopností, ale v indikovaných případech i k dosažení optimálně účinného a bezpečného léčení infekce. Zvláště citliví jsou starší multimorbidní pacienti, pokud není TDM provedeno včas [12, 13]. Pro správný farmakokinetický odhad jsou obvykle potřeba alespoň dvě hodnoty hladin: 1. na konci dávkovacího intervalu (tzv. trough), 2. za půl hodiny po ukončení infuze u AMG a za hodinu po i.v. infuzi u vankomycinu (tzv. peak).
Vedle administrativních a identifikačních dat nemocného na žádance se vzorkem pro TDM považujeme za nezbytné pro predikci dalšího dávkování tyto údaje:
- o nemocném: klinický stav, důvod požadavku TDM (optimalizace dávkování, suspektní toxicita, změny eliminačních funkcí), hmotnost, výška, parametry renálních funkcí, případně čas a trvání dialýzy;
- o původci infekce, případně jaká je jeho citlivost (MIC90);
- o léku: název, aplikační cesta, dávka léku a čas poslední dávky, dávkovací interval, současně podávané léky;
- o času odběru vzorku biologického materiálu (datum a hodina).
- preanalytická (rozhodnutí o dávkovacím režimu, žádost o monitorování s odůvodněním a doplněním důležitých informací o pacientovi);
- analytická (měření hladiny použitím ověřené metody, např. FPIA – fluorescenční polarizační imunoesej);
- postanalytická (výsledky analýzy vyhodnocené na základě klinických dat a pomocí vhodného softwaru s použitím Bayesovy metody výpočtu individuálních kinetických parametrů nemocného).
- doporučenou další dávku léku,
- doporučený dávkovací interval,
- případné doporučení dalšího odběru vzorku ke kontrole hladin léčiva.
Závěrečné výsledky TDM, samozřejmě včetně doporučení optimální další dávky léku a dávkovacího intervalu, sdělujeme ošetřujícímu lékaři co nejdříve, nejpozději před podáním uvažované další dávky. Zásadně nepovažujeme za užitečné sdělení pouhého číselného výsledku analýzy bez provedené predikce oscilací hladin v celém dávkovacím intervalu. Bez kvalifikované interpretace a farmakokinetického zhodnocení nemá ošetřující lékař k dispozici prostředky k optimalizaci dávkování léku, neboť konvenční, tzv. terapeutické rozmezí sérové koncentrace léčiva má jen hrubě orientační význam.
TDM antimykotik
Zde se krátce zmíníme o azolových antimykotikách, s jejichž používáním je zkušenost z hlediska TDM relativně slušná i u nás.
Itrakonazol
Itrakonazol je podáván především perorálně jako suspenze v profylaxi mykotických infekcí. Jeho biologická dostupnost je však velmi variabilní, což indikuje úpravu dávek na základě titrace hladin v krvi (správněji TDM) při ustáleném stavu. Riziko vzniku lékových interakcí, připočtené k horší toleranci itrakonazolu ve srovnání s jinými léčivy ve skupině azolů, která vede k nižší compliance nemocného, je dalším důvodem k TDM tohoto léku [14]. Navíc u vysokého procenta pacientů, zejména dětí (40–70 %), není při konvenčně doporučeném dávkování dosaženo žádoucí terapeutické hladiny, což může v důsledku vést k selhání cílené léčby. Na základě faktů a vlastností tohoto léku je doporučeno dávkovat itrakonazol individuálně, podle exaktních hladin [15].
Vorikonazol
Vorikonazol se stal významnou alternativou v léčbě invazivní aspergilózy, a to zejména v poslední době, po zkušenostech se závažnou toxicitou amfotericinu B, viz obr. 1; vorikonazol je také používán k profylaxi u příjemců argonových transplantací sp ojených s vysokým rizikem [16, 17].Vedle flukonazolu je nejvíce zkušeností s použitím azolů u dětí právě s vorikonazolem. Při konvenčním jednotném podávání se však jeho plazmatické koncentrace liší mezi pacienty až stonásobně v souvislosti s mnoha faktory, mimo jiné i v důsledku polymorfismu v oblasti CYP2C19, zprostředkujícího jeho metabolismus, a věkem danými rozdíly. Od uvedení flukonazolu do klinického použití bylo dávkování pro děti upravováno v závislosti na výsledcích nových farmakologických studií a na zkušenostech s TDM především u dětí mladších dvou let. V průběhu roku 2010 publikovala řada pracovišť svoje zpravidla retrospektivní zkušenosti s TDM u dětí léčených vorikonazolem v perorální i parenterální formě. Děti byly léčeny zpravidla až dvojnásobně vyšší dávkou parenterálního vorikonazolu proti dospělým (až 8 mg/kg/dávka vs. 4 mg/kg/dávka) a k dosažení terapeutických hladin při perorální formě podávání potřebovaly stejné dávky jako dospělí (2 × 200 mg) už od věku nad 6 let. U menších dětí (2–6 let) se však i tyto dávky častěji ukázaly jako nedostatečné [18–23]. Vzhledem k tomu, že není možno jednoduše určit optimální dávku pro optimální léčebný efekt, lze TDM považovat za pomocný nástroj při léčbě vorikonazolem zvláště u dětí [24].
ojených s vysokým rizikem [16, 17].Vedle flukonazolu je nejvíce zkušeností s použitím azolů u dětí právě s vorikonazolem. Při konvenčním jednotném podávání se však jeho plazmatické koncentrace liší mezi pacienty až stonásobně v souvislosti s mnoha faktory, mimo jiné i v důsledku polymorfismu v oblasti CYP2C19, zprostředkujícího jeho metabolismus, a věkem danými rozdíly. Od uvedení flukonazolu do klinického použití bylo dávkování pro děti upravováno v závislosti na výsledcích nových farmakologických studií a na zkušenostech s TDM především u dětí mladších dvou let. V průběhu roku 2010 publikovala řada pracovišť svoje zpravidla retrospektivní zkušenosti s TDM u dětí léčených vorikonazolem v perorální i parenterální formě. Děti byly léčeny zpravidla až dvojnásobně vyšší dávkou parenterálního vorikonazolu proti dospělým (až 8 mg/kg/dávka vs. 4 mg/kg/dávka) a k dosažení terapeutických hladin při perorální formě podávání potřebovaly stejné dávky jako dospělí (2 × 200 mg) už od věku nad 6 let. U menších dětí (2–6 let) se však i tyto dávky častěji ukázaly jako nedostatečné [18–23]. Vzhledem k tomu, že není možno jednoduše určit optimální dávku pro optimální léčebný efekt, lze TDM považovat za pomocný nástroj při léčbě vorikonazolem zvláště u dětí [24].
Při podávání vorikonazolu v primární či sekundární profylaxi se můžeme setkat s nežádoucím účinkem v podobě kožní fotosenzitivity až těžké fototoxicity [25]. Proto je TDM tohoto léku doporučeno obzvláště u speciální populace, jakou jsou transplantovaní [26].
Navíc nestabilita metabolismu a tím nelineární kinetika znemožňuje dost dobře predikovat správnou dávku, aniž by se stanovovala koncentrace léčiva u jednotlivce. Přes existenci nepřesností je prokázána bezpečnost a účinnost koncentrace v rozmezí 1–5,5 mg/l z odběru na konci dávkovacího intervalu (trough level) s tím, že selhání terapie vorikonazolem byla u pacientů často spojena s hladinou „trough“ < 1 mg/l a encefalopatie byla pozorována jen u pacientů s hladinou vorikonazolu „trough“ > 5,5 mg/l, což opět diktuje nutnost TDM při podávání tohoto antimykotika [27].
Posakonazol
Před několika lety byla publikována multicentrická, spíše retrospektivní zkušenost s podáváním posakonazolu jako záchranné (tzv. salvage) léčby – s vysokou pravděpodobností se jednalo o mykotické infekce u 15 dětí ve věku od 3 let. V té době bohužel nebyla u většiny pacientů stanovována hladina léku v krvi (TDM), a proto nelze farmakokinetiku/farmakodynamiku s jistotou komentovat, až na fakt, že k nejčastěji pozorovaným nežádoucím účinkům patřily gastrointestinální obtíže (nauzea, průjem, bolesti břicha) [28]. Dnes je nicméně TDM standardem i při podávání tohoto lék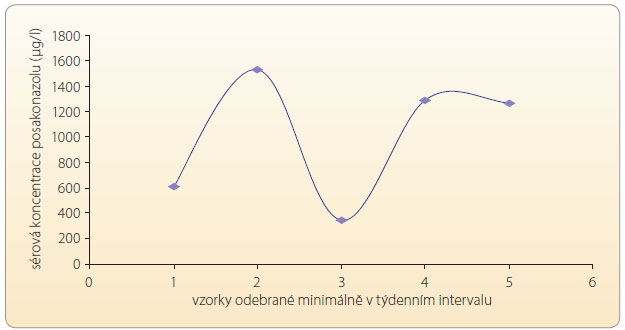 u, a to jak u dospělých, tak u dětí. Při použití precizních metod analýzy, které by minimalizovaly interference, při velmi opatrné a komplexní interpretaci a následné intervenci má TDM i v případě léčby antimykotiky praktický přínos pro kvalitu péče o pacienta i z důvodu nestability hladin u individuálního pacienta, viz graf 7.
u, a to jak u dospělých, tak u dětí. Při použití precizních metod analýzy, které by minimalizovaly interference, při velmi opatrné a komplexní interpretaci a následné intervenci má TDM i v případě léčby antimykotiky praktický přínos pro kvalitu péče o pacienta i z důvodu nestability hladin u individuálního pacienta, viz graf 7.
TDM některých antidepresiv
Antidepresiva jsou skupinou léčiv, při jejichž podávání často dochází k nežádoucím účinkům, mimo jiné i z důvodu jejich zneužití a incidentálního předávkování. Ani selhání terapeutického efektu, byť z důvodů non-compliance nebo tolerance, není vzácností. Proto je intervalové monitorování terapie užitečné.
Amitriptylin
Při podávání amitriptylinu je plazmatické koncentrace v ustáleném stavu dosaženo obvykle během 7–10 dnů po zahájení léčby, přesto se optimální klinický farmakodynamický efekt objeví opožděně (až za 4–6 týdnů). Hlavní aktivní metabolit nortriptylin by měl být pro relevantnější interpretaci a eventuální optimalizaci dávky také monitorován, nicméně genetický polymorfismus v oblasti CYP2D6 je poměrně častý a personalizace léčby by se v ideálním případě měla opírat o fenotypizaci. Pro rutinní sledování je však zatím TDM s perfektní a komplexní interpretací praktické i dnes. Při dalším pokroku farmakogenetiky by mělo testování hladiny zůstat spíše u toxikologického významu než u terapeutického monitorování, dostupnost fenotypizace totiž může pomoci skutečné personalizaci medicíny.
Lithium
Lithium je v klinické praxi používáno velmi dlouho zejména pro léčbu maniodepresivních syndromů. Terapeutické rozmezí lithia není pro rozhodnutí o tom, zda pacient trpí nežádoucím účinkem, nebo ne, spolehlivé. Je typickým příkladem léku s úzkým terapeutickým indexem a vysoce variabilní toxikodynamikou. Již při hladině 1,5–2,5 mmol/l může docházet ke středně těžkým projevům toxicity a hladina lithia vyšší než 3,5 mmol/l může být život ohrožující. Pacientův stav je třeba interpretovat velmi komplexně a doporučit jeho intenzivní sledování – při akutní intoxikaci může být hladina lithia mnohonásobně překročena, avšak klinické symptomy přesto nemusejí být ze začátku zřetelné; takovými se stanou až ve chvíli, kdy dojde k nasycení nervových tkání po distribuci s markantními klinickými projevy. Naopak po dialyzačním odstranění značného množství léku může být hladina ještě vysoká v důsledku tzv. rebound fenoménu, kdy se lék z tkáňové distribuce vrátí do plazmy. Proto má být po hemodialyzační intervenci hladina ještě sledována.
TDM antiepileptik
Rutinní TDM antiepileptik by mělo být indikováno po dosažení ustáleného stavu. Přesto mohou být vzorky při vybraných zvláštních situacích (např. akutní interkurentní nemoc ovlivňující farmakokinetické a farmakodynamické parametry, podezření na intoxikaci nebo náhlé zhoršení záchvatů po dlouhodobě stabilizovaném stavu) odebrány v neustáleném stavu. Vzhledem k významné vazbě na bílkoviny je u některých antiepileptik vhodnější monitorování sérové koncentrace volné frakce, mimo jiné i z důvodu sledování kinetiky nultého řádu. Celková (total) plazmatická koncentrace zahrnuje i frakce vázané na plazmatické bílkoviny, což bude znamenat změny stavu při kompetenci léků vázajících bílkoviny i chorobné stavy ovlivňující množství krevních bílkovin, jako je hypoalbuminemie, zvláště při koincidenci s uremií a nefrotickým syndromem a obecně při ztrátách plazmatických bílkovin do moči.
Ethosuximid
Předpokládá se, že existuje dobrá korelace mezi plazmatickou koncentrací a dávkou ethosuximidu. Terapeutický index je také relativně velký. Přesto je toxicita při relativně delším čase potřebném k dosažení ustáleného stavu (5–7 dnů u dětí a 10–14 dnů u dospělých) neprediktabilní.
Fenobarbital
Fenobarbital je známým induktorem enzymů rodiny CYP. Výsledky zjištěné ze vzorku před dosažením ustáleného stavu (1–2 týdny u dětí a 2–4 týdny u dospělých ) jsou obvykle nepoužitelné, jedině k potvrzení diagnózy toxicity. Přesto může sériové sledování hladiny u předávkovaného pacienta pomoci při intenzivní péči. Pro rutinní kontrolu jsou hladiny ze vzorku odebraného na konci dávkovacího intervalu po dlouhodobé kompenzaci adekvátní. Při přidání inhibitoru, např. valproátu sodného, k fenobarbitalu je nutné a životně důležité pečlivě titrovat hladiny a eventuálně vést terapii podle výsledku, jinak může mít velmi těžko zvladatelné následky ve smyslu lékové interakce a toxicity [29]. Je třeba zdůraznit, že primidon se nakonec metabolizuje na fenobarbital, a monitorovat by se tudíž měl i fenobarbital, dostává-li pacient lék primidon jako parentní látku. U jedinců s vysokou metabolizační schopností může být hladina fenobarbitalu dokonce vyšší než hladina podávaného primidonu, což indikuje TDM obou látek.
Fenytoin
Fenytoin má nejen úzký terapeutický index, ale také vykazuje saturační kinetiku, což znamená, že i malé zvýšení dávky může způsobit značné zvýšení koncentrace vedoucí k nežádoucímu a neočekávanému účinku. Monitorování fenytoinu je proto považováno za významný krok k optimalizaci dávkování. Bohužel jeho TDM je často odkázáno na měření celkové hladiny, přitom fenytoin patří mezi léky s velmi vysokou vazbou na plazmatické bílkoviny. Mnohdy může pacient trpět předávkováním, i když se celková hladina nachází v tzv. normě. Pro farmakodynamický efekt je totiž rozhodující volná frakce a celková hladina nám o ní nic neřekne. Proto je třeba velké opatrnosti při interpretaci hladiny fenytoinu u pacientů s hypoalbuminemií, s nefrotickým syndromem a s další medikací s vysokou vazbou na albumin v plazmě.
Gabapentin
Podle dostupných dat [30] je absorpce gabapentinu velmi rapidní a maximální koncentrace je dosaženo obvykle za 2–3 hodiny po aplikaci. Poločas eliminace je 5–7 hodin, ustáleného stavu dosahuje gabapentin během 1–2 dnů. Vzhledem k tomu, že se látka eliminuje výlučně ledvinami v nezměněné formě, údaj o stavu renálních funkcí je velmi relevantní informací pro zvážení TDM, interpretaci výsledku a eventuální optimalizaci dávky. Také je logické ještě více zvážit TDM, jde-li o pacienta, který při relativní renální insuficienci dlouhodobě užívá současně s gabapentinem jiné nefrotoxické léky. Pouhý fakt, že gabapentin není ani induktorem, ani inhibitorem enzymů, ho tak nevylučuje ze seznamu kandidátních léků pro TDM. Data extrahovaná ze zkušenosti s TDM gabapentinu mohou v budoucnu ukázat i úzkou souvislost mezi jeho hladinou a efektem a tím vytvořit konvenční praktické terapeutické rozmezí.
Karbamazepin
Karbamazepin indukuje vlastní metabolismus, takže dosažení ustálené terapeutické hladiny může trvat řadu týdnů (2–4) od zahájení léčby. Proto je dávka za účelem dosažení žádoucí koncentrace pro optimální klinický efekt pomalu stupňována. Výběr metody měření k určení metabolitu, hlavně epoxidu tohoto léku, je velmi důležitý [31], jelikož metabolit je aktivní a toxičtější než parentní látka. Proto se zde vyplatí monitorovat pomocí vysokoúčinné kapalinové chromatografie (high-performance liquid chromatography, HPLC) jak karbamazepin, tak jeho antiepilepticky aktivní metabolit epoxid-karbamazepin; indikace tohoto léku je ještě širší než jen jako antiepileptikum, jeho monitorování a toxikodynamické sledování bude nezbytné, ne-li v takové frekvenci, jako je tomu u indikace pro léčbu určité kategorie epilepsie.
Levetiracetam
Levetiracetam, jehož indikací je hlavně refrakterní parciální epilepsie nebo parciálně generalizovaný záchvat, patří mezi relativně nové generace antiepileptik. Je také doporučován u juvenilní myoklonické epilepsie (tonicko-klonické křeče). Toto léčivo, které bylo původně vyvinuto pro léčbu trigeminální neuralgie, má dnes široké použití nejen v epileptologii, ale také u psychiatrických a neurologických poruch včetně autismu, bipolárních poruch, úzkostných poruch a také u Alzheimerovy nemoci. Levetiracetam má lineární kinetiku, neváže se významně na plazmatické bílkoviny, není ani problém s jeho absorpcí a vylučuje se převážně renálně. Z farmakokinetických vlastností levetiracetamu nevyplývá, že by jeho hladiny měly být u každého pacienta monitorovány. Na rozdíl od mnoha antiepileptik není induktorem ani inhibitorem enzymů, a tak se ani příliš neobáváme lékových interakcí. Přesto je-li k dispozici precizní metoda analýzy, může TDM levetiracetamu významně přispět k odhalení non-compliance a také ke správné titraci dávky u pacientů s renální insuficiencí nebo u těhotných žen, kde dochází ke změnám parametrů renální funkce v souvislosti s fází gravidity.
Terapeutické rozmezí hladin levetiracetamu také není zatím zcela jednotné, přesto lze hladiny „trough” 5–45 μg/ml považovat pro většinu pacientů za referenční s tím, že při hodnotách nacházejících se v blízkosti horní hranice rozpětí je třeba ostražitosti kvůli potenciální toxicitě. Nicméně existují také publikované práce, které dokládají, že odpověď na léčbu je závislá na koncentraci, i když s jistotou není určena koncentrace spojená s nežádoucími účinky [32].
Lamotrigin
Současné podávání lamotriginu s jinými antiepileptiky má značný vliv na clearance tohoto léčiva. Např. valproát může zdvojnásobit jeho poločas (24–48 hodin), karbamazepin a fenobarbital jeho poločas zkracují na zhruba 12 hodin. Existují důkazy o tom, že toxicita lamotriginu je na koncentraci závislá. Velmi významné je monitorování lamotriginu u těhotných, kde je eliminace jiná než v jiném období. V prvním měsíci těhotenství může u žen, které užívají lamotrigin, docházet v důsledku vyšší eliminace v prvním trimestru k dekompenzaci již plně kontrolované epilepsie, není-li dávkování pečlivě monitorováno a dávka patřičně titrována. Navíc přítomnost v mateřském mléce dosahující až 60 % hladiny v séru kojící matky je důvodem k monitorování i u novorozence v tzv. režimu plného kojení, aby mohla být učiněna případná opatření v zájmu dítěte.
Valproát
Antikonvulzivní aktivita a toxicita valproátu nevykazuje jednoduchý vztah s jeho plazmatickou koncentrací. Proto bylo rutinní měření koncentrace obecně považováno za málo přínosné, mimo jiné i pro jeho relativně krátký plazmatický poločas způsobující velkou variabilitu mezi jednotlivými dávkami. Přesto je jeho monitorování, vzhledem k jeho inhibičnímu vlivu na eliminaci jiných antiepileptik, stále považováno za užitečné. Mimo jiné existují důkazy o toxikodynamickém vztahu při dlouhodobém užívání samotného valproátu. Proto je TDM přínosem k monitoraci terapie při podávání tohoto léku.
Vigabatrin
Vigabatrin patří do novější generace antiepileptik, předpokládalo se, že nevstupuje do farmakokinetických interakcí s ostatními antiepileptiky, a tudíž by měření jeho hladiny nepřineslo nijak významné poznatky k ovlivnění individuální dávky. Vezmeme-li přesto v úvahu, že vigabatrin ireverzibilně inhibuje enzym GABA-transaminázu a tím zvyšuje koncentraci kyseliny γ-aminomáselné (GABA) v mozku, přičemž důsledkem je snížení propagace abnormálních excitačních aktivit, může být účinek GABA při kombinaci se synergicky působícími látkami extrémní a dojde k útlumu až k somnolenci. Proto není ani monitorování tohoto antiepileptika zbytečné, zvláště při polyterapii v zájmu toxikodynamiky.
TDM theofylinu
Plazmatická koncentrace theofylinu predikuje jak intenzitu bronchodilatačního efektu, tak hrozbu toxického účinku. Je důležité uvědomit si, že theofylin může být významně metabolizován na kofein u novorozenců a u těch dospělých, u nichž došlo k poruše jaterního metabolismu tohoto léku. U těchto jedinců tak lze očekávat veškerý efekt kofeinu. Hladina theofylinu může být u konzumentů kávy zvýšena jak skutečně (následkem částečné biotransformace kofeinu na theofylin), tak falešně (následkem interference s kofeinem při použití imunochemických metod k determinaci hladiny). Proto je při poruchách srdečního rytmu v přímé časové souvislosti s maximální plazmatickou koncentrací theofylinu třeba pečlivě interpretovat hladiny s ostatními markery, jako je např. sérové kalium. Při otravě theofylinem doprovázené arytmií může současně dojít k závažné hypokalemii, což jsme při konkrétním incidentu pozorovali v minulosti [33].
TDM cytostatik
Využití TDM v oblasti cytostatik má bohužel mnoho úskalí. Lineární souvislosti mezi koncentrací v tělních tekutinách a efektem na nádorové buňky nebo s koncentrací v místě účinku nejsou zdaleka jasné. Přesto má bližší monitorování hladin a farmakokinetické hodnocení v několika případech (methotrexát, busulfan, platinové komplexy – karboplatina, cisplatina, oxaliplatina) své opodstatnění. Například při myeloablativní indikaci busulfanu před plánovanou transplantací kostní dřeně se ukázala predikce plochy pod křivkou plazmatické koncentrace (AUC) jako přínosná hlavně z hlediska předcházení nežádoucím účinkům. Přesto je následné terapeutické monitorování nutné i z důvodu intraindividuální variability [34, 35].
Monitorování hladiny methotrexátu se vyplatí při léčbě mimořádně vysokými dávkami. I pro vedení tzv. rescue therapy (záchranná léčba v případě předávkování) počítáme s použitím antidota leukovorinu. Někdy zůstává i podání vysoké dávky leukovorinu bez efektu a dojde k významnému opoždění eliminace, jež vyžaduje mimořádnou intervenci [36].
V poslední době se ukázalo, že použitím AUC v souladu s renálními funkcemi pacienta lze karboplatinu aplikovat přesněji a předcházet tak nebezpečí toxicity. Velkou naději skýtá v případě podávání karboplatiny i možnost chemoredukce solidních nádorů paralelně s terapeutickým monitorováním AUC pomocí limitovaných vzorků [35, 36]. Přesto jsou hladiny jako takové, vzhledem k vlastnosti nádoru, hlavně s expresí genu tzv. MDR (multi-drug resistance) málo užitečné, až na potvrzení možné toxicity předávkováním. Někdy je obtížné pacientům s renálním selháním zároveň adekvátně dávkovat cytostatika, která se eliminují ledvinami. V rámci cyklického podávání cytostatik je často stanovení dávky pro další cyklus dáno mezinárodním protokolem určení dávky pomocí TDM u prvního cyklu. Např. u cisplatiny není bez významu [39![Graf 8 Změny koncentrace cisplatiny ve vzorcích ultrakoncentrátu u dialyzovaného pacienta v prvním a druhém léčebném cyklu; podle [39] – Tesfaye, et al., 2012.](https://www.remedia.cz/photo-a-29939---.jpg) ], jak znázorňuje graf 8 níže. Graf ukazuje, jak lze pomocí titrace cisplatiny v ultrafiltrátu odhadnout adekvátní dávku u dialyzovaného pacienta s diagnózou malobuněčného karcinomu plic. Zde je poukázáno na to, jak je predikovaná dávka ve druhém cyklu, ve srovnání s prvním cyklem, blíže efektivní protinádorové expozici.
], jak znázorňuje graf 8 níže. Graf ukazuje, jak lze pomocí titrace cisplatiny v ultrafiltrátu odhadnout adekvátní dávku u dialyzovaného pacienta s diagnózou malobuněčného karcinomu plic. Zde je poukázáno na to, jak je predikovaná dávka ve druhém cyklu, ve srovnání s prvním cyklem, blíže efektivní protinádorové expozici.
TDM mů![Graf 9 Úprava dávky i.v. busulfanu na základě TDM; podle [40] – Tesfaye, et al., 2014. Ilustrace případu, kde cílové (target) AUC nebylo dosaženo na bázi dávky fixně stanovené podle tělesné hmotnosti pacienta – dítěte, jemuž byl při přípravě na transplantaci kmenových buněk (HSCT) podáván i.v. busulfan. Graf dokumentuje typickou intraindividuální variabilitu s nutností dalšího monitorování a patřičné úpravy dávek. AUC – plocha pod křivkou plazmatické koncentrace; HSCT – hematopoietic stem cell transplantation; TDM – terapeutické monitorování léčiv](https://www.remedia.cz/photo-a-29940---.jpg) že velmi významně přispět k úspěchu přípravné terapie busulfanem před transplantací kmenových buněk; podle vlastních zkušeností lze doložit vysokou inter- a intraindividuální variabilitu vyžadující TDM u těch pacientů, jak dětských, tak dospělých, kde iniciální dávka stanovená na základě tělesné hmotnosti není úplně věrohodná, jak je ilustrováno v grafu 9 a 10a, b [40, 41]. V této kapitole nebylo považováno za nutné detailně rozebírat význam TDM pro optimalizaci léčby, neboť cílová skupina léků, při jejichž podávání je TDM rutinní praxí, byla s výjimkou cytostatik již vcelku dostatečně představena v kapitole minulé. Nicméně sledování kinetiky cytostatik v souv
že velmi významně přispět k úspěchu přípravné terapie busulfanem před transplantací kmenových buněk; podle vlastních zkušeností lze doložit vysokou inter- a intraindividuální variabilitu vyžadující TDM u těch pacientů, jak dětských, tak dospělých, kde iniciální dávka stanovená na základě tělesné hmotnosti není úplně věrohodná, jak je ilustrováno v grafu 9 a 10a, b [40, 41]. V této kapitole nebylo považováno za nutné detailně rozebírat význam TDM pro optimalizaci léčby, neboť cílová skupina léků, při jejichž podávání je TDM rutinní praxí, byla s výjimkou cytostatik již vcelku dostatečně představena v kapitole minulé. Nicméně sledování kinetiky cytostatik v souv![Graf 10a, b Ukázka nespolehlivosti predikce AUC podle prvních dávek s nutností titrace pomocí TDM k dosažení cílové AUC při přípravném režimu před HSCT jak u dospělého (a), tak u pediatrického pacienta (b); podle [41] – Tesfaye, et al., 2013. HSCT – hematopoietic stem cell transplantation](https://www.remedia.cz/photo-a-29941---.jpg) islosti s dynamikou má velkou budoucnost podporovanou myšlenkou personalizace medicíny, včetně geno-fenotypizace, alespoň u potenciálně vysoce toxických cytostatik, jak již bylo zmíněno.
islosti s dynamikou má velkou budoucnost podporovanou myšlenkou personalizace medicíny, včetně geno-fenotypizace, alespoň u potenciálně vysoce toxických cytostatik, jak již bylo zmíněno.
TDM imunosupresiv
Imunosupresiva se prokazatelně podílejí na úspěchu transplantace. Tyto léky vyžadují bližší monitorování nejen pro svůj úzký terapeutický index, ale také pro vysokou interindividuální variabilitu farmakokinetických parametrů. TDM je nedílnou součástí transplantačního protokolu [42–44]. Cyklosporin, takrolimus, sirolimus a mykofenolát mofetil jsou běžně monitorovány. Přesnost a specificita měření jsou v této oblasti fundamentální pro správnou interpretaci. HPLC s UV detekcí jsou považovány za zlatý standard pro cyklosporin.
Dosažení udržovací cílové hladiny C2 (plazmatická koncentrace léčiva naměřená po 2 hod. od podání dávky) po transplantaci plic je spojeno s nižší incidencí akutního odhojení štěpu a bronchoobliteračního syndromu, se zachováním renálních funkcí a s výborným krátkodobým přežitím ve srovnání s historickými kontrolními případy hladiny C0 (plazmatická koncentrace před podáním další dávky léčiva). ,,Trough“ hladiny u kyseliny mykofenolové poklesly o 50 % při kombinaci s cyklosporinem ve srovnání s kombinací s takrolimem.
Ve srovnání s pacienty bez cystické fibrózy, kterým byla provedena transplantace plic, vyžadovali pacienti s cystickou fibrózou k dosažení terapeutické hladiny o 30 % vyšší dávku mykofenolát mofetilu. Pacienti s cystickou fibrózou také potřebovali k dosažení podobné expozice vyšší dávky takrolimu než nemocní bez cystické fibrózy. Proto by měl být populační model pro pacienty s cystickou fibrózou proveden odděleně od pacientů bez cystické fibrózy. Výše uvedené okolnosti a fakt, že imunosupresiva jsou podávána jak profylakticky, tak terapeuticky, nás vedou k závěru, že jejich monitorování je u transplantací obligátní a u jiných indikací přinejmenším mandatorní. Problém lékové interakce a interindividuální variability diktuje přednostní monitorování pacientů právě při léčbě těmito látkami. Potenciální toxicita u těchto léků je známým důvodem k pravidelné monitoraci, přestože není jednotný názor na terapeutické rozmezí mimo transplantační užití [45].
Velmi dobře popsanými projevy toxicity imunosupresiv jsou:
- vyšší náchylnost k infekcím;
- organotoxicita podle použitých imunosupresiv (kalcineurinová imunosupresiva jsou obecně neurotoxická);
- dysbalance některých komponentů vnitřního prostředí, např. cyklosporin může dlouhodobě vést k hypercholesterolemii;
- hypertenze – někdy je považována za důsledek vazookluzivního působení některých imunosopresiv;
- nelze ignorovat ani psychologický dopad hirsutismu jako vedlejší účinek léčby některými imunosupresivy.
Přestože nejsou zatím klinicky pozorovány, není vyloučena existence dalekosáhlých vedlejších účinků imunosupresiv včetně nových nežádoucích účinků.
TDM kardiotonik a antiarytmik
Digoxin má velmi úzký terapeutický index a vyžaduje pečlivou optimalizaci dávkovacího režimu. Měřené výsledky je možno správně interpretovat pouze za předpokladu, že odběr vzorku je proveden po ukončení distribuční fáze (tedy 6 hodin po aplikaci). Eliminace digoxinu je silně ovlivněna stavem renálních funkcí. Proto je při současném podávání potenciálně nef![Graf 11 Ilustrace kumulující se koncentrace digoxinu u staršího pacienta při užívání obvyklé chronické udržovací dávky digoxinu. Roli mohla pravděpodobně hrát údajná kombinace s amiodaronem (indikován pro arytmie po trombektomii, hladina neurčena); podle [46] – Tesfaye, et al., 2005.](https://www.remedia.cz/photo-a-29942---.jpg) rotoxických a výlučně renálně se eliminujících léčiv nebo jiných léčiv, která blokují eliminaci digoxinu, třeba dostatečné opatrnosti. U pacientů s alterací renálních funkcí s léčbou digoxinem může při podávání běžné dávky docházet ke kumulaci, jak ukazuje graf 11. Digoxin je velmi problematický lék v tom, že sérová koncentrace ne vždy odpovídá pozorovanému účinku. Přesto má TDM tohoto léku své opodstatnění, jelikož může určit intervenci, včetně aplikace antidot, podle měřené koncentrace.
rotoxických a výlučně renálně se eliminujících léčiv nebo jiných léčiv, která blokují eliminaci digoxinu, třeba dostatečné opatrnosti. U pacientů s alterací renálních funkcí s léčbou digoxinem může při podávání běžné dávky docházet ke kumulaci, jak ukazuje graf 11. Digoxin je velmi problematický lék v tom, že sérová koncentrace ne vždy odpovídá pozorovanému účinku. Přesto má TDM tohoto léku své opodstatnění, jelikož může určit intervenci, včetně aplikace antidot, podle měřené koncentrace.
Toxicita digoxinu není závislá pouze na měřené hladině, ale také na jiných faktorech, jako jsou elektrolyty, zejména kalium a magnezium, věk, chorobný stav srdce, dále jiná současně podávaná léčiva. Např. senzitivitu myokardu na digoxin mohou zvýšit následující stavy: hypokalemie, hyperkalcemie, hypomagnezemie, hypoxemie, hypotyroidismus, a tím vést k toxicitě i při běžné hladině. Naopak senzitivitu na digoxin mohou snížit stavy hypokalcemie a hypertyroidismu. Ve vyšším věku stoupá riziko toxicity digoxinu i z důvodu vyšší senzitivity myokardu starších [47]. Naopak myokard dětský je vůči digoxinu relativně méně senzitivní. U prokainamidu, lidokainu a quinidinu byla již prokázána užitečnost TDM.
V případě modernějších antiarytmik, jako je amiodaron, neexistuje jednoznačný názor na monitorování, přesto klinické případy potvrzují nezbytnost TDM, zvláště pokud je amiodaron podáván současně např. s digoxinem, kde hrozí potenciální nebezpečí kumulace digoxinu vedoucí ke zhoršení arytmie, viz graf 11; důvodem jsou vzájemné lékové interakce, jejichž důsledkem je větší riziko intoxikace digoxinem.
Závěr
Posledních deset let je věnována velká pozornost personalizaci medicíny jako modernímu léčebnému přístupu, který překonává tzv. strategii „one fits all“. Metody založené na genotypizaci a fenotypizaci nejsou bohužel zatím rutinně dostupné pro všechny pacienty (z hlediska relevantnosti použití a dostupnosti metod pro všechna léčiva). TDM chápaná jako činnost vysoce interdisciplinární povahy zatím představuje velmi dobře osvědčený způsob individualizace terapie. Přes existující úskalí, při správně zvolené metodě analýzy, kvalifikované interpretaci v kontextu jak laboratorních, tak klinických parametrů je TDM velmi užitečnou disciplínou umožňující sofistikovaněji aplikovat princip racionální farmakoterapie.
Seznam použité literatury
- [1] Moore RD, Lietman PS, Smith CR. Clinical response to aminoglycoside therapy: importance of the ratio of peak concentration to minimal inhibitory concentration. J Infect Dis 1987; 155: 93–99.
- [2] Zaske DE, Cipolle RJ, Strate RG, et al. Rapid gentamicin elimination in obstetric patients. Obstet Gynecol 1980; 56: 559–564.
- [3] Zaske DE, Cipolle RJ, Rotschafer JC, et al. Individualizing amikacin regimens: accurate method to achieve therapeutic concentrations. Ther Drug Monit 1991; 13: 502–506.
- [4] Hickling K, Begg E, Moore ML. A prospective randomised trial comparing individualised pharmacokinetic dosage prediction for aminoglycosides with prediction based on estimated creatinine clearance in critically ill patients. Intensive Care Med 1989; 15: 233–237.
- [5] Hickling KG, Begg EJ, Perry RE, et al. Serum aminoglycoside clearance is predicted as poorly by renal aminoglycoside clearance as by creatinine clearance in critically ill patients. Crit Care Med 1991; 19: 1041–1047.
- [6] Tesfaye H, Jedlickova B, Prusa R. Evidence of renal function deterioration on once-daily administration of amikacin in an elderly patient: a warning case. Klin Biochem Metab 2007; 15: 49–52.
- [7] Tesfaye H, Jedlickova B, Prusa R, et al. Aged patients with concomitant cardiac disease are certainly prone to toxicity with potentially nephrotoxic antibiotics commonly used: Case series based evidence In: Recent Researches in Medicine, Biology and Bioscience 2013: 86–93, Proceedings of the 4th International Conference on Bioscience and Bioinformatics (ICBB ‚13) Chania, Crete Island, Greece August 27–29, 2013.
- [8] Destache CJ, Meyer SK, Bittner MJ, Hermann KG. Impact of a clinical pharmacokinetic service on patients treated with aminoglycosides: a cost-benefit analysis. Ther Drug Monit 1990; 12: 419–426.
- [9] Destache CJ. Use of therapeutic drug monitoring in pharmacoeconomics. Ther Drug Monit 1993; 15: 608–610.
- [10] Destache CJ, Meyer SK, Rowley KM. Does accepting pharmacokinetic recommendations impact hospitalization? A cost-benefit analysis. Ther Drug Monit 1990; 12: 427–433.
- [11] Tesfaye H. Terapeutické monitorování léčiv: In Průvodce laboratorními nálezy, 2012, Nakladatelství RAABE Praha, ISB N978-80-87553-68-8, 1250 s.
- [12] Tesfaye H, Lukášková J, Hořínková J. Sudden renal function deterioration in an elderly patient on vancomycin therapy for endokarditis. Cas Lek Cesk 2012; 151: 531–534.
- [13] Tesfaye H, Jedlickova B, Semansky M, et al. Early therapeutic drug monitoring in elderly patients being treated with potentially nephrotoxic antibiotics may help reduce toxicity risk. Ther Drug Monit 2011; 33: 512–513.
- [14] Kobayashi R, Suzuki D, Yasuda K, Kobayashi K. Itraconazole for invasive fungal infection with pediatric malignancies. Pediatr Int 2010; 52: 707–710.
- [15] Bruggemann RJ, van der Linden JW, Verweij PE, et al. Impact of Therapeutic Drug Monitoring of Voriconazole in a Pediatric Population. Pediatr Infect Dis J 2010; 30: 533–534.
- [16] Johnson LB, Kauffman CA. Voriconazole: a new triazole antifungal agent. Clin Infect Dis 2003; 36: 630–637.
- [17] Herbrecht R, Denning DW, Patterson TF, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002; 347: 408–415.
- [18] Goutelle S, Larcher R, Padoin C, et al. Oral voriconazole dose in children: one size does not fit all. Clin Infect Dis 2010; 51: 870–871.
- [19] Shima H, Miharu M, Osumi T, et al. Differences in voriconazole trough plasma concentrations per oral dosages between children younger and older than 3 years of age. Pediatr Blood Cancer 2010; 54: 1050–1052.
- [20] Neely M, Rushing T, Kovacs A, et al. Voriconazole pharmacokinetics and pharmacodynamics in children. Clin Infect Dis 2010; 50: 27–36.
- [21] Walsh TJ, Driscoll T, Milligan PA, et al. Pharmacokinetics, safety, and tolerability of voriconazole in immunocompromised children. Antimicrob Agents Chemother 2010; 54: 4116–4123.
- [22] Michael C, Bierbach U, Frenzel K, et al. Voriconazole pharmacokinetics and safety in immunocompromised children compared to adult patients. Antimicrob Agents Chemother 2010; 54: 3225–3232.
- [23] Spriet I, Cosaert K, Renard M, et al. Voriconazole plasma levels in children are highly variable. Eur J Clin Microbiol Infect Dis 2010; 30: 283–287.
- [24] Pasqualotto AC, Shah M, Wynn R, Denning DW. Voriconazole plasma monitoring. Arch Dis Child 2008; 93: 578–581.
- [25] Vohringer S, Schrum J, Ott H, Hoger PH. Severe phototoxicity associated with long-term voriconazole treatment. J Dtsch Dermatol Ges 2011; 9: 274–276.
- [26] Trifilio S, Pennick G, Pi J, et al. Monitoring plasma voriconazole levels may be necessary to avoid subtherapeutic levels in hematopoietic stem cell transplant recipients. Cancer 2008; 109: 1532–1535.
- [27] Pascual A, Calandra T, Bolay S, et al. Voriconazole therapeutic drug monitoring in patients with invasive mycoses improves safety and efficacy outcomes. Clin Infect Dis 2008; 46: 201–211.
- [28] Lehrnbecher T, Attarbaschi A, Duerken M, et al. Posaconazole salvage treatment in paediatric patients: a multicentre survey. Eur J Clin Microbiol Infect Dis 2010; 29: 1043–1045.
- [29] Tesfaye H, Klapková E, Tesfayeová A, Komárek V. Antiepileptic drug interactions: a clinical case demonstration. Cas Lek Cesk 2011; 150: 451–456.
- [30] Souhrn údajů o přípravku Neurontin, dostupné na www. sukl.cz Navštíveno 2. 6. 2014.
- [31] Tesfaye H. Terapeutické monitorování léčiv v současném pojetí. Remedia 2014; 24: 52–57.
- [32] Lancelin F, Franchon E, Kraoul L, et al. Therapeutic drug monitoring of levetiracetam by high-performance liquid chromatography with photodiode array ultraviolet detection: preliminary observations on correlation between plasma concentration and clinical response in patients with refractory epilepsy. Ther Drug Monit 2007; 29: 576–583.
- [33] Tesfaye H, Průsa R, Doupovcová J. Hypokalaemia in a suicide attempt of an adolescent girl. Cas Lek Cesk 2008; 147: 333–336.
- [34] Tesfaye H, Klapkova E, Prusa R. Area under the concentrations versus time curve (AUC) based busulfan exposure monitoring in paediatric patients. Proceedings of the 9th Congress of the European Association for Clinical Pharmacology and Therapeutics – EACPT (July 12–15, 2009, Edinburgh, Scotland, United Kingdom) Editors: David J. Webb, Simon RJ Maxwell, ISBN: 978-88-7587-548-0 L712C0062 s. 215–219.
- [35] Janeckova D, Sedlacek P, Tesfaye H, et al. PP113 –Parenteral busulfan in myeloablative conditioning regimens for hematopoietic stem-cell transplantation (HSCT) in children. Clinical Therapeutics 2013; 35 (Suppl.): e49–e50.
- [36] Tesfaye H, Beyerova M, Jedlickova B, et al. Extremely delayed elimination of methotrexate in a young man with osteosarcoma: A case study demonstrating an association with impaired renal function. Energy, Environment, Biology and Biomedicine, Proceedings of the 2014 International conference on Biology and Biomedicine II (BIO14) Prague, Czech Republic, April 2–4, 2014 ISBN: 978-1-61804-232-3: 85–90.
- [37] Tesfaye H, Kukacka J, Malis J, et al. Spare sampling strategy for therapeutic drug monitoring (TDM) of carboplatin in children. European Society for Developmental, Perinatal and Paediatric Pharmacology, 11th congress (Abstr.), Arch Dis Child 2009; 94: e1 (Abstr.).
- [38] Kukacka J, Tesfaye H, Malis J, et al. Carboplatin monitoring by flameless atomic absorption spectrophotometry and metallothionein levels in pediatric patients with solid tumors. Clin Chem 2008; 54, A11.
- [39] Tesfaye H, Netíková I, Bránová R, et al. TDM řízené cyklické dávkování cis-platiny u pacienta s karcinomem plic a chronickým renálním selháním. 15. česká konference klinické farmakologie 28. – 30. 6. 2012 Zámek Štiřín, Česká republika.
- [40] Tesfaye H, Branova R, Klapkova E, et al. The importance of Therapeutic Drug Monitoring (TDM) for parenteral busulfan dosing in conditioning regimen for Hematopoietic Stem Cell Transplantation (HSCT) in children. Ann Transplant 2014; 19: 214–224.
- [41] Tesfaye H, Branova R, Riha P, et al. Current challenges of body weight based intravenous busulfan dosing versus dose adjustment based on therapeutic drug monitoring. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013; 157 (Suppl. 1): 81–85.
- [42] Glanville AR, Abouyoun CL, Morton JM, et al. Cyclosporine C2 target levels and acute cellular rejection after lung transplantation. J Heart Lung Transplant 2006; 25: 928–934.
- [43] Gerbase MW, Fathi M, Spiliopoulos A, et al. Pharma cokinetics of mycophenolic acid associated with calcineurin inhibitors: long-term monitoring in stable lung recipients with and without cystic fibrosis. J Heart Lung Transplant 2003; 22: 587–590.
- [44] Saint-Marcoux F, Knoop C, Debord J, et al. Pharmacokinetic study of tacrolimus in cystic fibrosis and non-cystic fibrosis lung transplant patients and design of Bayesian estimators using limited sampling strategies. Clin Pharmacokinet 2005; 44: 1317–1328
- [45] Tesfaye H, Prusa R, Jedlickova B, Segethova J. Cyclosporine use in miscellaneous clinical settings other than organ transplantations: is there any evidence for target levels? Ann Transplant 2008; 13: 34–40.
- [46] Tesfaye H, Alusik S, Jedlickova V, et al. Serum digoxin levels and clinical state relationship: A retrospective data evaluation. Basic Clin Pharmacol Toxicol 2005; 97 (Suppl. 1): 108.
- [47] Tesfaye H, Paluch Z, Jedlickova B, Skokanova J. Significant number of elderly patients live with potentially toxic levels of digoxin most probably overlooked for long enough. In: Recent Researches in Medicine and Medical Chemistry, Proceedings of the 3rd WSEAS International Conference on Cardiology (part of Summer WORLDMED) July 14–17, 2012 Kos Island, Greece: 213–219.
