Terapeutické monitorování léčiv v současném pojetí
Terapeutické monitorování léčiv (TDM) je multidisciplinární obor, který zahrnuje vícero odborných sfér – klinickou farmakologii a klinickou farmacii, klinickou patologii, klinickou chemii, klinickou toxikologii, analytickou chemii a další příslušná odvětví medicíny. Zásadní využití TDM je podmíněno interdisciplinárním pojetím vědecké komunikace, které překračuje úzké hranice jednotlivých odborností, jimiž je často vymezeno i zaměření lékařských časopisů. K optimalizaci péče o pacienta jsou potřeba široké znalosti z mnoha disciplín. V minulosti se jak lékaři, tak farmakologové pokoušeli zjistit, proč je stanovené dávkování léčiva u některých jedinců terapeuticky účinné, zatímco u jiných takto nepůsobí. Po celá léta se vhodné dávkovací režimy stanovovaly empiricky, moderní analytické techniky však přinesly další možnost – korelaci sérových či plazmatických koncentrací léčiva s pozorovaným klinickým účinkem dané látky – a poskytly tak nový terapeutický vhled.
Díky rozvoji nových analytických metod se TDM stalo v současné době důležitým nástrojem v systému zajišťování kvality managementu léčiv. Cílem je, aby byl správný lék podán správnému pacientovi ve správné dávce k navození požadovaného efektu, se záměrem zvýšení bezpečnosti léčby a redukce nežádoucích účinků. Nicméně je třeba podotknout, že TDM zahrnuje nejen měření koncentrace léčiv, ale i klinickou interpretaci výsledku, která vyžaduje znalost farmakokinetiky, času odběru vzorku, lékové anamnézy, v neposlední řadě znalost klinického stavu pacienta a specifických laboratorních hodnot odpovídajících biomarkerů. Cílem tohoto sdělení je mezioborově seznámit čtenáře se současným konceptem TDM zaměřeným na zkvalitnění péče o pacienty, poukázat také na podmínky optimálního zajištění TDM, inspirovat k jeho využití a zároveň upozornit i na stávající omezení.
Současná definice a význam TDM
Terapeutické monitorování léčiv (TDM, therapeutic drug monitoring/therapeutic drug management) je praktická aplikace farmakokinetických a farmakodynamických principů, jež slouží k optimalizaci farmakoterapie u individ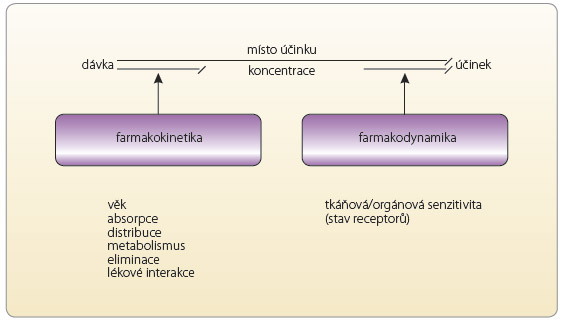 uálního pacienta. Obecně lze TDM definovat jako kvalifikovaný, konziliární a interdisciplinární servis, při kterém se měří koncentrace léčiva (příp. jeho metabolitů) v krevních vzorcích nemocného odebraných v definovaném časovém intervalu od poslední podané dávky léčiva. Na základě naměřených hodnot, při zvážení klinického stavu nemocného a s přihlédnutím k farmakokinetice léčiva se optimalizuje další dávkování léku tak, aby jeho účinnost a bezpečnost byla co nejvyšší (obr. 1). Jinými slovy, cílem TDM je optimalizace dávkovacího režimu léku pro nemocného, tj. stanovení nejvhodnější dávky léku (při zvolené aplikační cestě) a délky dávkovacího intervalu. TDM výrazně snižuje nebezpečí jak předávkování lékem (léky), tak také poddávkování, a tím může ve svém důsledku snižovat náklady na léčbu [1–3].
uálního pacienta. Obecně lze TDM definovat jako kvalifikovaný, konziliární a interdisciplinární servis, při kterém se měří koncentrace léčiva (příp. jeho metabolitů) v krevních vzorcích nemocného odebraných v definovaném časovém intervalu od poslední podané dávky léčiva. Na základě naměřených hodnot, při zvážení klinického stavu nemocného a s přihlédnutím k farmakokinetice léčiva se optimalizuje další dávkování léku tak, aby jeho účinnost a bezpečnost byla co nejvyšší (obr. 1). Jinými slovy, cílem TDM je optimalizace dávkovacího režimu léku pro nemocného, tj. stanovení nejvhodnější dávky léku (při zvolené aplikační cestě) a délky dávkovacího intervalu. TDM výrazně snižuje nebezpečí jak předávkování lékem (léky), tak také poddávkování, a tím může ve svém důsledku snižovat náklady na léčbu [1–3].
Tato lékařská disciplína je poměrně mladá. Do počátku sedmdesátých let se dávkovací režimy léků upravovaly dle populačních modelů farmakokinetiky a farmakodynamiky, pomocí tzv. nomogramů. K úpravě dávek docházelo na základě sérové koncentrace kreatininu a odhadem jeho clearance [4]. Ukázalo se však, že existuje nejen interindivi duální variabilita (v důsledku rozdílnosti ve vnitřní výbavě jednotlivců – polymorfismus), ale také intraindividuální variabilita (v důsledku stavu onemocnění). Genetický polymorfismus podmiňuje odlišný fenotypický projev při metabolizaci léčiva, ovlivňuje jeho biologickou dostupnost, eliminaci a následně i dynamiku jak z hlediska očekávaného účinku, tak z hlediska toxicity. Stav onemocnění může ovlivnit mnoho farmakokinetických a farmakodynamických procesů, populační parametry nelze často při farmakoterapii individuálního pacienta extrapolovat, obr. 2. Proto je TDM, založené na principu měření koncentrace léčiv ve vhodném biologickém materiálu a na komplexní farmakologické interpretaci, osvědčeným nástrojem k optimalizaci farmakoterapie a zároveň k minimalizaci potenciálních nežádoucích účinků léků.
duální variabilita (v důsledku rozdílnosti ve vnitřní výbavě jednotlivců – polymorfismus), ale také intraindividuální variabilita (v důsledku stavu onemocnění). Genetický polymorfismus podmiňuje odlišný fenotypický projev při metabolizaci léčiva, ovlivňuje jeho biologickou dostupnost, eliminaci a následně i dynamiku jak z hlediska očekávaného účinku, tak z hlediska toxicity. Stav onemocnění může ovlivnit mnoho farmakokinetických a farmakodynamických procesů, populační parametry nelze často při farmakoterapii individuálního pacienta extrapolovat, obr. 2. Proto je TDM, založené na principu měření koncentrace léčiv ve vhodném biologickém materiálu a na komplexní farmakologické interpretaci, osvědčeným nástrojem k optimalizaci farmakoterapie a zároveň k minimalizaci potenciálních nežádoucích účinků léků.
TDM má své moderní základy v sedmdesátých letech a během minulých 25–30 let prošlo převratným vývojem. Jeho klinické využití se značně rozrostlo jak kvantitativně, tak kvalitativně s rozvojem vysoce validních analytických metod. Vývoj farmakoterapie ukázal, že populační modely velmi málo predikují osud léků u jednotlivců z důvodu značných interindividuálních rozdílů. Individualizace terapie a zlepšení kvality života se stává základem filozofie zdravotní péče. Do centra pozornosti se dostává pacient, nikoli samotné kvantitativní stanovení koncentrace („treat the patient and not the level“). Toto směřování vedlo k rozvoji dalších významných disciplín, jako je farmakoekonomika, která zpracovává a hodnotí výsledky tzv. studií dopadu, kde jsou posuzovanými měřítky kvalita života, počet zachráněných životů ročně, počet úspěšně vyléčených nebo správně diagnostikovaných aj. Často se využívá metoda hodnocení přímých a nepřímých nákladů (tzv. cost-effectiveness analysis). Laboratorní profesionálové mají tu čest a zodpovědnost jasně prokázat, že produkované výsledky a celkový servis jejich laboratoří mají specifický vliv na zdravotní péči.
Možnosti klinického použití TDM
Indikace TDM není nutná pro všechna léčiva. Existují však tzv. léčiva s úzkým terapeutickým indexem, u nichž není velký rozdíl mezi konvenčně účinnou a potenciálně toxickou koncentrací. Taková léčiva často vyžadují bližší monitorování, zejména kvůli prevenci potenciální toxicity. Na druhé straně může docházet k selhání léčby v důsledku nedostatečné koncentrace, např. z důvodu intenzity eliminace nebo jiných změn v organismu.
Nepochybně s prokazatelným klinickým významem se již dlouho monitorují tato léčiva:
- antibiotika (amikacin, gentamicin, netilmycin, tobramycin, vankomycin),
- antidepresiva (lithium),
- antiepileptika (ethosuximid, primidon, fenobarbital, valproát, karbamazepin, fenytoin, lamotrigin, sulthiam),
- bronchodilatancia (theofylin),
- cytostatika (methotrexát, busulfan, …),
- imunosupresiva (cyklosporin, mykofenolát, sirolimus, takrolimus),
- kardiotonika (digoxin).
TDM představuje účinný nástroj také z hlediska nákladové efektivity. Zkracuje délku hospitalizace a eliminuje výdaje vyvolané nežádoucím účinkem daného léku. Dalším důvodem k indikaci TDM z hlediska léků je významná inter- a intraindividuální variabilita farmakokinetických parametrů, (např. při měnících se eliminačních funkcích v těžkých klinických stavech), často ovlivněná i lékovou formou.
Indikací k TDM jsou také potenciálně významné interakce současně podávaných léčiv jak na úrovni farmakokinetiky, tak farmakodynamiky. Například potenciálně nefrotoxické léky jako aminoglykosidy a glykopeptidy, amfotericin B, platinové komplexy mohou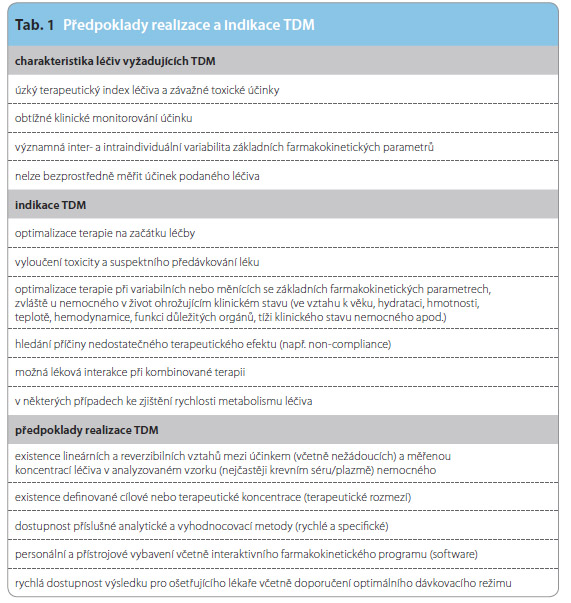 riziko toxicity mnohonásobně zvýšit, jsou-li podávány současně. Při léčbě epilepsie je často indikována polyterapie s vysokou pravděpodobností vzniku lékové interakce na úrovni metabolismu. Metabolismus je dynamický, s časem se měnící proces, který může ovlivnit i farmakodynamiku léčiva jako celku. Některá z antiepileptických léčiv mají nepředvídatelné kinetické vlastnosti. Velmi malá změna v dávce může znamenat nepredikovatelné změny v koncentraci. Typickým příkladem je fenytoin. Na začátku podávání sleduje kinetiku 1. řádu, která se však v průběhu terapie mění na kinetiku 0. řádu a původní predikce se stává irelevantní. K dalším důvodům indikace TDM patří podezření na toxicitu daného léčiva a tzv. non-compliance a následná absence očekávaného účinku Hlavní důvody a podmínky realizace TDM shrnuje tab. 1.
riziko toxicity mnohonásobně zvýšit, jsou-li podávány současně. Při léčbě epilepsie je často indikována polyterapie s vysokou pravděpodobností vzniku lékové interakce na úrovni metabolismu. Metabolismus je dynamický, s časem se měnící proces, který může ovlivnit i farmakodynamiku léčiva jako celku. Některá z antiepileptických léčiv mají nepředvídatelné kinetické vlastnosti. Velmi malá změna v dávce může znamenat nepredikovatelné změny v koncentraci. Typickým příkladem je fenytoin. Na začátku podávání sleduje kinetiku 1. řádu, která se však v průběhu terapie mění na kinetiku 0. řádu a původní predikce se stává irelevantní. K dalším důvodům indikace TDM patří podezření na toxicitu daného léčiva a tzv. non-compliance a následná absence očekávaného účinku Hlavní důvody a podmínky realizace TDM shrnuje tab. 1.
Odběr vzorků
K tomu, abychom mohli provést individualizaci kinetických parametrů podaného léčiva a uvažovat o optimalizaci dávk ování, potřebujeme vzorek (vzorky) biologického materiálu a nezbytné údaje o nemocném (tab. 2). Příprava pacienta a ostatní preanalytické instrukce (týkající se správného označení, teploty skladování vzorku, dostatečného objemu či typu kontejneru aj.) z laboratoře provádějící TDM jsou velmi užitečné a umožňují předejít nepraktickým a zbytečným opakováním a tím eliminují zdržení a zdražení provozu. Vzorek (,,matrix“), kterým může být plazma, sérum, krev, slina, moč, mozkomíšní mok, žluč nebo peritoneální tekutina/dialyzát, musí být vhodný k nalezení a měření sledované látky.Z hlediska bezpečnosti práce s biologickým materiálem mají být všechny vzorky biologických materiálů považovány za potenciálně infekční a má jim být věnována zvláštní pozornost (vysoce rizikové vzorky typu HIV, virus hepatitidy B, C, EB virus apod.).
ování, potřebujeme vzorek (vzorky) biologického materiálu a nezbytné údaje o nemocném (tab. 2). Příprava pacienta a ostatní preanalytické instrukce (týkající se správného označení, teploty skladování vzorku, dostatečného objemu či typu kontejneru aj.) z laboratoře provádějící TDM jsou velmi užitečné a umožňují předejít nepraktickým a zbytečným opakováním a tím eliminují zdržení a zdražení provozu. Vzorek (,,matrix“), kterým může být plazma, sérum, krev, slina, moč, mozkomíšní mok, žluč nebo peritoneální tekutina/dialyzát, musí být vhodný k nalezení a měření sledované látky.Z hlediska bezpečnosti práce s biologickým materiálem mají být všechny vzorky biologických materiálů považovány za potenciálně infekční a má jim být věnována zvláštní pozornost (vysoce rizikové vzorky typu HIV, virus hepatitidy B, C, EB virus apod.).
Vzorky musí být odebrány ze správného místa, do správného kontejneru. Vzorek krve odebíráme z jiné žíly, než do které byl lék aplikován. Pro určení plazmatické koncentrace léčiva je obvykle použita plazma či sérum. Přesto se např. cyklosporin posunuje mezi erytrocyty a plazmou v závislosti na teplotě a době skladování, což vyžaduje analýzu z plné krve. Některé odběrové kepy, zvláště obsahující gel k separaci buněk a plazmy, nejsou vhodné, protože mohou absorbovat lékové komponenty (léky).Odebraný vzorek – správně označený a nepoškozený – musí být neprodleně transportován do laboratoře a tam neprodleně zpracován a analyzován.
Podle doby odběru vzorku od podání léku rozlišujeme:
- tzv. trough – vzorek odebraný bezprostředně před aplikací další dávky;
- tzv. peak – vzorek odebraný půl hodiny až dvě hodiny po ukončení infuze nebo dvě až osm hodin po perorální aplikaci, podle doby potřebné k distribuci;
- tzv. random – vzorek odebraný kdykoliv (často naléhavý – k odhalení toxicity).
Pro mnoho léků je obvykle preferováno měření tzv. trough a peak koncentrace ke zjištění, zdali se plazmatická koncentrace léčiva nachází v konvenčním terapeutickém rozmezí. V některých případech je určujícím vodítkem pro výběr tzv. target koncentrace místo působení, v případě léčby antibiotiky pak místo infektu (např. vyšší peak je žádoucí pro léčbu pneumonie než při léčbě infekce močových cest aminoglykosidy). Tzv. peak koncentrace je někdy lepší i k odhalení úrovně toxicity. Např. novorozenec, který demonstruje tachykardii po každé dávce theofylinu a je dále bez problémů, může být lépe léčen menší dávkou v krátkém intervalu. V takovém případě normální trough koncentrace neznamená, že pacient je v bezpečí (je ohrožen v průběhu vyšší peak koncentrace). Trough koncentrace slouží jak k odhalení toxicity, tak ke zjištění nedostatku optimální koncentrace. Údaje o nefrotoxicitě aminoglykosidů byly publikovány v souvislosti s velikostí trough koncentrace. Monitorování chronického podávání léků je založeno především na měření trough koncentrace. Typickým příkladem je profylaktická léčba epilepsie, udržovací dávka digoxinu a řady dalších léčiv relevantních k TDM.
Správný čas odběru vzorku je velmi důležitý. Koncentrace léků se mění v průběhu dávkovacího intervalu a délky podání a v souvislosti s ustáleným stavem. Pro léky s krátkým poločasem je nejméně variabilním časovým bodem „trough“. Pro léky s dlouhým p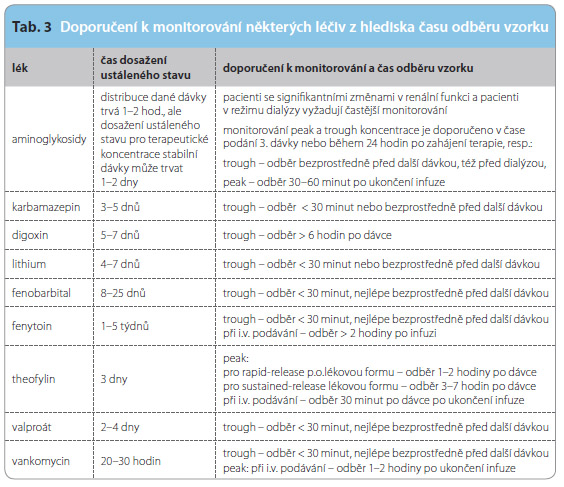 oločasem, jako je fenytoin, fenobarbital a amiodaron, je odběr v kterémkoliv čase dávkovacího intervalu akceptovatelný. Nejméně variabilní časové body nesou označení „trough“. Pro digoxin je jakýkoliv čas odběru po distribuční fázi (6 hodin po aplikaci) akceptován. Je-li odběr proveden před dosažením ustáleného stavu, je to třeba předem uvést, aby nedošlo k chybné interpretaci a tím k neadekvátní
oločasem, jako je fenytoin, fenobarbital a amiodaron, je odběr v kterémkoliv čase dávkovacího intervalu akceptovatelný. Nejméně variabilní časové body nesou označení „trough“. Pro digoxin je jakýkoliv čas odběru po distribuční fázi (6 hodin po aplikaci) akceptován. Je-li odběr proveden před dosažením ustáleného stavu, je to třeba předem uvést, aby nedošlo k chybné interpretaci a tím k neadekvátní
intervenci.Doporučení k monitorování včetně času odběru vzorku některých léků uvádí tab. 3.
Metody analýz při TDM
Při vývoji TDM se všemi nároky na exaktnost a kvalitu v rámci medicíny založené na důkazech (evidence based medicine) jsou externě a interně kontrolované akreditované laboratoře s nejmodernějšími metodami nezbytné pro kvalitní péči o zdraví pacienta.
Biochemické laboratoře vyvíjejí metody pro analýzu účinné lékové substance nebo toxického metabolitu ve vybraném biologickém vzorku. Pomáhají prokázat případnou přítomnost toxického účinku xenobiotik nepřímo, měřením tzv. surrogate markerů (např. proteinurie u pacientů léčených penicilaminem a tyreoidální dysfunkce u pacientů léčených antiarytmikem obsahujícím jód – amiodaronem), měřením specifických terapeutických odpovědí (např. glykemie při léčbě antidiabetiky nebo test tyreoidální funkce při léčbě karbimazolem) nebo diagnostikou orgánových funkcí (např. měřením metabolitu lidokainu – monoethylglycin-xylididu, MGEX).
Analytické metody pro zjištění plazmatické koncentrace léků musí být dostatečně citlivé, aby umožnily stanovení i minimální přítomnosti dané substance ve zvoleném vzorku, specifické pro danou substanci nebo její metabolit a zároveň přesné a precizní. Analytický proces by měl být dostupný, jednoduchý, rychlý a v neposlední řadě nákladově efektivní.
Mnoho lékových analýz se provádí automatizovanými imunochemickými stanoveními. Metody měření pomocí komerčně vyrobených kitů, jako jsou RIA, EMIT, FPIA, významně zlepšily dostupnost, rychlost i robustnost. Přesto některé lékové analýzy stále vyžadují použití manuálně kontrolovaných metod, jako je vysokoúčinná kapalinová či plynová chromatografie (HPLC, GC).
Postanalytická fáze
Postanalytická fáze zahrnuje biologickou a klinickou validaci výsledků a způsob jejich konečné klinické utilizace.
Klinické posouzení výsledků vyžaduje fundamentální, praktické, analytické a medicínské dovednostní vzdělání. V tzv. numbers only laboratořích (tj. bez kvalifikované interpretace výsledků, dodaným výsledkem analýzy jsou pouze číselné hodnoty) provozujících TDM podstatná část požadavků často chybí. Nové technologie umožňují všem laboratořím měření koncentrace léků často automatizovanými metodami. Systém kontroly kvality garantuje správnost analytických výsledků, ale k interpretaci je nutná znalost a vnímání farmakokinetiky/farmakodynamiky. Výsledky bez medicínské validace jsou nejen málo užitečné, ale mohou často vést ke zmatení klinika.
Při interpretaci získaných výsledků je třeba zodpovědět následující otázky:
- Je výsledek normální?
- Je významně rozdílný oproti předchozím výsledkům?
- Je výsledek konzistentní s klinickými nálezy?
- Jaká opatření jsou relevantní pro další postup při řešení definovaného pro-
- blému?
Pohled na terapeutické rozmezí
Je třeba si uvědomit, že tzv. terapeutická rozmezí (rozmezí mezi minimální účinnou a potenciálně toxickou koncentrací) jsou pouze orientační a nelze je považovat za neměnná (tab. 4). Je důležité zdůraznit, že léčíme pacienta jako celek, nikoliv laboratorní hodnoty, případně koncentrace.
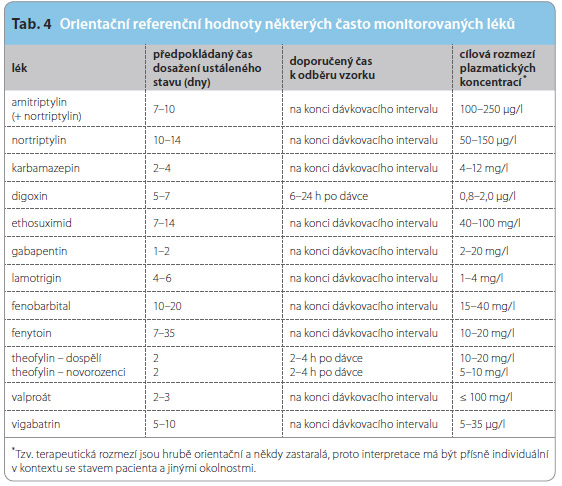
Terapeutické rozmezí je v mnoha případech odvozeno od pozorování terapeutických efektů a nežádoucích účinků u malé skupiny pacientů, nebo dokonce u experimentálních modelů. Tak mohou existovat jedinci, kteří dosáhnou léčebného efektu již při mnohem nižší koncentraci, nebo se u nich naopak objeví nežádoucí účinek, aniž by byla překročena horní hranice terapeutického rozmezí. Terapeutické rozmezí je dané individuální farmakodynamickou variabilitou a u jednotlivců se může lišit.
Vazba na plazmatické bílkoviny
Mnohdy jsou měřeny celkové koncentrace v plazmě nebo v krvi (vázaná + volná frakce léčiva). U léků, kde je vazba na plazmatické bílkoviny výrazná, může být měřená hodnota v disproporci s volnou frakcí, v závislosti na stavu. Dojde-li ke změně vazby v důsledku chorobného stavu, vytěsnění jiným lékem nebo non-linearitou vazby na plazmatické bílkoviny, musí toto vést k modifikaci vlastní interpretace měřené koncentrace. Např. terapeutické rozmezí fenytoinu na základě celkové plazmatické koncentrace 10–20 mg/l koresponduje s koncentrací volné frakce fenytoinu (fu – fenytoin unbound) 1–2 mg/l, kde je fu normálně 0,1 mg/l. Je-li fu 0,2 mg/l, jako např. u renálních onemocnění, cílová koncentrace volné frakce je stále 1–2 mg/l, ale terapeutické rozmezí pro celkovou plazmatickou koncentraci je 5–10 mg/l. Non-lineární vazbou se projevují např. valproát a salicyláty a tím ztěžují interpretaci celkových koncentrací těchto léků [4].
Aktivní metabolity a lékové interakce
Typickým příkladem existujících aktivních metabolitů a dalších lékových interakcí jsou antiepileptika, při jejichž podávání velmi často měříme celkové sérové koncentrace. Metabolity, i když nejsou determinovány, se mohou farmakodynamicky uplatnit. Např. karbamazepin (KBZ) versus KBZ-10,11--epoxid nebo prokainamid versus N-acetyl--prokainamid.
Theofylin u novorozenců (nikoliv u dospělých) se biotransformuje na kofein, takže terapeutické rozmezí je u novorozenecké apnoe 6–12 mg/l, 10–20 mg/l pro bronchodilatační efekt u dospělých. Terapeutické rozmezí imipraminu a amitriptylinu je založeno na sumární koncentraci parentní látky a aktivního metabolitu (desipramin a nortriptylin). Primidon a jeho metabolit fenobarbital a také další metabolit, fenylethylmalonamid, jsou farmakologicky aktivní.
Zde podrobně rozebíráme pro pochopení významu měření včetně aktivních metabolitů úskalí léčby KBZ použitím precizních analytických metod. Metabolismus KBZ je soubor reakcí, kde bylo identifikováno více než 30 metabolitů.Hlavními metabolity jsou 10,11-epoxid a jeho hydrolytický trans-dihydrodiol metabolit; 2-hydroxy-KBZ (vedlejší metabolit), vznikající ztrátou karboxyamidu, může být metabolizován na iminochinon, který může být v důsledku své chemické reaktivity zodpovědný za idiosynkratické reakce. KBZ je spojován s idiosynkratickými nepříznivými reakcemi zahrnujícími kožní vyrážky, krevní onemocnění, hepatitidy u jedné třetiny až poloviny pacientů. Tyto nežádoucí účinky jsou dávány do souvislosti s tvorbou metabolitů KBZ.Z tohoto důvodu má TDM metabolitů důležitý klinický význam bez ohledu na dávku parentní látky. Kromě toho je KBZ dobře známý jako enzymový induktor cytochromu P450.
Jako běžné nežádoucí účinky se vyskytují ospalost, zhoršení motorické koordinace a/nebo žaludeční nevolnost. Méně běžné nežádoucí účinky zahrnují kardiální arytmii, rozostřené nebo dvojité vidění a/nebo dočasnou mírnou ztrátu krevních buněk a destiček. Ve výjimečných případech se může jednat o stav ohrožující život, proto je nutné během prvních měsíců užívání provádět krevní testy 3–4krát ročně. Může být zvýšena funkce štítné žlázy, proto je doporučeno provádět vyšetření štítné žlázy jednou ročně. Běžně se vyskytuje mírné snížení počtu leukocytů a sodného iontu. Jsou popsány také vedlejší sluchové efekty, kdy pacienti vnímají jednotlivé tóny o půltón nižší, než jaká je jejich aktuální výška. KBZ může způsobovat SIADH (syndrome of inappropriate antidiuretic hormone secretion), syndrom zvyšující uvolňování a účinek adiuretinu (vazopresinu). KBZ může zhoršovat juvenilní myoklonickou epilepsii, proto je důležité se zmínit o jakýchkoliv záškubech, zejména během rána před podáním léku.Existují publikované výsledky, kdy byly ve třech případech falešně pozitivní hodnoty tricyklických antidepresiv (TCA) diagnostikovány jako intoxikace KBZ [5]. Také byly pozorovány významné interference KBZ s TCA při stanovení FPIA (fluorescenční polarizační imunoanalýza) [6]. Například u pacienta se subterapeutickou koncentrací KBZ 6,5 µg/ml (27,5 µmol/l) byla naměřena koncentrace TCA 50,7 ng/ml (180,8 nmol/l).
U jiného pacienta s koncentrací KBZ 17,5 µg/ml (74,0 µmol/l) byla naměřena koncentrace TCA 124,6 ng/ml (444,3 nmol/l). Tyto hodnoty jsou klinicky signifikantní vzhledem k omezenému terapeutickému rozsahu TCA.
U KBZ jsou pozorovány významně více zkřížené reakce s TCA než u jeho aktivního metabolitu KBZ-10,11-epoxidu. Například když bylo in vitro přidáno 40 µg/ml (169,2 µmol/l) KBZ k alikvotu séra s nulovou hodnotou KBZ, byla naměřena koncentrace TCA 176,8 ng/ml (630,5 nmol/l). Na rozdíl od toho byla v přítomnosti 40 µg/ml (158,4 mol/l) KBZ 10,11-epoxidu naměřena koncentrace TCA pouze 43,3 ng/ml (154,4 nmol/l). Metoda HPLC je užitečná zvláště pro pacienty se známkami toxicity KBZ, přestože dávka byla dlouhodobě stabilní s hladinami v tzv. terapeutickém rozmezí, ale tito nemocní mohou mít vysokou hladinu epoxidu. Interference s endogenními substancemi a s jinými antiepileptiky dosud nebyla podrobně studována a popsána.
Mimo jiné dalším problémem mohou být generické přípravky. Problém s generiky byl prvně pozorován v Brisbane v Austrálii, kde se u epileptických pacientů vyskytla intoxikace fenytoinem [7]. Důvodem byla změna ve výrobě, kde byl síran vápenatý nahrazen laktózou. Následkem byl značný vzrůst biologické dostupnosti a zvýšení sérové koncentrace fenytoinu na 80–100 %, takže u 51 pacientů byly přítomny typické příznaky intoxikace fenytoinem – ataxie, dvojité vidění, zvracení. U 87 % pacientů byla pozorována koncentrace fenytoinu přibližně 20 mg/ml. Byla zjištěna kompletní remise u všech pacientů, kde bylo obnoveno použití původního přípravku [8].Pro stanovení bioekvivalence je používáno tzv. pravidlo zařazení, což znamená, že při 90% intervalu spolehlivosti u nových přípravků by měl být splněn limit pro plochu pod křivkou: AUC 80–125 %. Zkouška bioekvivalence mezi referenčním a testovaným přípravkem neznamená, že jsou volně zaměnitelné. Mohou být použity testované přípravky s prokázanou bioekvivalencí, např. na začátku léčby nebo u špatně kontrolovatelných pacientů s koncentrací v séru nacházející se ve středním rozsahu hodnot. Bylo názorně dokázáno, že užití obvyklých pravidel pro bioekvivalenci a rozsah akceptovatelnosti je u KBZ problematický [9]. U epileptických dětí vystavených oxidativnímu stresu a obvyklým antiepileptickým lékům se mění oxidační/antioxidační rovnováha. Oxidační a antioxidační stav v séru u epileptických dětí s monoterapií kyselinou valproovou (VPA) je lépe regulován než u dětí s monoterapií KBZ a fenobarbitalem.
Efektivita TDM
Konziliární závěr vycházející z TDM by měl pro ošetřujícího lékaře obsahovat nejlépe tyto údaje:
- zda bylo dosavadní dávkování léku optimální, či nikoli,
- jakou doporučujeme dávku v případě, že dosavadní dávka léku nepostačuje,
- jaký doporučujeme dávkovací interval,
- kdy v případě nutnosti provést další odběr vzorku ke kontrole hladin léčiva.
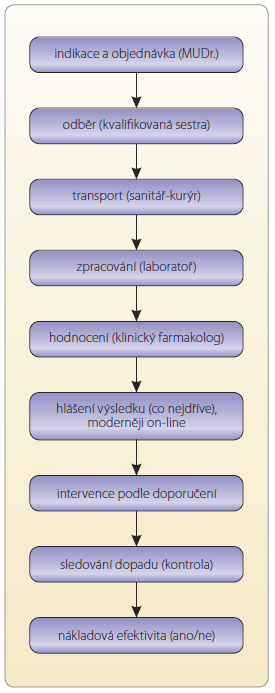 k je terapeutické monitorování skutečně pomocným nástrojem pro optimalizaci farmakoterapie a v neposlední řadě může být nákladově efektivní. K dosažení cíle terapeutického monitorování je nezbytně nutná multidisciplinární spolupráce všech zainteresovaných (obr. 3).Předpokladem pro efektivitu TDM je náležitá indikace, správný odběr vzorku do vhodného kontejneru, správná a precizní metoda analýzy, správná interpretace výsledků, interdisciplinární komunikace při komplexní péči o pacienta a správná reakce na výsledky TDM.Mezi nejčastejší chyby při TDM patří: nesprávné vzorkování, označení a zacházení se vzorkem, chybný odhad doby dosažení ustáleného stavu po úpravě dávky, neužitečná indikace, nedostatečné pochopení farmakokinetických změn způsobených chorobným stavem, přemrštěná víra v naměřené hodnoty proti objektivnímu klinickému stavu a dalším ukazatelům, neuvědomění si praktické limitace terapeutického rozmezí. Důležité je neopomenout zásadu „Neléčíme čísla, ale pacienta jako celek“ a pečlivě zhodnotit všechny okolnosti, zvážit užitek i škody související s danou intervencí.
k je terapeutické monitorování skutečně pomocným nástrojem pro optimalizaci farmakoterapie a v neposlední řadě může být nákladově efektivní. K dosažení cíle terapeutického monitorování je nezbytně nutná multidisciplinární spolupráce všech zainteresovaných (obr. 3).Předpokladem pro efektivitu TDM je náležitá indikace, správný odběr vzorku do vhodného kontejneru, správná a precizní metoda analýzy, správná interpretace výsledků, interdisciplinární komunikace při komplexní péči o pacienta a správná reakce na výsledky TDM.Mezi nejčastejší chyby při TDM patří: nesprávné vzorkování, označení a zacházení se vzorkem, chybný odhad doby dosažení ustáleného stavu po úpravě dávky, neužitečná indikace, nedostatečné pochopení farmakokinetických změn způsobených chorobným stavem, přemrštěná víra v naměřené hodnoty proti objektivnímu klinickému stavu a dalším ukazatelům, neuvědomění si praktické limitace terapeutického rozmezí. Důležité je neopomenout zásadu „Neléčíme čísla, ale pacienta jako celek“ a pečlivě zhodnotit všechny okolnosti, zvážit užitek i škody související s danou intervencí.Nákladová efektivita
Prospektivní farmakoekonomické studie existují hlavně u TDM aminoglykosidů, vankomycinu, digoxinu, theofylinu a antiepileptik. Destache a kol. ve svých studiích [1–3] dokumentovali, že farmakokinetický servis (monitorování a možná reakce na změny ve farmakokinetice) např. při léčbě aminoglykosidy zkrátil významně délku hospitalizace, a v jedné studii vedl dokonce k úsporám vyčísleným částkou 2 220 540 amerických dolarů ročně u 500 pacientů, což by znamenalo úsporu kolem 4441 amerických dolarů ročně na pacienta. Přestože nejsou zatím známy podobné studie, lze očekávat přinejmenším podobnou situaci obzvláště u hospitalizovaných pacientů i u nás.
Zajímavá bude obdobná studie např. u TDM tricyklických antidepresiv, imunosupresiv, TDM pomocí genofenotypizace, v onkologii a u léčby AIDS. TDM může být nákladově efektivní, pokud prokáže lepší odpověď na léčbu, dokáže snížit frekvenci a počet nežádoucích účinků; tím redukuje náklady na léčbu, dobu pobytu v ústavní péči a přispěje ke zlepšení kvality péče a života.
Závěr
Není pochyb o tom, že TDM umožňuje optimalizovat dávkování daného léku tak, aby léčení nemocného bylo co nejúčinnější a nejbezpečnější. Proto je vývoj referenčních analytických metod k zajištění požadované přesnosti a preciznosti pro výkon TDM nezbytný. Přes nevyhnutelné výdaje je to jediný způsob, jak zaručit kvalitu TDM tak, aby bylo dosaženo cíle. Mezi stálými problémy zůstává interpretace výsledku v situaci, kde je mnoho aktivních metabolitů, které oslabují docenění významu TDM lékaři. Podobné problémy jsou i s lékovými interakcemi zvláště v situaci polypragmazie (polyfarmacie).
Studií dokumentujících ekonomické přínosy TDM je málo. Ještě hůře na tom jsou studie o analytických cílech (téměř neexistují). Význam farmakokinetických a farmakodynamických parametrů a vztah hladin je v některé oblasti stále nejistý. Tak např. „viral load monitoring“ u léčby AIDS, „tumor load assessment“ u léčby nádorů chemoterapeutiky a „bone marker changes“ u farmakoterapie osteoporózy by mohly být v budoucnosti užitečnější. Přesto vývoj nových analytických metod na základě definovaného problému bude pokračovat a tak se stane TDM se svými analytickými komponentami dynamickou součástí moderního vybavení zdravotní péče. Zvláště důležité je u nemocných v nestabilních, například septických stavech nebo při měnících se renálních funkcích.
Souhrnně je třeba zdůraznit, že provedení TDM je založeno na několika disciplínách, sleduje aspekty farmakokinetické, farmakodynamické, analytické a farmakoekonomické. Pro uspokojivý dopad na zdravotní péči musí analytické cíle TDM vycházet z definice problému, výběru správného vzorku (matrix), validovaných analytických schémat a metodologie zaručující kvalitu. Samotné určení sérové koncentrace léčiva nelze považovat za dostatečné. Především je nezbytné výsledek interpretovat při zvážení klinického stavu nemocného a v kontextu ostatních dat, s přihlédnutím k diagnóze a k farmakokinetice podávaného léčiva.
Seznam použité literatury
- [1] Destache CJ, Meyer SK, Bittner MJ, Hermann KG. Impact of a clinical pharmacokinetic service on patients treated with aminoglycosides: a cost-benefit analysis. Ther Drug Monit 1990; 12: 419–426.
- [2] Destache CJ. Use of therapeutic drug monitoring in pharmacoeconomics. Ther Drug Monit 1993; 15: 608–610.
- [3] Destache CJ, Meyer SK, Rowley KM. Does accepting pharmacokinetic recommendations impact hospitalization? A cost-benefit analysis. Ther Drug Monit 1990; 12: 427–433.
- [4] Winter ME. Clearance In: Basic Clinical Pharmacokinetics. 3rd ed. Vancouver: Applied Therapeutics, Inc. 1994: 26–36.
- [5] Matos ME, Burns MM, Shannon MW. False-Positive Tricyclic Antidepressant Drug Screen Results Leading to the Diagnosis of Carbamazepine Intoxication. Pediatrics 2000; 105: E66.
- [6] Dasgupta A, McNeese C, Wells A. Interference of carbamazepine and carbamazepine 10,11-epoxide in the fluorescence polarization immunoassay for tricyclic antidepressants: estimation of the true tricyclic antidepressant concentration in the presence of carbamazepine using a mathematical model. Am J Clin Pathol 2004; 121: 418–425.
- [7] Eadie MJ, Sutherland JM, Tyrer JH. “Dilantin” overdose. Med J Aust 1968; 2: 515.
- [8] TyrerJH, Eadie MJ, Sutherland JM, Hooper WD. Outbreak of anticonvulsant intoxication in an Australian City. Br Med J 1970; 4: 271–273.
- [9] Mayer T, May TW, Altenmuller D-M, et al. Clinical problems with generic antiepileptic drugs. Clin Drug Invest 1999;18:17–26.