Věkem podmíněná makulární degenerace (VPMD) je v rozvinutých zemích hlavní příčinou těžké a nevratné ztráty zraku u osob starších 50 let. Vlhká forma VPMD představuje pouze 10 % celkové prevalence této choroby, avšak je zodpovědná za 90 % případů těžké ztráty zraku [1, 2]. Je charakteristická růstem subretinální neovaskulární membrány (CHNV) s následným otokem a krvácením v oblasti žluté skvrny sítnice.
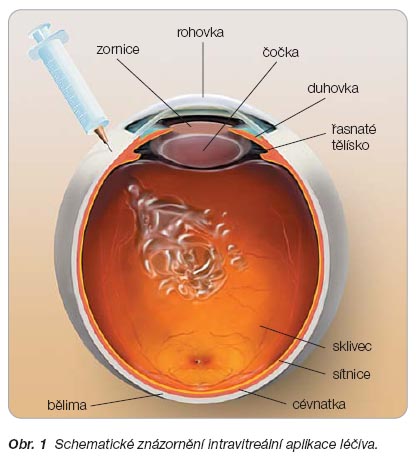
Novým léčebným přístupem užívaným u pacientů s vlhkou formou VPMD je injekční aplikace léčiva přes spojivku, skléru a pars plana řasnatého tělesa přímo do sklivce (
obr. 1
). Výhodou tohoto způsobu podání je vysoká cílenost léčby s minimalizací systémových nežádoucích účinků. Poprvé byla intravitreální aplikace jako léčebný způsob použita v roce 1911, kdy v rámci léčby odchlípené sítnice byl do
sklivce injekčně aplikován vzduch [3].
Prv
ním léčivem, které bylo schváleno
k intravitreální aplikaci, byl v roce 1998 fomivirsen sodný, používaný k léčbě cyto
mega
lovirové retinitidy. Z dalších léčiv intravitreálně aplikovaných následoval 5-fluorouracil, užívaný k inhibici fibroblastické proliferace u pacientů s proliferativní vitreoretinopatií [4], dexamethason, podávaný po pars plana vitrektomii u pacientů s diabetickou retinopatií [5], a tkáňový aktivátor plazminogenu (t-PA), který byl užíván k léčbě submakulárních hemoragií [6].
V léčbě vlhké formy VPMD je dnes možno použít přípravky inhibující vaskulární endoteliální růstový faktor (vascular endothelial growth factor, VEGF), tzv. anti-VEGF preparáty – pegaptanib, ranibizumab, bevacizumab. Všechna tato léčiva jsou aplikována formou injekce přímo do sklivcové dutiny. VEGF je homodimerický glykoprotein patřící do skupiny růstových
faktorů a vyskytuje se v několika izofor
mách.
Rozlišujeme VEGF-A206, VEGF-A189, VEGF-A165, VEGF-A121, VEGF-
A110, VEGF-B, VEGF-C, VEGF-D,
VEGF-E. Ačkoli byl VEGF původně charakterizován jako angiogenní faktor, víme, že hraje roli v řadě fyziologických procesů v organismu. V oku samotném je nezbytný pro trofiku choriokapilaris, má neuroprotektivní vliv na sítnici v případech retinální ischémie. Celkově je v organismu důležitý pro vývoj a funkci
ledvin, neuroprotekci, hojení ran, růst kostí,
ženský reprodukční cyklus, vazorelaxaci, protekci jaterních buněk proti hepatotoxinům a pro regeneraci skeletálního svalstva. Je nezbytný pro podporu kapilár v řadě orgánů. Z patologického hlediska má VEGF zásadní význam pro
rozvoj očních neovaskularizací, protože
je nesilnějším známým stimulátorem angio
geneze. Kromě toho je nejsilnějším induk
torem vaskulární permeability a při
spívá k rozvoji zánětlivé reakce. To, že
má zásadní význam pro rozvoj očních neovaskularizací a zejména pro rozvoj vlhké formy VPMD, dokládají práce a studie, které prokázaly jeho zvýšenou hladinu u očních vaskularizujících nozologických
jednotek, zvláště pak v CHNV. Prekli
nické studie n
a zvířecích mode
lech
prokázaly, že experimentálně zvýšená hladina VEGF vede k očním neovaskularizacím, a naopak jeho blokace v experimentálních podmínkách bránila rozvoji neovaskularizací. Výzkumy ukázaly, že ze všech izoforem VEGF se jako nejsilnější jeví izoforma 165.
Pegaptanib je syntetický oligonukleotid, který funguje jako selektivní inhibitor izoformy VEGF-A165. Svým působením se podobá protilátce, váže se na izoformu VEGF-A165 a brání tím její vazbě na receptor VEGFR-2. Je podáván injekčně přes skléru a pars plana corporis ciliaris přímo do sklivce. Poněvadž je v nitroočním prostoru degradován nukleázami, je potřeba jej vpravovat do nitra oka opakovaně. Pegaptanib je doporučován pro léčbu všech typů CHNV při vlhké formě VPMD.
Doporučená dávka při injekční intravitreál
ní
aplikaci je 0,3 mg a lék je podáván v šes
titýdenních intervalech, viz
tab. 1
[7].
Ranibizumab je fragment protilátky a neutralizuje všechny aktivní izoformy VEGF-A. Je podáván přes skléru a pars plana corporis ciliaris do sklivce. Ranibizumab je schváleným preparátem pro léčbu všech typů CHNV při VPMD. Doporučená dávka při injekční intravitreální aplikaci je 0,5 mg a lék je podáván v čtyřtýdenních intervalech
, viz
tab. 1
[7].
Bevacizumab je monoklonální protilátka proti VEGF. Váže se na všechny jeho izoformy a blokuje jejich interakci s recep
torem. Je podáván přes skléru a pars pla
na corporis ciliaris do sklivce. Bevacizumab je léčivo, které má schválení pro léčbu metastazujícího kolorektálního karcinomu, metastazujícího nemalobuněčného karcinomu plic, karcinomu prsu a karcinomu ledviny. Shodou okolností se v klinické praxi podařilo vysledovat i jeho užitečnost pro léčbu očních neovaskularizací. Nikdy však nebyly provedeny řádné prospektivní, randomizované, dvojitě slepé multicentrické studie, které by prověřily účinnost a bezpečnost bevacizumabu při dlouhodobém podávání. Chybějí studie, které by srovnaly jeho účinnost a bezpečnost s již existujícími a dostupnými léčebnými prostředky pro léčbu vlhké formy VPMD, tedy s fotodynamickou
terapií (PDT), pegaptanibem a ranibizu
mabem. Proto je nutno pohlížet na léčbu bevacizumabem jako na klinický pokus, který je přípustný až v situaci, kdy jiné léčebné postupy selhávají. Obvykle je podáván v dávce 1,25 mg až 2,50 mg ve čtyřtýdenních intervalech.
Z dosud řečeného je zřejmé, že všechny preparáty inhibující VEGF jsou v rámci léčby vlhké formy VPMD podávány opa
kovaně, injekčně do nitroočního prostoru. Aby byl maximalizován přínos léčby a minimalizována rizika pro pacienta, je
potřeba dodržet jisté zásady a principy
aplikace.
Péče v období před injekčním podáním léčiva
A.
Je potřeba vyřešit a zaléčit veškeré patologické stavy, které mohou zvýšit rizika spojená s intravitreálním podáním léčiva.
• Je-li pacient již léčen pro glaukom, měla by být před zahájením intravitreální aplika
ce léčiva zavedena adekvátní antiglauko
matózní terapie. Pacient by neměl být indikován k intravitreální aplikaci léčiva v případě, že aktuální hodnota nitroočního tlaku je 35 mm Hg či vyšší, a stejně tak, je-li hodnota nitroočního tlaku na léčeném oku chronicky zvýšena nad 30 mm Hg. Z toho plyne, že diagnostikovaný glaukom nepředstavuje absolutní kontraindikaciintravitreální aplikace anti-VEGF prepará
tů. Je-li injekční léčba anti-VEGF prepará
ty
nezbytná pro záchranu zrakové ostros
ti
,
ošetřující lékař by měl naplánovat jenom zvý
šený dozor u pacienta s glaukomem s četnějšími kontrolami nitroočního tlaku jak
v období před injekcí, tak po ní
a u pacienta je zapotřebí zvolit řádnou antiglaukomatózní terapii. Při tranzitorním vzestupu nitroočního tlaku bezprostředně po intravitreální aplikaci léčiva je paracentéza přední komory indikována pouze tehdy, je-li elevace nitroočního tlaku natolik výrazná, že představuje jasnou hrozbu trvalého poškození zraku.
• Je-li v okolí oka, na víčkách, spojivce
či v slzných cestách přítomen aktivní infekč
ní zánět, je nezbytné aplikaci intravitreálních injekcí oddálit a zánětlivý proces řádně zaléčit. Infekční zánět těchto struktur zvyšuje riziko endoftalmitidy [8].
• Anamnesticky je vhod
né pátrat po alergických reakcích na léčiva, kte
rá budou užita v obdo
bí
před injekcí, při samot
né aplikaci injekce
i v následném období.
B.
Je na zvážení lékaře, zdali se rozhodne
pro aplikaci antibiotik
do spojivkového vaku v období několika dnů před samotnou intravitreální injekcí, není-li přítomen infekční zánět, který by užití těchto antibiotik vyžadoval. Víme, že touto lokální aplikací antibiotik můžeme sní
žit počet bakterií ve
spojivkovém vaku, ale neexistuje jednoznačný důkaz, že tím snížíme riziko endoftalmitidy po provedené injekci. Navíc potlačení přirozené mikroflóry spojivkového vaku může podpořit proliferaci více virulentních a rezistentních kmenů. Například od roku 1990 do roku 2001 se rezistence
S. aureus
, častého původce endoftalmitid, izolovaného při keratitidách a konjunktivitidách, vůči ciprofloxacinu zvýšila o 166 % [9]. Jako optimální se jeví kapat po dobu 3 dnů, 4krát denně,
širokospektré antibiotikum a bezprostřed
ně před injekcí dezinfikovat okolí oka a spojivkový vak ředěným roztokem jodpovidonu. Tato kombinace minimalizuje spojivkovou bakteriální flóru [10–12].
C.
V období před intravitreální injekcí bychom se měli vyhnout hrubší manipulaci s víčky, neměla by být komprimována oční víčka, marga víček či oční adnexa. Pokud chceme před injekční aplikací léčiva snížit nitrooční tenzi, měl by být tlak vyvíjen cíleně jen na oční bulbus. Můžeme tedy zvážit opatrné provedení masáže očního bulbu tak, abychom nevyvíjeli tlak na okraje víček, oční adnexa a nezpůsobili jejich zbytečné podráždění. Intravitreální injekci je vhodné aplikovat ve sterilních rukavicích, poněvadž se předpokládá, že se tím snižuje riziko infekčních komplikací v období po zákroku. Ze stejného důvodu je doporučováno sterilní krytí především víček a řas.
Provedení intravitreální injekce
A.
Aplikací sympatomimetik či parasympatolytik navodíme dilataci zornice. Mydriáza je vhodná, abychom po provedené injekci mohli zkontrolovat zadní oční segment a vyloučit případné komplikace.
B.
Do spojivkového vaku aplikujeme ve formě očních kapek anestetikum. Frekvence aplikace odpovídá zvyklostem pracoviště při jiných zákrocích. Někdy bývá doporučováno přiložit do místa injekční aplikace léčiva na 10 sekund špejli s vatovým smotkem smočeným v anestetiku. Na zvážení ošetřujícího lékaře je kombinace této topické anestezie se subkonjunktivální aplikací anestetika.
C.
Spojivkový vak, řasy víček, marga víček, kožní stranu víček i kůži v okolí oka řádně dezinfikujeme. Jak již bylo řečeno výše, třídenní aplikace širokospektrého antibiotika následovaná bezprostředně před injekcí dezinfekcí okolí oka a spojivkového vaku roztokem jodpovidonu minimalizuje spojivkovou bakteriální flóru. Dosud nebyla provedena studie, která by zodpověděla otázku, je-li lépe aplikovat dezinfekci formou kapek, či výplachem spojivkového vaku. Mino de Kaspar ve své práci pozoroval, že výplach spojivkového vaku 5%
roztokem jodpovidonu je v eliminaci bakteriální flóry ze spojivkového vaku účinněj
ší než aplikace roztoku jodpovidonu formou 2 kapek do spojivkového vaku. Výplach spojivkového vaku prováděl 5% roztokem jodpovidonu v množství 10–15 cm3 [13, 14]. Naproti tomu Flynn
doporučuje použít k výplachu spojivko
vé
ho vaku 5% roztok jodpovidonu. Dezinfekci řas, kůže víček a okolí oka provádí špejlí se smotkem vaty, který je namočen v 10% roztoku jodpovidonu [10].
D.
Použijeme sterilní rozvěrač víček. Po nasazení rozvěrače je vhodné aplikovat několik kapek dezinfekčního roztoku do
místa zamýšlené intravitreální injekce nebo
přitisknout na místo zamýšlené injekce
špejli se smotkem vaty, který je namočen v 5% roztoku jodpovidonu.
E.
Injekce
je
aplikována
v
dolním
temporálním
kvadrantu
přes
pars
plana
corporis
ciliaris
do
sklivce.
Místo
injekce
je
u
afakických
či
artefakických
očí
3,5
mm
posteriorně
od
rohovkového
limbu
a
u
fakických
očí
4
mm
posteriorně
od
limbu
rohovky.
Vzdálenost
odměříme
sterilním
měřítkem.
F.
Použijeme jehlu 27 gauge či tenčí. Jehlu vedeme směrem do centra oka minimálně 6 mm do nitroočního prostoru.
G.
Léčivo aplikujeme do sklivce pozvolně. Příliš rychlá aplikace léčiva vede k jeho přílišné disperzi ve sklivcové dutině, může také přivodit uvolnění jehly z konu injekční stříkačky, a tím nekontrolovaný pohyb jehly v nitroočním prostoru. Po dokončení pozvolné aplikace léčiva do nitroočního prostoru je jehla opatrně vyjmuta a je vhodné po 10 sekund tamponovat místo vpichu sterilní štětičkou, abychom zabránili refluxu léčiva i sklivce.
H.
Následně je vhodné provést oftalmoskopickou kontrolu zadního očního segmentu. Kontrolujeme náplň cév na terči zrakového nervu. Je-li to možné, ověřujeme přítomnost léčiva ve sklivcové dutině. Dále si všímáme, zdali je sítnice přiložena a není-li přítomna nějaká nová nitrooční hemoragie.
Péče v období po intravitreální injekci
A.
V období po zákroku je vhodná topická aplikace antibiotik do spojivkového vaku. Antibiotika a jejich dávku bychom měli vybírat s ohledem na riziko potenciace mikro
biální rezistence. Doporučuje se, aby anti
biotikum nebylo podáváno déle než 3 dny [10].
B.
Je důležité sledovat v období po provedené intravitreální injekci nitrooční tlak. Je doporučováno léčebně zakročit proti elevaci nitroočního tlaku, pokud je spojena s okluzí centrální sítnicové arterie na terči zrakového nervu a pacient má po dobu více než 1 až 2 minut chybějící světelnou projekci. V těchto případech již obvykle bývá potřebná paracentéza přední komory s odpuštěním předněkomorové tekutiny, což vede k natolik dostatečnému poklesu nitroočního tlaku, že je možné pozorovat rychlou reperfuzi cév na terči zrakového nervu. Tranzitorní zašednutí či zamlžení vidění je očekávané a není třeba je terapeuticky řešit.
C.
I když u pacienta nebyly po provedené intravitreální injekci zaznamenány komplikace, je vhodné pacientovi doporučit, aby si oko nemnul, a poučit ho o příznacích, které by mohly svědčit pro nastupující endoftalmitidu, odchlípení sítnice či nitrooční krvácení, jako jsou zvýšený diskomfort až bolest oka, stupňující se zarudnutí oka, zamlžené či zhoršující se vidění a zvýšená citlivost oka na světlo. Pacient by měl být poučen, že mírné zamlžení zraku, často popisované jako zákalky v zorném poli, je v období po injekci normální a zákalky obvykle v rozpětí několika dnů či týdnů vymizí.
D.
Do týdne by mělo být provedeno
oční
kontrolní vyšetření u ošetřujícího oční
ho
lékaře.
Pegaptanib v léčbě vlhké formy VPMD
Přínos pegaptanibu pro léčbu vlhké formy VPMD hodnotila studie V.I.S.I.O.N. (VEGF Inhibition Study In Ocular Neovascularization clinical trial group). Při léčbě pegaptanibem v dávce 0,3 mg, 1,0 mg a 3,0 mg zaznamenalo po 54 týdnech sledování při vyšetření na ETDRS optotypu ztrátu zrakové ostrosti (ZO) menší než 15 písmen 70 %, 71 % a 65 % pacientů, zatímco při léčbě placebem zaznamenalo ztrátu menší než 15 písmen jen 55 % pacientů. Při léčbě pegaptanibem v dávce
0,3 mg byla po dvou letech sledování ztrá
ta méně než 15 písmen ETDRS optotypu pozorována u 59 % očí ve srovnání se 45 % očí, které byly léčeny placebem.
Po dvou letech sledování bylo možno konstatovat, že léčba pegaptanibem je přínosná pro všechny typy CHNV. Bylo konstatováno, že léčba je zvláště nadějná pro pacienty s časnými formami CHNV, u nichž byla ZO na počátku léčby lepší než 54 písmen ETDRS optotypu a velikost CHNV byla menší než dvojnásobek standardizované plochy disku. U pacientů, kteří splňovali tato vstupní kritéria, byla ztráta méně než 3 řádky ETDRS optotypu pozorována u 76 % očí oproti 50 % očí, které byly léčeny placebem [15, 16].
Nežádoucí účinky při léčbě pegaptanibem
Studie V.I.S.I.O.N. hodnotila také výskyt nežádoucích účinků, s nimiž může být intravitreální aplikace pegaptanibu spojena. V průběhu prvního roku léčby bylo hodnoceno 1190 pacientů zařazených do studie. Každému z nichž byl alespoň jedenkrát aplikován pegaptanib či placebo, celkově bylo aplikováno 7545 intravitreálních injekcí pegaptanibu a 2557 injekcí placeba. Oční nežádoucí účinky byly zaznamenány u 820 z 892 (92 %) pacientů, jimž byl aplikován pegaptanib, a u 260 z 298 (87 %) pacientů, kteří dostávali placebo. Závažné nežádoucí příhody byly zaznamenány u 169 z 892 (19 %) pac
ientů léčených pegaptanibem a u 45 z 298
(15 %) pacientů, kteří dostávali placebo. 90 z 892 pacientů (10 %), kteří dostávali pegaptanib, a 23 z 298 pacientů (8 %), kteří byli léčeni placebem, ze studie vystoupilo, ale jen minimum pacientů (2 % ze skupiny léčené pegaptanibem a 1 % ze skupiny léčené placebem)
tak učinilo na základě nežádoucích pří
hod.
U pacientů léčených pegaptanibem byla nejčastější oční komplikací bolestivost oka, vyskytla se u 299 z 892 (34 %) pacientů, sklivcové zákalky u 294 z 892 pacientů (33 %), punktátní keratitida postihla 286 z 892 (32 %) pacientů. Vždy šlo jen o lehkou či středně závažnou míru obtíží a jednotliví lékaři účastnící se studie se shodují, že se většinou jednalo o komplikace spojené s přípravou a provedením nitrooční injekce, a nikoli o komplikace způsobené samotným pegaptanibem. Rovněž vzestup nitroočního tlaku po aplikaci léčiva je poměrně častou komplikací tohoto způsobu léčby, byl pozorován u 177 z 892 (20 %) pacientů. 30 minut po aplikaci byl nitrooční tlak v průměru o 2–4 mm Hg vyšší než před injekcí, přičemž nejpozději do týdne byla pozorována úprava hodnot nitroočního tlaku na úroveň před aplikací léčiva. U žádného pacienta nebyla pozorována chronická elevace nitroočního tlaku, která by souvisela s podáváním pegaptanibu po dobu jednoho roku. U žádného pacienta nebylo třeba pro vysoký nitrooční tlak operativně zasáhnout a u žádného pacienta nebylo nutné přerušit léčbu pro zvýšení nitroočního tlaku či kvůli progresi zeleného zákalu. Přesto je třeba pacientům, kteří jsou ve sledování pro oční hyper
tenzi či zelený zákal, věnovat při tomto způ
sobu terapie zvýšenou pozornost. U pacientů, kteří vstupovali do léčby s anamnézou oční hypertenze či glaukomu, byl častěji (32 %) po injekci naměřen nitrooční tlak vyšší než 35 mm Hg. U žádného z pacientů léčených pegaptanibem nebyla v průběhu studie pozorována závažná zánětlivá reakce v přední komoře oka. U 9 z 892 pacientů (1 %) léčených pegaptanibem byla zaznamenána střední zánětlivá reakce v přední komoře, u žádného z těchto pacientů nebylo třeba v důsledku zánětlivé reakce v přední komoře léčbu ukončit. U léčených nebyla pozorována senzibilizace pegaptanibem. To dokládá pokles incidence zánětlivé reakce v přední komoře, která se v průběhu studie snižovala z 8 % během prvních tří injekcí na 5 % v období mezi sedmou a devátou injekcí. S mírně vyšší četností byla ve skupině pacientů léčených pegaptanibem oproti pacientům léčeným placebem jako nežádoucí příhoda hlášena progrese katarakty. Avšak ani ve skupině pacientů léčených pegaptanibem nebyl pozorován výraznější nárůst skutelárních katarakt, které bývají typické pro léčbu intravitreálními injekcemi. Ze závažných očních komplikací tohoto způsobu léčby, které mohou
vždy přivodit závažné poškození zraku, pří
padně až slepotu, je třeba vzpomenout riziko infekčního nitroočního zánětu (end
o
ftalmitidy), riziko odchlípení sítnice, nit
ro
očního krvácení či poškození čočky oka. Endoftalmitida byla zaznamenána u 12 pacientů, což při počtu 7545 provedených intravitreálních injekcí znamená 0,16% riziko endoftalmitidy na 1 injekci. Jen u 1 pacienta s endoftalmitidou byla výsledkem této komplikace těžká ztráta zraku (≥ 30 písmen ETDRS optotypu), u 8 pacientů pak byla pozorována ztráta ≤ 2 řádků ETDRS optotypu (≤ 10 písmen ETDRS optotypu). U 9 z 12 případů endoftalmitidy bylo zjištěno porušení doporučeného protokolu aplikace, nejčastěji nepoužití sterilního víčkového rozvěrače. Endoftalmitidu, riziko zavlečení infekce při průniku jehly přes stěnu oka do sklivce, nelze nikdy zcela vyloučit. Pokud jsou však při těchto intravitreálních injekcích dodrženy přísné zásady sterility, pohybuje se riziko endoftalmitidy po provedené injekční aplikaci léčiva na úrovni 0,04 % [17]. Odchlípení sítnice bylo
pozorováno u 6 pacientů. U 2 pacientů šlo
o exsudativněhemoragické odchlípení sítnice a pravděpodobně souviselo se samotným patologickým procesem v subretinálním prostoru. U 4 pacientů šlo o rhegmatogenní odchlípení sítnice. Riziko odchlípení sítnice je udáváno kolem 0,08 % na injekci [17]. U 5 pacientů došlo v průběhu prvního roku léčby k iatrogennímu poranění čočky. U 4 pacientů se tak stalo injekční jehlou zaváděnou do sklivce.
U 1 pacienta byla pro vysoký nitrooční tlak
bezprostředně po intravitreální injekci prováděna paracentéza přední komory a došlo k poranění předního pouzdra čočky. Z toho vyplývá riziko poškození čočky kolem 0,07 % na 1 injekci [17]. Přechodné snížení perfuze arteria centralis retinae bylo pozorováno u 4 pacientů, vždy bezprostředně po intravitreální injekci v souvislosti s elevací nitrooční tenze. U všech pacientů došlo k úpravě po provedení paracentézy přední komory. Okluze retinální žíly nebyla nikdy pozorována [17]. U 16 pacientů bylo pozorováno nitrosklivcové krvácení, což při počtu 7545 injekcí pegaptanibu znamená riziko 0,21 % na jednu injekci. V 7 případech bylo krvácení komplikací samotné vlhké formy VPMD, v 9 případech komplikací injekční aplikace pegaptanibu. Ve všech těchto 9 případech bylo krvácení mírného rozsahu.
U žádného z pacientů nebylo krvácení spo
jeno se sítnicovou trhlinou či s odchlípením sítnice [17]. Při hodnocení fluoroangiogramů pacientů léčených pegaptanibem nebyly popsány retinální vaskulární abnormity, které by nesouvisely se základní patologií VPMD. Nebyly pozorovány známky pegaptanibem navozené toxicity na cévách sítnice či cévnatky, tedy nebylo pozorováno zpomalení arteriovenózního průtoku, abnormity v choroidální perfuzi či známky arteriální okluze [17]. Celkové nežádoucí účinky byly se stejnou frekvencí zastoupeny ve skupině pacientů léčených pegaptanibem i ve skupině pacientů dostávajících placebo. Nejčastější nežádoucí příhody, kardiální poruchy, byly s vyšší četností – 5 % – pozorovány ve skupině pacientů léčených placebem, zatímco ve skupině léčené pegaptanibem dosáhla frekvence těchto nežádoucích příhod 3 %. K úmrtí pacienta došlo ve stejné frekvenci (2 %) v obou léčených skupinách. U pacientů léčených pegaptanibem nebyly pozorovány celkové nežádoucí účinky, které jsou známy ze systémového podání
neselektivního inhibitoru VEGF bevacizumabu (hypertenze, tromboembolické příhody, hemoragické komplikace) [17]. V druhém roce studie se zjištěná data kryla s výsledky prvního roku pozorování. Kon
traindikací pro tento způsob léčby vlhké for
my věkem podmíněné makulární degenerace tak zůstává jen okulární či periokulární infekce a přecitlivělost na anti-VEGF prepará
ty či jiné složky přípravku [17].
Ranibizumab v léčbě vlhké formy VPMD
Přínos ranibizumabu pro léčbu vlhké formy VPMD hodnotily studie MARINA a ANCHOR. V klinické studii MARINA (Minimally classic/occult trial of the anti-VEGF antibody ranibizumab in the treatment of
neovascular age-related macular degene
ration) byla testována účinnost dávky 0,3 mg a 0,5 mg ranibizumabu u minimálně kla
sických a okultních CHNV bez přítomnos
ti klasické složky. Při léčbě ranibizumabem v dávce 0,3 mg a 0,5 mg zaznamenalo po jednom roce sledování při vyšetření na ETDRS optotypu ztrátu ZO menší než
15 písmen 95 % a 95 % pacientů, zatím
co při podávání placeba zaznamenalo ztrátu menší než 15 písmen jen 62 % pacientů. Po dvou letech sledování zaznamenalo ztrátu ZO menší než 15 písmen 92 % pacientů léčených dávkou 0,3 mg ranibizumabu a 90 % pacientů léčených dávkou 0,5 mg ranibizumabu, zatímco ve skupině
pacientů s placebem zaznamenalo po
dvou letech sledování ztrátu menší než 15 písmen jen 53 % pacientů [18].
Ve studii ANCHOR (Anti-VEGF antibody for the treatment of predominantly classic choroidal neovascularization in age-related macular degeneration) byl srovnáván přínos ranibizumabu podávaného v dávce 0,3 mg a 0,5 mg s PDT při léčbě převážně klasických CHNV. Po 12 měsících sledování byl pokles ZO menší než 15 písmen ve srovnání se vstupní ZO zaznamenán u 64,3 %, 94,3 % a 96,4 % pacientů léčených PDT či ranibizumabem v dávce 0,3 mg, resp. 0,5 mg. Po 24 měsících sledování byly výsledky obdobné. Zhoršení ZO o méně než 15 písmen ve srovnání se vstupní ZO bylo pozorováno u 65,7 %, 90,0 % a 89,9 % pacientů léčených PDT či ranibizumabem v dávce 0,3 mg, resp. 0,5 mg [19].
Nežádoucí účinky při léčbě ranibizumabem
Studie MARINA hodnotila i bezpečnost léčby ranibizumabem. Incidence závažných očních nežádoucích účinků byla v průběhu 2 let studie nižší než 1,5 % na pacienta. Endoftalmitida byla zjištěna u 5 z 448 (1 %) pacientů léčených ranibizumabem, což odpovídá riziku 0,05 % na jednu injekci. Celkem 3 případy endoftalmitidy byly zaznamenány v průběhu prvního roku léčby a 2 případy v průběhu druhého roku léčby. U žádného z těchto 5 pacientů nebyla po 2 letech sledování konstatována těžká ztráta zraku (≥ 30 písmen ETDRS optotypu), u 2 pacientů bylo po 2 letech sledování konstatováno zlepšení zrakové ostrosti o 4, resp. 10 písmen ETDRS optotypu a u žádného ze zbývajících 3 pacientů nebyla po 2 letech studie konstatována ztráta zrakové ostrosti vyšší než 15 písmen ETDRS optotypu. Uveitida byla v průběhu dvouleté studie zaznamenána u 6 (1,5 %) pacientů léčených ranibizumabem, velmi pravděpodobně jako reakce na aplikaci samotného ranibizumabu. Elevace nitroočního tlaku po injekční aplikaci ranibizumabu či placeba byla přechodná. Ve skupině léčené ranibizumabem v dávce 0,3 mg a 0,5 mg byla průměrná elevace nitroočního tlaku
1,9–3,5 mm Hg, respektive 2,1–3,4 mm
Hg ve srovnání se skupinou, která dostávala placebo a kde se elevace nitrooční tenze pohybovala v rozmezí 0,8–1,5 mm Hg. Elevace nitroočního tlaku vyšší než 30 mm Hg
byla konstatována u 13 % a 18 % paci
en
tů léčených ranibizumabem v dávce 0,3 mg
a 0,5 mg, ale jen u 3 % pacientů užívajících placebo. Mezi třemi léčenými skupinami nebyl zjištěn signifikantní rozdíl ve výskytu závažných mimoočních nežádoucích účinků. Hypertenze byla diagnostikována u 17,2 % a 16,3 % pacientů léčených ranibizumabem v dávce 0,3 mg, resp. 0,5 mg a u 16,1 % pacientů užívajících placebo. Po 24 měsících sledování nebyl ve studii MARINA zaznamenán statisticky signifikantní rozdíl v počtu tromboembolických příhod u pacientů dostávajících ranibizumab a placebo. Nebylo zaznamenáno úmrtí pacienta v souvislosti s aplikací ranibizumabu. V průběhu 24 měsíců sledování zemřelo 17 osob. Z toho 6 osob ve skupině s placebem a 5, resp. 6 osob ve skupině s ranibizumabem podávaným v dávce 0,3 mg a 0,5 mg [18].
Bezpečnost léčby ranibizumabem pro pacienta potvrzují i výsledky studie
ANCHOR. Incidence endoftalmitidy, závažné uveitidy, sklivcového krvácení a rhegmatogenní amoce byly ve všech skupinách
pod hranicí 1 %. Nebyla zjištěna celková
nerovnováha ve výskytu závažných nežádoucích mimoočních účinků u skupin pacientů léčených ranibizumabem v dávce 0,3 mg a 0,5 mg a ve skupině pacientů léčených PDT s vertporfinem [19].
Závěr
Závěrem lze konstatovat, že ve velkých prospektivních multicentrických randomizovaných dvojitě slepých studiích prokázaly pegaptanib i ranibizumab svůj přínos pro léčbu vlhké formy VPMD. Při znalosti a dodržení zásad správné aplikace a řádné péče o pacienta je možné léčebný postup s přímým injekčním podáním účinné látky do sklivce prohlásit za bezpečný s přijatelnými a zvladatelnými riziky pro pacienta.

