223Radium
Metastatické postižení kosti provází s vysokou prevalencí pokročilá stadia karcinomu prostaty. Kostní postižení způsobuje kromě algického syndromu i výskyt kostních komplikací, patologických zlomenin, kompresí míšních, hyperkalcemii, eventuálně dochází ke karcinomatóze kostní dřeně s důsledky pro krvetvorbu. Výskyt kostních metastáz a jejich komplikací koreluje s přežitím. K léčbě osteolýzy a k oddálení výskytu kostních komplikací jsou používány bisfosfonáty, jak perorální, tak i intravenózní, nebo monoklonální protilátka denosumab. Jednoznačné je jejich postavení v léčbě hyperkalcemie. Nový pohled na léčbu kostních metastáz u pacientů s metastatickým kastračně refrakterním karcinomem prostaty (mCRCP) přináší aplikace α-zářiče 223radia. Kalcimimetikum se selektivně vychytává v místech zvýšeného kostního obratu. Jeho aplikace je spojena s analgetickým účinkem u pacientů s mCRPC, s jejich prodlouženým přežitím a s minimálním množstvím nežádoucích účinků.
Farmakologická skupina
Přípravek patří mezi terapeutická radiofarmaka, je zařazen do ATC skupiny C10XX03.
Chemické a fyzikální vlastnosti
Léčivý přípravek obsahuje v jednom mililitru roztoku 223radium dichloridum 1000 kBq, což odpovídá 223radium 0,53 ng k referenčnímu datu. Radium se nachází v roztoku jako volný iont. Jedna injekční lahvička obsahuje 6 ml roztoku (223radium dichloridum 6,0 MBq k referenčnímu datu).
Mechanismus účinku
Látka označená jako 223radium (22![Obr. 1 Mechanismus účinku radia-223 dichloridu; volně podle [1] – Bruland, 2006. Po intravenózní injekci se 223radium primárně ukládá do kostí a kostních metastáz. Jako radium-223 dichlorid napodobuje vápník a začleňuje se na jeho místo v hydroxyapatitu kosti, zejména v oblastech zvýšeného kostního obratu (kostní metastázy). Radium-223 emituje α-částice, které v nádorových buňkách poškozují dvojšroubovici DNA, což vede k cytotoxickému účinku a zániku nádorové buňky](https://www.remedia.cz/photo-a-29898---.jpg) 3Ra, Radium-223) je léčivo emitující terapeutické α-částice. Aktivní složka radium-223 (jako radium-223 dichlorid) napodobuje vápník a její působení je selektivně cíleno na kost, konkrétně na oblasti kostních metastáz tím, že tvoří komplexy s kostním minerálem hydroxyapatitem. Vysoký lineární energetický přenos α-zářičů (80 keV/µm) vede k vysoké frekvenci zlomů dvojité šroubovice DNA v sousedních nádorových buňkách a to má za následek cytotoxický účinek. Další účinky na nádorové mikroprostředí včetně osteoblastů a osteoklastů také přispívají k účinnosti in vivo [1, 2]. Dosah α-částice z 223Ra je menší než 100 µm (méně než 10 průměrů buňky), což minimalizuje poškození zdravé sousední tkáně (obr. 1).
3Ra, Radium-223) je léčivo emitující terapeutické α-částice. Aktivní složka radium-223 (jako radium-223 dichlorid) napodobuje vápník a její působení je selektivně cíleno na kost, konkrétně na oblasti kostních metastáz tím, že tvoří komplexy s kostním minerálem hydroxyapatitem. Vysoký lineární energetický přenos α-zářičů (80 keV/µm) vede k vysoké frekvenci zlomů dvojité šroubovice DNA v sousedních nádorových buňkách a to má za následek cytotoxický účinek. Další účinky na nádorové mikroprostředí včetně osteoblastů a osteoklastů také přispívají k účinnosti in vivo [1, 2]. Dosah α-částice z 223Ra je menší než 100 µm (méně než 10 průměrů buňky), což minimalizuje poškození zdravé sousední tkáně (obr. 1).
Farmakokinetické vlastnosti
Údaje o farmakokinetice, biodistribuci a dozimetrii byly získány ze tří studií fáze I. Farmakokinetické údaje byly získány od 25 pacientů při aktivitách od 46 kBq/kg do 250 kBq/kg.
Absorpce
Přípravek se podává v intravenózní injekci, a proto má 100% biologickou dostupnost.
Distribuce
Po intravenózní injekci je 223Ra rychle eliminováno z krve a ukládá se primárně do kostí a kostních metastáz nebo se vylučuje do střeva. Patnáct minut po aplikaci zůstalo asi 20 % podané aktivity v krvi. Za 4 hodiny zůstala v krvi asi 4 % podané aktivity a 24 hodin po aplikaci aktivita klesla na méně než 1 %. Distribuční objem byl vyšší než objem krve, což ukazuje na distribuci do periferních kompartmentů; 10 minut po aplikaci injekce byla aktivita pozorována v kostech a ve střevě. Úroveň aktivity v kostech dosahovala za 4 hodiny po injekci 44–77 %. Za 4 hodiny po aplikaci nebylo pozorováno žádné významné vychytávání v jiných orgánech, jako jsou srdce, játra, ledviny, močový měchýř a slezina.
Biotransformace
Radium-223 je izotop, který se rozpadá a není metabolizován (obr. 2), 223Ra je α-zářič s poločasem rozpadu 11,4 dne. Specifická aktivita ![Obr. 2 Řetězec rozpadu 223Ra s fyzikálními poločasy; podle [4] – SPC Xofigo.](https://www.remedia.cz/photo-a-29899---.jpg) 223Ra je 1,9 MBq/ng. Šestistupňový rozpad 223Ra na 207Pb nastává přes dceřiné rozpadové produkty s krátkou životností a je doprovázen množstvím záření alfa, beta a gama s různými energiemi a vlastnostmi záření. Frakce energie emitovaná z 223Ra a jeho dceřiných produktů jako α-částice je 95,3 % (energetické rozmezí 5,0–7,5 MeV). Frakce emitovaná jako β-částice je 3,6 % (průměrné energie jsou 0,445 MeV a 0,492 MeV) a frakce emitovaná jako záření gama je 1,1 % (energetické rozmezí 0,01–1,27 MeV).
223Ra je 1,9 MBq/ng. Šestistupňový rozpad 223Ra na 207Pb nastává přes dceřiné rozpadové produkty s krátkou životností a je doprovázen množstvím záření alfa, beta a gama s různými energiemi a vlastnostmi záření. Frakce energie emitovaná z 223Ra a jeho dceřiných produktů jako α-částice je 95,3 % (energetické rozmezí 5,0–7,5 MeV). Frakce emitovaná jako β-částice je 3,6 % (průměrné energie jsou 0,445 MeV a 0,492 MeV) a frakce emitovaná jako záření gama je 1,1 % (energetické rozmezí 0,01–1,27 MeV).
Eliminace
Eliminace ve stolici je hlavní cestou eliminace z těla. Asi 5 % je vyloučeno v moči a neexistuje žádný důkaz o vylučování hepatobiliární cestou. Celotělové měření uskutečněné 7 dnů po aplikaci injekce (po úpravě vzhledem k rozpadu) ukazuje, že z těla bylo vyloučeno průměrně 76 % podané aktivity. Rychlost eliminace radia-223 dichloridu z gastrointestinálního traktu je ovlivněna vysokou variabilitou intestinálního tranzitu napříč populací s normálním rozmezím vyprazdňování jednou denně až jednou týdně.
Klinické zkušenosti
Klinické zkušenosti vycházejí z registrační studie ALSYMPCA (ALpharadin in SYMptomatic Prostate CAncer), prezentov![Obr. 3 Design klinické studie ALSYMPCA; podle [3] – Parker, 2013. ALP – alkalická fosfatáza; CRCP – kastračně refrakterní karcinom prostaty; PSA – prostatický specifický antigen](https://www.remedia.cz/photo-a-29900---.jpg) ané v roce 2013 [3]. Do sledování bylo zařazeno od června 2008 do února 2011 celkem 921 mužů s mCRPC, kteří byli randomizovaně rozděleni v poměru 2 : 1 do skupin s léčbou 223Ra a s podáváním placeba. Stratifikace studie (obr. 3) umožnila zařazení pacientů, kteří mohli současně užívat bisfosfonáty, i nemocných, kteří byli předléčeni docetaxelem nebo jeho podání odm
ané v roce 2013 [3]. Do sledování bylo zařazeno od června 2008 do února 2011 celkem 921 mužů s mCRPC, kteří byli randomizovaně rozděleni v poměru 2 : 1 do skupin s léčbou 223Ra a s podáváním placeba. Stratifikace studie (obr. 3) umožnila zařazení pacientů, kteří mohli současně užívat bisfosfonáty, i nemocných, kteří byli předléčeni docetaxelem nebo jeho podání odm![Graf 1 Kaplanovy-Meierovy křivky celkového přežití ve studii ALSYMPCA; podle [3] – Parker, 2013.](https://www.remedia.cz/photo-a-29901---.jpg) ítli, popřípadě u nich byla aplikace docetaxelu kontraindikována.
ítli, popřípadě u nich byla aplikace docetaxelu kontraindikována.
Primárním cílem studie ALSYMPCA bylo dosažení celkového přežití (graf 1), kde signifikantní rozdíl ve prospěch 223Ra oproti placebu představuje 14,9 měsíce oproti 11,3 měsíce (konfidenční interval – 95% CI: 0,58–0,83). Rozdílná doba přežití byla u nemocných s předchozím podáním docetaxelu (14,4 měsíce) ve srovnání s chemonaivními nemocnými (![Graf 2 Kaplanovy-Meierovy křivky doby do první kostní příhody ve studii ALSYMPCA; podle [3] – Parker, 201](https://www.remedia.cz/photo-a-29902---.jpg) 16,1 měsíce). Delší přežití bylo zaznamenáno u nemocných se současným podáním bisfosfonátů oproti nemocným, kteří léčbu bisfosfonáty nedostali – 15,3 měsíce vs. 14,5 měsíce. Při podání radia dochází k prodloužení doby do první kostní příhody (skeletal related event, SRE). Medián dosáhl ve skupině s léčbou 223Ra 15,6 měsíce, u nemocných ve skupině s placebem 9,8 měsíce, jak uvádí graf 2 (95% CI: 0,52–0,83). Při podání radia navíc dochází k prodloužení doby do progrese ALP (alkalická fosfatáza) a PSA (prostatický specifický antigen) ve srovnání s placebem. Význam podávání radia-223 dic
16,1 měsíce). Delší přežití bylo zaznamenáno u nemocných se současným podáním bisfosfonátů oproti nemocným, kteří léčbu bisfosfonáty nedostali – 15,3 měsíce vs. 14,5 měsíce. Při podání radia dochází k prodloužení doby do první kostní příhody (skeletal related event, SRE). Medián dosáhl ve skupině s léčbou 223Ra 15,6 měsíce, u nemocných ve skupině s placebem 9,8 měsíce, jak uvádí graf 2 (95% CI: 0,52–0,83). Při podání radia navíc dochází k prodloužení doby do progrese ALP (alkalická fosfatáza) a PSA (prostatický specifický antigen) ve srovnání s placebem. Význam podávání radia-223 dic![Graf 3 Význam podávání radia-223 dichloridu napříč podskupinami pacientů; podle [3] – Parker, 2013. ALP – alkalická fosfatáza; ECOG – The Eastern Cooperative Oncology Group, skóre hodnotící celkovou fyzickou aktivitu nemocného, přičemž ECOG = 0 znamená plnou fyzickou aktivitu bez omezení](https://www.remedia.cz/photo-a-29903---.jpg) hloridu napříč podskupinami pacientů, kteří byli zařazeni do klinické studie ALSYMPCA, ukazuje graf 3.
hloridu napříč podskupinami pacientů, kteří byli zařazeni do klinické studie ALSYMPCA, ukazuje graf 3.
Výskyt nežádoucích účinků je prakticky srovnatelný s placebem. Počet pacientů, kteří nezaznamenali nežádoucí účinky, dosáhl 93 % ve skupině s aktivní léčbou a 96 % při podávání placeba. Toxicita stupně 3 nebo 4 byla ve studii zaznamenána u 56 % pacientů ze skupiny léčených radiem a u 62 % pacientů ve skupině s placebem. Pro nežádoucí účinky ukončilo předčasně studii 16 % pacientů ze skupiny s podáváním 223Ra a 21 % ze skupiny s placebem. Hematologická a nehematologická toxicita byla popsána u méně než 5 % pacientů. Febrilní neutropenie se vyskytla u jednoho pacienta ve skupině radia a jednoho pacienta ve skupině placeba. Jeden pacient měl při léčbě 223Ra trombocytopenii stupně 4. Mezi závažné vedlejší účinky patří progrese onemocnění (11 % při podávání 223Ra a 12 % při podávání placeba), algický kostní syndrom (10 % vs. 16 %), anémie (8 % vs. 9 %) a spinální léze (4 % vs. 5 %). Při hodnocení kvality života podle skóre FACT-P (Functional Assessment of Cancer Therapy-Prostate) byl zjištěn signifikantní rozdíl ve prospěch podání radia-223 dichloridu.
Zařazení do současné palety léčiv
Od začátku tisíciletí dochází ke změně pohledu na pokročilá stadia karcinomu prostaty, především na kastračně refrakterní karcinom prostaty (CRPC). Koncem minulého tisíciletí byl zařazen do algoritmu léčby režim mitoxantron s prednisonem, který příznivě ovlivnil algický syndrom. Prvním režimem, který vedl k prodloužení přežití, byl docetaxel s prednisonem ve třítýdenním podání [5]. Byl do managementu zařazen v roce 2004 a dodnes je standardem v léčbě, i když je postupně i v první linii léčby zvolna nahrazován především hormonálními přípravky abirateronem [6] a enzalutamidem [7]. Imunoterapie sipuleucelem T [8], od letošního roku schválená i v Evropě, je terapií pro asymptomatické a minimálně symptomatické nemocné, významnější místo si zatím nezískala. Kabazitaxel je jediným z přípravků, který měl v registrační studii jako komparátor léčivý přípravek, nikoliv placebo [9]. V současné době je jeho místo ve druhé linii léčby po selhání docetaxelu, především u agresivně se chovajících nádorů s viscerálními metastázami, krátkou dobou odpovědi vůči hormonální terapii a vysokým Gleasonovým skóre.
P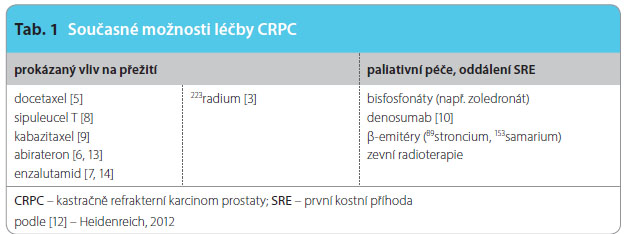 ro asymptomatické nemocné nyní volíme obvykle pouze podání látek modifikujících kostní metabolismus, tedy bisfosfonáty nebo denosumab [10]. Teprve s rozvojem symptomů rozšiřujeme terapii o další přípravky (přehled je v tab. 1). Pro nemocné, kteří mají výlučně kostní postižení, podstoupili léčbu docetaxelem nebo nejsou vhodní k podání docetaxelu, představuje kvalitní možnost léčby podání 223Ra [11]. Jeho aplikace je spojena s minimem možných nežádoucích účinků a dobrou kvalitou života. Podání 223Ra vede k prodloužení přežití a k oddálení kostních komplikací.
ro asymptomatické nemocné nyní volíme obvykle pouze podání látek modifikujících kostní metabolismus, tedy bisfosfonáty nebo denosumab [10]. Teprve s rozvojem symptomů rozšiřujeme terapii o další přípravky (přehled je v tab. 1). Pro nemocné, kteří mají výlučně kostní postižení, podstoupili léčbu docetaxelem nebo nejsou vhodní k podání docetaxelu, představuje kvalitní možnost léčby podání 223Ra [11]. Jeho aplikace je spojena s minimem možných nežádoucích účinků a dobrou kvalitou života. Podání 223Ra vede k prodloužení přežití a k oddálení kostních komplikací.
Indikace
Radium-223 je indikováno k léčbě dospělých mužů s mCRPC, se symptomatickými metastázami v kostech a bez známých viscerálních metastáz.
Nežádoucí účinky
Celkový bezpečnostní profil přípravku vychází z dat od 600 pacientů léčených 223Ra v registrační studii MPC (ALSYMPCA). Nejčastěji pozorovanými nežádoucími účinky (≥ 10 %) u pacientů léčených 223Ra byly průjem, nevolnost, zvracení a trombocytopenie. Nejzávažnějšími nežádoucími účinky byly trombocytopenie a neutropenie. Nežádoucí účinky pozorované v souvislosti s podáním 223Ra jsou uvedeny v tab. 2. Jsou klasifikovány podle tříd orgánových s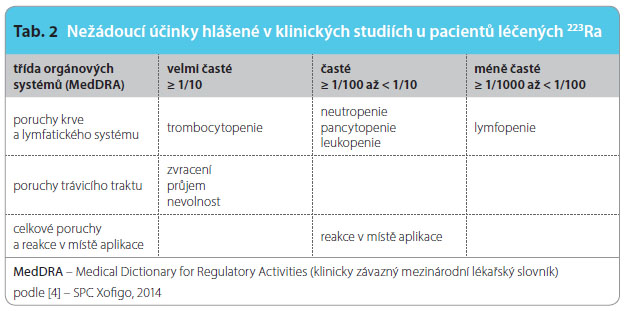 ystémů. Pro popis určité reakce a jejich synonym a souvisejících stavů je použit nejvhodnější termín MedDRA (Medical Dictionary for Regulatory Activities). Nežádoucí účinky z klinických studií jsou klasifikovány podle frekvence jejich výskytu. V každé skupině četností jsou nežádoucí účinky uvedeny v pořadí podle klesající závažnosti.
ystémů. Pro popis určité reakce a jejich synonym a souvisejících stavů je použit nejvhodnější termín MedDRA (Medical Dictionary for Regulatory Activities). Nežádoucí účinky z klinických studií jsou klasifikovány podle frekvence jejich výskytu. V každé skupině četností jsou nežádoucí účinky uvedeny v pořadí podle klesající závažnosti.
Trombocytopenie a neutropenie
Trombocytopenie (všech stupňů) se vyskytla u 11,5 % pacientů ze skupiny s léčbou radiem-223 a u 5,6 % pacientů ze skupiny placeba. Trombocytopenie stupně 3 a 4 byla pozorována u 6,3 % pacientů léčených a u 2 % pacientů užívajících placebo. Frekvence trombocytopenie stupně 3 a 4 byla celkově nižší u pacientů, kteří dosud nedostávali docetaxel (2,8 % pacientů léčených radiem oproti 0,8 % pacientů užívajících placebo) ve srovnání s pacienty, kteří dříve dostávali docetaxel (8,9 % pacientů léčených oproti 2,9 % pacientů užívajících placebo). V případě pacientů s karcinomem prostaty s pokročilou difuzní infiltrací kostí – EOD4 („superscan”) – byla u 19,6 % pacientů léčených radiem a u 6,7 % pacientů užívajících placebo hlášena trombocytopenie (všech stupňů). U 5,9 % pacientů ze skupiny s léčbou radiem-223 a u 6,7 % pacientů ze skupiny dostávající placebo byl pozorován stupeň trombocytopenie 3 a 4. Neutropenie (všech stupňů) byla hlášena u 5 % pacientů léčených přípravkem s aktivní látkou a u 1 % pacientů užívajících placebo. Neutropenie stupně 3 a 4 byla pozorována u 2,2 % pacientů léčených radiem a u 0,7 % pacientů užívajících placebo. Frekvence neutropenie stupně 3 a 4 byla celkově nižší u pacientů, kteří dosud nedostávali docetaxel (0,8 % pacientů léčených oproti 0,8 % pacientů užívajících placebo), ve srovnání s pacienty, kteří dříve dostávali docetaxel (3,2 % pacientů léčených oproti 0,6 % pacientů užívajících placebo).
Reakce v místě aplikace injekce
Reakce v místě aplikace injekce stupně 1 a 2, např. erytém, bolest a otok, byly hlášeny u 1,2 % pacientů léčených radiem a 0 % pacientů užívajících placebo.
Sekundární maligní nádory
Podávání léčivého přípravku s obsahem 223Ra přispívá k celkové dlouhodobé kumulativní radiační expozici u pacienta. Dlouhodobá kumulativní expozice může být spojena se zvýšeným rizikem vzniku rakoviny a vrozených defektů. Zejména riziko vzniku osteosarkomu, myelodysplastického syndromu a leukemie může být zvýšeno. V klinických studiích nebyly při sledování po dobu až tří let hlášeny žádné případy malignity v souvislosti s léčbou 223Ra.
Lékové interakce
Nebyly provedeny žádné klinické studie interakcí.Protože nemůže být vyloučena interakce s vápníkem a fosfáty, podávání přípravků s těmito látkami a/nebo vitaminem D by mělo být několik dnů před zahájením léčby přípravkem s obsahem 223Ra přerušeno. Chemoterapie souběžná s terapií 223Ra může mít aditivní účinky na supresi kostní dřeně. Bezpečnost a účinnost chemoterapie podávané současně s 223Ra nebyly stanoveny.
Těhotenství a kojení
Reprodukční studie u zvířat nebyly s 223Ra provedeny. Radionuklidy obecně mají vliv na reprodukci a vývoj. Vzhledem k možnosti účinků na spermatogenezi související s ozářením by mělo být mužům doporučeno, aby během léčby a až 6 měsíců po ukončení léčby léčivým přípravkem používali účinné metody antikoncepce.
Přípravek není indikován u žen a nemá být používán u žen, které jsou nebo mohou být těhotné, nebo u kojících žen.
Nejsou k dispozici žádné údaje u člověka o účinku 223Ra na fertilitu. Z výsledků studií provedených u zvířat vyplývá možné riziko, že záření z přípravku by mohlo mít nežádoucí účinky na fertilitu. Pacienti by měli zvážit možnost konzervace spermií před léčbou.Radionuklidy jsou obecně považovány za genotoxické a karcinogenní.
Dávkování
Léčivý přípravek 223Ra je podáván v dávce o aktivitě 50 kBq/kg tělesné hmotnosti ve 4týdenních intervalech. Je podáváno 6 injekcí přípravku. U starších pacientů není nutná žádná úprava dávkování, stejně tak ani u nemocných s poruchou funkce ledvin a jater.
Závěr
Pro pacienty s mCRPC přichází nová alternativa léčby, ze které mohou mít užitek především nemocní s kostním postižením bez viscerálního postižení. Léčba 223Ra signifikantně prodlužuje přežití a oddaluje výskyt kostních komplikací. Jeho podání není spojeno se zvýšením počtu nežádoucích účinků ve srovnání s placebem. Do spektra léčby mCRPC se tak dostává nové léčivo, ze kterého může mít uvedená skupina nemocných přínos.
Seznam použité literatury
- [1] Bruland OS, Nilson S, Fischer DR, Larsen RH. High-Linear Energy Transfer Irradiation Targeted to Skeletal Metastases by the α-Emitter 223Ra: Adjuvant or Alternative to Conventional Modalities. Clin Cancer Res 2006;12: 6250–6257.
- [2] Cheetham PJ, Petrylak DP. Alpha Particles as Radiopharmaceuticals in the Treatment of Bone Metastases: Mechanism of Action of Radium-223 Chloride (Alpharadin) and Radiation protection. Oncology 2012; 26: 330–337, 341.
- [3] Parker C, Nilsson, S, Heinrich D, et al. Alpha Emitter Radium-223 and Survival in Metastatic Prostate Cancer. N Engl J Med 2013; 369: 213–223.
- [4] Summary of product characteristics (SPC) Xofigo. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002653/WC500156172.pdf Navštíveno 15. 8. 2014.
- [5] Tannock IF, de Witt R, Berry WR, et al. Docetaxel plus prednisone or Mitoxantrone plus prednisone for advanced prostate cancer. New Engl J Med 2004; 351: 1502–1512.
- [6] Ryan CJ, Smith MR, de Bono JS, et al. Abiraterone in Metastatic Prostate Cancer without Previous Chemotherapy. NEJM 2013; 368: 38–48.
- [7] Beer TM, et al. Enzalutamide in men with chemotherapy-naive metastatic prostate cancer (mCRPC): Results of phase III PREVAIL study. J Clin Oncol 2014; 32 (suppl 4; abstr LBA1^).
- [8] Kantoff PW, Gitano CS, Shore ND, et al. Sipuleucel-T Immunotherapy for Castration-Resistant Prostate Cancer. N Engl J Med 2010; 363: 411–422.
- [9] De Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376: 1147–1154.
- [10] Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011; 377: 813–822.
- [11] Harrison MR, Wong TZ, Armstrong AJ, et al. Radium-223 chloride: a potential new treatment for castration-resistant prostate cancer patients with metastatic bone disease. Canc Manag Res 2013; 5: 1–14.
- [12] Heidenreich A, Bastion PJ, Bellmunt J, et al. Guidelines on Prostate Cancer. European Association of Urology 2012. Dostupné na: http://www.uroweb.org/gls/pdf/08%20Prostate%20Cancer_LR%20March%2013th%202012.pdf. Navštíveno 15. 8. 2014.
- [13] Fizazi K, Scher HI, Molina A, et al. Final overall survival (OS) analysis of COU-AA-301, a phase 3 study of abiraterone acetate plus prednisone in patients with metastatic castration-resistant prostate cancer (mCRPC) pretreated with docetaxel. European Multidisciplinary Cancer Congress 2011, abstract 7000.
- [14] Scher HI, Fizazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. NEJM 2012; 367: 1187–1197.