Aclidinium bromid
Aclidinium bromid je nový inhalační dlouhodobě působící antagonista muskarinových receptorů (LAMA, long-acting muscarinic antagonist), který získal v České republice úhradu pro udržovací léčbu u dospělých pacientů se stabilizovanou fází chronické obstrukční plicní nemoci (CHOPN). Studie fáze IIa s podáváním 400 µg aclidinium bromidu dvakrát denně prokázala srovnatelnou účinnost s tiotropiem, navíc větší bronchodilataci a nižší výskyt symptomů ve druhé polovině dne. Bronchodilatace byla také již první den významně vyšší než při podání tiotropia. Studie fáze IIb ověřila srovnatelný účinek s podávaným formoterolem při dávkování aclidinium bromidu 200 µg nebo 400 µg dvakrát denně. Studie fáze III ACCORD I a ATTAIN trvaly 12 týdnů, respektive 24 týdnů, a používaly dávky 200 µg i 400 µg. Oproti podávání placeba bylo zjištěno signifikantní zlepšení tzv. trough FEV1 (forced expiratory volume in 1 second) – ranní předléčebné hodnoty FEV1 ve 12. a 24. týdnu, klinicky významné zlepšení kvality života dle dotazníku SGRQ (St. George‘s Respiratory Questionnaire), zmírnění dušnosti a došlo ke snížení počtu exacerbací. Studie prokázaly významný bronchodilatační efekt, snížení aplikace záchranné medikace, významně nižší frekvenci nočních obtíží i menší omezení ranních aktivit. Klinicky významného zlepšení kvality života bylo dosaženo pouze při podávání dávky 400 µg. Studie fáze IIIb prokázala stejnou účinnost aclidinium bromidu jako tiotropia, významně účinnější byl aclidinium bromid ve zmírnění nočních a časných ranních symptomů při dávkování 400 µg dvakrát denně.
Aclidinium bromid je aplikován pomocí dechem aktivovaného inhalátoru Genuair® pro práškovou formu léku. Tento inhalátor nemocní hodnotí jako nejsnadněji zvládnutelný a více preferovaný než ostatní porovnávané inhalátory.
Aclidinium bromid lze hodnotit jako bezpečný a dobře snášený LAMA s rychlým nástupem účinku. V porovnání s nejčastěji používaným LAMA – tiotropiem – prokázal tento přípravek minimálně stejné zlepšení FEV1, zlepšení zdravotního stavu, snížení frekvence užívání záchranné medikace i zmírnění dušnosti u nemocných se středně těžkou a těžkou CHOPN. Výrazné je snížení výskytu nočních a ranních obtíží při prokázané lepší bronchodilataci po aclidinium bromidu ve srovnání s tiotropiem ve druhé polovině dne. Uvedené charakteristiky vytvářejí profil, který je jedinečný ve srovnání s jinými blokátory muskarinových receptorů, a ukazují na možnost dalšího rozšíření spektra léčby pro nemocné se stabilizovanou CHOPN.
Úvod
Chronická obstrukční plicní nemoc (CHOPN) patří mezi civilizační nemoci, jejichž výskyt je ovlivněn zevními faktory, jako je kouření a stav zevního prostředí [1]. Třebaže je výskyt významně ovlivněn i geneticky, stoupá úměrně ekologickým podmínkám a kuřáckým návykům. CHOPN je léčitelné a preventabilní onemocnění, jehož klinickou heterogenitu poznáváme zatím hlavně fenotypicky, protože genetické a epigenetické faktory tohoto zánětu nejsou dostatečně prozkoumány [2]. U CHOPN dominují plicní projevy, ale mimoplicní postižení je neméně důležité. Plicní komponenta je diagnosticky určující a je sdružena s obligátní přítomností ne zcela reverzibilní bronchiální obstrukce.
V současné době je CHOPN čtvrtou nejčastější příčinou úmrtí a je jednou z hlavních příčin morbidity – světová prevalence se odhaduje na 210 milionů [1]. V evropském regionu trpí CHOPN 4–6 % populace, 250 000 Evropanů na CHOPN ročně umírá, což prezentuje 2,5 % evropské mortality a zároveň z hlediska hodnocení zátěže tímto onemocněním pomocí DALYs (Disability Adjusted Life-Years, ztracená léta v důsledku nemoci) představuje 2,9 milionu (2 % v evropském měřítku) [3]. V České republice se tradičně uvádí, že CHOPN postihuje 8 % dospělé populace [4]. Svou vysokou prevalencí, ale i mortalitou představuje CHOPN významnou zdravotní, sociální a ekonomickou zátěž.
Základem úspěchu v boji proti této nemoci by měla být prevence, nicméně reálně je třeba spoléhat na včasnou efektivní léčbu. Ta je cílena na redukci symptomatologie onemocnění, zpomalení přirozené progrese nemoci, zlepšení kvality života, zvýšení tolerance fyzické zátěže, na prevenci akutních exacerbací a zmírnění jejich dopadů. Při efektivní léčbě by mělo dojít ke snížení počtu návštěv lékaře a hospitalizací, k zabránění vzniku komplikací a trvalých následků onemocnění, v neposlední řadě i k prodloužení života. Podle stadií a kategorií CHOPN se používají krátkodobě nebo dlouhodobě působící bronchodilatancia, protizánětlivými léky jsou inhalační kortikoidy a inhibitory fosfodiesterázy 4.
Anticholinergika
Anticholinergika patří mezi základní léky podávané u všech stadií CHOPN, patofyziologicky ovlivňují poruchu autonomní nervové regulace tonu hladké svaloviny dýchacích cest [2]. Cholinergní nervové zásobení významně zvyšuje tonus těchto svalů, přičemž tato částečně reverzibilní komponenta bronchiální obstrukce je usměrňována antagonisty muskarinových receptorů, kterých je známo pět (M1 až M5), ale v bronších se nacházejí pouze receptory M1, M2 a M3 [5]. Receptory M1 jsou v parasympatických gangliích, kde umožňují neurotransmisi, nesynaptické receptory M2 modulují uvolňování acetylcholinu v tom smyslu, že jejich blokáda vede ke zvýšenému uvolňování acetylcholinu, a tím ke zvýšení bronchokonstrikce na cholinergní podněty. Receptory M3 jsou přítomny v hladké svalovině dýchacích cest, dále v submukózních žlázách i v endotelu plicních cév. Kontrakce hladkých svalů bronchů a jejich obstrukce je způsobena především aktivací těchto receptorů acetylcholinem. Působení anticholinergik na této úrovni je podkladem jejich klinické účinnosti [5].
Do léčby CHOPN byly zavedeny v posledních čtyřiceti letech – v roce 1974 ipratropium bromid, v roce 1990 oxitropium bromid a v roce 2004 tiotropium bromid, nyní se zavádí také glykopyrronium bromid [6, 7].
Farmakologická skupina
Aclidinium bromid (obr. 1) je nový inhalační dlo uhodobě účinkující antagonista muskarinových receptorů (LAMA, long-acting muscarinic antagonist), který je registrován jako udržovací bronchodilatační léčba ke zmírnění příznaků u dospělých pacientů s CHOPN.
uhodobě účinkující antagonista muskarinových receptorů (LAMA, long-acting muscarinic antagonist), který je registrován jako udržovací bronchodilatační léčba ke zmírnění příznaků u dospělých pacientů s CHOPN.
Mechanismus účinku
Mechanismus působení aclidinium bromidu spočívá v kompetitivní blokádě účinku acetylcholinu na receptoru M3, což vede k bronchodilataci a snížení slizniční sekrece [9, 10]. V preklinických studiích vykázal aclidinium bromid vysokou afinitu k muskarinovým receptorům, s vazebnou silou 8krát až 16krát vyšší než ipratropium
bromid a srovnatelnou s tiotropiem [10]. Afinita k podtypům muskarinových receptorů (M1–M5) sice nevykazuje selektivitu, ale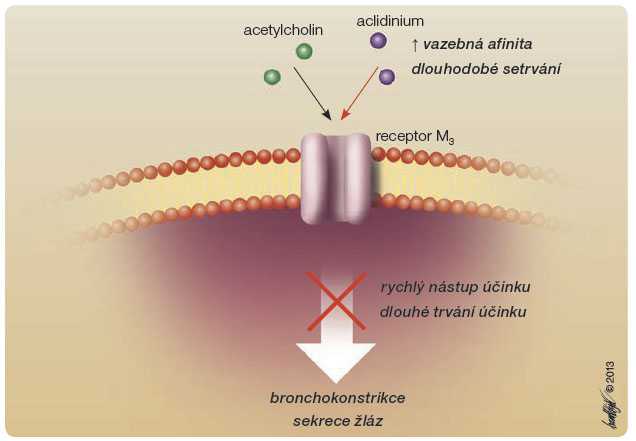 doba rezidence na receptorech M3 je selektivně delší s tím, že disociace z receptorů M3 je přibližně šestkrát delší než disociace z receptorů M2 (poločas 29,2 hodiny vs. 4,7 hodiny), obr. 2.
doba rezidence na receptorech M3 je selektivně delší s tím, že disociace z receptorů M3 je přibližně šestkrát delší než disociace z receptorů M2 (poločas 29,2 hodiny vs. 4,7 hodiny), obr. 2.
Aclidinium bromid je esterová sloučenina, která je v lidské plazmě rychle hydrolyzována (eliminační poločas 2,4 minuty) na dva neaktivní metabolity, což vede k minimální systémové depozici [11, 12]. Proces hydrolýzy je významně rychlejší než u tiotropia a ipratropia. Metabolity obsahující karboxylovou skupinu a alkoholový metabolit se váží na plazmatické bílkoviny, především na albumin [13]. Při podávání dávek 600 μg až 1800 μg byl aclidinium bromid v plazmě zjistitelný jen do jedné hodiny po podání [14, 15].
Výsledky preklinických studií
Charakteristika aclidinium bromidu v preklinických studiích, včetně trvalé blokády receptorů M3, krátkého setrvání na receptorech M2 a rychlé eliminace z plazmy, vytváří profil, který je jedinečný ve srovnání s jinými blokátory muskarinových receptorů. Vysoká vazebná afinita a dlouhá rezidence aclidinium bromidu na receptorech M3 je příčinou rychlého nástupu a dlouhého trvání bronchodilatačního účinku prokázaného na izolované tkáni bronchu [10, 16]. Na zvířecích modelech in vivo byl prokázán nástup účinku za 30 minut, což bylo stejně rychle jako při podání krátkodobě působícího anticholinergika ipratropia, ale rychleji, než byl nástup účinku tiotropia (80 minut) [10]. Podobně doba účinného ovlivnění bronchokonstrikce byla delší než u ipratropia (t1/2 ~ 29 hodin vs. 8 hodin), ale kratší než u tiotropia (t1/2 ~ 64 hodin) [10].
Rychlá hydrolýza aclidinium bromidu v lidské plazmě vedoucí k nízké systémové expozici spolu s kratší dobou účinku na receptory M2 snižuje pravděpodobnost lékových interakcí a výskytu systémových nežádoucích účinků. V dalších zvířecích modelech in vivo aclidinium bromid neprokázal významný vliv na retenci moči, renální funkce nebo motilitu tlustého střeva [11, 17]. V supraterapeutických dávkách vyvolal aclidinium bromid kratší zvýšení srdeční frekvence než tiotropium [10]
Farmakokinetické vlastnosti
U zdravých dobrovolníků byla depozice aclidinium bromidu v plicích vysoká a po inhalaci 200 μg dosáhla 34 % podané dávky [18]. Látka byla rychle vstřebána z plic a doba do dosažení maximální plazmatické koncentrace (cmax) byla přibližně 5 minut [19]. Plazmatická koncentrace aclidinium bromidu rychle klesala a přibližně za jednu hodinu po podání se koncentrace nacházely v blízkosti dolní meze stanovitelnosti [19].
Po intravenózním podání 400 μg aclidinium bromidu byly cmax neaktivních metabolitů pozorovány po pěti minutách od aplikace [20]. Přibližně 1 % aclidinium bromidu bylo vyloučeno v nezměněné formě, jeho metabolity jsou vylučovány v převládající míře močí [20].
Tyto nálezy ve farmakokinetických studiích fáze I u zdravých dobrovolníků [14, 15] byly v souladu s preklinickými daty [12] a potvrzují, že systémová expozice aclidinium bromidu je nízká, což souvisí s malým potenciálem systémových nežádoucích účinků.
Hodnoty cmax (71,1–82,3 pg/ml) bylo u pacientů s CHOPN dosaženo za 10 až 15 minut po inhalaci jednotlivé dávky 400 μg aclidinium bromidu [21]. Žádná akumulace při opakovaném podávání aclidinium bromidu nebyla pozorována u zdravých dobrovolníků ani u pacientů s CHOPN [21, 22]. Při podávání dávky 400 µg dvakrát denně se předpokládá doba dvou dnů k dosažení ustáleného stavu [22].
Farmakokinetické vlastnosti aclidinium bromidu jsou podobné u mladších (40 až 59 roků) i starších (nad 70 roků) pacientů se středně těžkou až těžkou CHOPN [21]. Proto není nutná úprava dávkování u starších nemocných.
Renální funkce nemají vliv na farmakokinetiku aclidinium bromidu. Ve studii dospělých s normálními funkcemi ledvin a rovněž s různým stupněm jejich poškození nebyly zjištěny statisticky významné rozdíly v průměrných plazmatických koncentracích. Tato farmakokinetická studie [23] naznačila, že úprava dávkování ani další sledování nejsou pro pacienty s CHOPN a postižením ledvin nutné. Studie in vitro ukázaly, že aclidinium bromid v terapeutické dávce nezpůsobuje interakce s léky, které jsou substrátem P-glykoproteinu, nebo s léky, které jsou metabolizovány enzymy cytochromu P450 a esterázami [13].
Klinické zkušenosti
Studie fáze II
Ve studiích byla hodnocena účinnost dávek 25, 50, 100, 200 a 400 µg. Jako nejefektivnější dávka, která nejvíce zvyšovala ranní předléčebnou hodnotu (trough) FEV1 v porovnání s placebem u nemocných se středně těžkou a těžkou CHOPN, bylo vyhodnoceno 200 µg aclidinium bromidu [24]. Studie fáze II srovnávaly aclidinium bromid s jinými bronchodilatačními léky. Studie fáze IIa, jíž se účastnilo 30 nemocných [25], měla tzv. crossover design a nemocní užívali 15 dní postupně aclidinium bromid 400 µg, tiotropium 18 µg jako aktivní komparátor a placebo. Mezi jednotlivými fázemi této studie byl 9–15denní vymývací (wash out) interval. Během podávání aclidinium bromidu i tiotropium bromidu došlo 15. den k signifikantnímu zlepšení FEV1 oproti placebu. Srovnání aclidinia s tiotropiem oproti placebu prokázalo, že léčebný rozdíl ve FEV1 pro druhou polovinu dne představoval u aclidinium bromidu 101 ml (první den) a 78 ml (den 15; p < 0,01 a p < 0,05). Při podávání aclidinium bromidu došlo také k výraznější redukci nočních obtíží než při léčbě tiotropiem. Závěr studie vyzněl pozitivně ve smyslu zajištění 24hodinové bronchodilatace s aditivním efektem snížení výskytu symptomů ve druhé polovině dne [25].
Studie fáze IIb měla opět crossover design. Účastnilo se jí 79 nemocných, kterým bylo postupně podáváno sedm dní placebo, aclidinium dvakrát denně v dávce 100 µg, 200 µg a 400 µg nebo dostávali formoterol 12 µg. Optimálně vyhodnocené dávky aclidinium bromidu 200 µg a 400 µg dvakrát denně prokázaly srovnatelné zlepšení FEV1 [26].
Studie fáze III
Následovaly studie fáze III zaměřené na zhodnocení účinnosti a bezpečnosti aclidinium bromidu v dávce 200 µg podané dvakrát denně nemocným s CHOPN. Zařazováni byli nemocní starší 40 let, kuřáci (kouření více než deset „balíčkoroků“) nebo bývalí kuřáci s FEV1/FVC (forced vital capacity) nižší než 70 % a postbronchodilatační FEV1 v rozmezí 30–80 % normálních hodnot. Vyřazovací kritéria představovala diagnóza astmatu a exacerbace CHOPN léčená ambulantně před méně než šesti týdny nebo s hospitalizací před méně než třemi měsíci. Nebyli zařazováni nemocní s jinými známými kontraindikacemi podání anticholinergik, s abnormalitami na EKG nebo s akutním infarktem myokardu před méně než šesti měsíci. Jako konkomitantní terapie bylo povoleno užití krátkodobě působících β2-agonistů (SABA, short acting beta2-agonists) dle potřeby, inhalační i perorální kortikosteroidy (do dávky 10 µg prednisonu denně) nebo methylxantiny, ale nebyla povolena léčba dlouhodobě působícími β2-agonisty a jinými anticholinergiky. Všechny dávky aclidinium bromidu byly podány dvakrát denně pomocí inhalačního systému pro práškové formy léku Genuair®.
Studie fáze III ověřovaly účinnost aclidinium bromidu u nemocných se stabilní středně těžkou až těžkou CHOPN proti placebu v různých populacích [27]. Studie ACCORD I trvala 12 týdnů a zahrnula 561 nemocných z USA a Kanady [28]. Randomizace v poměru 1 : 1 : 1 se týkala aclidinium bromidu v dávkách 200 µg a 400 µg a placeba. Druhá studie – ATTAIN – trvala 24 týdnů, měla stejný design a bylo do ní zapojeno 828 nemocných z Evropy a Jižní Afriky [29]. Hodnocení bylo komplexní, ve srovnání se studiemi fáze II bylo sledováno více parametrů. Kromě plicních funkcí to byl celkový zdravotní stav, stupeň dušnosti, užití záchranné medikace, počty exacerbací, výskyt nočních a časných ranních symptomů. Studie fáze IIIb pak hodnotila účinky aclidinium bromidu 400 µg oproti tiotropiu 18 μg, které byly podávány dvakrát denně, a účinky placeba; tato klinická sledování probíhala v Německu, České republice, Maďarsku a Polsku. Celkem 414 pacientů bylo randomizováno v poměru 2 : 2 : 1 [30].
Výsledky studií ACCORD I a ATTAIN
Obě studie fáze III prokázaly signifikantní zlepšení FEV1 oproti placebu: ve studii ACCORD I ve 12. týdnu sledování při dávkování 400 µg o 124 ml (p = 0,0001), ve studii ATTAIN ve 24. týdnu o 128 ml (p = 0,0001) při stejném dávkování [28, 29]. Signifikantního zlepšení FEF1 (forced expiratory flow in 1 second) bylo dosaženo při léčbě oběma dávkami aclidinium bromidu (200 µg i 400 µg) oproti placebu již v prvním týdnu; toto zlepšení trvalo po celou dobu obou studií (p = 0,0001). Dále byl sledován vrcholový FEV1 (peak FEV1) měřený tři hodiny po ranním podání aclidinium bromidu. Signifikantní zlepšení proti placebu ve studii ACCORD I nastalo ve 12. týdnu: při podávání dávky 200 µg to bylo o 146 ml a při podávání dávky 400 µg o 192 ml (p = 0,0001). Ve studii ATTAIN zlepšila dávka 200 µg ve 12. týdnu peak FEV1 o 182 ml, dávka 400 µg o 191 ml. Ve 24. týdnu činilo zlepšení 185 ml (při podávání dávky 200 µg) a 209 ml (při dávce 400 µg; p = 0,0001) [28, 29]. Zlepšení vrcholové FEV1 oproti placebu bylo pozorováno již první den po podání první dávky léku a přetrvávalo po celou dobu trvání obou studií. Jak je patrné, bronchodilatace navozená aclidinium bromidem v dávce 400 µg byla významnější než při dávce 200 µg.
V obou studiích byla hodnocena dušnost pomocí změny mezi počátečním stupněm dušnosti (BDI, baseline dyspnoe index) a stupněm dušnosti na konci sledovaného období (TDI, transitional dyspnoe index) [31]. V obou studiích dosáhly obě dávky aclidinia signifikantně většího zmírnění dušnosti hodnocené dle TDI ve srovnání s placebem (p < 0,05) [28, 29]. Klinicky významného zlepšení TDI o jednu jednotku a více bylo dosaženo při podání aclidinium bromidu v dávce 400 µg ve 12. týdnu studie ACCORD I (p < 0,005) a ve 24. týdnu studie ATTAIN (p < 0,001).
Nemocní užívající aclidinium bromid mohli snížit frekvenci inhalační úlevové léčby (SABA) ve srovnání s nemocnými, kteří dostávali placebo. Toto snížení bylo závislé na dávce. Během 12 týdnů trvání studie ACCORD I došlo u pacientů užívajících aclidinium bromid v dávce 200 µg ke snížení užívání SABA o 0,7 inhalace za den (p < 0,002), pacienti léčení dávkou aclidinia 400 µg snížili užívání SABA o 0,9 inhalace za den (p < 0,0001). Ve 24týdenní studii ATTAIN došlo při podávání dávky 200 µg k redukci o 0,6 inhalace za den (p < 0,001), dávkou 400 µg bylo dosaženo snížení o 1,0 inhalace za den (p < 0,0001) [28, 29]. Obě dávky aclidinium bromidu ve studii ATTAIN navíc nemocným přinesly významně více dní bez užití záchranné medikace (o 11 %) ve srovnání s nemocnými, kteří dostávali placebo.
V obou studiích byly hodnoceny počty exacerbací. Jako středně těžká exacerbace bylo hodnoceno zhoršení symptomů, které trvalo dva po sobě následující dny a vyžadovalo ambulantní léčbu antibiotiky a/nebo systémovými kortikosteroidy. Za těžkou exacerbaci byl považován stav vyžadující hospitalizaci [28, 29]. Průměrné počty exacerbací na pacienta a rok byly při podávání aclidinium bromidu v obou studiích statisticky nevýznamně nižší (ACCORD I: 200 µg, 0,42; 400 µg, 0,42; ATTAIN: 200 µg, 0,35; 400 µg, 0,34) než u kontrolní větve (ACCORD I: 0,63; ATTAIN: 0,47). Důvodem je velmi pravděpodobně krátká doba sledování v obou studiích [40].
Kvalita života byla posuzována v obou studiích dle dotazníku SGRQ (St. George‘s Respiratory Questionnaire). Zlepšení oproti placebu bylo statisticky významné v obou studiích při dávkování 200 µg i 400 µg (p < 0,05). Klinicky významného zlepšení stavu (aspoň o 4 jednotky) dosáhla ale jen dávka 400 µg ve 24. týdnu ve studii ATTAIN [29].
Výskyt nočních i časných ranních symptomů byl hodnocen pomocí speciálních dotazníků. Ve studii ACCORD I nemocní vyplňovali denně dotazník zaměřený na noční obtíže (Nighttime Symptoms Questionnaire) – dušnost, kašel, pískoty, a na produkci sputa [28]. Ve 12. týdnu měli nemocní léčení aclidinium bromidem významně nižší frekvenci nočních obtíží i menší omezení ranních aktivit (p < 0,05). Ve studii ATTAIN byly stejné potíže zaznamenávány do elektronických karet a posuzovalo se také svírání na hrudi a ranní obtíže. Během 24 týdnů sledování trpělo nočními symptomy významně nižší procento nemocných léčených aclidinium bromidem v dávce 400 µg oproti kontrolní větvi (p < 0,001). Dávky 200 µg i 400 µg významně snížily výskyt ranních symptomů oproti placebu (p < 0,01).
Studie fáze IIIb
Beierová a kol. provedli studii fáze IIIb, která je přímým srovnáním aclidinium bromidu podávaného dvakrát denně s tiotropiem v dávce 18 μg jednou denně po dobu 6 týdnů [30]. Pro studii byla zvolena dávka 400 µg aclidinium bromidu, protože vykazovala větší účinnost v uvedených studiích fáze III. Stejně jako v předchozích šlo i zde o pacienty s diagnózou stabilní středně závažné až závažné CHOPN. Na rozdíl od předchozího klinického hodnocení však pacienti používali inhalátor Genuair® s aclidinium bromidem a s placebem a inhalátor HandiHaler® s tiotropiem a s placebem. Byla měřena 24hodinová noční i denní bronchodilatace.
Primárním cílovým ukazatelem byla změna normalizované plochy pod křivkou hodnot FEV1 v průběhu 24hodinového období po ranní dávce (AUC 0–24) v týdnu 6 (tiotropium bylo podáváno každý den ráno, aclidinium bromid dvakrát denně ráno a večer) oproti výchozímu stavu. Změna normalizované AUC FEV1 v průběhu noci (AUC 12–24) v týdnu 6 oproti výchozímu stavu byla sekundárním cílovým ukazatelem. Pacienti vyplňovali každý večer před spaním dotazník EXACT (EXAcerbations of Chronic pulmonary disease Tool) obsahující 14 položek. Odpovědi popisující změny určitých respiračních příznaků byly použity k výpočtu celkového skóre respiračních příznaků EXACT (E-RS) [32]. Dotazník dalších příznaků CHOPN vyplňovali pacienti každé ráno, dotazy byly cíleny k popisu závažnosti časných ranních a nočních příznaků a k frekvenci nočního probouzení se v důsledku příznaků CHOPN. Hodnocení probíhalo pomocí elektronických deníků.
V porovnání s placebem byly změny normalizované plochy pod křivkou hodnot FEV1 (AUC 0–24 FEV1 a AUC 12–24 FEV1) v 6. týdnu u aclidinium bromidu numericky zvýšeny více než u tiotropia (rozdíl o 150 ml, resp. 160 ml; vs. rozdíl o 140 ml, resp. 123 ml) a byly signifikantně větší než u placeba (p < 0,0001). Výsledky byly hodnoceny v průběhu 24hodinového období po ranní dávce. Aclidinium bromid v porovnání s placebem přinesl statisticky významná zlepšení časně ranních a nočních příznaků, která byla trvale numericky větší než zlepšení pozorovaná při podávání tiotropia. Snížení závažnosti nočních příznaků v porovnání s placebem bylo významně odlišné pouze při podávání aclidinium bromidu (p < 0,05), což by mohlo naznačovat, že numerická převaha aclidinia nad tiotropiem, co se týče větší noční bronchodilatace, může přinést statisticky významné změny ve výsledcích hlášených pacienty.
Zařazení do současné palety léčiv
Aclidinium bromid je bezpečný a dobře snášený LAMA s relativně rychlým nástupem účinku. U nemocných se středně těžkou a těžkou CHOPN prokázal aclidinium bromid v porovnání s tiotropiem minimálně stejné zlepšení FEV1, zlepšení zdravotního stavu, redukci užívání záchranné medikace i zmírnění dušnosti. Charakteristický účinek – snížení výskytu nočních a časných ranních obtíží – vytváří profil, který je ve srovnání s jinými blokátory muskarinových receptorů jedi-
nečný.
Indikace
Aclidinium bromid je indikován jako udržovací bronchodilatační léčba k úlevě od příznaků u dospělých pacientů s CHOPN.
Kontraindikace
Kontraindikací léčby aclidinium bromidem je hypersenzitivita na aclidinium bromid, atropin nebo jeho deriváty včetně ipratropia, oxitropia nebo tiotropia nebo na pomocné látky léčivého přípravku.
Dávkování a způsob podání
Aclidinium bromid je uváděn na trh jako prášek pro inhalaci, s podáváním dvakrát denně. Při použití dechem aktivovaného inhalátoru Genuair® obsahuje každá podaná dávka (dávka opouštějící dávkovač z náustku) 375 μg aclidinium bromidu, což odpovídá 322 μg aclidinium bromidu – aktivní složky. K této depozici je vhodná měřená dávka (dávka rozptýlená v inhalátoru) 400 μg, která je ekvivalentní 343 μg aclidinium bromidu.
Aplikátor obsahuje množství léku na jeden měsíc, je opatřen jištěním proti zdvojení dávky a je schopen zvukem i opticky upozornit nemocného, že dávka byla podána úspěšně (slyšitelný klik, změna barvy v kontrolním okénku ze zelené na červenou) [33].
Při sledováních, jichž se zúčastnili zdraví dobrovolníci, bylo prokázáno, že depozice léku v plicích je vysoká a činí 30 % odměřené dávky. Nemocní s CHOPN jsou schopni vytvořit potřebnou inspirační sílu k vdechnutí celé dávky léku [34]. V porovnávací studii byl tento inhalátor hodnocen 48 nemocnými s CHOPN jako nejsnadněji zvládnutelný a byl více preferován než ostatní porovnávané inhalátory, kterými byly Diskus®, HandiHaler® a Respimat® [33]. I ve studii fáze III dával významně větší počet pacientů v týdnu 6 přednost inhalátoru Genuair® před inhalátorem HandiHaler® (80,1 % vs. 10,7 %; p = 0,0001). Není překvapivé konstatovat, že snadnost použití tohoto inhalátoru je důležitým faktorem pro úspěšnou léčbu.
Nežádoucí účinky
Bezpečnost podávání aclidinium bromidu byla ověřována u zdravých dobrovolníků i u nemocných s CHOPN. Zdravým dobrovolníkům byly podávány dvakrát denně dávky v rozmezí 200–800 µg [22],
nemocní se středně těžkou a těžkou CHOPN dostávali 100–400 µg [25]. Ve studiích fáze III byla nejčastějším nežádoucím účinkem exacerbace CHOPN [28, 29, 35]. Její výskyt byl ale méně častý než v kontrolní skupině s placebem. Při podávání aclidinium bromidu v dávkách 200 a 400 µg došlo k exacerbacím u 7,4 % a 9,2 % nemocných ve studii ACCORD I, ve studii ATTAIN nastaly exacerbace onemocnění u 14,1 % a 15,9 % pacientů. V kontrolní skupině s placebem se exacerbace vyskytly u 12,4 % nemocných ve studii ACCORD I a u 20,5 % nemocných ve studii ATTAIN. Ostatní nežádoucí účinky léčby aclidiniem byly nezávažné a jejich výskyt nepřesáhl 3 % nemocných. Jednalo se nejčastěji o bolesti hlavy (6,6 %), nazofaryngitidu (5,5 %), bolesti v zádech, průjem a rýmu. Počty těžkých nežádoucích příhod byly nízké: 2,2 % až 4,3 % ve studii ACCORD I a 4,3 % až 5,6 % ve studii ATTAIN, nejčastěji se v obou studiích jednalo opět o exacerbace CHOPN [28, 29]. Exacerbace CHOPN byly také nejčastějšími nežádoucími příhodami vedoucími k ukončení studie. Nejvíce nemocných, kteří takto ukončili studii, užívalo placebo [36].
Typické nežádoucí účinky
Ve výše uvedených studiích se počty typických nežádoucích účinků léčby anticholinergiky vyskytly u 2,5 % nemocných užívajících aclidinium bromid [36]. Nejčastějším takovým příznakem je suchost v ústech. Ve studii ACCORD I se objevila při léčbě aclidinium bromidem v dávce 200 µg u 1,6 % nemocných a při dávce 400 µg u 0,5 % nemocných, v kontrolní skupině s placebem trpělo suchostí v ústech 1,1 % nemocných. Ve studii ATTAIN mělo příznak při léčbě aclidinium bromidem v dávce 200 µg 0,7 % pacientů a při dávce 400 µg 0,4 % nemocných, ve skupině placeba 0,4 % nemocných.
Kardiovaskulární toxicita byla ověřována v randomizované dvojitě slepé paralelní studii s 272 zdravými dobrovolníky s cílem zhodnotit průměrné změny výchozích hodnot individuální tepové frekvence a prodloužení intervalu QT. Dobrovolníci byli randomizováni do ramen s inhalací aclidinium bromidu (200 μg nebo 800 μg), placeba nebo s pozitivní kontrolou (moxifloxacin 400 mg po dobu tří dnů). Výsledky při použití několika metod ukázaly, že aclidinium bromid neovlivňuje QT interval [22]. Studie fáze II doložily, že bezpečnost a snášenlivost dávek 200 μg nebo 400 μg podávaných dvakrát denně byly přijatelné. Ve studiích fáze III se jakákoliv kardiální nežádoucí příhoda vyskytla u malého počtu nemocných (< 1,5 %) [33].
Lékové interakce
Nebyl zjištěn žádný klinický průkaz závažných lékových interakcí aclidinium bromidu a jiných léků současně aplikovaných u pacientů s CHOPN, včetně β2--agonistů, methylxantinů a inhalačních steroidů. Současné podávání aclidinium bromidu s ostatními anticholinergními léčivy nebylo studováno, a proto se nedoporučuje. Nebylo zjištěno žádné úmrtí, které by souviselo s léčbou, ani žádné závažné laboratorní odchylky, změny krevního tlaku nebo změny na EKG [29].
Závěr
Konzistentní výsledky klinických studií fáze II a III, stejně jako farmakokinetické vlastnosti, preklinická data a bezpečnostní profil aclidinium bromidu lze shrnout do následujících závěrů. Aclidinium bromid podávaný dvakrát denně v dávce 400 µg významně zlepšuje plicní funkce, zlepšuje kvalitu života, redukuje užití záchranné medikace a snižuje výskyt symptomů. Bronchodilatace nastává již po prvním podání dávky a přetrvává po celou dobu podávání léku. Účinky aclidinium bromidu na zlepšení tolerance fyzické zátěže i na dynamickou hyperinflaci jsou srovnatelné s jinými dlouhodobými bronchodilatačními léky, jako je tiotropium nebo indakaterol. Výsledky metaanalýzy deseti randomizovaných studií s aclidinium bromidem vyhodnotily léčbu celkem 3922 nemocných [37]. Metaanalýza prokázala, že aclidinium bromid je bezpečný a dobře snášený LAMA s relativně rychlým nástupem účinku. U nemocných se středně těžkou a těžkou CHOPN se v porovnání s tiotropiem prokázalo minimálně stejné zlepšení FEV1, zlepšení zdravotního stavu, redukce užívání záchranné medikace i zmírnění dušnosti. Charakteristickým účinkem je snížení výskytu nočních a časných ranních obtíží při podávání léku dvakrát denně [38]. Uvedené charakteristiky vytvářejí profil, který je jedinečný ve srovnání s jinými blokátory muskarinových receptorů, a ukazují na možnost dalšího rozšíření spektra léčby pro nemocné se stabilizovanou CHOPN [39]. Pro přesnější závěry bude potřeba provést delší srovnávací studie.
Seznam použité literatury
- [1] Global Initiative for Obstructive Lung Disease. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease. Updated 2013, 79 s.
- [2] Koblížek V, Chlumský J, Zindr V, et al. Doporučený postup ČPFS pro diagnostiku a léčbu stabilní CHOPN. In: Kolek a kolektiv. Doporučené postupy v pneumologii. 2013, 460 s.
- [3] European Respiratory Society: The European lung white book. Ed. GJ Gibson, R Loddenkemper, Y Sibille, B Lundbäck. 2013, 471 s.
- [4] Kašák V. CHOPN. In: Kolek V., Kašák V., Vašáková M.: Pneumologie. Praha Maxdorf, 2012, 122 s.
- [5] Barnes PJ. Chronic obstructive pulmonary disease. N Engl J Med 2000; 343: 269–280.
- [6] Gandevia B. Historical review of the use of parasympatholytic agents in the treatment of respiratory disorders. Postgrad Med J 1975; 51: 213–228.
- [7] Rennard SI, Serby CW, Ghafouri M, et al. Extended therapy with ipratropium is associated with improved lung function in patients with COPD. A retrospective analysis of data from even clinical trials. Chest 1996; 110: 62–70.
- [8] Buhl R, Banerji D. Profile of glycopyrronium for once-daily treatment of moderate-to-severe COPD. Int J Chron Obstruct Pulmon Dis 2012; 7: 729–741.
- [9] Belmonte KE. Cholinergic pathways in the lungs and anticholinergic therapy for chronic obstructive pulmonary disease. Proc Am Thorac Soc 2005; 2: 297–304.
- [10] Gavalda A, Miralpeix M, Ramos I, et al. Characterrization of aclidinium bromide, a novel inhaled muscarinic antagonist, with long duration of action and a favorable pharmacological profile. J Pharmacol Exp Ther 2009; 331: 740–751.
- [11] Gavalda A, Gras J, Llupià J, et al. Aclidinium bromide, a novel long-acting muscarinic antagonist for COPD with improved preclinical renal and urinary safety profile. Life Sci 2012; 90: 301–305.
- [12] Sentellas S, Ramos I, Alberti J, et al. Aclidinium bromide, a new, long-acting, inhaled muscarinic antagonist: in vitro plasma inactivation and pharmacological activity of its main metabolites. Eur J Pharm Sci 2010; 39: 283–290.
- [13] Alberti J, Martinet A, Sentellas S, Salva M. Identification of the human enzymes responsible for the enzymatic hydrolysis of aclidinium bromide. Drug Metab Dispos 2010; 38: 1202–1210.
- [14] Jansat J, Lamarca R, de Miquel G, et al. Safety and pharmacokinetics of multiple doses of aclidinium bromide, a novel long-acting muscarinic antagonist for the treatment of chronic obstructive pulmonary disease, in healthy participants. J Clin Pharmacol 2009; 49: 1239–1246.
- [15] Jansat JM, Lamarca R, Garcia Gil E, Ferrer P. Safety and pharmacokinetics of single doses of aclidinium bromide, a novel long-acting, inhaled antimuscarinic, in healthy subjects. Int J Clin Pharmacol Ther 2009a; 47: 460–468.
- [16] Cortijo J, Sarria B, Gavalda, et al. In vitro characterization of aclidinium bromide, a novel long-acting anticholinergic: effects on isolated human bronchi. Am J Respir Crit Care Med 2008; 177: A654.
- [17] Montero JL, Anton F, Vinals M, et al. Effect of aclidinium bromide, a novel longacting anticholinergic, on salivation, colonic motility and faecal output in different animal models. Eur Respir J 2008; 32 (Suppl. 52): 3637.
- [18] Newman SP, Sutton DJ, Segarra R, et al. Lung deposition of aclidinium bromide, a multidose dry powder inhaler. Respiration 2009; 78: 322–328.
- [19] Ortiz S, Flach S, Caracta C, et al. Safety and tolerability of aclidinium administered intravenously and absolute bioavailability of inhaled aclidinium in healthy male participants. J Clin Pharmacol 2012; 52: 819–827.
- [20] Ortiz S, Flach S, Ho J, et al. Mass balance and metabolism of aclidinium bromide following intravenous administration of [(14) C]-aclidinium bromide in healthy subjects. Biopharm Drug Dispos 2012; 33: 39–45.
- [21] De la Motte S, BeierJ, Schmid K, et al. Pharmacokinetics and safety of aclidinium bromide in younger and elderly patients with chronic obstructive pulmonary disease. Int J Clin Pharmacol Ther 2012; 50: 403–412.
- [22] Lasseter K, Dilzer S, Jansat J, et al. Safety and pharmacokinetics of multiple doses of aclidinium bromide administered twice daily in healthy volunteers. Pulm Pharmacol Ther 2012; 25: 193–199.
- [23] Schmid K, Pascual S, Gil E, et al. Pharmacokinetics and safety of aclidinium bromide, a muscarinic antagonist, in adults with normal or impaired renal function: A phase I, open-label, single-dose clinical trial. Clin Ther 2010; 32: 179–192.
- [24] Chanez P, Burge P, Dahl R, et al. Aclidinium bromide provides long-acting bronchodilation in patients with COPD. Pulm Pharmacol Ther 2010; 23: 15–21.
- [25] Fuhr R, Magnussen H, Sarem K, et al. Efficacy of aclidinium bromide 400 microgram twice daily compared with placebo and tiotropium in patients with moderate to severe COPD. Chest 2012; 141: 745–752.
- [26] Singh D, Magnussen H, Kirsten A, et al. A randomised placebo-and active-controlled dose-finding study of aclidinium bromide administered twice a day in COPD patients. Pulm Pharmacol Ther 2012; 25: 248–253.
- [27] Jones P, Rennard S, Agusti A, et al. Efficacy and safety of once-daily aclidinium in chronic obstructive pulmonary disease. Respir Res 2011; 12: 55.
- [28] Kerwin EM, D’Urzo AD, Gelb AF, et al., ACCORD I study investigators. Efficacy and safety of a 12-week treatment with twice-daily aclidinium bromide in COPD patients (ACCORD COPD I). COPD 2012; 9: 90–101.
- [29] Jones PW, Singh D, Bateman ED, et al. Efficacy and safety of twice-daily aclidinium bromide in COPD patients: The ATTAIN study. Eur Respir J 201; 40: 830–836.
- [30] Beier J, Kirsten AM, Mróz R, et al. Efficacy and Safety of Aclidinium Bromide Compared with Placebo and Tiotropium in Patients with Moderate-to-Severe Chronic Obstructive Pulmonary Disease: Results from a 6-week, Randomized, Controlled Phase Iiib Study. Journal of Chronic obstructive pulmonary Disease 2013; 10: 511–522.
- [31] Mahler D, Weinberg D, Wells C, Feinstein A. The measurement of dyspnea. Contents, interobserver agreement, and physiologic correlates of two clinical indexes. Chest 1984; 85: 751–758.
- [32] Murray L, Houle C, Stolar M, et al. Quantifying the severity of respiratory symptoms of chronic obstructive pulmonary disease (COPD): performance properties of the EXAcerbations of Chronic pulmonary disease Tool-Respiratory Symptoms (E-RS) in 3 randomized controlled trials. Am J Resp Crit Care Med 2012; 185: A1515.
- [33] Chrystyn H, Niederlaender C. The Genuair® inhaler: a novel, multidose dry powder inhaler. Int J Clin Pract 2012; 66: 309–317.
- [34] Magnussen H, Watz H, Zimmermann I, et al. Peak inspiratory flow through the Genuair® inhaler in patients with moderate or severe COPD. Respir Med 2009; 103: 1832–1837.
- [35] Kesten S, Jara M, Wentworth C, Lanes S. Pooled clinical trial analysis of tiotropium safety. Chest 2006; 130: 1695–1703.
- [36] Bateman E, Singh D, Jones P, et al. The ATTAIN study: safety and tolerability of aclidinium bromide in chronic obstructive pulmonary disease (poster). In: Proceedings of the European Respiratory Society Annual Congress 2011 24–28 September; Amsterdam, the Netherlands.
- [37] Suppli UC. Aclidinium Bromide: Clinical Benefit in Patients with Moderate to Severe COPD. Open Respir Med J 2012; 6: 150–154.
- [38] Agusti A, Jones PW, Bateman ED, et al. Improvement in symptoms and rescue medication use with aclidinium bromide in patients with chronic obstructive pulmonary disease: results from ATTAIN. Eur Respir J 2011; 38 (Suppl. 55), 874.
- [39] Frampton JE. Aclidinium in chronic obstructive pulmonary disease. Drugs 2012; 72: 1999–2011.