Aflibercept z pohledu očního lékařství
Aflibercept patří do skupiny inhibitorů vaskulárního endotelového růstového faktoru (vascular endothelial growth factor, VEGF) pro nitrooční použití a je určen k léčbě vlhké formy věkem podmíněné makulární degenerace, makulárního edému v důsledku okluze centrální sítnicové žíly a poruch zraku u diabetického makulárního edému. Tento rekombinantní fúzní protein působí jako falešný receptor, který váže všechny izoformy VEGF-A, dále VEGF-B a placentární růstový faktor (placental growth factor, PlGF). Vazebná afinita afliberceptu pro VEGF-A a PlGF je vyšší než afinita jejich přirozených receptorů. Aflibercept účinně blokuje vazbu a aktivaci receptorů VEGF a proliferaci endotelových buněk a tím inhibuje růst abnormálních nových cév a snižuje nadměrnou cévní permeabilitu. Proniká všemi vrstvami sítnice a neindukuje apoptózu. Pomáhá stabilizovat a v mnoha případech i zlepšit zrakovou ostrost. Aflibercept je dodáván jako roztok pro injekce aplikované do sklivcové dutiny.
Farmakologická skupina
Aflibercept je v oftalmologii používán k léčbě neovaskularizací v oblasti oka, patří do farmakoterapeutické skupiny oftalmologika/látky určené k léčbě neovaskularizace v oblasti oka, ATC kód: S01LA05.
Chemické a fyzikální vlastnosti
Aflibercept je dimerní glykoprotein s molekulární hmotností proteinové části 97 kilodaltonů (kDa), glykosylace zvyšuje celkovou molekulární hmotnost o 15 %, na hodnotu 115 kDa. Roztok pro použití v oftalmologii je čirý, bezbarvý až světle žlutý a je izoosmotický.
Mechanismus účinku, farmakodynamika
Vaskulární endotelový růstový faktor (vascular endothelial growth factor, VEGF) a placentární růstový faktor (placental growth factor, PlGF) jsou zástupci angiogenních faktorů, které mohou mít mitogenní a chemotaktický účinek na endotelové buňky a mohou ovlivňovat permeabilitu cév oka. VEGF-A působí prostřednictvím dvou receptorů – VEGFR-1 a VEGFR-2, které se nacházejí na povrchu endotelových buněk. PlGF se váže pouze na VEGFR-1, který se nalézá také na povrchu leukocytů. Nadměrná aktivace receptorů působením VEGF-A může podnítit patologický růst novotvořených cév a zvýšit cévní permeabilitu. PlGF může působit současně s VEGF-A a podpořit leukocytární infiltraci a zánět [1].
Aflibercept je rekombinantní fúzní protein skládající se z částí extracelulárních domén humánních receptorů 1 a 2 pro VEGF fúzovaných na Fc fr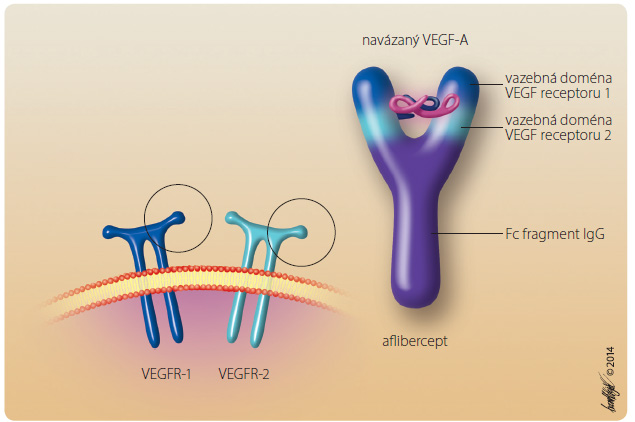 agment humánního IgG1 (obr. 1). Aflibercept (VEGF trap, tzn. „VEGF-past”) působí jako rozpustný falešný receptor, který váže všechny izoformy VEGF-A, dále VEGF-B, PlGF-1 a PlGF-2. Vazebná afinita afliberceptu pro VEGF-A a PlGF je vyšší než afinita jejich přirozených receptorů. Aflibercept tak účinně blokuje vazbu a aktivaci receptorů VEGF a proliferaci endotelových buněk a tím inhibuje růst abnormálních nových cév [2]. Proniká všemi vrstvami sítnice a neindukuje apoptózu [3, 4].
agment humánního IgG1 (obr. 1). Aflibercept (VEGF trap, tzn. „VEGF-past”) působí jako rozpustný falešný receptor, který váže všechny izoformy VEGF-A, dále VEGF-B, PlGF-1 a PlGF-2. Vazebná afinita afliberceptu pro VEGF-A a PlGF je vyšší než afinita jejich přirozených receptorů. Aflibercept tak účinně blokuje vazbu a aktivaci receptorů VEGF a proliferaci endotelových buněk a tím inhibuje růst abnormálních nových cév [2]. Proniká všemi vrstvami sítnice a neindukuje apoptózu [3, 4].
Vlhká forma věkem podmíněné makulární degenerace (VPMD) je charakterizována patologickou chorioideální neovaskularizací (choroidal neovascularization, CNV). Křehké novotvořené cévy snadno krvácejí a dochází k prosakování tekutiny. Výsledkem je ztluštění nebo edém sítnice, někdy s přítomností krvácení, následkem je ztráta zrakové ostrosti. U pacientů léčených afliberceptem se obecně snižuje tloušťka sítnice brzy po zahájení léčby, také se zmenšuje plocha léze [5].
Při okluzi centrální sítnicové žíly (central retinal vein occlusion, CRVO) dochází k ischemii sítnice, která vede k uvolnění VEGF. Následuje destabilizace těsných spojení a podpora růstu endotelových buněk a neovaskularizací. Zvýšení cévní permeability způsobí edém sítnice. U pacientů léčených afliberceptem nastává rychlá odpověď se snížením centrální tloušťky sítnice [6].Diabetický makulární edém (DME) je způsoben zvýšenou cévní permeabilitou a poškozením sítnicových kapilár a může vést ke ztrátě zrakové ostrosti. U pacientů léčených afliberceptem byla brzy po zahájení léčby pozorována rychlá a masivní morfologická odpověď se snížením centrální tloušťky sítnice [7].
Farmakokinetické vlastnosti
Aflibercept používaný v oftalmologii se podává injekcí přímo do sklivcové dutiny pro docílení lokálního účinku v oku. Aflibercept je po podání do sklivcové dutiny pomalu absorbován z oka do krevního oběhu a je pozorován v systémovém oběhu převážně jako neaktivní stabilní komplex s VEGF. Maximální plazmatické koncentrace volného afliberceptu (systémová cmax) byly ve farmakokinetické podstudii nízké, s průměrnou hodnotou 0,02 µg/ml za 1 až 3 dny po injekčním podání dávky 2 mg do sklivcové dutiny, a byly nedetekovatelné dva týdny po aplikaci téměř u všech pacientů. Při podání do sklivcové dutiny každé 4 týdny se aflibercept neakumuluje v plazmě [8].Aflibercept je léčivý přípravek na bázi proteinu, proto nebyly provedeny žádné studie hodnotící metabolismus. Volný aflibercept se váže na VEGF za tvorby stabilního a inertního komplexu. Jako u jiných velkých proteinů se i v tomto případě očekává, že jak volný, tak vázaný aflibercept budou eliminovány proteolytickým katabolismem.
Klinické zkušenosti
Vlhká forma VPMD
Bezpečnost a účinnost afliberceptu u pacientů s vlhkou formou VPMD byly hodnoceny ve dvou paralelních studiích fáze III s aktivní kontrolou (VIEW 1 a VIEW 2). Celkem bylo léčeno a hodnoceno 2412 pacientů. V každé studii byli pacienti náhodně přiřazeni v poměru 1 : 1 : 1 : 1 do skupiny s jedním ze čtyř dávkovacích režimů: 1) aflibercept 2 mg podávaný každých 8 týdnů po třech úvodních měsíčních dávkách (2q8); 2) aflibercept 2 mg podávaný každé 4 týdny (2q4); 3) aflibercept 0,5 mg podávaný každé 4 týdny (0,5q4); 4) ranibizumab 0,5 mg podávaný každé 4 týdny (Rq4). Ve druhém roce studií pokračovali pacienti s upraveným režimem dávkování na základě výsledků vyšetření zrakové ostrosti a anatomických poměrů při maximálním intervalu dávkování 12 týdnů. V obou studiích byl primárním cílovým ukazatelem účinnosti podíl pacientů, u kterých byla udržena zraková ostrost definovaná jako ztráta méně ![Graf 1 Průměrná změna zrakové ostrosti od výchozího stavu do týdne 96. Kombinované údaje ze studií VIEW 1 a VIEW 2 u vlhké formy VPMD; podle [9, 10] – Heier, et al., 2012, Schmidt-Erfurth, et al., 2014. 2q8 – pacienti s terapií afliberceptem 2 mg aplikovaným každých 8 týdnů po třech úvodních měsíčních dávkách; 2q4 – pacienti s terapií afliberceptem 2 mg podávaným každé 4 týdny; Rq4 – pacienti s terapií ranibizumabem 0,5 mg aplikovaným každé 4 týdny; ETDRS – logaritmické vyšetřovací tabule podle Early Treatment Diabetic Retinopathy Study; VPMD – věkem podmíněná makulární degenerace](https://www.remedia.cz/photo-a-29974---.jpg) než 15 písmen při vyšetření na optotypech ETDRS (logaritmické vyšetřovací tabule podle Early Treatment Diabetic Retinopathy Study) v týdnu 52 ve srovnání s výchozím stavem.
než 15 písmen při vyšetření na optotypech ETDRS (logaritmické vyšetřovací tabule podle Early Treatment Diabetic Retinopathy Study) v týdnu 52 ve srovnání s výchozím stavem.
Ve studii VIEW 1 byla zraková ostrost udržena v týdnu 52 u 95,1 % pacientů ve skupině 2q8 ve srovnání s 94,4 % pacientů ve skupině Rq4. Ve studii VIEW 2 byla udržena zraková ostrost v týdnu 52 u 95,6 % pacientů ve skupině 2q8 ve srovnání s 94,4 % pacientů ve skupině Rq4. Léčba afliberceptem prokázala, že není horší než léčba ve skupině Rq4 (je non-inferiorní) a že je této léčbě klinicky rovnocenná. Podíl pacientů, kteří v týdnu 96 získali minimálně 15 písmen optotypů ETDRS oproti výchozímu stavu, byl 33,4 % ve skupině 2q8 a 31,6 % ve skupině Rq4. Ve druhém roce studií tak byla účinnost udržena do posledního hodnocení v 96. týdnu (graf 1). Zmenšení průměrné plochy CNV bylo patrné ve všech skupinách v obou studiích. V kombinované analýze dat ze studií VIEW 1 a VIEW 2 bylo u afliberceptu prokázáno zlepšení oproti výchozímu stavu také v sekundárním cílovém ukazateli účinnosti, a to v dotazníku Národního očního institutu pro oční funkci (National Eye Institute Visual Function Questionnaire, NEI VFQ-25). Mezi afliberceptem a referenčním ranibizumabem nebyly v 52. týdnu léčby nalezeny žádné statisticky významné rozdíly ve změnách v celkovém skóre NEI VFQ-25 a na podškálách oproti výchozímu stavu. Průměrný věk pacientů ve studiích byl 76 let [9, 10].
Makulární edém v důsledku CRVO
Bezpečnost a účinnost afliberceptu u pacientů s makulárním edémem v důsledku CRVO byly hodnoceny ve dvou studiích fáze III kontrolovaných předstíranou („sham“) procedurou (studie COPERNICUS a GALILEO). Léčeno a hodnoceno bylo 358 pacientů. V obou studiích byli pacienti náhodně přiřazeni v poměru 3 : 2 buď do skupiny s léčbou afliberceptem v dávce 2 mg podávané každé 4 týdny (2q4) nebo do kontrolní skupiny, která dostávala předstíranou léčbu každé 4 týdny s celkovým počtem 6 injekcí. Poté všichni pacienti pokračovali v injekčních aplikacích afliberceptu za podmínky, že splnili předem specifikovaná kritéria; pouze pacienti v kontrolní skupině ve studii GALILEO dále dostávali předstírané injekce (kontrola kontroly) do týdne 52. Od tohoto časového bodu byla všem pacientům nabídnuta léčba, pokud splnili předem specifikovaná kritéria. Primárním cílovým ukazatelem účinnosti byl podíl pacientů, kteří získali minimálně 15 písmen optotypů ETDRS v týdnu 24 ve srovnání s výchozím stavem. Dalším hodnoceným parametrem byla perfuze sítnice. Neperfundované oči měly na fluorescenční angiografii nález zón kapilární neperfuze v rozsahu 10 a více ploch terče zrakového nervu [11].
Rozdíl mezi léčenými skupinami byl statisticky významný ve prospěch afliberceptu. V obou studiích bylo maximálního zlepšení zrakové ostrosti dosaženo v měsíci 3 s následnou stabilizací zrakové ostrosti a centrální tloušťky sítnice. Statisticky významný rozdíl mezi skupinami byl udržen nejméně do týdne 52.
Podíl pacientů s perfuzí sítnice, kteří zahájili studii COPERNICUS ve skupině léčené afliberceptem, byl 67,5 % a v rameni s předstíranou léčbou 68,5 %. V týdnu 24 měli pacienti s perfuzí sítnice léčení afliberceptem zisk minimálně 15 písmen optotypů ETDRS v 58,4 %, pacienti v rameni s předstíranou léčbou v 16,0 %. V týdnu 52 dosahovaly podíly 58,4 % a 30,0 %. Podíl pacientů s neperfuzí sítnice, kteří v týdnu 24 získali 15 a více písmen optotypů ETDRS, představoval ve skupině léčené afliberceptem 51,4 %, zatímco v tzv. sham rameni 4,3 %, v týdnu 52 byl podíl pacientů 48,6 % oproti 30,4 % [12]. V týdnu 100 mělo zisk 15 a více písmen 49,1 % pacientů ze skupiny léčené afliberceptem a 23,3 % pacientů z ramene s předstíranou léčbou. V týdnu 100 získali pacienti léčení od počátku afliberceptem 13,0 písmen oproti zisku 1,5 písmene u pacientů v rameni s placebem [13].
Většina pacientů měla při vstupu do studie GALILEO perfundovanou sítnici (86,4 % léčených afliberceptem a 79,4 % v tzv. sham rameni). V týdnu 52 měli pacienti léčení afliberceptem signifikantně vyšší zisk, a to 16,9 písmene optotypů ETDRS v porovnání se ziskem 3,8 písmene u pacientů v rameni s předst![Graf 2 Průměrná změna zrakové ostrosti od výchozího stavu do týdne 52. Studie GALILEO u makulárního edému v důsledku CRVO; podle [14] – Korobelnik, et al., 2014. *p < 0,0001 vs. sham **Pacienti ve skupině s léčbou afliberceptem v dávce 2 mg podávané každé 4 týdny (2q4) do týdne 24 dále dostávali aflibercept 2 mg podle potřeby. CRVO – okluze centrální sítnicové žíly; ETDRS – logaritmické vyšetřovací tabule podle Early Treatment Diabetic Retinopathy Study](https://www.remedia.cz/photo-a-29975---.jpg) íranou léčbou (graf 2), stejně tak u nich bylo zjištěno významnější snížení centrální tloušťky sítnice o 423,5 µm oproti snížení o 219,3 µm. V 52. týdnu studie mělo 60,2 % pacientů ze skupiny s afliberceptem a 32,4 % pacientů ze skupiny s předstíranou léčbou zisk minimálně 15 písmen optotypů ETDRS [14].
íranou léčbou (graf 2), stejně tak u nich bylo zjištěno významnější snížení centrální tloušťky sítnice o 423,5 µm oproti snížení o 219,3 µm. V 52. týdnu studie mělo 60,2 % pacientů ze skupiny s afliberceptem a 32,4 % pacientů ze skupiny s předstíranou léčbou zisk minimálně 15 písmen optotypů ETDRS [14].
Příznivý účinek léčby afliberceptem na zrakové funkce byl u podskupin pacientů s perfuzí a bez perfuze sítnice obdobný, stav perfuze neměl vliv na rychlost odezvy na léčbu. V kombinované analýze dat ze studií GALILEO a COPERNICUS bylo prokázáno zlepšení kvality života hodnocené pomocí dotazníku NEI VFQ-25. Průměrný věk pacientů byl 64 let.Léčebné účinky ve všech hodnotitelných podskupinách (např. věk, pohlaví, rasa, výchozí zraková ostrost, typ léze, velikost léze, stav perfuze sítnice) v každé studii odpovídaly obecně výsledkům u celkové populace [12–14].
Diabetický makulární edém
Vyšší účinnost afliberceptu v porovnání s laserovou fotokoagulací v léčbě diabetického makulárního edému prokázaly paralelní studie fáze III VIVIDDME a VISTADME s 872 pacienty. Pacienti léčení 2 mg afliberceptu (2q4) každý měsíc ve studii VIVIDDME provedené v Evropě, Japonsku a Austrálii získali v 52. týdnu 10,5 písmene optotypů ETDRS. Pacienti, kteří obdrželi léčbu každých 8 týdnů (2q8) po počátečních pěti injekcích v měsíčním intervalu, získali 10,7 písmene oproti pacientům, kteří byli léčeni laserovou fotokoagulací se ziskem 1,2 písmene optotypů ETDRS (graf 3). Ve studii VISTADME provedené v USA získali pacienti při měsíčním dávkování afliberceptu v 52. týdnu 12,5 písmene, při dávkování 5 úvodních injekcí následovaných aplikacemi každých 8 týdnů byl zisk 10,7 písmene a v rameni s laserovou fotokoagulací získali pacienti 0,2 písmene. V obou studiích mohli být pacienti s předem stanovenou ztrátou zrakové ostrosti zařazeni od 24. týdne do skupiny s do![Graf 3 Průměrná změna zrakové ostrosti od výchozího stavu do týdne 52. Studie VIVIDDME u DME; podle [7] – Korobelnik, et al., 2014. 2q8 – pacienti s terapií afliberceptem 2 mg aplikovaným každých 8 týdnů po pěti úvodních měsíčních dávkách; 2q4 – pacienti s terapií afliberceptem 2 mg podávaným každé 4 týdny; kontrola – pacienti v rameni s laserovou fotokoagulací; DME – diabetický makulární edém; ETDRS – logaritmické vyšetřovací tabule podle Early Treatment Diabetic Retinopathy Study](https://www.remedia.cz/photo-a-29976---.jpg) datečnou léčbou afliberceptem nebo laserovou fotokoagulací. Většina pacientů měla diabetes mellitus 2. typu [7].
datečnou léčbou afliberceptem nebo laserovou fotokoagulací. Většina pacientů měla diabetes mellitus 2. typu [7].
Zařazení do současné palety léčiv
Mezi léky používané k léčbě neovaskularizací v oblasti oka a registrované v České republice k podání do sklivce patří v současné době sodná sůl pegaptanibu, ranibizumab a aflibercept.
Sodná sůl pegaptanibu
Sodná sůl pegaptanibu byla do klinického užívání uvedena v roce 2004. Jde o modifikovaný oligonukleotid, který se s vysokou afinitou specificky váže pouze na izoformu VEGF-A 165 a blokuje její vazbu na receptor. Použití pegaptanibu v léčbě vlhké formy VPMD bylo hodnoceno ve studii V.I.S.I.O.N. V 54. týdnu sledování si uchovalo zrakovou ostrost 70 % pacientů. Po dvou letech mělo prospěch z léčby 54 % pacientů léčených pegaptanibem oproti kontrolní skupině bez léčby, kde si zrakovou ostrost uchovalo 45 % pacientů [15].
Ranibizumab
Ranibizumab je fragment humanizované monoklonální protilátky, který se váže se silnou afinitou na všechny lidské izoformy VEGF-A a brání vazbě VEGF-A na receptory VEGFR-1 a VEGFR-2. Klinicky je používán od roku 2006. V porovnání se sodnou solí pegaptanibu je skupina pacientů, u kterých došlo ke zlepšení zrakové ostrosti a k vymizení aktivity onemocnění, významně větší. Studie MARINA a ANCHOR hodnotily změnu zrakové ostrosti při fixním dávkovacím režimu jedenkrát měsíčně po celé sledované období léčby vlhké formy VPMD. Zlepšení nebo ztráta méně než 15 písmen optotypů ETDRS byly zaznamenány u 90 % pacientů po dvou letech léčby [16, 17]. Režim tří úvodních aplikací ranibizumabu s následnými čtvrtletními podáními účinné látky byl testován ve studiích PIER a EXCITE. Zrakovou ostrost si po dobu 12 měsíců uchovalo 90 % pacientů, ale počáteční zlepšení zrakové ostrosti nebylo při čtvrtletním podávání stabilní [18, 19]. Individuální dávkovací režim v léčbě vlhké formy VPMD hodnotily studie SAILOR, SUSTAIN a PrONTO. Po úvodních třech aplikacích ranibizumabu bylo podání opakováno pouze při definovaných známkách aktivity léze. V prvním roce byla udržena zraková ostrost u 95 % pacientů. Tento funkční výsledek podporuje používání individuálního dávkovacího režimu ranibizumabu v klinické praxi [20–22]. Ranibizumab v léčbě makulárního edému v důsledku uzávěru větve a kmene centrální sítnicové žíly byl sledován ve studiích BRAVO a CRUISE. Po 12 měsících léčby získali pacienti 18,3 písmene (studie BRAVO) a 13,9 písmene (studie CRUISE) optotypů ETDRS [23–25]. Účinnost ranibizumabu v léčbě poškození zraku u DME byla hodnocena ve studiích RESOLVE, RESTORE a RETAIN. Po roce léčby byl zjištěn zisk 10,3 písmene (RESOLVE) a 6,8 písmene (RESTORE) při monoterapii [26, 27]. Ve studii RETAIN získali pacienti po 24 měsících v režimu léčby „treat-and-extend“ 6,5 písmene a v režimu „pro re nata“ 8,1 písmene optotypů ETDRS [28].
Aflibercept
Aflibercept je lékem srovnatelně účinným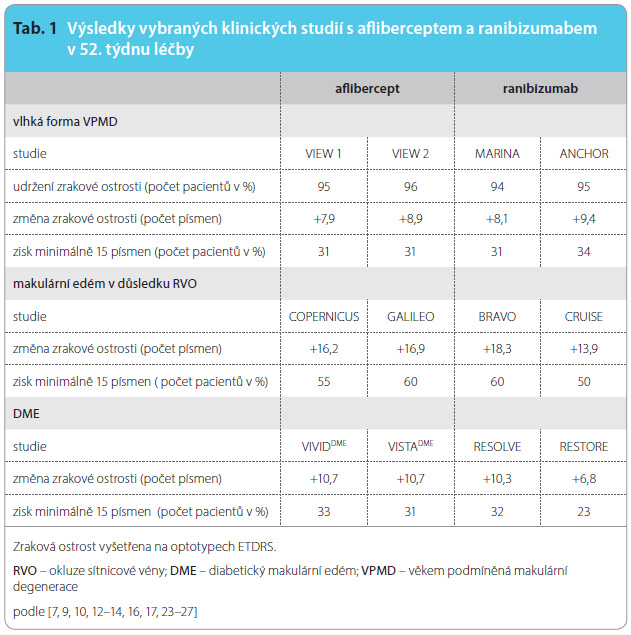 s ranibizumabem (tab. 1). Do klinické praxe se dostal v roce 2011. Aflibercept je možno použít jako iniciální léčbu nebo při selhání předchozí léčby ranibizumabem nebo sodnou solí pegaptanibu. Ceny jednotlivých dávek afliberceptu a ranibizumabu jsou srovnatelné, náklady na léčbu závisejí na dávkovacím režimu.
s ranibizumabem (tab. 1). Do klinické praxe se dostal v roce 2011. Aflibercept je možno použít jako iniciální léčbu nebo při selhání předchozí léčby ranibizumabem nebo sodnou solí pegaptanibu. Ceny jednotlivých dávek afliberceptu a ranibizumabu jsou srovnatelné, náklady na léčbu závisejí na dávkovacím režimu.
Indikace
Aflibercept je v očním lékařství indikován u dospělých pacientů k léčbě neovaskulární (vlhké) formy věkem podmíněné makulární degenerace, u poruch zraku způsobených makulárním edémem v důsledku okluze centrální sítnicové žíly a poruch zraku v důsledku diabetického makulárního
edému.
Kontraindikace
Kontraindikací k použití afliberceptu je aktivní oční nebo periokulární infekce nebo podezření na ni, aktivní závažný nitrooční zánět a hypersenzitivita na léčivou látku nebo na kteroukoli z pomocných látek přípravku.
Nežádoucí účinkyBezpečnostní profil afliberceptu byl stanoven na souboru pacientů v šesti studiích fáze III. Závažné nežádoucí účinky související s injekční aplikací se vyskytly u méně než jedné z 2600 injekcí a zahrnovaly kataraktu, odchlípení sítnice, odloučení zadní sklivcové membrány, endoftalmitidu a zvýšení nitroočního tlaku.
Mezi nejčastější nežádoucí účinky patřily spojivkové krvácení (25,3 %), snížení zrakové ostrosti (11,2 %), bolest oka (10,2 %), zvýšení nitroočního tlaku (7,3 %), odloučení zadní sklivcové membrány (7,0 %), sklivcové zákalky (6,9 %) a katarakta (6,9 %) [7, 9, 10, 12–14]. Při aplikaci injekce musejí být vždy používány vhodné aseptické techniky. Pacienti by měli být poučeni, aby ihned hlásili všechny příznaky, které by mohly svědčit pro endoftalmitidu (bolest oka, světloplachost, zhoršující se vidění, zarudnutí oka), a tyto příznaky by měly být bez prodlení léčeny. Během 60 minut po aplikaci injekce do sklivcové dutiny bylo u některých pacientů pozorováno zvýšení nitroočního tlaku. Požadováno je sledování a vhodná léčba jak nitroočního tlaku, tak perfuze papily zrakového nervu.
Bezpečnost a účinnost léčby afliberceptem podávaným do obou očí současně nebyla studována. S opatrností je třeba zahajovat léčbu afliberceptem u pacientů s rizikovými faktory pro vznik trhlin pigmentového epitelu sítnice. Léčba má být ukončena u pacientů s rhegmatogenním odchlípením sítnice nebo v případě výskytu makulárních děr v plné tloušťce sítnice. V léčbě afliberceptem se nesmí pokračovat při poklesu nejlépe korigované zrakové ostrosti o 30 a více písmen optotypů ETDRS oproti předchozímu stanovení zrakové ostrosti, stejně tak při výskytu subretinálního krvácení, které zahrnuje střed fovey, nebo když velikost hemoragie dosahuje 50 % a více z celkové plochy léze. Dávka nemá být podávána během 28 dní před očním chirurgickým zákrokem a 28 dní po zákroku. Zvýšená incidence spojivkového krvácení byla pozorována u pacientů, kteří dostávali antitrombotika.
Vzhledem k tomu, že aflibercept je protein, existuje při jeho použití riziko imunogenity.
Po intravitreálním použití inhibitorů VEGF existuje teoretické riziko vzniku arteriálních tromboembolických příhod, které potenciálně souvisejí se systémovou inhibicí VEGF. Arteriální tromboembolické příhody zahrnují infarkt myokardu, cévní mozkovou příhodu nebo úmrtí z kardiovaskulární příčiny. Incidence ve studiích VIEW 1 a VIEW 2 u vlhké formy VPMD byla 3,3 % v kombinované skupině pacientů léčených afliberceptem ve srovnání s 3,2 % u pacientů léčených ranibizumabem. Incidence u nemocných s CRVO ve studiích GALILEO a COPERNICUS byla 0,6 % u pacientů léčených minimálně jednou dávkou afliberceptu ve srovnání s 1,4 % ve skupině pacientů, kteří dostávali pouze předstíranou léčbu. Ve studiích VISTADME a VIVIDDME u DME byla incidence 3,3 % u pacientů léčených afliberceptem ve srovnání s 2,8 % u léčených laserovou fotokoagulací [7, 9, 10, 12–14, 29].
Lékové interakce
Dosud nebyly provedeny žádné studie interakcí a také nebylo hodnoceno použití afliberceptu v kombinaci s fotodynamickou léčbou s verteporfinem.
Těhotenství a kojení
Ženy ve fertilním věku musejí během léčby a minimálně tři měsíce po poslední injekci afliberceptu používat antikoncepci. Údaje o podávání afliberceptu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly embryofetální toxicitu po vysoké systémové expozici. Aflibercept proto nemá být používán během těhotenství, pokud přínosy léčby nepřeváží možná rizika pro plod. Není známo, zda se aflibercept vylučuje do lidského mateřského mléka, a jeho podávání není během kojení doporučeno.
Ovlivnění pozornosti
V souvislosti s podáním injekce nebo s očním vyšetřením může dojít k přechodným poruchám zraku a pacienti nemají řídit nebo obsluhovat stroje, dokud tyto poruchy dostatečně neustoupí.
Dávkování
Aflibercept v očním lékařství je určen pouze pro injekci do sklivcové dutiny.
Pacienti s VPMD
U vlhké formy VPMD je jednotlivá doporučená dávka 2 mg afliberceptu, což odpovídá 50 µl. Na začátku léčby se podává jedna injekce měsíčně ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce. Není požadována kontrola mezi injekcemi. Po prvních 12 měsících léčby může být na základě vyšetření zrakové ostrosti a anatomických změn léčebný interval prodloužen.
Pacienti s makulárním edémem v důsledku CRVO
U makulárního edému v důsledku CRVO je doporučená dávka afliberceptu také 2 mg. Po první injekci je léčba aplikována jednou měsíčně. Interval mezi dvěma dávkami nemá být kratší než jeden měsíc. Jestliže po prvních třech injekcích nedojde ke zlepšení zrakové ostrosti a anatomických poměrů, další léčba se nedoporučuje. Léčba pokračuje, dokud nedojde ke stabilizaci zrakové ostrosti a anatomických poměrů na základě tří kontrol prováděných vždy jednou za měsíc. Poté má být zvážena potřeba další léčby. Pokud je to nutné, může léčba pokračovat s postupně se prodlužujícími léčebnými intervaly, aby byla udržena stabilita zrakové ostrosti a anatomických poměrů.
Pacienti s DME
Léčba DME je zahajována injekční aplikací 2 mg afliberceptu jednou měsíčně s pěti po sobě jdoucími dávkami a s následným podáváním jedné injekce každé dva měsíce. Po 12 měsících může být interval prodloužen, nebo může být podávání ukončeno, pokud léčba není pro pacienta přínosná.
Zvláštní populace
Dostupné údaje nenaznačují potřebu úpravy dávky afliberceptu při použití v očním lékařství u pacientů s poškozenou funkcí jater a/nebo ledvin. U starší populace nejsou nutná žádná zvláštní opatření.
U dětí a dospívajících nebyly stanoveny bezpečnost a účinnost afliberceptu. Neexistuje žádné relevantní použití afliberceptu u pediatrické populace v indikacích vlhké formy VPMD, CRVO a DME.
Způsob aplikace
Injekce do sklivcové dutiny musí podávat kvalifikovaný lékař se zkušenostmi s touto formou aplikace. Musí být zajištěna anestezie a asepse, která zahrnuje použití lokálního širokospektrého mikrobicidního prostředku, jakým je např. jodovaný povidon aplikovaný na kůži kolem oka, oční víčko a povrch oka. Je doporučena chirurgická dezinfekce rukou, použití sterilních rukavic, sterilní roušky a sterilního spekula. Injekční jehla se zasune 3,5–4,0 mm posteriorně od limbu rohovky do prostoru sklivce tak, aby směřovala do centra očního bulbu. Poté se aplikuje objem injekce 50 µl. Ihned po podání léku do sklivcové dutiny by měli být pacienti sledováni s ohledem na riziko zvýšení nitroočního tlaku.Každá předplněná injekční stříkačka může být použita pouze pro léčbu jednoho oka. Předplněná injekční stříkačka obsahuje množství převyšující doporučenou dávku 2 mg (50 µl) afliberceptu. Přebytečný objem musí být před aplikací z injekce odstraněn.
Stabilita
Aflibercept je třeba uchovávat v chladničce (2–8 °C) a chránit před světlem. Před použitím je možno lék uchovávat při pokojové teplotě do 25 °C po dobu až 24 hodin.
Závěr
Aflibercept rozšířil skupinu inhibitorů VEGF pro nitrooční použití, je účinný v léčbě vlhké formy VPMD, makulárního edému v důsledku CRVO a poruch zraku u DME. Aflibercept pomáhá stabilizovat a v mnoha případech i zlepšit zrakovou ostrost
Neschválené indikace
Příznivé výsledky léčby myopické chorioideální neovaskularizace (myopic choroidal neovascularization,
mCNV) afliberceptem uvádí studie fáze III MYRROR. Pacienti byli léčeni úvodní jednou dávkou 2 mg afliberceptu, další injekce byly podány podle potřeby. Ve 24. týdnu léčby účinnou látkou činil zisk 12,1 písmene optotypů
ETDRS v porovnání se ztrátou 2,0 písmene u pacientů s mCNV, kteří dostávali předstírané injekce. V týdnu 48 získali pacienti léčení afliberceptem13,5 písmene [30].
Seznam použité literatury
- [1] Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis. J Clin Oncol 2005; 23: 1011–1027.
- [2] Browning DJ, Kaiser PK, Rosenfeld PJ, et al. Aflibercept for age-related macular degeneration: a game-changer or quiet addition? Am J Ophthalmol 2012; 154: 222–226.
- [3] Schnichels S, Hagemann U, Januschowski K, et al. Comparative toxicity and proliferation testing of aflibercept, bevacizumab and ranibizumab on different ocular cells. Br J Ophthalmol 2013; 97: 917–923.
- [4] Malik D, Tarek M, Caceres del Carpio J, et al. Safety profiles of anti-VEGF drugs: bevacizumab, ranibizumab, aflibercept and ziv-aflibercept on human retinal pigment epithelium cells in culture. Br J Ophthalmol 2014; 98 (Suppl 1): i11–16.
- [5] Nguyen QD, Campochiaro PA, Shah SM, et al. Evaluation of very high- and very low-dose intravitreal aflibercept in patients with neovascular age-related macular degeneration. J Ocul Pharmacol Ther 2012; 28: 581–588.
- [6] Huang P, Niu W, Ni Z, et al. A meta-analysis of anti-vascular endothelial growth factor remedy for macular edema secondary to central retinal vein occlusion. PLoS One 2013; 8: e82454.
- [7] Korobelnik JF, Do DV, Schmidt-Erfurth U, et al. Intravitreal Aflibercept for Diabetic Macular Edema. Ophthalmology 2014; 121: 2247–2254.
- [8] Stewart MW, Rosenfeld PJ. Predicted biological activity of intravitreal VEGF Trap. Br J Ophthalmol 2008; 92: 667–668.
- [9] Heier JS, Brown DM, Chong V, et al. Intravitreal aflibercept (VEGF trap-eye) in wet age-related macular degeneration. Ophthalmology 2012; 119: 2537–2548.
- [10] Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age-related macular degeneration: ninety-six-week results of the VIEW studies. Ophthalmology 2014; 121: 193–201.
- [11] The Central Vein Occlusion Study Group. Natural history and clinical management of central retinal vein occlusion. Arch Ophthalmol 1997; 115: 486–491.
- [12] Brown DM, Heier JS, Clark WL, et al. Intravitreal aflibercept injection for macular edema secondary to central retinal vein occlusion: 1-year results from the phase 3 COPERNICUS study. Am J Ophthalmol 2013; 155: 429–437.
- [13] Heier JS, Clark WL, Boyer DS, et al. Intravitreal aflibercept injection for macular edema due to central retinal vein occlusion: Two-year results from the COPERNICUS study. Ophthalmology 2014; 121: 1414–1420.
- [14] Korobelnik JF, Holz FG, Roider J, et al. Intravitreal aflibercept injection for macular edema resulting from central retinal vein occlusion: One-year results of the phase 3 GALILEO study. Ophthalmology 2014; 121: 202–208.
- [15] Chakravarthy U, Adamis AP, Cuninngham ET Jr., et al. Year 2 efficacy results of 2 randomized controlled clinical trials of pegaptanib for neovascular age-related macular degeneration. VEGF Inhibition Study in Ocular Neovascularization (V.I.S.I.O.N.) Clinical Trial Group. Ophthalmology 2006; 113: 1508.e1–25.
- [16] Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006; 355: 1419–1431.
- [17] Brown DM, Michels M, Kaiser PK, et al. Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: Two-year results of the ANCHOR study. Ophthalmology 2009; 116: 57–65.
- [18] Abraham P, Yue H, Wilson L. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER study year 2. Am J Ophthalmol 2010; 150: 315–324.
- [19] Schmidt-Erfurth U, Eldem B, Guymer R, et al. Efficacy and safety of monthly versus quarterly ranibizumab treatment in neovascular age-related macular degeneration: the EXCITE study. Ophthalmology 2011; 118: 831–839.
- [20] Boyer DS, Heier JS, Brown DM, et al. A Phase IIIb study to evaluate the safety of ranibizumab in subjects with neovascular age-related macular degeneration. Ophthalmology 2009; 116: 1731–1739.
- [21] Holz FG, Amoaku W, Donate J, et al. Safety and efficacy of a flexible dosing regimen of ranibizumab in neovascular age-related macular degeneration: the SUSTAIN study. Ophthalmology 2011; 118: 663–671.
- [22] Fung AE, Lalwani GA, Rosenfeld PJ, et al. An optical coherence tomography-guided, variable dosing regimen with intravitreal ranibizumab (Lucentis) for neovascular age-related macular degeneration. Am J Ophthalmol 2007; 143: 566–583.
- [23] Brown DM, Campochiaro PA, Bhisitkul RB, et al. Sustained benefits from ranibizumab for macular edema following branch retinal vein occlusion: 12-month outcomes of a phase III study. Ophthalmology 2011; 118: 1594–1602.
- [24] Campochiaro PA, Brown DM, Awh CC, et al. Sustained benefits from ranibizumab for macular edema following central retinal vein occlusion: twelve-month outcomes of a phase III study. Ophthalmology 2011; 118: 2041–2049.
- [25] Thach AB, Yau L, Hoang C, et al. Time to clinically significant visual acuity gains after ranibizumab treatment for retinal vein occlusion: BRAVO and CRUISE trials. Ophthalmology 2014; 121: 1059–1066.
- [26] Massin P, Bandello F, Garweg JG, et al. Safety and efficacy of ranibizumab in diabetic macular edema (RESOLVE Study): a 12-month, randomized, controlled, double-masked, multicenter phase II study. Diabetes Care 2010; 33: 2399–2405.
- [27] Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study: ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011; 118: 615–625.
- [28] Pruente C. Efficacy and safety of ranibizumab in two treat-and-extend versus pro-re-nata regimes in patients with visual impairment due to diabetic macular edema: 24-month results of RETAIN study. Invest Ophthalmol Vis Sci 2014; 55: E-Abstract 1700.
- [29] Antithrombotic Trialists‘ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71–86.
- [30] Sharma YR, Tripathy K, Venkatesh P, et al. Aflibercept –How does it compare with other Anti-VEGF Drugs?