Asciminib
Pro terapii pacientů s chronickou myeloidní leukemií (CML) v chronické fázi, u nichž došlo k selhání již dvou linií léčby, je nově k dispozici asciminib, první alosterický inhibitor aktivity kinázy BCR::ABL1. Podává se perorálně, mezi jeho přednosti patří vysoká specificita a účinnost při přítomnosti většiny mutací kinázové domény [1].
Chronická myeloidní leukemie představuje nádorové myeloproliferativní onemocnění, které vzniká na podkladě genetické abnormality vedoucí k nekontrolovanému množení krvetvorných buněk myeloidní linie. Příčiny genetické abnormality nejsou dosud známy, ale její podstata ano. Mezi chromozomy 9 a 22 dochází k reciproké translokaci části ramének za vzniku tzv. filadelfského (Ph) chromozomu. Při translokaci se vedle sebe dostanou geny ABL1 z chromozomu 9 a BCR z chromozomu 22, které splynou v tzv. fúzní gen BCR‑ABL1. Tento gen kóduje vznik patologické konstitutivně aktivované tyrozinkinázy BCR::ABL1 (protein p120), která je zodpovědná za nekontrolovanou proliferaci krvetvorných buněk a jejich sníženou odpověď na proapoptotické signály [2].
Posun ve znalostech molekulární biologie a patofyziologie CML umožnil zavedení cílené léčby – inhibitorů tyrozinkináz (TKI), které významně změnily dřívější, fatální prognózu CML a staly se standardem léčby CML [3–5]. U 20–30 % nemocných však dochází k selhání léčby, a to buď na podkladě rezistence na terapii (vznik mutací), nebo její intolerance [1].
Farmakologická skupina
Asciminib představuje první alosterický inhibitor BCR::ABL1 kinázové aktivity. Vyznačuje se vysokou specificitou a účinností při přítomnosti kinázových mutací, které jsou obvykle příčinou omezené účinnosti léčby TKI [3].
Přípravek je dle ATC klasifikace řazen do skupiny Cytostatika, Inhibitory proteinkináz (ATC kód: L01EA06).
Indikace
Přípravek je indikován k léčbě dospělých pacientů s Philadelphia chromozom pozitivní (Ph+) chronickou myeloidní leukemií v chronické fázi, kteří byli dříve léčeni nejméně dvěma TKI [6].
Dávkování
Asciminib je doporučeno podávat v dávce 40 mg 2× denně v přibližně 12hodinových intervalech. Terapie asciminibem pokračuje, dokud je pozorován klinický přínos nebo dokud se neobjeví nepřijatelná toxicita.
Přípravek je určen k terapii dospělých pacientů, u pediatrických nemocných nebyly jeho účinnost a bezpečnost hodnoceny. U seniorních pacientů ve věku 65 let a starších ani u pacientů s porušenou funkcí ledvin nebo jater není třeba jakákoliv úprava dávkování. Dávku je doporučeno upravit v případě výskytu nežádoucích účinků (tab. 1) [6].

V případě opomenutí dávky o méně než šest hodin je doporučeno dávku užít a dále pokračovat v zavedeném schématu dávkování. Při vynechání dávky s prodlením delším než šest hodin se daná dávka již vynechává a další se užije opět dle plánu [6].
Způsob podání
Přípravek je určen k perorálnímu podání, tablety se polykají v celku, nemají se lámat ani drtit. Asciminib je potřeba podávat bez jídla, konzumaci jídla je třeba se vyhnout nejméně dvě hodiny před užitím a jednu hodinu po užití asciminibu.
Mechanismus účinku
Tyrozinkinázové inhibitory dosud používané v léčbě CML se vážou na kinázovou doménu, kompetují o vazebné místo pro adenosintrifosfát (ATP) a blokují autofosforylaci kinázy, klíčový mechanismus abnormální aktivace signálních drah. Rezistence na léčbu TKI se rozvíjí obvykle v důsledku mutací v oblasti kinázové domény [1,4].
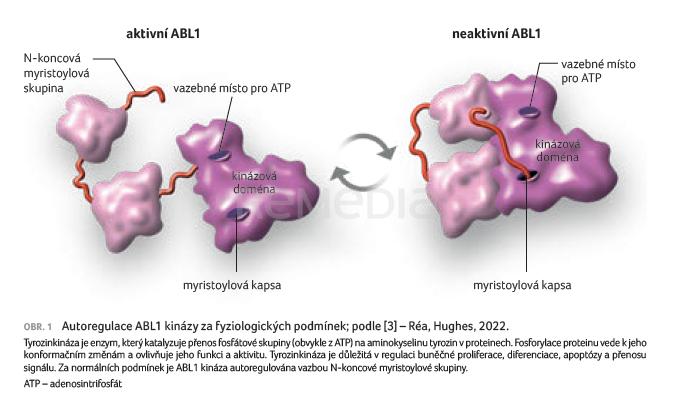
Asciminib je silný alosterický inhibitor BCR::ABL1 tyrozinkinázy. Její aktivitu tlumí specifickým cílením na ABL1 myristoylovou kapsu, která za normálních okolností váže N‑koncovou myristoylovou skupinu a vede k autoinhibici kinázové aktivity (obr. 1) [1,3]. Tato autoregulace se ztrácí tvorbou BCR::ABL1.
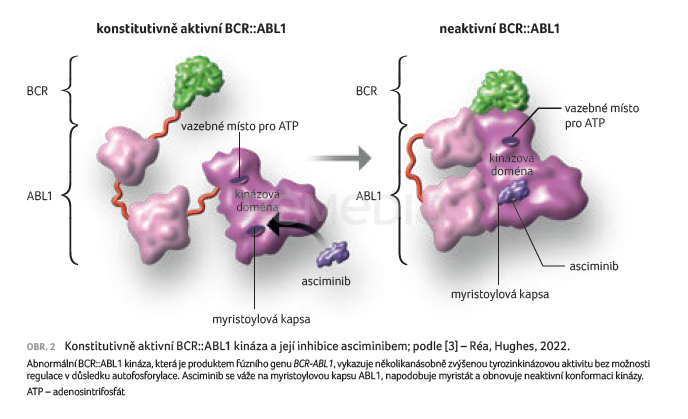 Asciminib vazbou na ABL1 myristoylovou kapsu napodobuje interakci myristoylové kapsy a vytvořením neaktivní konformace inhibuje aktivitu BCR::ABL1 (obr. 2) [3,7–9].
Asciminib vazbou na ABL1 myristoylovou kapsu napodobuje interakci myristoylové kapsy a vytvořením neaktivní konformace inhibuje aktivitu BCR::ABL1 (obr. 2) [3,7–9].
V souvislosti s tímto mechanismem účinku byl zaveden termín STAMP (Specificly Targeting the ABL Myristoyl Pocket) [1], jehož cílem je odlišit způsob, kterým účinkuje asciminib, oproti doposud užívaným TKI, jež se vážou na vazebné místo pro ATP.
Farmakokinetické vlastnosti
Asciminib se rychle a kompletně vstřebává, maximální plazmatické koncentrace (cmax = 793 ng/ml) dosahuje za 2–3 hodiny po perorálním podání bez ohledu na velikost dávky. Biologická dostupnost se odhaduje na přibližně 73 %. Může být negativně ovlivněna souběžným podáním přípravků obsahujících jako pomocnou látku hydroxypropyl‑β‑cyklodextrin (obsažen např. v perorálním roztoku itrakonazolu). Biologickou dostupnost dále snižuje komzumace potravy, a to zejména s vysokým obsahem tuku [6].
Asciminib je distribuován hlavně do plazmy, z 97,3 % se váže na plazmatické proteiny. Zdánlivý distribuční objem asciminibu v ustáleném stavu činí 111 litrů.
Asciminib je primárně metabolizován prostřednictvím cytochromu P450 CYP3A4 a glukuronidací pomocí uridindifosfát glukuronosyltransferáz UGT2B7 a UGT2B17. Vylučuje se převážně stolicí (z 80 %) a v menší míře močí (asi 11 %). Celková perorální clearance asciminibu se odhaduje na 6,3 l/hod. Poločas eliminace asciminibu je dle populačních farmakokinetických analýz 5,2 hodiny při dávce 40 mg podávané 2× denně [6].
Klinické zkušenosti
Asciminib prokázal svoji účinnost již ve studii fáze I (NCT02081378), která si dala za cíl stanovit doporučenou a maximálně tolerovanou dávku asciminibu. Zařazeno bylo celkem 150 pacientů s CML, u nichž byla zaznamenána rezistence na léčbu nebo neakceptovatelná toxicita léčby alespoň dvěma ATP‑kompetitivními TKI. Asciminib byl podáván silně předléčeným pacientům s CML (70 % bylo léčeno alespoň třemi TKI, včetně léčby ponatinibem) [7]. Asciminib byl podáván jednou nebo dvakrát denně (v dávkách 10–200 mg), medián sledování byl 14 měsíců.
Ze 113 pacientů s chronickou fází CML bez mutace T315I, kteří byli léčeni asciminibem jednou nebo dvakrát denně, dosáhlo kompletní hematologické odpovědi (tj. normální hodnoty krevních buněk, absence myeloidních buněk, normální velikost sleziny a bezpříznakovost) 34 ze 37 (92 %) pacientů, u nichž na počátku sledování nebyla přítomna. Z 57 pacientů bez kompletní cytogenetické odpovědi (tj. při vyšetření karyotypu nalezeny jen zdravé buňky bez Ph chromozomu) na počátku sledování jí dosáhlo 31 (54 %) pacientů s mediánem léčby 24 (4–126) týdnů.
Z hlediska bezpečnosti se u všech 150 hodnocených bez ohledu na výši dávky objevily jako nejčastější nehematologické nežádoucí účinky asymptomatické zvýšení aktivity lipázy nebo amylázy, vyrážka a celkové příznaky, jako jsou únava, nevolnost, bolest hlavy nebo artralgie. V 92 % se jednalo o stupeň 1 nebo 2. Nejčastějším kardiovaskulárním nežádoucím účinkem byla hypertenze hlášená u 19 % pacientů [7].
Ve studii ASCEMBL (NCT03106779) demonstroval asciminib statisticky i klinicky významně vyšší účinnost než bosutinib a příznivý bezpečnostní profil [3,10]. Tato multicentrická otevřená studie fáze III sledovala dospělé pacienty v chronické fázi CML, kteří byli dříve léčeni dvěma a více TKI. Medián věku zařazených pacientů byl 52 (18–83) let, 51,5 % tvořily ženy. Z 233 pacientů bylo 18,9 % ve věku ≥ 65 let a 2,6 % ve věku ≥ 75 let. Dvěma TKI bylo dříve léčeno 48,1 %, třemi 31,3 %, čtyřmi 14,6 % a pěti nebo více 6 % pacientů.
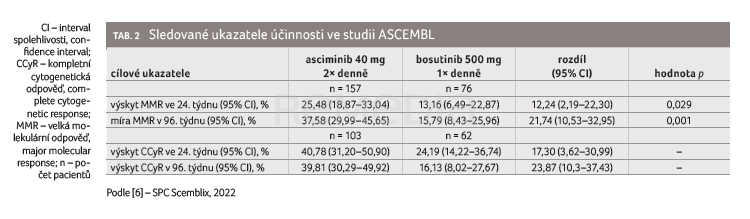
Pacienti byli randomizováni v poměru 2 : 1 k podávání asciminibu v dávce 40 mg dvakrát denně (n = 157) nebo bosutinibu v dávce 500 mg jednou denně (n = 76) [3,10]. Primárním cílovým ukazatelem účinnosti byla míra dosažení minimální až nulové zbytkové choroby na molekulární úrovni, tzv. velké molekulární odpovědi (major molecular response, MMR) ve 24. týdnu. Dosáhlo jí 25,5 % pacientů užívajících asciminib oproti 13,2 % pacientů léčených bosutinibem [3,10]. Jako sekundární cílové ukazatele byly zvoleny MMR v 96. týdnu, kompletní cytogenetická odpověď (complete cytogenetic response, CCyR) ve 24. a 96. týdnu. Hlavní výsledky studie ASCEMBL shrnuje tabulka 2.
U 50,6 % pacientů léčených asciminibem a 60,5 % pacientů užívajících bosutinib byly zaznamenány nežádoucí účinky stupně 3 a vyššího. V rameni s asciminibem se nejčastěji jednalo o trombocytopenii (21,8 %) a neutropenii (17,8 %), v rameni s léčbou bosutinibem byly s nejvyšší frekvencí hlášeny zvýšená aktivita alaninaminotransferázy (14,5 %), neutropenie (14,5 %) a průjem (10,5 %). K úmrtí při léčbě došlo u dvou pacientů (1,3 %) užívajících asciminib (ischemická cévní mozková příhoda a arteriální embolie) a u jednoho pacienta (1,3 %) užívajícího bosutinib (septický šok).
Kontraindikace
Jedinou kontraindikací léčby asciminibem je hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku přípravku. Přípravek nemají užívat pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, úplným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy [6].
Monitorace pacientů před léčbou a během ní
Z důvodu prodloužení intervalu QT, které bylo zachyceno při podávání asciminibu, je doporučeno před zahájením terapie provést elektrokardiogram, kompenzovat hypokalemii a hypomagnezemii. Během léčby vše dále sledovat dle klinické potřeby [6].
Při léčbě jinými TKI došlo u chronických nosičů viru hepatitidy B (HBV) k reaktivaci viru. Před zahájením terapie asciminibem mají být proto pacienti vyšetřeni na infekci HBV a nositelé HBV během léčby a několik měsíců po ní pečlivě sledováni [6].
Z důvodu možného výskytu hypertenze je doporučeno během terapie asciminibem pravidelně monitorovat krevní tlak a další kardiovaskulární rizikové faktory [6].
Při terapii asciminibem je třeba rovněž sledovat známky a příznaky myelosuprese. V průběhu prvních tří měsíců je doporučeno vyšetřovat každé dva týdny kompletní krevní obraz a následně toto vyšetření provádět jednou za měsíc nebo dle klinické potřeby [6].
Dále je při léčbě třeba monitorovat možné známky a příznaky pankreatické toxicity. Jednou měsíčně nebo dle klinické potřeby mají být vyšetřeny hodnoty sérové lipázy a amylázy. U pacientů s anamnézou pankreatitidy je třeba provádět častější sledování. V případě zvýšení aktivity sérové lipázy a amylázy, které je doprovázeno abdominální bolestí, je třeba léčbu dočasně přerušit a zvážit vhodné diagnostické testy k vyloučení pankreatitidy [6].
Nežádoucí účinky
U pacientů léčených asciminibem byly v rámci klinických hodnocení nejčastěji zaznamenány bolesti svalů a kloubů, infekce horních cest dýchacích, trombocytopenie, únava, bolest hlavy, zvýšená aktivita pankreatických enzymů, bolest břicha, průjem a nauzea [6].
Z nežádoucích účinků stupně 3 a vyššího se jednalo nejčastěji o trombocytopenii (18,5 %), neutropenii (15,7 %), zvýšení hodnot pankreatických enzymů (12,4 %), hypertenzi (8,7 %) a anémii (5,3 %) [6].
Závažné nežádoucí účinky byly zaznamenány u 12,4 % léčených. S nejvyšší incidencí to byly pleurální výpotek (u 2,5 %), infekce dolních cest dýchacích (u 2,2 %), trombocytopenie (u 1,7 %), pyrexie (u 1,4 %), pankreatitida (u 1,1 %), nekardiální bolest na hrudi (u 1,1 %) a zvracení (u 1,1 %) [6].
Interakce
Asciminib je metabolizován prostřednictvím CYP3A4, UGT2B7 a UGT2B17 a do žluči je vylučován pomocí transportéru BCRP (breast cancer resistance protein). Léčivé přípravky, které inhibují nebo indukují dráhy CYP3A4, UGT a BCRP, mohou proto změnit expozici asciminibu. Plazmatické koncentrace asciminibu mohou snižovat silné induktory CYP3A4, jako jsou rifampicin, karbamazepin, fenobarbital, fenytoin nebo třezalka tečkovaná [6].
Asciminib je substrátem i inhibitorem BCRP a P‑gp. In vitro reverzibilně inhibuje CYP3A4/5, CYP2C9, CYP2C8 a UGT1A1 [11]. Opatrnosti je proto třeba u léčiv s úzkým terapeutickým indexem, jež jsou substráty CYP3A4 (midazolam, fentanyl, alfentanil, dihydroergotamin, ergotamin) nebo CYP2C9 (warfarin, fenytoin).
Prodloužení intervalu QT pozorované při léčbě asciminibem zvyšuje riziko komorové arytmie torsade de pointes. Z tohoto důvodu je třeba opatrnosti při současné léčbě přípravky se známým rizikem torsade de pointes (chlorochin, klaritromycin, haloperidol, metadon, moxifloxacin aj.) [6].
Fertilita, těhotenství a kojení
O vlivu asciminibu na fertilitu u lidí nejsou dostupné žádné údaje. Léčba asciminibem v těhotenství se nedoporučuje. Studie na zvířatech prokázaly reprodukční toxicitu. Před zahájením terapie by mělo být u žen vyloučeno možné těhotenství a ženy by během léčby a minimálně tři dny po jejím ukončení měly používat účinnou metodu antikoncepce. Zda se asciminib vylučuje do mateřského mléka, není známo. Po dobu terapie a minimálně tři dny po jejím ukončení se doporučuje kojení přerušit [6].
Literatura
[1] Yeung DT, Shanmuganathan N, Hughed TP. Asciminib: a new therapeutic option in chronic‑phase CML with treatment failure. Blood 2022; 139: 3474–3479.
[2] Soverini S, Mancini M, Bavaro L, et al. Chronic myeloid leukemia: the paradigm of targeting oncogenic tyrosine kinase signaling and counteracting resistance for successful cancer therapy. Molecular Cancer 2018; 17: 49.
[3] Réa D, Hughes TP. Development of asciminib, a novel allosteric inhibitor of BCR‑ABL1. Crit Rev Oncol Hematol 2022; 171: 103580.
[4] Rossari F, Minutolo F, Orciuolo E. Past, present, and future of Bcr‑Abl inhibitors: from chemical development to clinical efficacy. J Hematol Oncol 2018; 11: 84.
[5] Klamová H. Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie. Vnitř Lek 2013; 59: 624–626.
[6] Souhrn údajů o přípravku Scemblix. 2022. Dostupné na: https://www.sukl.cz
[7] Hughes TP, Mauro MJ, Cortes JE, et al. Asciminib in Chronic Myeloid Leukemia after ABL Kinase Inhibitor Failure. N Engl J Med 2019; 381: 2315–2326.
[8] Schoepfer J, Jahnke W, Berellini G, et al. Discovery of asciminib (ABL001), an allosteric inhibitor of the tyrosine kinase activity of BCR‑ABL1. J Med Chem 2018; 61: 8120–8135.
[9] Wylie AA, Schoepfer J, Jahnke W, et al. The allosteric inhibitor ABL001 enables dual targeting of BCR‑ABL1. Nature 2017; 543: 733–737.
[10] Réa D, Mauro MJ, Boquimpani C, et al. A phase 3, open‑label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021; 138: 2031–2041.
[11] Hoch M, Sengupta T, Hourcade‑Potelleret F. Pharmacokinetic drug interactions of asciminib with the sensitive cytochrome P450 probe substrates midazolam, warfarin, and repaglinide in healthy participants. Clin Transl Sci 2022; 15: 1406–1416.
Komentář: Asciminib
Chronická myeloidní leukemie (CML) bylo první nádorové onemocnění, které bylo spjato s určitou jasně definovanou chromozomální abnormalitou. Další intenzivní výzkum v této oblasti přinesl vyluštění molekulární patogeneze této choroby, a také první cílenou terapii - imatinib. Imatinib je vlastně možno považovat za praotce všech dalších dnes používaných analogicky působících léků. Imatinib naprosto dramaticky změnil prognózu CML - z nádorové choroby s relativně krátkým přežitím se stala chronická nemoc, léčená perorálně, tabletami, což může částečně připomínat třeba hypertenzi nebo diabetes. Kdysi bývala CML jednou z hlavních indikací pro transplantaci krvetvorných buněk, ale to již dnes neplatí.
Imatinib zůstal pilířem v terapii CML, ale desítky procent pacientů tuto terapii změní pro slabou účinnost nebo nesnášenlivost léku. Obecně musí být snášenlivost terapie v takovém případě exkluzivní, poněvadž se jedná o dlouhodobé, zatím ve většině případů celoživotní podávání. Tyrozinkinázové inhibitory tzv. druhé generace a zvláště tzv. třetí generace překvapily svými nežádoucí účinky, jako jsou například pleurální výpotky (dasatinib) nebo kardiovaskulární toxicita (nilotinib, ponatinib).
Navíc se v poslední době objevuje zcela nový a nevídaný fenomén, kde je hematologická onkologie opět v popředí inovací: u pacientů, kteří se dostanou dlouhodobě do tzv. hluboké molekulární odpovědi, je možné terapii vysadit. Potřebujeme tedy vysoce účinný a málo toxický lék. Byť asciminib zase „pouze“ inhibuje BCR::ABL1 - neeliminuje tedy nádorové buňky -, zdá se, že by to mohl být velmi vítaný další člen do rodiny léků pro terapii CML. Blízká budoucnost ještě ukáže potenciál tohoto léku, dosavadní zkušenosti se jeví velmi pozitivně.