Atezolizumab
Key words: atezolizumab ‒ immunotherapy ‒ urothelial carcinoma ‒ lung cancer ‒ monoclonal antibody.
Receptor PD 1 a jeho ligandy
Receptor programované buněčné smrti (programmed death 1, PD 1) a jeho ligand (PD L1) jsou nejdůležitějším terapeutickým cílem nových imunoonkologických léků. Jejich inhibitory prokázaly u řady malignit schopnost odblokovat inhibované imunitní reakce proti nádoru.
PD 1 je receptor nacházející se na povrchu T lymfocytů, který funguje jako negativní regulátor imunitního systému tím, že zabraňuje aktivaci T lymfocytu inhibicí kinázové signalizační dráhy. Signalizací PD 1 je navozena apoptóza, anergie a funkční vyčerpání (exhaustion) aktivovaných cytotoxických T lymfocytů. Za fyziologických podmínek se tento receptor uplatňuje v prevenci autoimunitních onemocnění a v indukci buněčné tolerance. Receptor PD 1 ovlivňuje aktivitu T lymfocytů zejména v jejich efektorové fázi (zatímco další inhibiční receptor CTLA 4 se uplatňuje v ovlivnění časné fáze aktivace T lymfocytu).
PD 1 je exprimován T a B lymfocyty, monocyty a též NK buňkami. Váže dva ligandy ‒ PD L1 a PD L2 ‒, které inhibují proliferaci T lymfocytů, produkci cytokinů a buněčnou adhezi. Zatímco PD L1 je exprimován klidovými T a B lymfocyty, dendritickými buňkami, makrofágy a endoteliálními buňkami, PD L2 byl detekován jen na profesionálních antigen prezentujících buňkách – dendritických buňkách a makrofázích. Rolí PD L1 je tedy tlumit funkci T lymfocytů v periferních tkáních.
Nádorové buňky jsou však schopné produkovat a exprimovat protein PD L1 a využít ho k úniku před destrukcí imunitním systémem (inaktivovat T lymfocyty vazbou mezi PD L1 a PD 1). Kromě samotných nádorových buněk se v karcinomu nachází celá řada tzv. tumor infiltrujících imunitních buněk (například buňky typu MDSC – myeloid derived suppressor cells), které rovněž mohou exprimovat PD L1 a tím dále přispívat k inhibici protinádorové imunitní reakce [1]. V klinických studiích byl pozorován protinádorový účinek antagonistů PD 1 a PD L1 i v případě karcinomů bez detekovatelné exprese PD L1. Jedním z vysvětlení pro tento efekt je inhibice interakce PD 1/PD L1 v lymfatických tkáních.
Byly vyvinuty monoklonální protilátky jak proti PD 1 (nivolumab, pembrolizumab a další), tak i proti PD L1 (atezolizumab neboli MPDL3280A, avelumab a další).
Mechanismus účinku atezolizumabu
Atezolizumab je humanizovaná
monoklonální protilátka typu IgG1, která se váže na PD L1
a tím brání reakci mezi PD L1 a receptory PD 1
i B7.1 (CD80) na povrchu aktivovaných T lymfocytů
a antigen prezentujících buněk. Vazba PD 1 s PD L1
vede k supresi cytotoxické T buněčné aktivity, inhibuje
proliferaci T lymfocytů a produkci cytokinů, což v důsledku
vede k útlumu protinádorové imunitní odpovědi. Protilátka
proti PD L1 atezolizumab této pro nádorovou imunitu nežádoucí
reakci zabraňuje (obr. 1).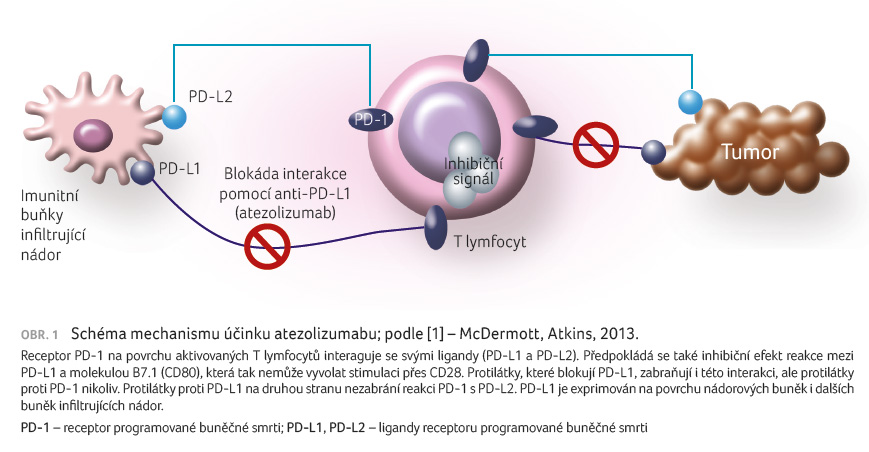
Indikace
Atezolizumab je v Evropě ke dni 21. září 2017 indikován k léčbě lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic (non small cell lung cancer, NSCLC) po předchozí chemoterapii, přičemž u pacientů s mutacemi aktivujícími EGFR (epidermal growth factor receptor, receptor pro epidermální růstový faktor) nebo s ALK pozitivní mutací karcinomu má být před podáním atezolizumabu vyčerpána cílená terapie. Dále je léčivo indikováno k léčbě lokálně pokročilého nebo metastazujícího uroteliálního karcinomu po předchozí chemoterapii obsahující platinu, a rovněž u pacientů, kteří nejsou schopni podstoupit léčbu cisplatinou. V České republice není schválena úhrada ze zdravotního pojištění ani v jedné z výše uvedených indikací.
Dávkování
Atezolizumab je podáván formou intravenózní infuze obvykle v dávce 1 200 mg v intervalu tří týdnů. V některých klinických studiích byla používána dávka 15 mg/kg. První podání by mělo trvat přibližně 60 minut za pečlivé monitorace stavu pacienta (vitální funkce). Pokud první podání proběhne bez komplikací, je možné další podání zkrátit na dobu 30 minut. Standardně není doporučena žádná specifická premedikace. V případě, že se během podání objeví infuzní reakce, je zapotřebí při dalších aplikacích přidat premedikaci (antihistaminika, antipyretika).
Farmakokinetika
V dávkovacím rozmezí 1‒20 mg/kg, které bylo testováno ve studiích a do něhož spadá i standardní dávka 1 200 mg užívaná každé tři týdny, roste expozice léčivu úměrně s narůstající dávkou. Dle populační analýzy lze popsat kinetiku atezolizumabu pomocí dvoukompartmentového modelu s eliminací prvního řádu. Ustáleného stavu je dosaženo při opakovaném podání přibližně po 2‒3 cyklech (tzn. za 6‒9 týdnů).
Distribuční objem léčiva činí v ustáleném stavu 6,9 litru [2]. Předpokládá se, že stejně jako tělu vlastní protilátky jsou i uměle vytvořené a dodané protilátky eliminovány specifickým katabolismem, biotransformace nebyla dále studována. Clearance atezolizumabu je 0,200 litru/den, typický terminální eliminační poločas je 27 dní. Nebyl prokázán vliv poruchy funkce ledvin ani jater na clearance atezolizumabu ‒ stejná hodnota clearance byla zaznamenána u pacientů s normální, případně středně závažnou poruchou funkce ledvin či jater. U pacientů se závažným poškozením funkce ledvin nebo jater testování nebylo provedeno.
Expozice atezolizumabu nebyla ovlivněna věkem, rasou, hmotností, pohlavím, koncentrací albuminu, hodnotou exprese PD L1 ani pozitivitou ATA (anti therapeutic antibodies), jejichž vliv na farmakokinetiku atezolizumabu byl pozorován jen u některých pacientů s nízkými dávkami léčiva, avšak v celé skupině nebyl signifikantní [3].
Nežádoucí účinky
Hlavními nežádoucími účinky atezolizumabu jsou autoimunitní reakce proti různým orgánům a tkáním, infekce a infuzní reakce [3].
Autoimunitní pneumonitida nebo intersticiální plicní onemocnění se v klinických studiích s atezolizumabem vyskytly u 2,6 % pacientů. Střední doba nástupu pneumonitidy byla 2,6 měsíce.
Jaterní poškození stupně 3 nebo 4 se manifestovalo jako elevace hodnot alaninaminotransferázy (2,5 %), aspartátaminotransferázy (2,3 %) nebo celkového bilirubinu (1,6 %). Střední doba nástupu jaterního poškození byla 1,1 měsíce.
Kolitida nebo průjem se v klinických studiích vyskytly u 19 % pacientů, průjem stupně závažnosti 3‒4 se však objevil jen u 1,2‒1,9 % jedinců. Jasně prokázaná autoimunitní kolitida se vyskytla u 0,5‒0,8 % pacientů. Střední doba nástupu autoimunitní kolitidy v různých studiích byla 21 dnů až 1,7 měsíce od zahájení léčby.
Z endokrinopatií byly hlášeny poruchy štítné žlázy (hypotyreóza 3,9 %, hypertyreóza 1,0 %), adrenální nedostatečnost (0,4 %), hypofyzitida (0,2 %) a diabetes mellitus 1. typu s ketoacidózou (0,2 %). Průměrná doba do nástupu poruch štítné žlázy byla 5,4 měsíce.
Jiné nežádoucí účinky autoimunitní etiologie včetně meningoencefalitidy, myastenického syndromu, syndromu Guillainova–Barrého a očních zánětů se vyskytly u ≤ 1,0 % osob léčených atezolizumabem. Symptomatická pankreatitida bez alternativní etiologie byla zaznamenána u 0,1 % pacientů léčených v rámci klinických studií.
V klinických hodnoceních byly hlášeny závažné infekce, včetně sepse, herpetické encefalitidy a mykobakteriální infekce. K infekci jakéhokoliv stupně závažnosti došlo u 38,4 % jedinců. V randomizované studii zaměřené na NSCLC byly infekce častější u pacientů léčených atezolizumabem (42 %) ve srovnání s pacienty léčenými docetaxelem (33 %). Infekce stupně 3 nebo 4 byly zaznamenány u 9,2 % jedinců léčených atezolizumabem oproti 2,2 % jedinců léčených docetaxelem. Nejčastějším typem infekce byla u pacientů s NSCLC pneumonie, u pacientů s karcinomem močového měchýře uroinfekce.
Závažné infuzní reakce jsou málo časté, byly hlášeny u 1,3 % osob v klinických studiích.
Atezolizumab může při podávání těhotné ženě způsobit poškození plodu. Studie na zvířatech prokázaly, že inhibice dráhy PD 1 může vést ke zvýšenému riziku imunitní rejekce a následně ke smrti plodu. Ženy s reprodukčním potenciálem by měly používat účinnou antikoncepci během léčby a po dobu nejméně pěti měsíců po poslední dávce.
Redukce dávky a terapie nežádoucích účinků
Redukce dávky atezolizumabu není doporučena. V případě výskytu nežádoucích účinků se další postup léčby odvíjí od jejich závažnosti – v úvahu připadá dočasné přerušení terapie, případně její úplné ukončení, zejména v případě autoimunitních nežádoucích účinků stupně 3‒4 typu pneumonitidy, hepatitidy, kolitidy, hypofyzitidy a dalších. V případě rozvoje myastenického syndromu jakéhokoliv stupně musí být léčba trvale ukončena.
Základem terapie nežádoucích účinků je jednak podpůrná, symptomatická léčba, jednak kortikoterapie, podle závažnosti stavu pacienta ve formě perorálního, případně intravenózního podání. Léčba by měla být zahájena po výskytu nežádoucího účinku co nejdříve v maximální dávce, následně ji lze podle vývoje stavu nemocného snižovat. Standardní dávkování kortikosteroidů je v případě prednisonu 1‒2 mg/kg/den p.o. a v případě metylprednisolonu 1‒4 mg/kg/den i.v. Součástí léčby by měla být i podpůrná, preventivní terapie dlouhodobého užívání vysokých dávek kortikosteroidů (gastroprotektiva, vitamin D). Po zlepšení stavu je nezbytné pomalé ukončování léčby kortikosteroidy, které by mělo trvat alespoň 28 dnů. Samotná kortikoterapie nijak nesnižuje protinádorový efekt podávané imunoterapie.
V případě nedostatečného účinku intravenózně podávaných kortikosteroidů se doporučuje přidat ke kortikoterapii infliximab (protilátka proti tumor nekrotizujícímu faktoru alfa, v dávce 5 mg/kg/2 týdny). Kontraindikací pro podání infliximabu je autoimunitní hepatitida z důvodu jeho hepatotoxicity. Zde je v případě neúčinnosti intravenózní kortikoterapie možné použít mykofenolát mofetil (3 mg/kg/den).
Přehled registračních klinických studií
Uroteliální karcinom
IMvigor 210 (GO29293) – mezinárodní, multicentrická, jednoramenná studie fáze II pro pacienty s lokálně pokročilým nebo metastatickým uroteliálním karcinomem. Pacienti byli rozděleni do dvou kohort. Kohortu 1 (celkem 119 osob) představovali pacienti, kteří nebyli doposud léčeni chemoterapií nebo nebyli vhodnými kandidáty pro léčbu na bázi cisplatiny, případně u nich došlo k progresi po 12 měsících od absolvování terapie cisplatinou. Kohorta 2 byla tvořena pacienty, kteří progredovali během léčby chemoterapií na bázi platiny v neoadjuvanci/adjuvanci nebo pro inoperabilní lokálně pokročilý či metastatický karcinom, případně pacienty, u nichž došlo k progresi do 12 měsíců od léčby na bázi platiny (celkem 310 osob).
Hlavním cílem bylo vyhodnocení míry léčebných odpovědí (objective response rate, ORR), výsledky byly vztaženy i k míře exprese PD L1. V kohortě 1 bylo dosaženo ORR u 21,9 % pacientů s expresí PD L1 ≥ 5 %, u 18,8 % pacientů s expresí PD L1 ≥ 1 % a u 19,3 % osob ve všech podskupinách. Medián celkového přežití (overall survival, OS) pro všechny skupiny pacientů byl 10,6 měsíce. V kohortě 2 dosáhlo ORR 28,0 % pacientů s expresí PD L1 ≥ 5 %, 19,3 % pacientů s expresí PD L1 ≥ 1 % a 15,8 % osob ve všech podskupinách.
Byl prokázán statisticky signifikantní vliv atezolizumabu na ORR. Odpovědi byly dlouhodobé a ORR byla vyšší u pacientů s vyšší mírou exprese PD L1. Léčba byla účinná bez ohledu na přítomnost nepříznivých prognostických faktorů. Nejčastějšími nežádoucími účinky u pacientů v kohortě 1 byly únava, nechutenství, nauzea, průjem. V kohortě 2 u pacientů předléčených platinovým režimem se nejčastěji objevily únava, nechutenství, zácpa, teploty a infekce močových cest [2‒4].
IMvigor 211 (GO29294) ‒ multicentrická, mezinárodní randomizovaná studie fáze III posuzující účinnost a bezpečnost atezolizumabu ve srovnání s chemoterapií (dle výběru ošetřujícího lékaře: vinflunin, docetaxel nebo paklitaxel) u pacientů s lokálně pokročilým nebo metastatickým uroteliálním karcinomem, kteří progredovali během léčby nebo po léčbě chemoterapeutickým režimem obsahujícím platinu.
Zařazeno bylo c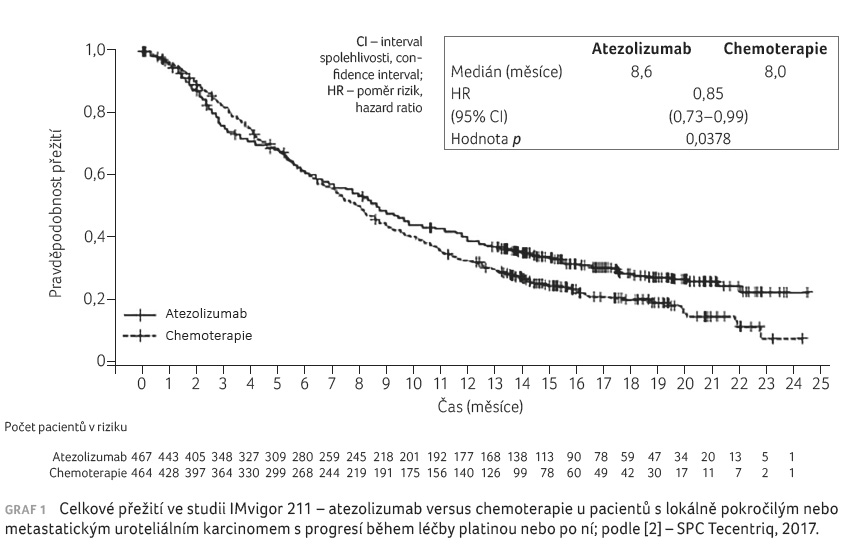 elkem 931 pacientů,
kteří byli randomizováni v poměru 1 : 1 do ramen
s atezolizumabem nebo s chemoterapií (vinflunin,
paklitaxel nebo docetaxel). Primárním cílovým ukazatelem bylo OS,
sekundárními cílovými ukazateli ORR, délka odpovědi na léčbu
(duration of response, DOR) a doba bez progrese onemocnění
(progression free survival, PFS).
Pacienti byli rozděleni do podskupin na základě
exprese PD L1.
elkem 931 pacientů,
kteří byli randomizováni v poměru 1 : 1 do ramen
s atezolizumabem nebo s chemoterapií (vinflunin,
paklitaxel nebo docetaxel). Primárním cílovým ukazatelem bylo OS,
sekundárními cílovými ukazateli ORR, délka odpovědi na léčbu
(duration of response, DOR) a doba bez progrese onemocnění
(progression free survival, PFS).
Pacienti byli rozděleni do podskupin na základě
exprese PD L1.
V rámci této studie nebyl splněn primární cíl ‒ tedy nebyl prokázán statisticky signifikantní vliv na OS ve srovnání s chemoterapií, ačkoliv u dlouho přežívajících pacientů je separace křivek OS ve prospěch atezolizumabu patrná (graf 1) [2,3,5]. Navzdory tomu došlo k registraci atezolizumabu v této indikaci Evropskou lékovou agenturou (EMA). Důvodem pro toto rozhodnutí jsou pravděpodobně účinnost odpovídající dosavadnímu standardu (v Evropě vinflunin) a přijatelná toxicita atezolizumabu.
Nemalobuněčný plicní karcinom
OAK (GO28915) ‒ multicentrická, mezinárodní randomizovaná studie fáze III srovnávající účinnost a bezpečnost atezolizumabu a docetaxelu u pacientů s lokálně pokročilým nebo metastatickým NSCLC, u nichž došlo k progresi během léčby založené na platině nebo po ukončení této terapie.
Celkem bylo do klinického sledování zařazeno 1 225 pacientů. Randomizace do podskupin byla provedena na základě exprese PD L1, histologie a počtu linií předchozí léčby. Primárním cílovým ukazatelem bylo stanoveno OS.
Prodloužení OS bylo pozorováno
napříč téměř všemi skupinami léčených atezolizumabem, bez
ohledu na míru exprese PD L1 (medián OS 13,8 měsíce vs.
9,6 měsíce) (graf 2).
Příznivý efekt léčby byl prokázán i u pacientů
s mozkovými metastázami. Jedinou skupinou, v níž nebyl
prokázán vliv na OS, byli jedinci 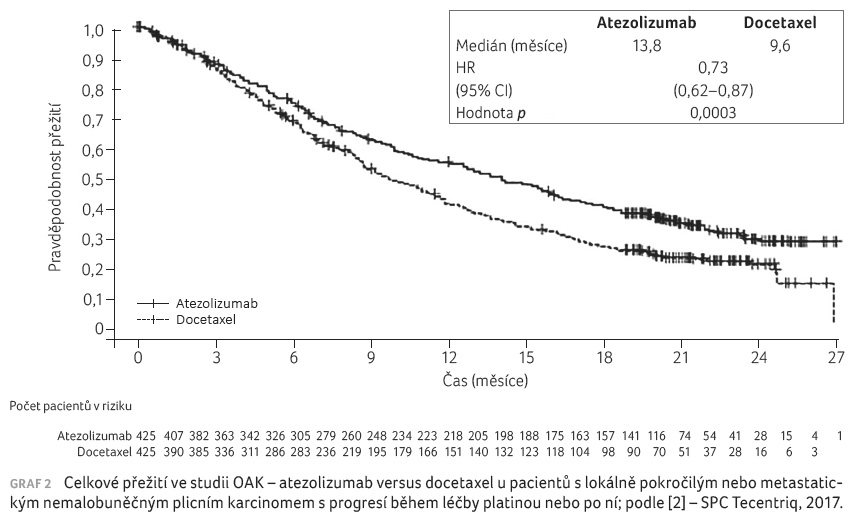 s prokázanou mutací
EGFR [2,3,6].
s prokázanou mutací
EGFR [2,3,6].
POPLAR (GO28753) ‒ multicentrická, mezinárodní randomizovaná studie fáze II s pacienty s lokálně pokročilým nebo metastatickým NSCLC, kteří progredovali během předchozí léčby chemoterapií obsahující platinu.
Primárním cílovým ukazatelem bylo OS, celkem bylo do studie zařazeno 287 pacientů rozdělených v poměru 1 : 1 k léčbě atezolizumabem versus docetaxelem. Randomizace proběhla na základě exprese PD L1, předchozí chemoterapie a histologie. Bylo prokázáno signifikantní prodloužení OS u pacientů léčených atezolizumabem (12,6 měsíce) oproti pacientům, kteří byli léčeni docetaxelem (9,7 měsíce). Nejčastějšími nežádoucími účinky při terapii atezolizumabem pro NSCLC byly v klinickém sledování únava, nechutenství, dyspnoe, kašel, nauzea a muskuloskeletální bolesti [2,3,7].
Prediktivní markery pro antagonisty dráhy PD 1
S příchodem nových léků jsou hledány nové cesty, jak detekovat pacienty, kteří by měli z dané léčby největší přínos. V případě imunoterapie a léčby antagonisty PD L1 se jako možná cesta jeví stanovení exprese PD L1 v nádorové tkáni a v tumor infiltrujících imunitních buňkách. V již uskutečněných studiích bylo prokázáno, že největšího účinku léčby bylo dosaženo u pacientů s největší pozitivitou exprese PD L1. Na základě těchto informací americký Úřad pro kontrolu potravin a léčiv (FDA) schválil test Ventana PD L1 (SP142) Assay k detekci míry exprese PD-L1 na tumor infiltrujících buňkách imunitního systému [6,7].
Probíhající studie s atezolizumabem
Studie fáze III s atezolizumabem probíhají kromě výše zmíněných indikací u kolorektálního karcinomu (v kombinaci s inhibitorem MEK cobimetinibem), u melanomu (v kombinaci s inhibitory MEK a BRAF), u kastračně refrakterního karcinomu prostaty (v kombinaci s inhibitory androgenového receptoru), u ovariálního karcinomu (v kombinaci s chemoterapií a antiangiogenní léčbou) a u malobuněčného plicního karcinomu (v kombinaci s chemoterapií). Dále probíhá více než 40 studií fází I a II u různých solidních a hematologických malignit.
Závěr
Atezolizumab představuje novou možnost léčby pacientů s NSCLC a metastatickým uroteliálním karcinomem. V současné době probíhá celá řada studií rovněž u dalších typů karcinomů, u nichž by mohla imunoterapie atezolizumabem (zpravidla v kombinacích s chemoterapií nebo s jinými cílenými léky) najít své místo. V budoucnu bude jistě nutné zohlednit finanční náklady terapie ‒ tedy najít optimální sekvenci dostupných typů léčby a identifikovat pacienty, kteří by z dané léčby měli největší prospěch.
Seznam použité literatury
- [1] McDermott DF, Atkins MB. PD‑1 as a potential target in cancer therapy. Cancer Medicine 2013; 2: 662‒673.
- [2] SPC Tecentriq (atezolizumab). European Medicines Agency, 2017. Dostupné na: http://www.ema.europa.eu/docs/en_GB/docu-
- [3] Tecentriq. Federal Drugs Agency. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/761041lbl.pdf [navštíveno 1. 12. 2017]
- [4] Rosenberg JE, Hoffman‑Censits J, Powles T, et al. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum‑based chemotherapy: a single‑arm, multicentre, phase 2 trial. Lancet 2016; 387: 1909‒1920.
- [5] Powles T, et al. IMvigor211: A Phase III Randomized Study Examining Atezolizumab Versus Chemotherapy for Platinum‑Treated Advanced Urothelial Carcinoma. Presented at the Second Special Conference of the European Association for Cancer Research (EACR), the American Association for Cancer Research (AACR) and the Italian Cancer Society (SIC), in Florence, Italy, 2017.
- [6] Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non‑small‑cell lung cancer (OAK): a phase 3, open‑label, multicentre randomised controlled trial. Lancet 2017; 389: 255‒265.
- [7] Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non‑small‑cell lung cancer (POPLAR): a multicentre, open‑label, phase 2 randomised controlled trial. Lancet 2016; 387: 1837‒1846.