Bexaroten
Bexaroten je syntetický retinoid, který selektivně aktivuje RXR receptory. Ačkoli přesný antitumorózní efekt není znám, perorálně podávaný bexaroten je podle provedených studií účinný a bezpečný v léčbě všech klinických stadií kožního T lymfomu. V současné době je bexaroten indikován k léčbě kožních projevů u pacientů v pokročilých stadiích kožního T lymfomu, který neodpovídá na nejméně jednu systémovou terapii.
Farmakologická skupina
Jiná cytostatika, retinoid, derivát vitaminu A, selektivní aktivátor retinových receptorů X (RXR) [1].
Fyzikální a chemické vlastnosti
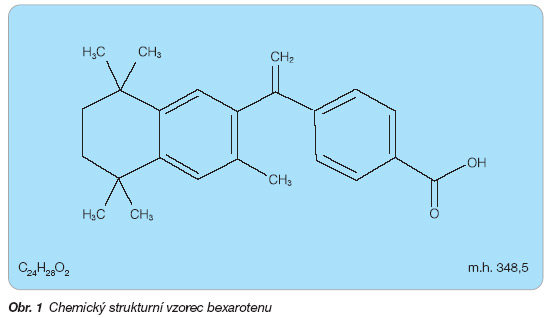
Chemicky je bexaroten 4-/1-(5,6,7,8-tetrahydro-3,5,5,8,8-pentamethyl-2-naph-thalenyl)ethenyl/benzoová kyselina (obr. 1) [2].
Sumární vzorec: C24H28O2
Molekulová hmotnost: 348,48
Bexaroten je bílý prášek nerozpustný ve vodě, slabě rozpustný v rostlinném oleji a v ethanolu [3].
Mechanismus účinku, farmakodynamika
Bexaroten je syntetická sloučenina reprezentující novou podskupinu retinoidů, která selektivně aktivuje retinové receptory X (RXR) [4]. Aktivací receptorů dochází k regulaci buněčné diferenciace a proliferace, ovlivněna je apoptóza, dochází ke změnám v genové expresi u normálních, premaligních a maligních buněk.
Antitumorózní efekt byl prokázán při léčbě všech stadií kožního T lymfomu, přesný mechanismus působení zůstává nejasný [5]. Bexaroten je indikován k léčbě pokročilých stadií kožního lymfomu u pacientů, u nichž toto onemocnění neodpovídá na nejméně jeden typ jiné systémové terapie.
Bexaroten je syntetická sloučenina, která se selektivně váže na a-, b- a g-receptory RXR a aktivuje je. Po aktivaci fungují tyto receptory jako transkripční faktory, které regulují různé procesy, ovlivňují buněčnou diferenciaci a proliferaci, apoptózu a zvyšují citlivost na inzulin [6, 7].
Selektivita bexarotenu k RXR podskupině retinových receptorů podporuje unikátní biologické vlastnosti: terapeutickou specificitu a snížení toxicity ve srovnání s ostatními neselektivními nebo RAR (receptory retinové kyseliny) selektivními retinoidy [1, 8]. Spektrum účinků bexarotenu je oproti klasickým retinoidům rozmanitější a širší. Tato vlastnost vyplývá ze schopnosti RXR vytvářet heterodimery s různými partnerskými receptory, které hrají důležitou roli ve fyziologii a funkci buněk [1–3].
In vitro inhibuje bexaroten růst nádorových buněčných linií pocházejících z hematopoetických a skvamózních buněk a vykazuje antitumorózní aktivitu proti estrogenovým receptorům a buněčným liniím karcinomu prsu [9, 10]. In vivo způsobuje u některých živočišných modelů regresi nádoru a u jiných zabraňuje indukci nádoru [11–13]. Přesný mechanismus působení u kožního T lymfomu není znám, účinky jsou dány aktivací retinových receptorů, jejímž prostřednictvím dochází k potlačení abnormální diferenciace nebo nadměrné proliferace [2, 3].
Farmakokinetické vlastnosti
Bexaroten se vstřebává po perorálním podání do systémové cirkulace a má relativně krátký poločas. Hodnoty poločasu celkové eliminace se pohybovaly obecně mezi jednou a třemi hodinami. Hladina v séru po jednorázové dávce v rozmezí 18–800 mg/m2 byla detekována s velkými individuálními rozdíly ve sledovaných parametrech. Farmakokinetika byla lineární do dávky 650 mg/m2 [2, 14].
Po opakovaném podání jedné dávky denně byly u některých pacientů při úrovni dávek > 230 mg/m2 hodnoty cmax a AUC nižší než příslušné hodnoty u jednorázové dávky. Nebyly pozorovány žádné známky dlouhodobé akumulace. Při dodržení doporučené počáteční denní dávky (300 mg/m2) byly farmakokinetické parametry u jednorázové dávky a u opakované denní dávky podobné [2, 3] (tab. 1).
Metabolismus bexarotenu probíhá oxidativní cestou, další metabolickou drahou je glukuronidace. Bexaroten se ve vysoké míře váže na plazmatické proteiny (> 99 %). Mezi jeho metabolity v plazmě patří 6- a 7-oxo-bexaroten a 6- a 7-hydroxy-bexaroten a bexaroten acyl glukuronid. Studie in vitro naznačují, že hlavním izoenzymem cytochromu P-450, který je odpovědný za tvorbu oxidativních metabolitů, je cytochrom P-450 3A4. Z vazebných studií metabolitů in vitro, z jejich profilu aktivace retinoidního receptoru a z poměrného zastoupení jednotlivých metabolitů v plazmě vyplývá, že tyto metabolity mají malý vliv na farmakologický profil aktivace retinoidního receptoru bexarotenem; není jasné, jak a zda se podílejí na účinnosti a bezpečnostním profilu bexarotenu [2, 15, 16].
Bexaroten ani jeho metabolity nebyly detekovány v moči, stanovená clearance ledvin pro bexaroten je méně než 1 ml/min. Vylučování ledvinami není významnou dráhou eliminace bexarotenu. Bexaroten je metabolizován primárně hepatobiliární cestou [3].
Klinické zkušenosti
Byla provedena řada klinických studií, ve kterých byl podáván bexaroten perorálně v různých denních dávkách pacientům s pokročilým nádorovým onemocněním. Jejich cílem bylo zjistit toleranci, bezpečnost, potenciální toxicitu, farmakokinetiku a metabolismus bexarotenu. Druhou oblastí zkoumání bylo stanovit účinky na klinické projevy nádorového onemocnění.
Studie fáze I měla za úkol definovat bezpečnost, toxicitu, farmakokinetiku a metabolický profil bexarotenu u pacientů s pokročilým nádorovým onemocněním. Bylo zařazeno 60 pacientů, kterým byla podávána dávka 5–1000 mg/m2/den. Farmakokinetika byla hodnocena 1. a 15. den. Dávku limitující toxicita nebyla zaznamenána do dávky 500 mg/m2/den. V závěru této studie byl bexaroten označen za minimálně toxický, s lepší farmakokinetikou než jiné retinoidy a pro studie fáze II byla doporučena dávka 500 mg/m2/den [14, 17, 18]. Dvě multicentrické otevřené klinické studie fáze II probíhaly u pacientů s perzistentním nebo na léčbu neodpovídajícím raným stadiem kožního T-buněčného lymfomu (CTCL) nebo pokročilou refrakterní formou CTCL [19, 20]. Celkem bylo zařazeno 152 pacientů (58 počáteční stadium, 94 pokročilé stadium). Úkolem bylo stanovit bezpečnost, toleranci a antitumorózní účinky bexarotenu. První skupina pacientů s raným stadiem CTCL byla rozdělena na dvě podskupiny s rozdílným dávkováním: 6,5 mg/m2/den a 650 mg/m2/den – tato dávka byla později modifikována na 300 mg/m2/den. V podskupině s nízkým dávkováním bylo možno dávku zvýšit po 8 týdnech, pokud byla pozorována progrese onemocnění, a po 16 týdnech, pokud nebyla zaznamenána klinická odpověď. V podskupině s vysokým dávkováním bylo možno dávku snížit v případě toxicity. Lék byl podáván denně 16 týdnů a déle. Odpověď na léčbu byla pozorována u 3 pacientů z 15 s iniciální dávkou 6,5 mg/m2/den, u 15 pacientů z 28 s dávkou 300 mg/m2/den a u 10 pacientů z 15 s dávkou vyšší než 300 mg/m2/den. U 8 pacientů z 11 převedených z dávky 6,5 mg/m2/den na vyšší byla zaznamenána následně dobrá klinická odpověď. Nejčastější vedlejší účinky hypertriglyceridémie a hypotyreóza vyžadovaly monitorování, ale při podávání příslušné medikace byly stabilizované a reverzibilní. Skupina 94 pacientů s pokročilým CTCL byla rozdělena na 2 podskupiny, 56 pacientů dostávalo iniciální dávku 300 mg/m2/den a u 38 pacientů byla léčba zahajována vyšší dávkou. Klinicky částečná a kompletní odpověď byla pozorována u 25 pacientů z 56 s dávkou 300 mg/m2/den a u 21 pacientů z 38 s dávkováním vyšším. Nejčastější vedlejší účinky zahrnovaly hypertriglyceridémii (zřídka asociovanou s pankreatitidou), hypercholesterolémii, hypotyreózu a bolesti hlavy.
Hodnocení antitumorózních účinků nemá široce přijímaná standardizovaná či uniformní kritéria. U těchto studií bylo posouzení účinnosti prováděno podle globálního úsudku lékaře a podle skóre pěti klinických příznaků (plocha postiženého povrchu, erytém, elevace plaků nebo tumorózních ložisek, šupení, hypo/hyperpigmentace) [3].
Další klinické studie byly zaměřeny na bezpečnostní profil bexarotenu. Bexaroten má jiné vedlejší účinky než ostatní léky ze skupiny retinoidů díky své selektivitě k RXR receptorům. Má méně nepříznivých účinků na sliznice, kůži a nehty, nezpůsobuje bolesti kloubů a svalů [21–23]. Bezpečnost bexarotenu byla v Evropě hodnocena v klinické studii u 193 pacientů s CTCL, kterým byl bexaroten podáván 118 týdnů. Další studie probíhaly u 420 pacientů s jiným nádorovým onemocněním. U 109 pacientů s CTCL léčených iniciální dávkou 300 mg/m2/den byly nejčastěji hlášeny tyto nežádoucí účinky: hyperlipidémie (74 %), hypotyreóza (29 %), hypercholesterolémie (28 %), bolesti hlavy (27 %), leukopenie (20 %), pruritus (20 %), astenie (19 %), prchavé erytémy (16 %), exfoliativní dermatitida (15 %) a bolesti (12 %). U pacientů s dávkováním vyšším než 300 mg/m2/den bylo hlášeno častěji a více nežádoucích účinků.
Zařazení do současné palety léčiv
Léčba pokročilých stadií CTCL by měla být vedena na specializovaných pracovištích. Pro volbu léčebného postupu je zásadní rozsah nemoci. Při postižení omezeném na kůži je základem lokální léčba, případně kombinace lokální a celkové léčby. Při pokročilém onemocnění je hlavní celková forma léčby. U rozsáhlejších infiltrátů CTCL je první metodou volby fotochemoterapie – PUVA (kombinace psoralenu a ultrafialového UVA záření). U tumorózních infiltrátů již PUVA terapie selhává, může být prospěšná v kombinaci s rekombinantními interferony a retinoidy (rePUVA). Variantou léčby je fotoferéza-extrakorporální fotochemoterapie. Další metodou volby je radioterapie – ozáření celého těla s nízkou energií (elektronová sprcha).
Pokud selžou výše uvedené postupy, je další terapeutickou možností právě podávání retinoidů – isotretinoin, etretinát, bexaroten v monoterapii.
Systémová chemoterapie je indikována jednoznačně u nemocných s prokázanou infiltrací uzlin a viscerálních orgánů, u pacientů s postižením omezeným pouze na kůži se před jejím nasazením snažíme vyčerpat jiné způsoby terapie. V rámci systémové terapie se může začít s methotrexátem, vysokými nárazovými dávkami citrovorumfaktoru nebo s prolongovanou terapií nízkými dávkami; zpočátku mají dobrý účinek glukokortikoidy ve středním dávkování. Z chemoterapeutických schémat se používá např. COPP: cyklofosfamid, vinkristin, prokarbazin, prednison.
Indikace
Bexaroten patří do skupiny retinoidů, derivátů vitaminu A. Bexaroten je indikován k léčbě kožních projevů u pacientů s pokročilým stadiem kožního T-buněčného lymfomu rezistentního vůči nejméně jedné celkové léčbě.
Kontraindikace
Podávání bexarotenu je kontraindikováno při známé hypersenzitivitě na bexaroten nebo na kteroukoli pomocnou látku přípravku. Nesmí být podáván v době těhotenství a laktace, u žen ve fertilním věku, pokud nepoužívají účinnou antikoncepci. Mezi další kontraindikace patří: pankreatitida v anamnéze, nekontrolovaná hypercholesterolémie a triglyceridémie, hypervitaminóza A, nekontrolované onemocnění štítné žlázy, jaterní insuficience a probíhající celková infekce.
Bexaroten je nutno s opatrností používat u pacientů se známou přecitlivělostí na retinoidy, i když žádné klinické případy zkřížené reaktivity nebyly zaznamenány. Pacienti užívající bexaroten nesmějí darovat krev k transfuzi [3].
Nežádoucí účinky
Bezpečnost bexarotenu byla zkoumána v klinických studiích u pacientů s CTCL, kteří užívali přípravek až 118 týdnů, a u onkologických pacientů s jiným onemocněním než CTCL. Mezi nejčastější hlášené nežádoucí účinky patří hyperlipidémie a hypercholesterolémie, hypotyreóza, bolesti hlavy, leukopenie, pruritus, slabost, kožní exantémy. Při vyšším dávkování byly zaznamenány další nežádoucí reakce: anémie, eozinofilie, bilirubinémie, deprese, abnormální vidění, katarakta, průjem, nechutenství, pankreatitida, gastrointestinální poruchy, alopecie, myastenie, změny hormonálních hladin, bolesti v zádech, zimnice a horečka. Byla zaznamenána závislost četnosti nežádoucích účinků na dávce, vyšší výskyt při dávkách > 300 mg/m2/den. Všeobecně vymizely bez následků po snížení dávky nebo po přerušení léčby [14, 17, 19, 20].
Mezi 810 pacienty léčenými bexarotenem, a to včetně těch, jejichž onemocnění nebylo maligní, byly zaznamenány tři vážné nežádoucí reakce s fatálními následky (akutní pankreatitida, subdurální hematom a selhání jater). Z nich bylo selhání jater následně určeno jako nesouvisející s podáváním bexarotenu.
Bexaroten má odlišný profil nežádoucích reakcí než jiné perorální retinoidy, které nejsou selektivní k RXR skupině retinových receptorů [1]. Díky této primární vazbě na RXR má bexaroten menší tendenci vyvolávat toxické účinky na sliznice, pokožku, nehty a vlasy a způsobovat bolesti kloubů a svalů, což jsou časté nežádoucí účinky hlášené u přípravků s vazbou na receptory retinové kyseliny [24–26].
Lékové interakce
Žádné formální studie hodnotící lékové interakce s bexarotenem nebyly provedeny. Na základě oxidativního metabolismu bexarotenu cytochromem P-450 3A4 je možno teoreticky usuzovat, že jeho společné podávání s jinými substráty cytochromu P-450 3A4 (ketokonazol, itrakonazol, inhibitory proteáz, klarithromycin, erythromycin) může vést ke zvýšení hladiny bexarotenu v plazmě. Předpokládá se, že společné podávání s induktory cytochromu P-450 3A4 (rifampicin, fenytoin, dexametason, fenobarbital) může způsobit snížení hladiny bexarotenu v plazmě. Na základě populační analýzy koncentrací bexarotenu u pacientů s CTCL se nedoporučuje současné podávání bexarotenu a gemfibrozilu, protože bylo zjištěno podstatné zvýšení koncentrace bexarotenu v plazmě při této kombinaci. Mechanismus této interakce není znám. Koncentrace bexarotenu nebyly za podobných podmínek ovlivněny současným podáváním atorvastatinu a levotyroxinu.
Vzhledem k tomu, že bexaroten je schopen indukovat cytochrom P-450 3A4, může jeho opakované podávání vyústit v autoindukci jeho vlastního metabolismu. Předpokládá se, že vyšší dávkování (> 300 mg/m2/den) může zvýšit rychlost metabolismu dalších látek metabolizovaných cytochromem P-450 3A4, a snížit tedy jejich koncentraci v plazmě (tamoxifen). Bexaroten může tak snižovat účinek perorálních kontraceptiv [3, 27].
Dávkování
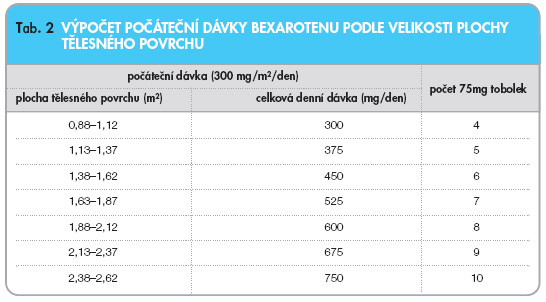
Léčbu bexarotenem může začít a řídit pouze lékař se zkušenostmi s léčbou pacientů s CTCL. Doporučená počáteční dávka je 300 mg/m2/den (tab. 2).
Bexaroten se podává jako jedna denní dávka s jídlem. Dávku je možno upravit při známkách toxicity, může být snížena na 200 mg/m2/den a pak na 100 mg/m2/den nebo lze léčbu dočasně přerušit. Dávku je možno znovu zvýšit po zvládnutí toxických příznaků. Při nedostatečné klinické odpovědi na léčbu dávkou 300 mg/m2/den bylo u jednotlivých pacientů zaznamenáno zlepšení stavu po zvýšení dávky při náležitém sledování klinických příznaků. Léčba dávkami vyššími než 650 mg/m2/den nebyla u pacientů s CTCL vyhodnocována. V průběhu klinických studií byl lék podáván až 118 týdnů. Je doporučeno pokračovat v léčbě, dokud je pacientovi prospěšná. Klinická bezpečnost a účinnost nebyla hodnocena u pacientů mladších 18 let, proto nesmí být tento lék u těchto pacientů používán, dokud nebudou k dispozici příslušná data [2, 3]. Nebyly pozorovány podstatné rozdíly v bezpečnosti mezi pacienty sedmdesátiletými a staršími a mezi mladšími, nelze však vyloučit vyšší citlivost některých starších jedinců na bexaroten. Starším pacientům se má podávat standardní dávka.
Balení
Viz tab. 3.
Obr. 1 Chemický strukturní vzorec bexarotenu
Léčivé přípravky obsahující bexaroten aktuálně dostupné v ČR
Seznam použité literatury
- [1] Boehm MF, Zhang L, Badea BA, et al. Synthesis and structure-activity relationship of novel retinoid X receptor-selective retinoids. J Med Chem 1994; 37: 2930–2941.
- [2] Targretin cps. Clinical monograph, 2004.
- [3] Targretin R Capsules. Summary of product characteristics.
- [4] Chambon P. The molecular and genetic dissection of retinoid signaling pathway. Rec Prog Horm Res 1995; 50: 317–332.
- [5] Sporn MB, Roberts AB. Role of retinoids in differentiation and carcinogenesis. JNCl 1984; 73: 1381–1389.
- [6] Boehm MF, Heyman RA, Nagpal S. A new generation of retinoid drugs for treatment of dermatological diseases. Emerg Drugs 1997; 2: 237–303.
- [7] Mukherjee R, Davies PJA, Crombie DL, et al. Sensitization of diabetic and obese mice to insulin by retinoid X receptor agonists. Nature 1997; 386: 407–410.
- [8] Heyman RA, Mangelsdorf DJ, Dyck JA, et al. 9-cis retinoic acid is a high affinity lignad for the retinoid X receptor. Cell 1990; 68: 397–406.
- [9] Lotan R. Effects of vitamin A and its analogs (retinoids) on normal and neoplastic cells. Biochem Biophys Acta 1980; 605: 33–91.
- [10] Mayer H, Bollag W, Hanni R, Ruegg R. Retinoids, a new class of compounds with profylactic and therapeutic activities in oncology and dermatology. Experientia 1978; 34: 1105–1119.
- [11] Bollag W. Retinoids and cancer. Cancer Chemother Pharmacol 1979; 3: 207–215.
- [12] Saffoti U, Montesano R, Sellakumar AR, Borg SA. Experimental cancer of the lung. Inhibition by vitamin A of the induction of tracheobronchial squamous metaplasia and squamous cell tumors. Cancer 1967; 20: 857–864.
- [13] Sporn MB, Dunlop NM, Newton DL, Smith JM. Prevention of chemical carcinogenesis by vitamin A and its synthetic analogs (retinoids). Fed Proc 1976; 35: 1332–1338.
- [14] Rizvi NA, Marshall JL, Dahut W, et al. A phase I study of LGD1069 in adults with advanced cancer. Clin Can Res 1999; 5: 1658–1664.
- [15] Napgal S, Athanikar J, Chandraratna RA, et al. Separation of transactivation and AP1 antagonism functions of retinoic acid receptor alpha. J Biol Chem 1995; 270: 923–927.
- [16] Boehm MF, Zhang L, Zhi L, et al. Design and synthesis of potent retinoid X receptor selective ligands that induce apoptosis in leukemia cells. J Med Chem 1995; 38: 3146–3155.
- [17] Miller VA, Benedetti FM, Riga JR, et al. Initial trial of a selective retinoid X receptor ligand, LGD1069. J CLIN Oncol 1997; 15: 790–795.
- [18] Papadimitrakopoulou V, Khuri FR, Lippman SM, et al. Phase I/II evaluation of Targretin (LGD1969) a novel, RXR-specific retinoid, in patiens with recurrents squamous cell carcinoma of the head and neck. In: Proceeding of ASCO 1998, abstrakt No 1512.
- [19] Duvic M, Martin AG, Kim Y, et al. Phase 2 and 3 clinical trial of oral bexarotene (Targretin R capsules) for the treatment of refractory or persistent early-stage cutaneous T-cell lymphoma. Arch Dermatol 2001; 137: 581–593.
- [20] Duvic M, Hymes K, Heald P, et al. Bexarotene is effective and safe for treatment of refractory advanced-stage cutaneous T-cell lymphoma: multinational Phase II-III trial results. J Clin Oncol 2001; 19: 2456–2471.
- [21] Herman SI, Gopal J, Haugen BR, et al. Central hypothyroidism associated with retinoid X receptor-selective ligands. N Engl J Med 1999; 340: 902–908.
- [22] Vu-Dac N, Schoonjans K, Kodykh V, et al. Retinoids increase human apolipoprotein A-II expression through activation the retinoid X receptor but not the retinoic acid receptor. Mol Cell Biol 1996; 16: 3350–3360.
- [23] Vu-Dac N, Garvois P, Torra IP, et al. Retinoids increase human apo C-III expresion at the transcriptional level via the retinoid X receptor: contribution to the hypertriglyceridemic action of retinoids. J Clin Invest 1998; 102: 625–632.
- [24] Kessler JF, Jones SE, Levie N, et al. Isotretinoin and cutaneous helper T-cell lymphoma (mycosis fungoides). Arch Dermatol 1987; 123: 201–204.
- [25] Hoting E, Meissner K. Arotinoid ethylester: Effectiveness in refractory cutaneous T-cell lymphomas. Cancer 1988; 62: 1044–1048.
- [26] Kuzel TM, Roenigk HH, Rosen ST. Mycosis fungoides and Sézary syndrome: A review of pathogenesis, diagnosis and therapy. J Clin Oncol 1991; 9: 1298–1313.
- [27] Zackheim HS. Treatment of cutaneous T cell lymphoma with retinoids. Dermatol Ther 1998; 7: 15–20.