Bezpečnost a účinnost léčby chronické virové hepatitidy typu C fixní kombinací sofosbuviru a velpatasviru (Epclusa®)
Souhrn:
Formou přehledového článku je proveden rozbor základních farmakologických vlastností, léčebných výsledků i indikací nového přípravku Epclusa. Jedná se o fixní kombinaci inhibitoru kofaktoru polymerázy (NS5A oblast virového genomu) velpatasviru a inhibitoru RNA dependentní RNA polymerázy sofosbuviru v jedné tabletě. Přípravek představuje první kombinaci virostatik účinnou proti všem základním genotypům viru hepatitidy C, jeho indikační pole je proto velmi široké. Výhodou podání přípravku je jeho vysoká bezpečnost, téměř 100% účinnost, a především jednoduchost podání z pohledu pacienta.
Key words: hepatitis C virus – sofosbuvir – velpatasvir – sustained virological response.
Summary:
This is a review of basic pharmacological properties, therapeutical effects, and indications of a new preparation Epclusa. It contains both polymerase cofactor inhibitor (NS5A region of viral genome) velpatasvir and RNA-dependent RNA polymerase inhibitor sofosbuvir in a fixed-combination single tablet. This preparation is the first to be effective against all basic genotypes of hepatitis C virus, thus having a very wide spectrum of indications. Advantages of this preparation include its high safety, almost 100% effectiveness, and especially the ease of use for the patients.
Úvod
Stávající moderní protivirová léčba virové hepatitidy typu C je založena na podání kombinace alespoň dvou přímo působících virostatik (directly acting antivirals, DAA). Přímo působící virostatika jsou nízkomolekulární látky, které přímo inhibují aktivitu jednoho ze tří klíčových enzymů replikačního cyklu viru hepatitidy C (HCV). Jde o tyto enzymy:
- iniciální proteáza, produkt NS3/4 oblasti virového genomu,
- kofaktor polymerázy, produkt NS5A oblasti virového genomu,
- RNA dependentní RNA polymeráza (RdRp), produkt NS5B oblasti virového genomu.
V současné době existuje celá řada látek řazených do skupiny DAA. Obvyklé dělení celé skupiny je podle cílové struktury (inhibitory NS3/4 proteázy, inhibitory NS5A, inhibitory polymerázy NS5B). V této souvislosti se mluví o „třídách“ virostatik. Ve třídě inhibitorů polymerázy NS5B ještě rozeznáváme látky charakteru nukleotidových analog a látky jiné struktury (tzv. non nukleotidové inhibitory). Mezi jednotlivými zástupci všech skupin DAA existují poměrně zásadní rozdíly v jejich účinnosti inhibice replikace HCV, v bezpečnosti jejich podání, v riziku vzniku variant viru způsobujících rezistenci apod. Většinu nežádoucích účinků jejich podání, především pak vznik zmíněných rezistentních variant viru, lze minimalizovat kombinací vždy alespoň dvou látek z různých tříd DAA.
Jedním z teoretických cílů, které byly vytyčeny v minulosti při vývoji jednotlivých virostatik, byla snaha nalézt virostatikum, či spíše kombinaci dvou či více virostatik, která by měla tzv. pangenotypovou účinnost, tj. virostatikum či jejich kombinace by efektivně inhibovala replikaci všech základních genotypů HCV (HCV GT 1–6). Až do současnosti žádné takové virostatikum nebylo dostupné. První kombinací, která tuto pangenotypovou účinnost vykázala v klinickém zkoušení a která se v brzké době dostane na evropský trh, je kombinace sofosbuviru a velpatasviru v přípravku Epclusa.
Epclusa
Epclusa (výrobce Gilead Sciences, USA) je fixní kombinace sofosbuviru 400 mg (inhibitor RdRp, produktu NS5B) a velpatasviru 100 mg (inhibitor kofaktoru polymerázy, produktu NS5A) v jedné tabletě [1]. Standardní dávkování ve všech dále diskutovaných režimech a indikacích představuje jedna tableta podávaná po 24 hodinách.
Farmakologická charakteristika sofosbuviru a velpatasviru
Sofosbuvir (SOF, viz obr. 1) je proléčivo, které prodělává intracelulární trifosforylaci, jejíž produkt je pomocí RdRp inkorporován do HCV RNA. Mechanismem účinku je tzv. ukončení řetězce, kdy po navázání aktivní látky (v našem případě SOF) nemůže pokračovat další řetězení dceřiné virové RNA. Sofosbuvir je účinný u všech hlavních nejrozšířenějších genotypů HCV (1–6), nei![Obr. 1 Strukturní vzorce sofosbuviru a velpatasviru; podle [6–10] – Jacobson, et al., 2013; Lawitz, et al., 2013; Cheng, et al., 2013; German, et al., 2013; Lawitz, et al., 2013.](https://www.remedia.cz/photo-a-30919---.jpg) nterferuje se syntézou lidské DNA či RNA, neinhibuje ani mitochondriální RNA polymerázy. Látka není metabolizována systémem cytochromu P450, potenciál lékových interakcí je tedy mnohem omezenější než u virostatik nižších generací. Sofosbuvir je substrátem lékového transportéru glykoproteinu P (P gp) a proteinu rezistence karcinomu prsu (BCRP), jeho aktivní metabolit však nikoliv. Potentní induktory P gp ve střevě (rifampicin, carbamazepin a fenytoin) snižují plazmatickou koncentraci SOF, snižuje se tedy rovněž intracelulární přítomnost aktivního metabolitu a dochází k poklesu protivirové účinnosti sofosbuviru. Naopak inhibitory P gp/BCRP zvyšují plazmatickou koncentraci SOF, avšak nikoliv aktivního metabolitu, takže SOF může být s inhibitory podáván současně.
nterferuje se syntézou lidské DNA či RNA, neinhibuje ani mitochondriální RNA polymerázy. Látka není metabolizována systémem cytochromu P450, potenciál lékových interakcí je tedy mnohem omezenější než u virostatik nižších generací. Sofosbuvir je substrátem lékového transportéru glykoproteinu P (P gp) a proteinu rezistence karcinomu prsu (BCRP), jeho aktivní metabolit však nikoliv. Potentní induktory P gp ve střevě (rifampicin, carbamazepin a fenytoin) snižují plazmatickou koncentraci SOF, snižuje se tedy rovněž intracelulární přítomnost aktivního metabolitu a dochází k poklesu protivirové účinnosti sofosbuviru. Naopak inhibitory P gp/BCRP zvyšují plazmatickou koncentraci SOF, avšak nikoliv aktivního metabolitu, takže SOF může být s inhibitory podáván současně.
Sofosbuvir je z velké míry metabolizován v játrech na farmakologicky aktivní trifosfátový nukleosidový analog GS 461203. Metabolická aktivační dráha zahrnuje sekvenční hydrolýzu karboxylesterové skupiny katalyzovanou lidským katepsinem A (CatA) nebo karboxylesterázou 1 (CES1) a štěpení fosforamidátu proteinem HINT1 (Histidine Triad Nucleotide binding protein 1), po nichž následuje fosforylace dráhou pyrimidinové nukleotidové biosyntézy. Defosforylace vede k tvorbě nukleosidového metabolitu GS 331007, který nemůže být účinně refosforylován a nemá anti HCV aktivitu in vitro. Sofosbuvir a GS 331007 nejsou substráty ani inhibitory enzymu UGT1A1 nebo enzymů CYP3A4, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 a CYP2D6. Po jednorázové perorální dávce 400 mg [14C] sofosbuviru představoval GS 331007 přibližně více než 90 % celkové systémové expozice.
Velpatasvir (VEL, viz obr. 1) je inhibitorem lékového transportéru P gp a BCRP a transportních molekul v bazolaterální membráně hepatocytu (OATP) 1B1 a OATP1B3. Velpatasvir je substrátem CYP2B6, CYP2C8 a CYP3A4 s pomalým metabolismem. Po jedné dávce 100 mg velpatasviru značeného izotopem 14C byla většina aktivity (> 98 %) v plazmě tvořena nezměněnou mateřskou látkou. Nezměněný velpatasvir je také hlavní složkou přítomnou ve stolici [1].
Účinnost a bezpečnost léčby chronické infekce HCV přípravkem Epclusa
Velmi rozsáhlá data o účinnosti a bezpečnosti podání kombinace SOF/VEL poskytly studie fáze III s názvy ASTRAL 1 až 4 [2–5]. Jako primární cíl ve všech těchto studiích bylo zvoleno procento pacientů, kteří dosáhli setrvalé virologické odpovědi definované jako negativní sérová HCV RNA metodou PCR v reálném čase ve 12. týdnu po skončení protivirové léčby (sustained virological response, SVR12). Jednotlivé studie se lišily léčenou populací a genotypovým složením léčeného souboru pacientů.
Studie ASTRAL 1![Graf 1 Výsledky studie ASTRAL‑1; celková SVR a SVR podle genotypu HCV; podle [11] – Feld, 2015. HCV – virus hepatitidy C; SVR12 – setrvalá virologická odpověď po dobu 12 týdnů, sustained virological response](https://www.remedia.cz/photo-a-30920---.jpg)
ASTRAL 1 byla multicentrická randomizovaná placebem kontrolovaná studie zkoumající účinnost a bezpečnost podávání kombinace SOF/VEL po dobu 12 týdnů u širokého spektra pacientů s chronickou infekcí HCV vyvolanou všemi šesti základními genotypy (osoby s genotypem 5 nebyly randomizovány, všichni byli zařazeni do léčebné větve) [2]. Do léčebné větve studie bylo zařazeno celkem 624 osob, z toho bylo 19 % pacientů s jaterní cirhózou a 32 % osob bylo již v minulosti léčených. Celkovou účinnost a bezpečnost léčby podle genotypu HCV ukazuje graf 1. Selhání léčby u pacientů s genotypem 1a bylo pozorováno pouze u jednoho pacienta, a to v důsledku relapsu, v ![Graf 2 Výsledky studie ASTRAL‑1; celková SVR a SVR u pacientů s jaterní cirhózou a bez cirhózy spolu s příčinami selhání léčby; podle [11] – Feld, 2015. Úsečky znázorňují 95% CI (confidence interval – interval spolehlivosti). SVR12 – setrvalá virologická odpověď po dobu 12 týdnů, sustained virological response](https://www.remedia.cz/photo-a-30921---.jpg) ostatních případech nešlo o „virologické selhání“. Jediné selhání léčby u genotypu 1b bylo dáno relapsem infekce po skončení léčby. Účinnost léčby a příčiny jejího selhání u pacientů s cirhózou a pacientů bez jaterní cirhózy ukazuje graf 2. Stejný graf znázorňuje i účinnost léčby a příčiny jejího selhání u pacientů dosud neléčených (naivních) a u osob, které již v minulosti léčeny byly. Jako nežádoucí reakce s výskytem přesahujícím 10 % byly hlášeny bolesti hlavy, únava, nazofaryngitida a nauzea.
ostatních případech nešlo o „virologické selhání“. Jediné selhání léčby u genotypu 1b bylo dáno relapsem infekce po skončení léčby. Účinnost léčby a příčiny jejího selhání u pacientů s cirhózou a pacientů bez jaterní cirhózy ukazuje graf 2. Stejný graf znázorňuje i účinnost léčby a příčiny jejího selhání u pacientů dosud neléčených (naivních) a u osob, které již v minulosti léčeny byly. Jako nežádoucí reakce s výskytem přesahujícím 10 % byly hlášeny bolesti hlavy, únava, nazofaryngitida a nauzea.
Studie ASTRAL 2
Cílovou populací ve studii ASTRAL 2 byly osoby infikované genotypem 2 a 3 [3]. Jednalo se o studii fáze III, kde byli pacienti randomizováni k léčbě kombinací SOF/VEL nebo SOF + ribav![Graf 3 Výsledky studie ASTRAL‑2; SVR12 u pacientů s genotypem HCV 3; podle [12,4] – Sulkowski, 2015; Foster, et al., 2015. Úsečky znázorňují 95% CI (confidence interval – interval spolehlivosti). HCV – virus hepatitidy C; RBV – ribavirin; SOF – sofosbuvir; SVR12 – setrvalá virologická odpověď po dobu 12 týdnů, sustained virological response; VEL – velpatasvir](https://www.remedia.cz/photo-a-30922---.jpg) irin (RBV). Zahrnuti byli pacienti s jaterní cirhózou i bez ní, osoby bez předchozí terapie i opakovaně léčené. Výsledky studie u osob infikovaných genotypem HCV 3 (druhý nejčastější v České republice) ukazuje graf 3. Bezpečnost podání kombinace SOF/VEL byla obdobná jako ve studii ASTRAL 1.
irin (RBV). Zahrnuti byli pacienti s jaterní cirhózou i bez ní, osoby bez předchozí terapie i opakovaně léčené. Výsledky studie u osob infikovaných genotypem HCV 3 (druhý nejčastější v České republice) ukazuje graf 3. Bezpečnost podání kombinace SOF/VEL byla obdobná jako ve studii ASTRAL 1.
Studie ASTRAL 3
Studie ASTRAL 3 srovnávala režim SOF/VEL podávaný po dobu 12 týdnů s režimem SOF + RBV podávaným po dobu 24 týdnů u osob s infekcí vyvolanou genotypem 3 [4]. Účinnost a příčiny selhání léčby v jednotlivých skupinách ukazuje graf 4. Je vidět, že nejnižší účinnosti režimu SOF/VEL bylo dosaženo ve skupině opakovaně léčených pacientů s jaterní cirhózou (SVR12 89 %). Všechna úmrtí uvedená v grafu byla zhodnocena jako úmrtí bez vztahu ke studijní medikaci (šlo například o střelné poranění).![Graf 4 Výsledky studie ASTRAL‑3; SVR12 podle přítomnosti cirhózy a historie léčby; podle [4,13] – Foster, et al., 2015; Mangia, 2015. RBV – ribavirin; SOF – sofosbuvir; SVR12 – setrvalá virologická odpověď po dobu 12 týdnů, sustained virological response; VEL – velpatasvir](https://www.remedia.cz/photo-a-30923---.jpg)
Studie ASTRAL 4
Studie ASTRAL 4 je důležitá z několika důvodů [5]. Především ukázala, že kombinace SOF/VEL + RBV po dobu 12 týdnů je účinnější než jiné režimy u pacientů s infekcí HCV vyvolanou jiným genotypem HCV, než je genotyp 1 (non 1 genotypy). U pacientů s dekompenzovanou cirhózou a s non 1 genotypy HCV bylo dosaženo SVR12 v 85–100 % případů. Důležitým poznatkem bylo, že režim s RBV po dobu 12 týdnů je účinnější než režim SOF/VEL bez RBV po dobu 24 týdnů. V tom je rozdíl proti kombinaci sofosbuviru s ledipasvirem (přípravek Harvoni), u kterého je 24týdenní režim bez RBV účinnější než 12týdenní režim s RBV. Nicméně i studie ASTRAL 4 ukázala, že RBV je u pacientů s dekompenzovanou jaterní cirhózou nositelem většiny nežádoucích reakcí. U 37 % osob byla výchozí dávka RBV redukována a u 17 % osob bylo nutno pro nežádoucí reakce léčbu RBV ukončit úplně.
Lékové interakce
Současné podávání kombinace SOF/VEL s léčivými přípravky, které jsou substráty výše zmíněných transportérů, může zvýšit expozici takovým léčivým přípravkům i jejich toxickým účinkům. Nositelem většiny lékových interakcí je VEL, potenciál lékových interakcí SOF je minimální. Z praktického hlediska je třeba upozornit na tyto problematické lékové skupiny či léčiva [1]:
- Současné podávání s inhibitory protonové pumpy se nedoporučuje. Je li současné podávání považováno za nezbytné, kombinaci SOF/VEL je třeba podávat s jídlem a užít ji čtyři hodiny před podáním inhibitoru protonové pumpy v maximálních dávkách odpovídajících 20 mg omeprazolu.
- Současné podání kombinace SOF/VEL a amiodaronu či digoxinu vede ke zvýšení koncentrací a toxicity obou antiarytmik. Proto je třeba během současného podávání těchto léčiv pacienty velmi pečlivě monitorovat.
- Současné podávání kombinace SOF/VEL a dabigatranu zvyšuje riziko krvácivých příhod. Kombinovat přípravek Epclusa s dabigatranem je proto možné, pouze není li jiná alternativa, a to ještě za bezprostředního sledování pacienta.
- Současné podání kombinace SOF/VEL a carbamazepinu, fenobarbitalu a fenytoinu je považováno za kontraindikované.
Léčivé přípravky, které jsou středně silnými induktory střevního P gp (např. oxcarbazepin, modafinil nebo efavirenz), mohou snižovat koncentraci sofosbuviru nebo velpatasviru v plazmě a vést k poklesu terapeutického účinku jejich kombinace. Současné podávání takových léčivých přípravků s přípravkem Epclusa se nedoporučuje. Současné podávání s léčivými přípravky, které inhibují P gp nebo BCRP, může zvýšit plazmatické koncentrace sofosbuviru nebo velpatasviru. Léčivé přípravky, které inhibují OATP, CYP2B6, CYP2C8 nebo CYP3A4, mohou zvyšovat plazmatické koncentrace velpatasviru. Klinicky významné interakce léčivých přípravků s kombinací SOF/VEL zprostředkované inhibitory P gp, BCRP, OATP nebo CYP450 se nepředpokládají.
Rezistence
Riziko vzniku rezistence na konkrétní virostatikum je považováno za jeden ze základních parametrů charakterizujících každé virostatikum. Podkladem rezistence je nejčastěji jednonukleotidový polymorfismus (single nucleotide polymorphism, SNP) vznikající vždy v oblasti virového genomu kódujícího příslušnou cílovou strukturu virostatika. Takový polymorfismus dává vzniknout virovému klonu, který je proti účinku daného virostatika do různé míry rezistentní (jeho replikační aktivita je většinou nižší, než je tomu u divokého viru). O správném názvosloví těchto skutečností se v současné době diskutuje, v dalším textu budeme hovořit o vzniku rezistentních variant viru (resistance-associated variants, RAV). Zaměříme se na klinicky významné RAV, nicméně je třeba vědět, že na úrovni replikonů HCV v buněčných kulturách a ve studiích in vitro je problematických SNP mnohem větší množství [1].
Studie u pacientů bez cirhózy a u pacientů s kompenzovanou cirhózou
V souhrnné analýze pacientů bez jaterní cirhózy nebo pacientů s kompenzovanou jaterní cirhózou, kteří užívali přípravek Epclusa po dobu 12 týdnů ve třech studiích fáze III, splnilo podmínky pro analýzu rezistence v důsledku virologického selhání 12 pacientů (dva s genotypem 1 a deset s genotypem 3). Jeden další pacient s infekcí HCV genotypu 3 měl na začátku reinfekci HCV genotypu 1a během virologického selhání a byl vyřazen z virologické analýzy. U žádného pacienta s infekcí HCV genotypu 2, 4, 5 nebo 6 nedošlo k virologickému selhání. Ze dvou pacientů s genotypem 1 s virologickým selháním měl jeden pacient virus s přítomnou NS5A RAV Y93N a další pacient měl virus s přítomnými NS5A RAV L31I/V a Y93H během virologického selhání. Oba pacienti měli virus při výchozích přítomných NS5A RAV. U dvou pacientů nebyly pozorovány při selhání žádné RAV na NS5B nukleosidový inhibitor (NI). Ve skupině deseti pacientů s genotypem 3 s virologickým selháním byla u všech při selhání pozorována Y93H (šest mělo Y93H po léčbě a čtyři pacienti měli Y93H na začátku léčby i po ní). U deseti pacientů nebyly pozorovány při selhání žádné NS5B NI RAV.
Studie u pacientů s dekompenzovanou cirhózou
V jedné studii fáze III u pacientů s dekompenzovanou jaterní cirhózou, kteří užívali kombinaci SOF/VEL + RBV po dobu 12 týdnů, tři pacienti (jeden s genotypem 1 a dva s genotypem 3) splnili podmínky pro analýzu rezistence v důsledku virologického selhání. U žádného pacienta s infekcí HCV genotypu 2 nebo 4 ve skupině léčené kombinací SOF/VEL + RBV po dobu 12 týdnů nedošlo k virologickému selhání. Jeden pacient s virologickým selháním s HCV genotypu 1 neměl žádné NS5A nebo NS5B RAV během selhání. U jednoho ze dvou pacientů s genotypem 3 s virologickým selháním byl pozorován výskyt NS5A RAV Y93H během selhání. Další pacient měl na začátku studie virus s Y93H a virologické selhání a během selhání se u něj také vyvinuly nízké koncentrace (< 5 %) NS5B NI RAV N142T a E237G.
Farmakokinetická data tohoto pacienta odpovídala nedodržování léčby. V této studii měli dva pacienti léčení kombinací SOF/VEL po dobu 12 nebo 24 týdnů bez ribavirinu přítomnou NS5B S282T nízkých koncentrací (< 5 %) spolu s L159F.
Účinek počáteční přítomnosti variant HCV spojených s rezistencí na výsledek léčby
Studie u pacientů bez cirhózy a u pacientů s kompenzovanou cirhózou
Ve studiích ASTRAL 1, ASTRAL 2 a ASTRAL 3 [2–4] byly provedeny analýzy zjišťující souvislost mezi stávajícími výchozími NS5A RAV a výsledkem léčby u pacientů bez jaterní cirhózy nebo s kompenzovanou jaterní cirhózou. Z celkového počtu 1 035 pacientů léčených kombinací SOF/VEL ve třech klinických studiích fáze III bylo 1 023 pacientů zařazeno do analýzy NS5A RAV; sedm pacientů bylo vyřazeno, protože ani nedosáhli trvalé virologické odpovědi (SVR12), ani u nich nedošlo k virologickému selhání, a pět dalších pacientů bylo vyřazeno, protože se nepodařilo genové sekvenování NS5A. V souhrnné analýze studií fáze III mělo 380/1 023 (37 %) pacientů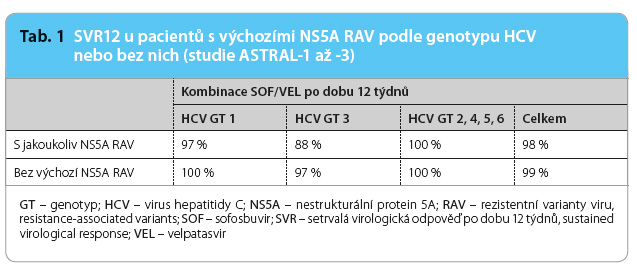 výchozí NS5A RAV. Pacienti s infekcí HCV genotypu 2, 4 a 6 měli vyšší prevalenci NS5A RAV (70 %, 63 %, resp. 52 %) v porovnání s pacienty s infekcí HCV genotypu 1 (23 %), genotypu 3 (16 %) a genotypu 5 (18 %). Výchozí RAV neměly žádný dopad na četnosti SVR12 u pacientů infikovaných HCV genotypu 1, 2, 4, 5 a 6 (viz tab. 1). Pacienti infikovaní genotypem 3 s NS5A RAV Y93H na začátku studie měli nižší četnost SVR12 než pacienti bez Y93H po léčbě kombinací SOF/VEL po dobu 12 týdnů. Ve studii ASTRAL 3 byla Y93H RAV detekována při výchozím stavu u 9 % pacientů léčených kombinací SOF/VEL.
výchozí NS5A RAV. Pacienti s infekcí HCV genotypu 2, 4 a 6 měli vyšší prevalenci NS5A RAV (70 %, 63 %, resp. 52 %) v porovnání s pacienty s infekcí HCV genotypu 1 (23 %), genotypu 3 (16 %) a genotypu 5 (18 %). Výchozí RAV neměly žádný dopad na četnosti SVR12 u pacientů infikovaných HCV genotypu 1, 2, 4, 5 a 6 (viz tab. 1). Pacienti infikovaní genotypem 3 s NS5A RAV Y93H na začátku studie měli nižší četnost SVR12 než pacienti bez Y93H po léčbě kombinací SOF/VEL po dobu 12 týdnů. Ve studii ASTRAL 3 byla Y93H RAV detekována při výchozím stavu u 9 % pacientů léčených kombinací SOF/VEL.
Studie u pacientů s dekompenzovanou cirhózou (třída B dle Childa–Pugha–Turcotta)
Ve studii ASTRAL 4 byly provedeny analýzy zkoumající souvislosti mezi stávajícími výchozími NS5A RAV a výsledkem léčby u pacientů s dekompenzovanou jaterní cirhózou. Z 87 pacientů léčených kombinací SOF/VEL + RBV bylo 85 pacientů zařazeno do analýzy NS5A RAV; dva pacienti byli vyřazeni, protože ani nedosáhli SVR12, ani u nich nedošlo k virologickému selhání. Z pacientů, kteří byli léčeni kombinací SOF/VEL  + RBV po dobu 12 týdnů, mělo 29 % (25/85) výchozí virus s NS5A RAV 29 % (19/66), 75 % (3/4), 15 % (2/13) a 50 % (1/2) pro pacienty s HCV genotypu 1, 2, 3, resp. 4. Setrvalou virologickou odpověď u pacientů s výchozími/bez výchozích NS5A RAV ve skupině kombinace SOF/VEL + RBV po dobu 12 týdnů pro tuto studii ukazuje tab. 3. Jeden pacient s genotypem 3, který měl výchozí NS5A RAV a nedosáhl SVR12, měl NS5A substituci Y93H na začátku studie; farmakokinetická data tohoto pacienta odpovídala nedodržování léčby. Tři pacienti ve skupině kombinace SOF/VEL + RBV po dobu 12 týdnů měli výchozí NS5B NI RAV (N142T a L159F) a všichni pacienti dosáhli SVR12.
+ RBV po dobu 12 týdnů, mělo 29 % (25/85) výchozí virus s NS5A RAV 29 % (19/66), 75 % (3/4), 15 % (2/13) a 50 % (1/2) pro pacienty s HCV genotypu 1, 2, 3, resp. 4. Setrvalou virologickou odpověď u pacientů s výchozími/bez výchozích NS5A RAV ve skupině kombinace SOF/VEL + RBV po dobu 12 týdnů pro tuto studii ukazuje tab. 3. Jeden pacient s genotypem 3, který měl výchozí NS5A RAV a nedosáhl SVR12, měl NS5A substituci Y93H na začátku studie; farmakokinetická data tohoto pacienta odpovídala nedodržování léčby. Tři pacienti ve skupině kombinace SOF/VEL + RBV po dobu 12 týdnů měli výchozí NS5B NI RAV (N142T a L159F) a všichni pacienti dosáhli SVR12.
Závěr
Výše uvedené výsledky klinického zkoušení kombinace SOF/VEL (přípravek Epclusa) poskytly dostatečnou datovou oporu pro registraci kombinace v indikacích a režimech (pro všechny genotypy HCV) podle tab. 4 [1]. V těchto indikacích by měla mít kombinace SOF/VEL stanovenou úhradu i v České republice. Zdá se tedy, že i v ČR bude v prvním čtvrtletí roku 2017 dostupný první přípravek s pangenotypovou účinností.Článek vznikl za podpory společnosti Gilead Sciences s.r.o.
[1]. V těchto indikacích by měla mít kombinace SOF/VEL stanovenou úhradu i v České republice. Zdá se tedy, že i v ČR bude v prvním čtvrtletí roku 2017 dostupný první přípravek s pangenotypovou účinností.Článek vznikl za podpory společnosti Gilead Sciences s.r.o.
Seznam použité literatury
- [1] SPC Epclusa, datum první registrace: 6. 7. 2016, datum poslední revize textu: červenec 2016.
- [2] Younossi ZM, Stepanova M, Feld J, et al. Sofosbuvir/velpatasvir improves patient‑reported outcomes in HCV patients: Results from ASTRAL‑1 placebo‑controlled trial. J Hepatol 2016; 65: 33–39.
- [3] Younossi ZM, Stepanova M, Sulkowski M, et al. Ribavirin‑free regimen with sofosbuvir and velpatasvir is associated with high efficacy and improvement of patient‑reported outcomes in patients with genotypes 2 and 3 chronic hepatitis C: results from Astral‑2 and ‑3 clinical trials. Clin Infect Dis 2016; 63: 1042–1048. doi:10.1093/cid/ciw496
- [4] Foster GR, Afdhal N, Roberts SK, et al.; ASTRAL‑2 Investigators; ASTRAL‑3 Investigators. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection N Engl J Med 2015; 373: 2608–2017. doi:10.1056/
- [5] Curry MP, O’Leary JG, Bzowej N, et al.; ASTRAL‑4 Investigators. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med 2015; 373: 2618–2628. doi:10.1056/NEJMoa1512614
- [6] Jacobson IM, Stuart CG, Kris VK, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. N Engl J Med 2013; 368: 1867–1877.
- [7] Lawitz E, Mangia A Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013; 368: 1878–1887.
- [8] Cheng G, et al. EASL 2013, poster 1191.
- [9] German P, et al. EASL 2013, poster 1195.
- [10] Lawitz E, et al. EASL 2013, poster 1082.
- [11] Feld, AASLD 2015; LB‑2. Feld JJ, et al. N Engl J Med 2015. doi:10.1056/NEJMoa1512610
- [12] Sulkowski, AASLD 2015; 205. Foster GR, et al. New Engl J Med 2015. doi: 10.1056/NEJMoa1512612
- [13] Mangia, AASLD 2015; 249. Foster GR, et al. New Engl J Med 2015. doi:10.1056/NEJMoa1512612