Bivalentní vakcína proti infekci lidskými papilomaviry
Cervarix je bivalentní vakcína proti infekci nejčastějšími onkogenními genotypy lidských papilomavirů (HPV) – 16 a 18. Ty jsou zodpovědné asi za 70 % případů invazivních nádorů děložního hrdla. Vakcína obsahuje velmi potentní adjuvans – AS04, které indukuje tvorbu vysokých hladin neutralizačních protilátek. Dokončení celého očkovacího schématu vede ve 100 % případů k rozvoji sérokonverze, která není závislá na věku ani na stavu HPV DNA před očkováním. Dostatečné titry specifických protilátek jsou detekovány minimálně po období 5,5 let. Vakcína vykazuje ve studiích určitou míru zkřížené protekce proti dalším onkogenním genotypům HPV – 45 a 31. Zkřížená protekce rozšiřuje spektrum účinnosti na více než 80 % případů karcinomu děložního hrdla. Podání bivalentní vakcíny je bezpečné a pozorované nežádoucí účinky po očkování jsou obvykle mírné.
Farmakologická skupina
Vakcíny, rekombinantní virus-like partikule v adjuvantním systému AS04.
Chemické a fyzikální vlastnosti
Bivalentní rekombinantní, adsorbovaná vakcína v adjuvantním systému AS04.
Jedna dávka (0,5 ml) vakcíny Cervarix obsahuje: Papillomaviri humani typus 16 proteinum L11, 20 mg; Papillomaviri humani typus 18 proteinum L11, 20 mg; 3-O-deacyl-4"-monofosforyl-lipid A (MPL)2, 50 mg; hydroxid hlinitý, hydratovaný (Al(OH)3)2, 0,5 mg; dihydrát dihydrogenfosforečnanu sodného (NaH2PO4 . 2 H2O), 625 mg; chlorid sodný (NaCl), 4,4 mg; voda na injekci.
1 L1 kapsidový virový protein ve formě neinfekčních viru podobných částic (VLP, virus-like particles) vyrobený rekombinantní DNA technologií cestou bakulovirového (Autographa californica) expresního systému.
2 Adjuvantní systém AS04 patentovaný společností GlaxoSmithKline (GSK) se skládá z MPL (detoxifikované formy lipidu S. minnesota) a hydroxidu hlinitého [1].
Vakcína je suspenzí, která po uskladnění vytváří jemný bílý depozit s čirým supernatantem.
Mechanismus účinku, farmakodynamika
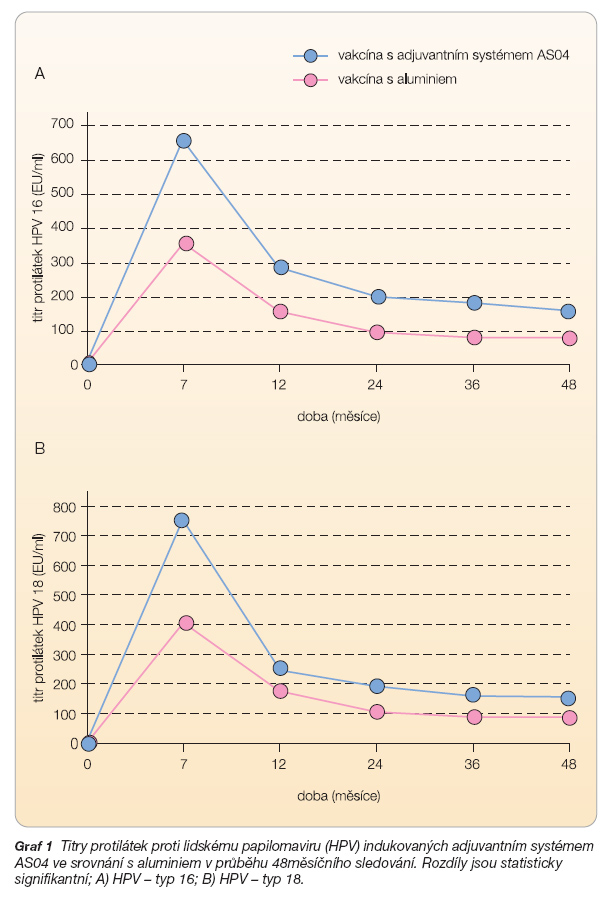
Viru podobné částice (VLP) tvořené replikovaným hlavním kapsidovým proteinem L1 jsou nositeli imunodominantních neutralizačních epitopů. L1 je v přirozené formě složen v pentamer, který je svým vzhledem mikroskopicky neodlišitelný od infekčních částic HPV [2]. Mechanismus účinku vakcíny je založen na indukci genotypově specifických vysokých titrů neutralizačních protilátek. Přítomnost originálního adjuvantního systému vede ke stimulaci humorální odpovědi, ale také ke stimulaci odpovědi zprostředkované buňkami Th1, které mají významnou úlohu v procesu spontánní clearance organismu od virové infekce. Adjuvantní systém AS04 vede ve srovnání s aluminiovou solí minimálně ke dvojnásobně vyšším titrům specifických protilátek a asi k dvojnásobně vyšší frekvenci paměťových buněk [1].
Farmakokinetické vlastnosti
Hodnocení farmakokinetických vlastností není u vakcín vyžadováno.
Klinické zkušenosti
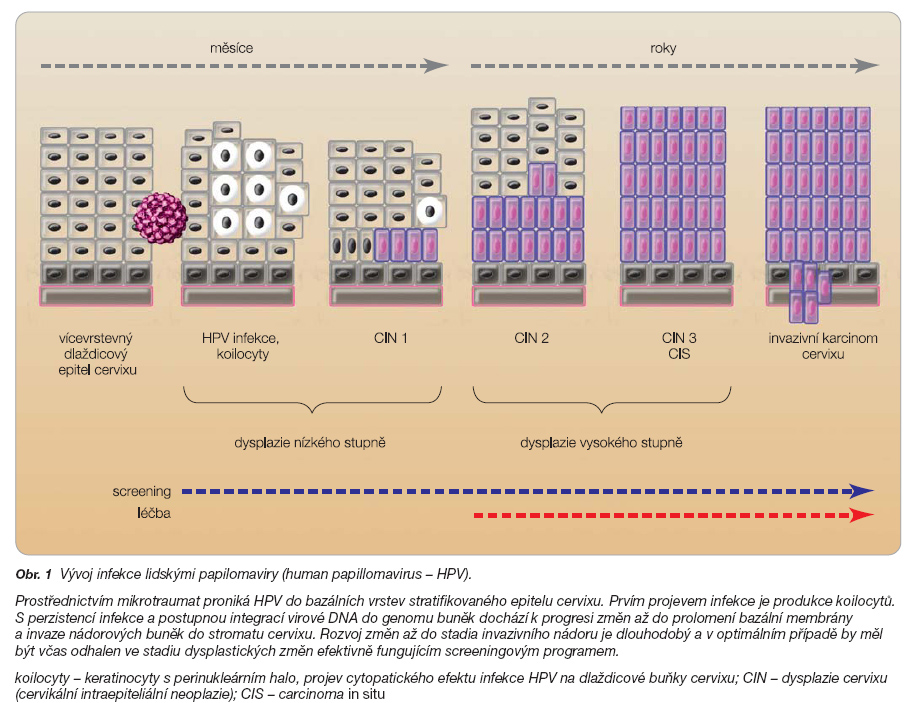
Klinicko-epidemiologické studie potvrzují, že perzistentní infekce onkogenními genotypy HPV je zodpovědná za téměř všechny případy karcinomu děložního hrdla. DNA high risk HPV je identifikována ve tkáni 99,7 % dlaždicobuněčných karcinomů a 95 % adenokarcinomů děložního hrdla [3] (obr. 1).
Nejčastější genotypy HPV 16 a 18 jsou dohromady zodpovědné za více než 70 % invazivních karcinomů děložního hrdla a za přibližně 50 % závažných (high grade) prekancerózních lézí – CIN 2/3, které jsou přímými prekurzory maligního onemocnění. Přibližný podíl jednotlivých genotypů na rozvoji invazivních karcinomů děložního hrdla představuje u HPV 16 asi 53 % a v případě HPV 18 asi 17 % [2].
Bivalentní vakcína proti infekci HPV byla hodnocena v klinických studiích prováděných ve 22 zemích světa. Dohromady byla hodnocena a publikována data získaná v klinických studiích zahrnujících téměř 30 000 očkovaných žen. Ve dvou stěžejních multicentrických, placebem kontrolovaných, dvojitě zaslepených, randomizovaných studiích bylo vakcinováno 19 778 žen ve věku 15 až 25 let a hodnocena byla účinnost a bezpečnost vakcíny [4–7]. Pro zařazení do příslušné skupiny ve studiích byla zohledněna anamnéza proběhlé infekce HPV a případná abnormita klinického nálezu na děložním hrdle. Kritériem pro vstup do kohorty „HPV-naivních" byla negativita PCR vyšetření 14 vysoce rizikových genotypů HPV ze stěrů děložního hrdla, normální výsledek cytologického stěru a séronegativita pro HPV 16 a 18. Neselektovaná skupina vakcinovaných zahrnovala ženy bez ohledu na případnou pozitivitu vstupních kritérií. Vzhledem k časové náročnosti, ale především kvůli etickému rozporu nebyl primárním cílovým parametrem studií stanoven vliv na incidenci invazivního karcinomu, ale vliv na přítomnost aktuální a perzistentní infekce HPV 16 a/nebo 18, respektive vliv na incidenci těžkých prekanceróz děložního hrdla – CIN 2/3 podmíněných genotypy HPV 16 a 18. Za perzistentní infekci, která je spojená s postupnou integrací virové DNA do genomu buněk bazálních vrstev sliznice děložního hrdla a s rozvojem maligních změn, je považována infekce HPV prokázaná v cervikálním stěru pomocí PCR minimálně 2krát v uvedeném časovém rozmezí [3, 4].
Účinnost vakcíny
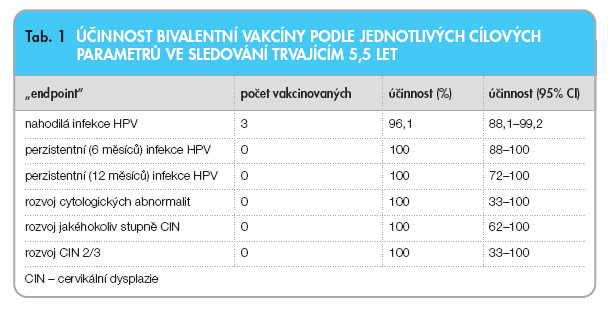
U žen s HPV 16 a 18 negativitou (dle stanovení DNA i sérologicky) plně vakcinovaných přetrvává po 5,5letém sledování 100% ochrana proti perzistentní infekci i proti rozvoji závažných prekanceróz (tab. 1).
Při hodnocení úrovně protekce plně vakcinovaných žen bez závislosti na vstupním stavu HPV DNA vykazovala účinnost ochrany proti CIN 2/3 67,8 %. Při předpokládaném 50% podílu HPV 16 a 18 na rozvoji CIN 2/3 poukazuje tato hodnota na přítomnost zkřížené protektivity vůči onkogenním genotypům HPV 45 a 31 fylogeneticky blízkým k HPV 16 a 18 [5]. Podíl HPV 45 a 31 na rozvoji invazivního onemocnění je asi 10 %. V 5,5letém sledování vykazovala zkřížená protekce sice méně komplexní, přesto signifikantní ochranu v 88 % případů proti HPV 45 a v 54 % případů proti HPV 31. Kumulativní protektivní úroveň vakcíny tak může být rozšířena na více než 80 % případů maligního onemocnění děložního hrdla.
Imunogenita indukovaná vakcínou
Imunogenita indukovaná 3 dávkami bivalentní vakcíny byla hodnocena u žen v širokém věkovém rozmezí mezi 10 a 55 lety. Ve 100 % případů bylo v 7. měsíci, tj. 1 měsíc po dokončení očkovacího schématu, prokázáno navození séropozitivity. Titry specifických protilátek IgG indukované vakcínou dosahovaly svého vrcholu právě v 7. měsíci, po mírném poklesu v následujících 2 letech se jejich hladina udržovala po celou dobu extendovaného 5,5letého sledování na stabilním plató minimálně 11krát vyšších titrů ve srovnání s titry navozenými přirozenou infekcí [7]. U žen HPV 16 a/nebo HPV 18 séropozitivních před vakcinací byly po dokončení očkovacího schématu indukovány vysoké hladiny specifických protilátek srovnatelné s hladinami u žen primárně séronegativních. Vysokých titrů protilátek bylo dosaženo bez ohledu na věkovou kategorii při hladinách minimálně 11krát vyšších než po přirozeně proběhlé infekci.
Bezpečnost
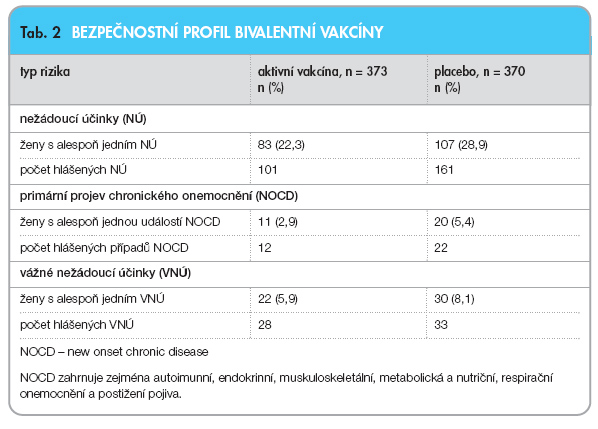
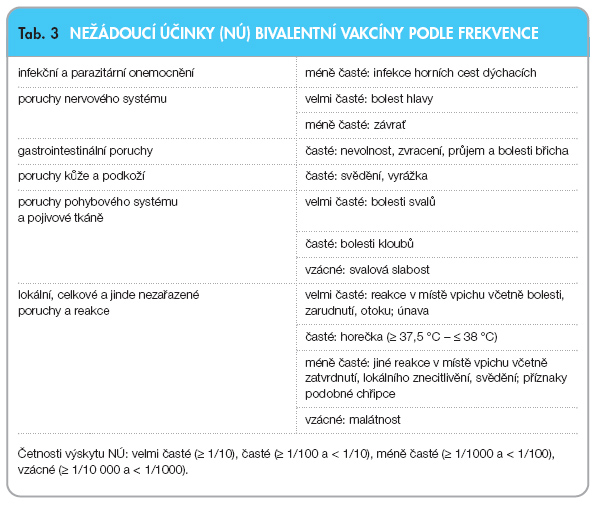
Přítomnost nežádoucích účinků byla ve studiích srovnatelná mezi vakcinovanou skupinou a kontrolní skupinou ve všech věkových kategoriích [6, 7]. Pozorované nežádoucí účinky byly převážně mírné a podání vakcíny bylo obecně velmi dobře tolerováno (tab. 2). Genotoxický nebo kancerogenní potenciál vakcíny nebyl zkoumán.
Zařazení do současné palety léčiv
Bivalentní vakcína proti infekci HPV je druhou očkovací látkou proti původci onkologického onemocnění děložního hrdla. Stejně jako vakcína kvadrivalentní, je i bivalentní vakcína aktuálně určena pouze k oportunní vakcinaci bez zařazení do standardního očkovacího schématu. Velmi vysoké hladiny specifických protilátek indukovaných přítomností originálního adjuvans mohou mít příznivý vliv na dlouhodobou ochranu i nutnost podání booster dávky [1] (graf 1).
Nejoptimálnějších výsledků je dosaženo po vakcinaci žen a dívek, které se dosud nesetkaly s infekcí HPV, přesto však příznivá data o imunogenitě ve vyšších věkových kategoriích včetně žen s anamnézou infekce HPV podporují využití profylaktického podání bivalentní vakcíny v širokém věkovém spektru.
Indikace
Bivalentní vakcína proti infekci HPV je určena pro ženy a dívky k prevenci rozvoje karcinomu děložního hrdla prostřednictvím ochrany před získáním a následnou perzistencí infekce HPV, slouží rovněž k prevenci rozvoje cytologických abnormit nejasného významu (ASC, AGC) a prekanceróz děložního hrdla všech stupňů způsobených infekcí HPV genotypy 16 a 18. Vakcína slouží k prevenci před rozvojem prekanceróz a karcinomů pochvy a vulvy podmíněných infekcí HPV 16 a 18. Vakcína nemá terapeutický efekt a v žádném případě nenahrazuje provádění screeningových prebioptických vyšetření děložního hrdla. Účinnost vakcíny dosud nebyla vyhodnocena u mužů.
Kontraindikace
Vakcína se nesmí podávat při známé přecitlivělosti na kteroukoliv její složku. Aplikace musí být odložena u osob trpících vážným akutním horečnatým onemocněním, mírná infekce však není kontraindikací imunizace.
Nežádoucí účinky
V klinických studiích byla po aplikaci u zdravých jedinců ve věkovém rozmezí 10–68 let hodnocena také bezpečnost podané vakcíny. Nejčastější reakcí pozorovanou po podání vakcíny byla bolest v místě vpichu, která se vyskytla po podání 77,6 % všech dávek. Většina těchto reakcí měla mírný až střední průběh a spontánně odezněla během 7denní doby sledování. Nežádoucí účinky podle frekvence jsou uvedeny v tab. 3.
Lékové interakce
Vakcína se nesmí mísit s jinými léčivými přípravky, protože dosud chybí studie o kompatibilitě.
Použití s jinými vakcínami
O současném podání s jinými vakcínami nejsou dostupné žádné údaje. Pokud se má bivalentní vakcína proti infekci HPV podat současně s jinou injekční vakcínou, musí se vždy obě vakcíny aplikovat do odlišných míst.
Použití s hormonální antikoncepcí
Asi 60 % žen ve studiích zaměřených na účinnost bivalentní vakcíny proti infekci HPV užívalo hormonální antikoncepci. Ze získaných dat lze předpokládat, že používání hormonální antikoncepce nemá žádný vliv na účinnost vakcíny.
Použití se systémovou imunosupresivní léčbou
Lze očekávat, že systémová imunosupresivní medikace může být příčinou absence dostatečné imunitní odpovědi po ukončení očkovacího schématu.
Těhotenství a kojení
Zvláštní studie s vakcínou u těhotných žen nebyly provedeny. Během předregistračního klinického vývojového programu byly hlášeny případy těhotenství u očkovaných žen. Účinek bivalentní vakcíny na embryofetální, perinatální a postnatální přežití a vývoj nebyl v klinických studiích prospektivně hodnocen. Účinek vakcíny na embryofetální, perinatální a postnatální přežití a vývoj byl hodnocen na potkanech. Studie provedené na těchto zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky s ohledem na fertilitu, graviditu, embryofetální vývoj, porod nebo postnatální vývoj.
Očkování bivalentní vakcínou proti infekci HPV během kojení by se mělo provádět jen tehdy, pokud možné výhody očkování převáží možná rizika. Účinek na kojené děti – po podání vakcíny jejich matkám – nebyl v klinických studiích hodnocen. Není známo, jestli vakcínou indukované protilátky procházejí do lidského mléka. Studie na zvířatech prokázaly, na rozdíl od antigenů vakcíny, možnou exkreci protilátek do mléka.
Dávkování
Cervarix se podává formou intramuskulární injekce, predilekčně je doporučována aplikace do deltového svalu horní končetiny. Vakcína nesmí být nikdy podána intravaskulárně ani intrakutánně. Informace o subkutánním podání nejsou k dispozici. Základní vakcinační schéma sestává ze tří samostatných dávek 0,5 ml podaných ve schématu 0., 1. a 6. měsíc. Alternativní očkovací schéma umožňuje při potřebě větší flexibility podání 2. dávky mezi 1 a 2,5 měsíci po aplikaci 1. dávky.
Cervarix je určen pro ženy a dívky od 10 let. V nižší věkové kategorii není doporučen pro nedostatek údajů o imunogenitě, bezpečnosti a účinnosti. Délka ochrany ani potřeba podání booster dávky nebyla dosud stanovena. Minimální doba perzistence dostatečně účinné hladiny protilátek je nejméně 5,5 roku. Dlouhodobé studie zaměřené na stanovení délky ochrany nadále probíhají.
Nejsou dostupné informace o předávkování nebo podání vyšších než doporučených dávek.
Očkovací program
Bivalentní vakcína proti infekci lidskými papilomaviry genotypů 16 a 18 není zařazena do oficiálního očkovacího kalendáře. Je určena k oportunní vakcinaci. Informace o imunogenitě u starších žen a žen s infekcí HPV naznačují indukci 100% sérokonverze po dokončení očkovacího schématu s titry protilátek vysoce převyšujícími titry po přirozeně proběhlé infekci. Nedostatečné jsou informace o podání u gravidních či imunokompromitovaných žen.
Monitorování léčiva
U vakcín se neprovádí monitorování v tělních tekutinách. S adekvátním odstupem lze měřit hladinu protilátek v séru nebo provádět měření buněčné imunity.
Balení
Informace o balení jsou dostupné z Austrálie, kde je vakcína registrována od 15. 6. 2007.
Balení vakcíny obsahuje 0,5 ml suspenze v předem naplněné injekční stříkačce s pístovou zátkou nebo v zátkovaných lékovkách.
Stabilita
Vakcíny je třeba skladovat při standardní teplotě 2–8 °C. Vakcína nesmí zmrznout. Vakcína musí být chráněna před světlem v původním obalu. Takto ji lze skladovat po dobu 3 let. Mimo uvedené teplotní rozmezí zůstává vakcína stabilní po dobu 1 týdne při teplotách nepřesahujících 37 °C.
Seznam použité literatury
- [1] Giannini SL, Hanon E, Moris P, et al. Enhanced humoral and memory B cellular imunity using HPV 16/18 L1 VLP vaccine formulated with the MLP/aluminium salt combination (AS04) compared to aluminim salt only. Vaccine 2006; 24: 33–34.
- [2] Sláma J, Freitag P. Vakcíny proti lidským papilomavirům. Prakt Gynekol 2007; 1: 30–32.
- [3] Prendiville W, Davies P. The health professional“s HPV handbook. Abingdon, Taylor and Francis 2004.
- [4] Koutsky LA, Ault KA, Wheeler CM, et al. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med 2002; 347: 1645–1651.
- [5] Harper DM, Franco EL, Wheeler CM, et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from randomised control trial. Lancet 2006; 367: 1247–1255.
- [6] Harper DM, Franco EL, Wheeler CM, et al. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet 2004; 364: 1757–1765.
- [7] Paavonen J, Jenkins D, Bosch FX, et al. Efficacy of prophylactic adjuvanted L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women: an in-terim analysis of a phase III double-blind, randomised controlled trial. Lancet 2007; 369: 2161–2170.