Carfilzomib – selektivní inhibitor proteasomu, další naděje v léčbě mnohočetného myelomu
Souhrn:
Zavedení „nových léků“ do léčby mnohočetného myelomu výrazně zlepšilo prognózu nemocných, a to zejména těch, kteří nemohou absolvovat vysokodávkovanou chemoterapii s následnou autotransplantací kmenových buněk. Dalším představitelem jejich nové generace je carfilzomib, selektivní inhibitor proteasomu s ireverzibilní vazbou, jehož použití je indikováno u nemocných s relapsem nebo s refrakterní formou onemocnění. Jedná se jednoznačně o jedno z nejúčinnějších léčiv, které bylo dosud u nemocných s mnohočetným myelomem testováno. Cílem tohoto článku je seznámit čtenáře s lékovým profilem carfilzomibu, a to jak s jeho farmakologickými vlastnostmi, tak s dosavadními zkušenostmi získanými při jeho použití.
Key words: carfilzomib – proteasome inhibitor – multiple myeloma – therapy.
Summary:
The introduction of “new drugs” in the treatment of multiple myeloma (MM) significantly improved the prognosis of patients, especially of those who can´t undergo high‑dose chemotherapy followed by autotransplantation of stem cells. One of the representatives of the new generation is carfilzomib. It is a selective proteasome inhibitor whose use is indicated for patients with relapsed or refractory disease. In this case, it is clearly one of the most effective drugs, which was tested in MM patients so far. The aim of this article is to familiarize readers with the profile of this drug, both its pharmacological properties, and also past experience gained with its use.
Úvod
Přestože se mnohočetný myelom (multiple myeloma, MM) řadí mezi vzácná onemocnění, je druhým nejčastějším krevním nádorovým onemocněním, jehož incidence v posledních letech stále stoupá (dříve uváděno 4/100 000 obyvatel ročně, dnes již téměř 6/100 000 obyvatel ročně). Současně je toto onemocnění zatím stále považováno za dlouhodobě nevyléčitelné, i když díky novým léčebným možnostem došlo u pacientů trpících MM k výraznému zlepšení prognózy a MM se stal chronickým onemocněním [1–3]. V některých případech můžeme hovořit o možném vyléčení, a to zejména u mladších nemocných, tj. nemocných, kteří mohou absolvovat vysokodávkovanou léčbu následovanou autologní transplantací periferních kmenových buněk. Zatím se však jedná pouze o malé procento nemocných (asi 10 % pacientů, u nichž je léčbou dosaženo dlouhodobé kompletní remise) a doposud nebyl popsán žádný prognostický faktor, který by dokázal tuto skupinu nemocných dopředu identifikovat. V současnosti víme, že dosažení kompletní remise, nebo ještě lépe hlubší léčebné odpovědi (tzv. imunofenotypové kompletní remise, iCR) by dnes mělo být cílem léčby u této nadále převážně fatální hematologické malignity [4].
Z výše uvedeného jasně vyplývá význam „nových léků“ u MM, mezi které patří např. bortezomib, první zástupce první generace tzv. inhibitorů proteasomu. Bortezomib byl poprvé schválen americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) pro použití u progredujícího relabujícího MM již v roce 2003, dnes je již používán celosvětově jak v rámci primoterapie, tak i v léčbě relabujícího/refrakterního onemocnění [5]. Nevýhodou bortezomibu při jeho standardním dávkování dvakrát týdně ve formě intravenózní infuze je výskyt periferní neuropatie u vysokého počtu nemocných (u 34–54 % léčených celkem; u 8–16 % pacientů se závažností postižení vyšší než 3. stupně). Periferní neuropatie navíc byla nejčastější nežádoucí příhodou vedoucí k přerušení léčby v rámci studií fáze II a III (u 4–8 % nemocných). Přechodem na subkutánní podávání s frekvencí aplikací pouze jednou týdně bylo sice dosaženo snížení výskytu i závažnosti periferní neuropatie provázející léčbu bortezomibem, nicméně pokračují snahy o nalezení dalších léků, přinejmenším stejně účinných, ale s lepším bezpečnostním profilem [6].
Jedním z představitelů další generace „nových léků“ u MM je carfilzomib. Jedná se o inhibitor proteasomu druhé generace s vysoce selektivní a ireverzibilní vazbou na konstitutivní podjednotku proteasomu 26S. Vyšší selektivita znamená i vyšší účinnost a nižší toxicitu ve srovnání s bortezomibem, jehož podávání je zatíženo rizikem vzniku neuropatie. Inhibicí proteasomu dochází ke snížení degradace poškozených proteinů uvnitř nádorové buňky, k posílení jejich exprese a k následné buněčné apoptóze. Carfilzomib (Kyprolis®) byl ve státech Evropské unie schválen v kombinaci s lenalidomidem a s dexamethasonem pro léčbu dospělých pacientů s MM po nejméně jedné předchozí linii léčby, a to na základě výsledků studie ASPIRE, která potvrdila superioritu této léčby oproti dosavadnímu standardu léčby u relabujícího/refrakterního MM, kombinaci imunomodulační látky lenalidomidu a kortikosteroidu dexamethasonu [7]. Jedná se o jeden z nejúčinnějších léků, který byl dosud u nemocných s MM testován a který se tak po zásluze stal další nadějí pro nemocné trpící tímto onemocněním.
Farmakologická skupina
Carfilzomib je analog epoxomicinu, je řazen do farmakoterapeutické skupiny cytostatik pod ATC kódem L01XX45.
Chemické vlastnosti
Carfilzomib je tetrapeptidický epoxyketon, sumární vzorec C40H57N5O7. Jeho molekulová hmotnost činí 719,91 g/mol.
Mechanismus účinku, farmakodynamika
Carfilzomib je inhibitor proteasomu, který se selektivně a ireverzibilně váže na N terminální aktivní místa obsahující threonin na podjednotce proteasomu 20S, což je proteolytická jádrová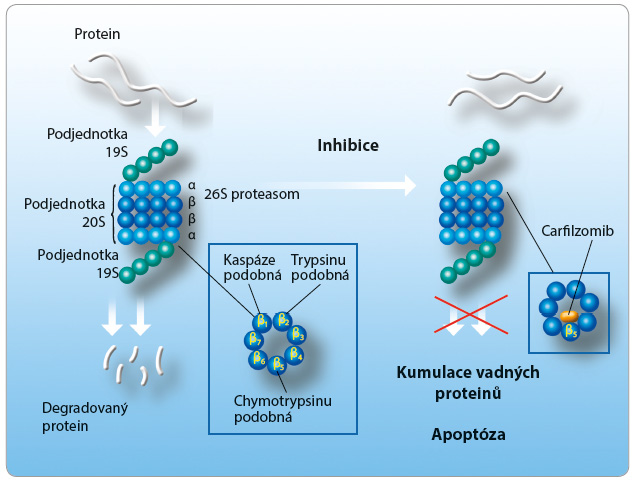 částice uvnitř podjednotky proteasomu 26S (obr. 1). Primárně inhibuje podjednotku ß5 (podobnou chymotrypsinu) na proteolytické části 20S a vykazuje nižší afinitu k proteázám ß2 a ß1. Carfilzomib prokázal antiproliferativní a proapoptotickou aktivitu v předklinických modelech u hematologických nádorů. V testech in vitro bylo zjištěno, že vykazuje minimální neurotoxicitu a minimální reakci na neproteasomální proteázy. Inhibice proteasomu trvá 48 hodin a déle, po aplikaci první intravenózní dávky carfilzomibu v každém týdnu podání bylo prokázáno, že k systémové kumulaci nedochází [9,10].
částice uvnitř podjednotky proteasomu 26S (obr. 1). Primárně inhibuje podjednotku ß5 (podobnou chymotrypsinu) na proteolytické části 20S a vykazuje nižší afinitu k proteázám ß2 a ß1. Carfilzomib prokázal antiproliferativní a proapoptotickou aktivitu v předklinických modelech u hematologických nádorů. V testech in vitro bylo zjištěno, že vykazuje minimální neurotoxicitu a minimální reakci na neproteasomální proteázy. Inhibice proteasomu trvá 48 hodin a déle, po aplikaci první intravenózní dávky carfilzomibu v každém týdnu podání bylo prokázáno, že k systémové kumulaci nedochází [9,10].
Farmakokinetické vlastnosti
Vazba carfilzomibu na plazmatické bílkoviny činí průměrně 97 %. Carfilzomib se rychle a výrazně primárně metabolizuje v játrech hlavně činností peptidázy a epoxid hydrolázy. V celkovém metabolismu carfilzomibu hrají mechanismy zprostředkované cytochromem P450 pouze malou roli, proto je nepravděpodobné, že by byl jeho farmakokinetický profil ovlivněn souběžným podáním inhibitorů a induktorů cytochromu P450. Metabolity carfilzomibu nemají žádnou známou biologickou aktivitu a k jejich vylučování dochází převážně močí.
Analýzy populačních farmakokinetických dat naznačují, že farmakokinetiku carfilzomibu neovlivňuje věk ani pohlaví pacienta. Stav funkce ledvin neměl žádný vliv na clearance nebo na expozici carfilzomibu po jednorázovém nebo opakovaném podání v dávkách až 20 mg/m2. U pacientů s poruchou funkce jater nebyly žádné farmakokinetické studie dokončeny.
Klinické zkušenosti
V rámci studií fáze I nebyla stanovena maximální tolerovaná dávka carfilzomibu v monoterapii. V současné době tak není k dispozici dostatek informací k tomu, aby bylo možné vyvodit závěry o bezpečnosti podávání vyšších dávek, než jsou dávky hodnocené v uskutečněných klinických studiích. Na základě bezpečnostního profilu byla stanovena úvodní dávka carfilzomibu na 20 mg/m2 s následnou eskalací na 27 mg/m2. Tento režim monoterapie carfilzomibem byl prvním, který byl schválen FDA pro použití u nemocných s relabujícím nebo refrakterním MM, a to na základě studie fáze II, v níž bylo u této populace nemocných dosaženo celkové léčebné odpovědi 23,7 % [11]. Stejná dávka se stala základem i u režimu léčby carfilzomibem v kombinaci s lenalidomidem a s dexamethasonem [12]. Při kombinaci carfilzomibu pouze s dexamethasonem je používána dávka 56 mg/m2 [13]. V současné době je v rámci probíhající studie ARROW testována dokonce dávka 72 mg/m2 carfilzomibu v kombinaci s dexamethasonem podávaná pouze jednou týdně v rámci prvních tří týdnů 28denního cyklu, jako úvodní dávka je stále podáváno 20 mg/m2.
V následujícím textu jsou zmíněny výsledky dvou hlavních klinických studií fáze III ASPIRE (PX 171 009) a ENDEAVOR (2011 003) [7,8], které se staly podkladem žádosti pro schválení použití carfilzomibu při léčbě nemocných s MM.
Studie ASPIRE
Studie ASPIRE hodnotila 792 pacientů s relapsem MM. Jednalo se o randomizovanou otevřenou multicentrickou studii, v níž byla zkoumána léčba kombinací carfilzomibu s lenalidomidem a s dexamethasonem oproti kombinaci lenalidomidu a dexamethasonu v poměru 1 : 1 [7], (obr. 2). Carfilzomib by![Obr. 2 Uspořádání studie ASPIRE; podle [7] – Stewart, et al., 2015.](https://www.remedia.cz/photo-a-30929---.jpg) l podáván po dobu maximálně 18 cyklů, pokud nebyla léčba ukončena dříve pro progresi choroby nebo pro nepřijatelnou toxicitu. V podávání lenalidomidu a dexamethasonu bylo možné pokračovat až do progrese onemocnění nebo do známek nepřijatelné toxicity. Vstupní data pacientů byla v obou ramenech vyvážená. Pacienti absolvovali před vstupem do studie jednu až tři linie léčby (medián byl dvě), včetně předchozí léčby bortezomibem (66 %), thalidomidem (44 %) a lenalidomidem (20 %). Pacienti léčení kombinací carfilzomibu, lenalidomidu a dexamethasonu dosáhli o devět měsíců delšího mediánu přežití bez progrese onemocnění (progression free survival, PFS) než pacienti, kterým byl podáván lenalidomid a dexamethason (medián PFS 26,3 měsíce vs. 17,6 měsíce, poměr rizik – hazard ratio [HR] 0,69, 95% interval spolehlivosti – confidence interval [CI] 0,57–0,83; p < 0,0001), což představuje 45% zlepšení PFS nebo 31% snížení rizika vzniku příhody (graf 1). Přínos pro PFS v rameni s carfilzomibem byl pozorován ve všech podskupinách, včetně pacientů ve věku 75 let a více (n = 96), pacientů s vysoce rizikovými genetickými mutacemi (n = 100) nebo s genetickými mutacemi o neznámém riziku (n = 375) a pacientů s výchozí hodnotou clearance kreatininu 30 až < 50 ml/min (n = 56). Superioritu prokázal carfilzomib i v sekundárních cílových ukazatelích – v celkové četnosti odpo
l podáván po dobu maximálně 18 cyklů, pokud nebyla léčba ukončena dříve pro progresi choroby nebo pro nepřijatelnou toxicitu. V podávání lenalidomidu a dexamethasonu bylo možné pokračovat až do progrese onemocnění nebo do známek nepřijatelné toxicity. Vstupní data pacientů byla v obou ramenech vyvážená. Pacienti absolvovali před vstupem do studie jednu až tři linie léčby (medián byl dvě), včetně předchozí léčby bortezomibem (66 %), thalidomidem (44 %) a lenalidomidem (20 %). Pacienti léčení kombinací carfilzomibu, lenalidomidu a dexamethasonu dosáhli o devět měsíců delšího mediánu přežití bez progrese onemocnění (progression free survival, PFS) než pacienti, kterým byl podáván lenalidomid a dexamethason (medián PFS 26,3 měsíce vs. 17,6 měsíce, poměr rizik – hazard ratio [HR] 0,69, 95% interval spolehlivosti – confidence interval [CI] 0,57–0,83; p < 0,0001), což představuje 45% zlepšení PFS nebo 31% snížení rizika vzniku příhody (graf 1). Přínos pro PFS v rameni s carfilzomibem byl pozorován ve všech podskupinách, včetně pacientů ve věku 75 let a více (n = 96), pacientů s vysoce rizikovými genetickými mutacemi (n = 100) nebo s genetickými mutacemi o neznámém riziku (n = 375) a pacientů s výchozí hodnotou clearance kreatininu 30 až < 50 ml/min (n = 56). Superioritu prokázal carfilzomib i v sekundárních cílových ukazatelích – v celkové četnosti odpo![Graf 1 Interim analýza přežití bez progrese ve studii ASPIRE; podle [7] – Stewart, et al., 2015. CI – confidence interval, interval spolehlivosti; HR – hazard ratio, poměr rizik; KRd – carfilzomib + lenalidomid + dexamethason; PFS – progression-free survival, doba bez progrese onemocnění; Rd – lenalidomid + dexamethason](https://www.remedia.cz/photo-a-30930---.jpg) vědí (overall response rate, ORR, 87 % vs. 67 %) i v trvání délky odpovědi (duration of response, DOR, medián DOR 28,6 měsíce vs. 21,2 měsíce). Nemocní v rameni s carfilzomibem dosáhli 3,5× častěji kompletních (complete response, CR) či lepších (stringent complete remission, sCR; immunophenotype complete remission, iCR; molecular complete remission, mCR) léčebných odpovědí než nemocní v rameni pouze s lenalidomidem a s dexamethasonem (31,8 % vs. 9,3 %). Celkové přežití pacientů (overall survival, OS) za 24 měsíců bylo 73,3 % (95% CI 68,6–77,5 %) vs. 65,0 % (95% CI 59,9–69,5 %) v rameni bez carfilzomibu. U nemocných léčených kombinací carfilzomibu s lenalidomidem a s dexamethasonem bylo také v porovnání s druhým ramenem studie zaznamenáno zlepšení celkové kvality života (health related quality of life, HRQoL) po
vědí (overall response rate, ORR, 87 % vs. 67 %) i v trvání délky odpovědi (duration of response, DOR, medián DOR 28,6 měsíce vs. 21,2 měsíce). Nemocní v rameni s carfilzomibem dosáhli 3,5× častěji kompletních (complete response, CR) či lepších (stringent complete remission, sCR; immunophenotype complete remission, iCR; molecular complete remission, mCR) léčebných odpovědí než nemocní v rameni pouze s lenalidomidem a s dexamethasonem (31,8 % vs. 9,3 %). Celkové přežití pacientů (overall survival, OS) za 24 měsíců bylo 73,3 % (95% CI 68,6–77,5 %) vs. 65,0 % (95% CI 59,9–69,5 %) v rameni bez carfilzomibu. U nemocných léčených kombinací carfilzomibu s lenalidomidem a s dexamethasonem bylo také v porovnání s druhým ramenem studie zaznamenáno zlepšení celkové kvality života (health related quality of life, HRQoL) po
18 cyklech léčby (p = 0,0001) měřené pomocí dotazníku EORTC QLQ C30.
Studie ENDEAVOR
Zatím poslední publikovanou studií fáze III je ENDEAVOR (2011 003) [8]. V tomto případě se jednalo o randomizovanou otevřenou multicentrickou studii hodnotící 929 pacientů s relapsem MM, v níž byla zkoumána kombinace carfil![Obr. 3 Uspořádání studie ENDEAVOR; podle [8] – Dimopoulos, et al., 2016. * Před prvním cyklem a po prvním cyklu i.v. hydratace 250–500 ml. ISS – International Staging System](https://www.remedia.cz/photo-a-30931---.jpg) zomibu s dexamethasonem oproti kombinaci bortezomibu s dexamethasonem v poměru 1 : 1 (obr. 3). Pacienti mohli pokračovat v léčbě až do progrese choroby nebo do projevů nepřijatelné toxicity. Demografická data nemocných byla v obou ramenech srovnatelná. Do studie mohli být zařazeni pacienti, kteří prodělali 1–3 předchozí linie léčby (medián byl dvě), včetně možné předchozí léčby bortezomibem nebo carfilzomibem, kdy bylo nutné dosažení alespoň parciální remise. U pacientů v rameni s carfilzomibem a s dexamethasonem bylo prokázáno zlepšení PFS v porovnání s pacienty v rameni s bortezomibem, kdy medián PFS v rameni s carfilzomibem do
zomibu s dexamethasonem oproti kombinaci bortezomibu s dexamethasonem v poměru 1 : 1 (obr. 3). Pacienti mohli pokračovat v léčbě až do progrese choroby nebo do projevů nepřijatelné toxicity. Demografická data nemocných byla v obou ramenech srovnatelná. Do studie mohli být zařazeni pacienti, kteří prodělali 1–3 předchozí linie léčby (medián byl dvě), včetně možné předchozí léčby bortezomibem nebo carfilzomibem, kdy bylo nutné dosažení alespoň parciální remise. U pacientů v rameni s carfilzomibem a s dexamethasonem bylo prokázáno zlepšení PFS v porovnání s pacienty v rameni s bortezomibem, kdy medián PFS v rameni s carfilzomibem do![Graf 2 Kaplanovy–Meierovy křivky a hodnocení mediánu přežití bez progrese ve studii ENDEAVOR; podle [8] – Dimopoulos, et al., 2016. Prodloužení PFS v rameni s carfilzomibem bylo patrné ve všech podskupinách pacientů, včetně věku, cytogenetického rizika, předchozího podávání lenalidomidu nebo bortezomibu. CI – confidence interval, interval spolehlivosti; HR – hazard ratio, poměr rizik; Kd – carfilzomib + dexamethason; PFS – progression-free survival, doba bez progrese onemocnění; Vd – bortezomib + dexamethason](https://www.remedia.cz/photo-a-30932---.jpg) sáhl 18,7 měsíce (95% CI 15,6 – dosud nestanoven) oproti rameni s bortezomibem, kde činil pouze 9,4 měsíce (8,4–10,4). To při celkovém hodnocení znamenalo dosažení statisticky významného rozdílu mezi oběma rameny (HR 0,53; p < 0,0001) (graf 2). Carfilzomib tak ve studii ENDEAVOR potvrdil svou vyšší účinnost a nižší toxicitu, zejména co se týče průvodní periferní neuropatie (celkový výskyt: 9 % vs. 26 %), v přímém srovnání s bortezomibem; léčbu tímto přípravkem tak může carfilzomib v jeho indikacích do budoucna nahradit.
sáhl 18,7 měsíce (95% CI 15,6 – dosud nestanoven) oproti rameni s bortezomibem, kde činil pouze 9,4 měsíce (8,4–10,4). To při celkovém hodnocení znamenalo dosažení statisticky významného rozdílu mezi oběma rameny (HR 0,53; p < 0,0001) (graf 2). Carfilzomib tak ve studii ENDEAVOR potvrdil svou vyšší účinnost a nižší toxicitu, zejména co se týče průvodní periferní neuropatie (celkový výskyt: 9 % vs. 26 %), v přímém srovnání s bortezomibem; léčbu tímto přípravkem tak může carfilzomib v jeho indikacích do budoucna nahradit.
Nežádoucí účinky
Nejčastějšími nežádoucími účinky pozorovanými v průběhu léčby carfilzomibem (vyskytujícími se u více než 20 % subjektů) byly: anémie, únava, průjem, trombocytopenie, nauzea, pyrexie, dušnost, infekce dýchacích cest, kašel a periferní otoky [10,14]. U pacientů léčených carfilzomibem byly hlášeny případy infuzních reakcí, a to včetně život ohrožujících. Ty se mohou nejčastěji projevit symptomy, ke kterým patří horečka, třesavka, artralgie, myalgie, návaly horka v obličeji, otok obličeje, zvracení, slabost, dušnost, hypotenze, synkopa, pocit tíhy nebo bolestí na hrudi. Tyto reakce se mohou objevit ihned po podání nebo až do 24 hodin po podání carfilzomibu. Ke snížení výskytu a závažnosti reakcí je doporučeno aplikovat před podáním carfilzomibu dexamethason.
Kromě toho však mohou být s léčbou carfilzomibem spojeny i velmi závažné nežádoucí účinky, ke kterým patří zejména syndrom nádorového rozpadu (tumor lysis syndrome, TLS), kardiální toxicita, plicní toxicita, hypertenze včetně hypertenzní krize, plicní hypertenze, syndrom posteriorní reverzibilní encefalopatie (PRES) a projevy trombotické trombocytopenické purpury a hemolyticko uremického syndromu (TTP/HUS).
U pacientů léčených carfilzomibem byly popsány případy TLS včetně smrtelných. U pacientů s velkou zátěží nádorovým onemocněním je proto nutné zajistit, aby byli dobře hydratovaní před podáním carfilzomibu v rámci prvního cyklu a podle potřeby i v dalších cyklech. U pacientů léčených carfilzomibem byla často hlášena dušnost. Při jejím výskytu je nutné vyhodnocení se zaměřením na možnost kardiopulmonálního onemocnění včetně srdečního selhání a plicních syndromů. Po podání carfilzomibu se totiž objevily nové případy nebo zhoršení stávajícího srdečního selhání, např. městnavé srdeční selhání, plicní edém, snížená ejekční frakce levé komory srdeční, ischemie myokardu a infarkt myokardu. Vyskytla se i úmrtí na srdeční zástavu v průběhu jednoho dne po podání carfilzomibu a byly hlášeny smrtelné následky srdečního selhání a infarktu myokardu. Zatímco před podáním léčivého přípravku v prvním cyklu je tedy potřebná adekvátní hydratace, všichni pacienti mají být sledováni z hlediska známek objemového přetížení organismu, zejména pacienti s rizikem srdečního selhání. Nejvyšší riziko je u starších pacientů (≥ 75 let). U pacientů léčených carfilzomibem se vyskytly případy syndromu akutní dechové tísně (acute respiratory distress syndrome, ARDS), akutního respiračního selhání a akutní difuzní infiltrativní plicní nemoci, jako je pneumonitida a intersticiální plicní nemoc. Při léčbě carfilzomibem byly pozorovány případy hypertenze, včetně hypertenzní krize a urgentních hypertenzních stavů. Všichni pacienti proto musejí být standardně vyšetřeni na přítomnost hypertenze a podle potřeby léčeni. Ojediněle byly u pacientů léčených carfilzomibem zaznamenány i případy plicní hypertenze. Některé z popisovaných nežádoucích účinků mohou být smrtelné, proto je nutné pacienty během léčby pečlivě sledovat.
U pacientů léčených carfilzomibem byly zaznamenány případy PRES. Tento syndrom, dříve nazývaný syndrom reverzibilní posteriorní leukoencefalopatie, je vzácná neurologická porucha, která se může manifestovat křečemi, bolestmi hlavy, letargií, zmateností, slepotou, poruchou vědomí a dalšími zrakovými a neurologickými poruchami spolu s hypertenzí. Při podezření na PRES je nutné léčbu carfilzomibem ukončit.
U pacientů léčených carfilzomibem byly hlášeny i případy trombotické mikroangiopatie, včetně trombotické trombocytopenické purpury (TTP) a hemolyticko uremického syndromu (HUS). Některé z těchto příhod byly smrtelné. Proto je nutné pacienty z hlediska možného výskytu příznaků a projevů TTP/HUS sledovat a při podezření na jejich přítomnost léčbu carfilzomibem přerušit. Jestliže se diagnóza TTP/HUS vyloučí, je následně možné její opětovní zahájení.
Indikace
Carfilzomib v kombinaci s lenalidomidem a s dexamethasonem nebo jen s dexamethasonem je na základě výše uvedených studií fáze III ASPIRE a ENDEAVOR [7,8] indikován k léčbě dospělých pacientů trpících MM, kteří prodělali nejméně jednu předchozí léčbu [10].
Dávkování
Carfilzomib se podává ve formě krátkodobé intravenózní infuze dva po sobě jdoucí dny každý týden po dobu tří týdnů (den 1, 2, 8, 9, 15 a 16), po nichž následuje období bez léčby trvající 12 dní (17. až 28. den). Každé 28denní období se považuje za jeden léčebný cyklus.
Doporučená zahajovací dávka carfilzomibu je 20 mg/m2 (maximální dávka je 44 mg) v prvním cyklu 1. a 2. den. Při snášenlivosti léčby se doporučuje dávku zvýšit v případě kombinace s lenalidomidem a s dexamethasonem na 27 mg/m2 (maximální dávka je 60 mg), resp. na 56 mg/m2 při kombinaci jen s dexamethasonem 8. den prvního cyklu. Léčba může pokračovat až do progrese onemocnění nebo do vzniku neakceptovatelné toxicity. Při kombinaci s carfilzomibem se lenalidomid podává v dávce 25 mg perorálně 1.–21. den a dexamethason v dávce 40 mg perorálně nebo intravenózně 1., 8., 15., a 22. den 28denních cyklů. Dexamethason se má podat 30 minut až 4 hodiny před podáním carfilzomibu, v rámci prvního cyklu je nutná dostatečná prehydratace. U pacientů léčených carfilzomibem je vhodná antivirová profylaxe, mimoto je v případě použití kombinace s lenalidomidem a s dexamethasonem doporučena tromboprofylaxe, která má být založena na vyhodnocení rizik a klinického stavu pacienta.
Zařazení do současné palety léčiv
Pro carfilzomib je oproti předchozí generaci inhibitorů proteasomu (= bortezomib) charakteristická vyšší účinnost a výrazně nižší neurotoxicita, která i v současnosti často limituje pokračování léčby nemocných přes její jednoznačnou účinnost. Carfilzomib je zatím schválen v České republice pro použití pouze u nemocných s relabujícím/refrakterním MM (viz stávající indikace uvedená výše), po vyřešení způsobu aplikace a zavedení opatření k minimalizaci nežádoucích účinků lze do budoucna očekávat jeho využití v rámci primoterapie. Jako nejvhodnější by se v tomto případě jevila jeho kombinace s lenalidomidem, dexamethasonem a s daratumumabem (protilátka proti antigenu CD38 na povrchu myelomových buněk).
Kontraindikace
Kontraindikací léčby carfilzomibem je hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku léčivého přípravku, kterými jsou sodná sůl sulfobutoxybetadexu, bezvodá kyselina citronová (E330) a hydroxid sodný.
Těhotenství a kojení
Jednoznačnou kontraindikaci dále představuje podání carfilzomibu u těhotné, ev. kojící ženy vzhledem ke skutečnosti, že na základě svého mechanismu účinku a provedených pokusů na zvířatech může carfilzomib po podání těhotné ženě způsobit poškození plodu. Pacientky, které mohou otěhotnět (a/nebo jejich partneři), proto musejí používat účinné antikoncepční metody během léčby a jeden měsíc po léčbě. Pacienti (muži) musejí používat účinné antikoncepční metody během léčby a dále tři měsíce po ukončení léčby, je li jejich partnerka těhotná nebo může li otěhotnět a nepoužívá li účinnou antikoncepci. Vzhledem k tomu, že carfilzomib může snižovat účinnost perorální antikoncepce a rovněž zvyšovat riziko vzniku žilních tromboembolických příhod, musejí se ženy během léčby carfilzomibem vyvarovat užívání hormonálních antikoncepčních přípravků, které jsou spojeny s rizikem vzniku trombózy. Pokud tedy pacientka užívá perorální antikoncepci nebo hormonální antikoncepční metodu spojenou s rizikem trombózy, je nutné její převedení na jinou účinnou antikoncepční metodu.
Lékové interakce
Jak již bylo uvedeno, mechanismy zprostředkované cytochromem P450 nejsou v metabolizaci carfilzomibu významné, proto je nepravděpodobné, že by byl jeho farmakokinetický profil ovlivněn souběžným podáním inhibitorů a induktorů cytochromu P450. Carfilzomib neinhibuje in vitro izoenzymy CYP1A2, 2B6, 2C8, 2C9, 2C19 a 2D6, a proto se nepředpokládá, že by ovlivňoval expozici léčivým přípravkům, které jsou substráty těchto enzymů jako výsledek inhibice. Carfilzomib je substrátem P glykoproteinu, proto je při jeho podávání v kombinaci s jinými substráty P glykoproteinu (např. s digoxinem a s kolchicinem) nutná opatrnost.
Závěr
Carfilzomib je selektivní inhibitor proteasomu, jehož použití bylo schváleno ať už samostatně nebo v kombinaci s dexamethasonem nebo s lenalidomidem a s dexamethasonem u nemocných s relapsem nebo s refrakterní formou onemocnění. Jedná se jednoznačně o jeden z nejúčinnějších léků, který byl u nemocných s mnohočetným myelomem dosud testován. Doba bez progrese onemocnění dosažená v rámci studie fáze III ASPIRE je dosud nejdelší, které bylo v této indikaci dosaženo. Carfilzomib se v letošním roce stal lékem dostupným i pro nemocné v České republice. Oproti předchozí generaci inhibitorů proteasomu je pro carfilzomib charakteristická vyšší účinnost a výrazně nižší neurotoxicita, která v minulosti často u nemocných často limitovala pokračování léčby bortezomibem přes její jednoznačnou účinnost. Jde o lék, který do budoucna zřejmě sehraje v léčbě pacientů trpících mnohočetným myelomem jednu z klíčových úloh, a to nejen v případě pokročilého onemocnění, ale postupem času jistě i v rámci primoterapie [15].
Seznam použité literatury
- [1] Kumar SK, Rajkumar SV, Dispenzieri A, et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008; 111: 2516–2520.
- [2] Dimopoulos MA, Chen C, Spencer A, et al. Long‑term follow‑up on overall survival from the MM‑009 and MM‑010 phase III trials of lenalidomide plus dexamethasone in patients with relapsed or refractory multiple myeloma. Leukemia 2009; 23: 2147–2152.
- [3] Benboubker L, Dimopoulos MA, Dispenzieri A, et al. Lenalidomide and dexamethasone in transplant‑ineligible patients with myeloma. N Engl J Med 2014; 371: 906–917.
- [4] Lonial S, Anderson KC. Association of response endpoints with survival outcomes in multiple myeloma. Leukemia 2014; 28: 258–268.
- [5] Jagannath S, Richardson PG, Barlogie B, et al; SUMMIT/CREST Investigators. Bortezomib in combination with dexamethasone for the treatment of patients with relapsed and/or refractory multiple myeloma with less than optimal response to bortezomib alone. Haematologica 2006; 91: 929–934.
- [6] Bringhen S, Larocca A, Rossi D, et al. Efficacy and safety of once‑weekly bortezomib in multiple myeloma patients. Blood 2010; 116: 4745–4753.
- [7] Stewart AK, Rajkumar SV, Dimopoulos MA, et al; ASPIRE Investigators. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015; 372: 142–152.
- [8] Dimopoulos MA, Moreau P, Palumbo A, et al. Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR): a randomised, phase 3, open‑label, multicentre study. Lancet Oncol 2016; 17: 27–38.
- [9] Kuhn DJ, Chen Q, Voorhees PM, et al. Potent activity of carfilzomib, a novel, irreversible inhibitor of the ubiquitin‑proteasome pathway, against preclinical models of multiple myeloma. Blood 2007; 10: 3281–3290.
- [10] Souhrn údajů o přípravku Kyprolis 2015, dostupné na ww.sukl.cz
- [11] Siegel DS, Martin T, Wang M, et al. A phase 2 study of single‑agent carfilzomib (PX‑171‑003‑A1) in patients with relapsed and refractory multiple myeloma. Blood 2012; 120: 2817–2825.
- [12] Niesvizky R, Martin TG III, Bensinger WI, et al. Phase Ib dose‑escalation study (PX‑171‑006) of carfilzomib, lenalidomide, and low‑dose dexamethasone in relapsed or progressive multiple myeloma. Clin Cancer Res 2013; 19: 2248–2256.
- [13] Papadopoulos KP, Siegel DS, Vesole DH, et al. Phase I study of 30‑minute infusion of carfilzomib as single agent or in combination with low‑dose dexamethasone in patients with relapsed and/or refractory multiple myeloma. J Clin Oncol 2015; 33: 732–739.
- [14] Siegel D, Martin T, Nooka A, et al. Integrated safety profile of single‑agent carfilzomib: experience from 526 patients enrolled in 4 phase II clinical studies. Haematologica 2013; 98: 1753–1761.
- [15] Jakubowiak AJ, Dytfeld D, Griffith KA, et al. A phase 1/2 study of carfilzomib in combination with lenalidomide and low‑dose dexamethasone as a frontline treatment for multiple myeloma. Blood 2012; 120: 1801–1809.