Cetuximab
Dostupnost monoklonálních protilátek znamenala na počátku 21. století kvalitativní skok v léčbě onemocnění metastatickým kolorektálním karcinomem. Cetuximab je chimérická protilátka proti receptoru epidermálního růstového faktoru. Mechanismem protinádorového účinku cetuximabu může být kompetitivní blokáda receptoru epidermálního růstového faktoru, mohou se však uplatnit i imunologické mechanismy. Cetuximab je v současné době registrován pro léčbu metastatického kolorektálního karcinomu po selhání standardní chemoterapie a pro léčbu pokročilých karcinomů hlavy a krku v kombinaci s radioterapií. I když je cetuximab účinný i v monoterapii, maxima účinnosti je dosaženo v kombinaci s cytotoxickými chemoterapeutiky nebo s radioterapií. Klinické studie probíhají u řady dalších nádorových onemocnění. Profil toxicity cetuximabu je, podobně jako u jiných biologických léčiv, příznivý, nejvýznamnějším vedlejším účinkem je kožní toxicita.
Farmakologická skupina
Monoklonální protilátky, inhibitory receptoru epidermálního růstového faktoru.
Chemické a fyzikální vlastnosti
Cetuximab je chimérická (lidská a myší) monoklonální protilátka třídy IgG1 proti receptoru epidermálního růstového faktoru. Cetuximab se skládá z oblasti Fv (odpovědné za vazbu na antigen) myšího původu a konstantních oblastí molekuly protilátky humánního původu. Molekulární hmotnost cetuximabu je přibližně 152 kDa. Cetuximab je dodáván v koncentraci 2 mg/ml jako bezbarvá tekutina s příměsí chloridu sodného a fosforečnanu sodného a pH mezi 7,0–7,4.
Mechanismus účinku, farmakodynamika
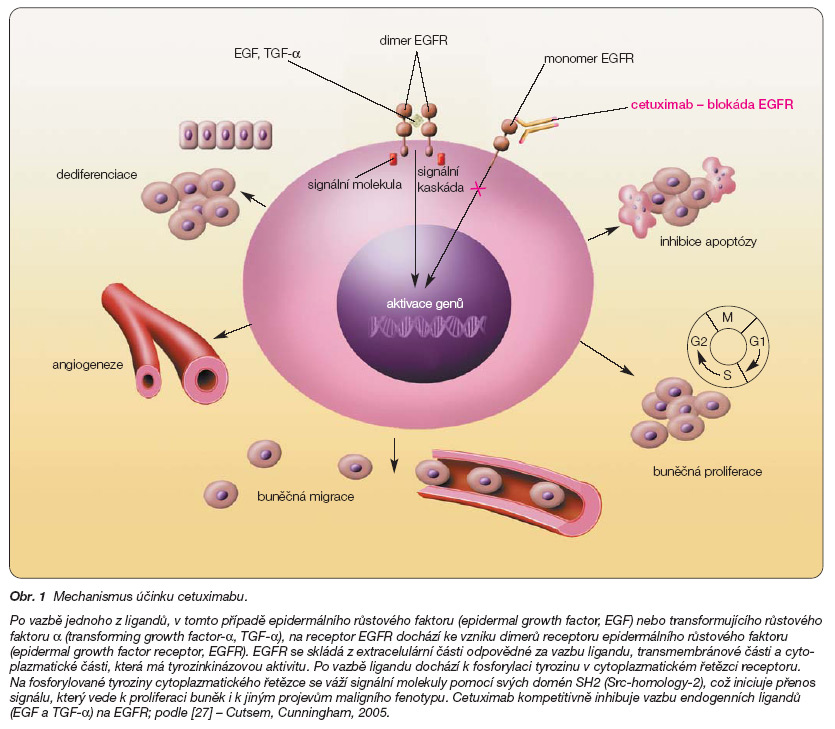
Mechanismus účinku cetuximabu je podmíněn interakcí této monoklonální protilátky s receptorem epidermálního růstového faktoru. Receptor epidermálního růstového faktoru je exprimován na povrchu nádorových buněk u řady malignit. Jedná se o receptor z rodiny lidských receptorů epidermálního růstového faktoru (human epidermal growth factor receptor – HER). Celkem známe 4 molekuly rodiny HER, z nichž receptor epidermálního růstového faktoru označujeme jako HER-1. Molekuly rodiny HER jsou na povrchu buňky přítomny jako monomery a po vazbě ligandů, kterým je v případě HER-1 epidermální růstový faktor (epidermal growth factor, EGF) a transformující růstový faktor a (transforming growth factor-a, TGF-a), dochází ke tvorbě dimerů. Nitrobuněčná část molekuly HER-1 má tyrozinkinázovou aktivitu a fosforylace tyrozinu, ke které dochází po vazbě ligandu, je odpovědná za další přenos signálu prostřednictvím signálních molekul bílkovinné povahy (obr. 1).
Protinádorový účinek cetuximabu může být zprostředkován několika mechanismy [1]. Cetuximab má vůči receptoru epidermálního růstového faktoru vyšší afinitu než přirozené ligandy tohoto receptoru – epidermální růstový faktor a transformující růstový faktor a. Cetuximab tak působí jako kompetitivní inhibitor těchto dvou cytokinů. Vazba cetuximabu na receptor epidermálního růstového faktoru vede také k internalizaci receptorů a ke snížení jejich exprese na povrchu buňky. Při pokusech in vitro inhiboval cetuximab buněčný cyklus ve fázi G1 a indukoval apoptózu nádorových buněk. Cetuximab také snižuje produkci autokrinních růstových faktorů v nádorových buňkách, například TGF-a, i angiogenních faktorů, včetně vaskulárního endoteliálního růstového faktoru (VEGF). V experimentálních studiích bylo rovněž prokázáno, že cetuximab snižuje invazivitu nádorových buněk a tvorbu metastáz. Cetuximab rovněž potencuje účinnost radioterapie. Synergistický účinek radioterapie a cetuximabu se zatím uplatnil zejména v léčbě pokročilých nádorů hlavy a krku [2]. V mechanismu účinku in vivo se může uplatnit skutečnost, že cetuximab je protilátkou, jejíž vazba na příslušný antigen může iniciovat cytotoxicitu buněk imunitního systému (makrofágů a NK buněk).
Dle zkušeností s jinými molekulárně-cílenými nádorovými léčivy bychom očekávali, že předpokladem účinnosti cetuximabu v klinické praxi bude průkaz exprese receptoru epidermálního růstového faktoru, ale klinická data toto očekávání nepotvrdila. U nemocných je dle dosud dostupných dat účinnost cetuximabu nezávislá na stupni exprese receptoru epidermálního růstového faktoru (zjištěném imunohistochemicky) [3]. Účinnost cetuximabu byla prokázána naopak i u nemocných, u kterých byl výsledek imunohistochemického vyšetření receptoru epidermálního růstového faktoru negativní. V retrospektivní analýze nemocných s metastatickým kolorektálním karcinomem a s negativním výsledkem imunohistochemického vyšetření exprese receptoru epidermálního růstového faktoru byla objektivní odpověď pozorována ve stejném procentu jako v prospektivní studii u nemocných s prokázanou expresí receptoru epidermálního růstového faktoru [4]. Prediktivním faktorem účinnosti cetuximabu však může být amplifikace genu receptoru epidermálního růstového faktoru detekovaná metodou fluorescenční in situ hybridizace (FISH). V pilotní studii byla přítomnost amplifikace genu receptoru epidermálního růstového faktoru prokázána metodou FISH u 8 z 9 nemocných, u kterých byla zaznamenána objektivní odpověď, ale pouze u 1 z 21 nemocných, u kterých se objektivní odpovědi nepodařilo dosáhnout [5].
Farmakokinetické vlastnosti
Cetuximab je podáván ve formě intravenózní infuze. Při podání cetuximabu v běžně používaném dávkování (první dávka 400 mg/m2, následné týdenní dávky 250 mg/m2) byly pozorovány maximální koncentrace v séru v rozmezí 153–202 mg/ml a plocha pod křivkou (AUC) byla v prvních 4 týdnech léčby 12 520–17 337 mg.h/ml [1]. Střední objem distribuce cetuximabu je 45–62 ml/kg, tedy přibližně odpovídá objemu plazmy.
Za hlavní cestu eliminace je považována vazba na receptor epidermálního růstového faktoru ve tkáních, zejména v játrech a kůži, s následnou internalizací a degradací komplexu cetuximab-receptor [1]. Clearance cetuximabu se snižuje se zvyšující se dávkou, což naznačuje saturaci této cesty eliminace [6]. Střední poločas eliminace cetuximabu je při standardním dávkování 79–129 hodin. Maximální účinnosti léčby cetuximabem je dosaženo při úplné saturaci receptorů epidermálního růstového faktoru. Této saturace je dosaženo právě dávkovacím schématem používaným v klinické praxi (první dávka 400 mg/m2, následné týdenní dávky 250 mg/m2).
Klinické zkušenosti
Kolorektální karcinom
Účinnost cetuximabu jako monoklonální protilátky proti receptoru epidermálního růstového faktoru je teoreticky dána expresí cílové molekuly nádorovými buňkami. Exprese epidermálního růstového faktoru je přítomna u řady běžně se vyskytujících nádorových onemocnění. Účinnost léčby cetuximabem je v současné době dokumentována především u nemocných s metastatickým kolorektálním karcinomem po selhání léčby irinotekanem. U nemocných s kolorektálním karcinomem je exprese receptoru epidermálního růstového faktoru velmi různorodá, co se týče procenta buněk exprimujících tento receptor i intenzity exprese, nicméně u velké většiny nemocných je prokazatelná exprese této molekuly nádorovými buňkami. Exprese receptoru epidermálního růstového faktoru je rovněž u nemocných s kolorektálním karcinomem spojena se špatnou prognózou. V pilotní studii s 57 nemocnými s metastatickým kolorektálním karcinomem (jaterní metastázy u 70 % nemocných) po selhání léčby irinotekanem byla po podání cetuximabu v monoterapii objektivní odpověď zaznamenána u 11 % případů, u dalších 35 % pacientů bylo onemocnění nejméně 3 měsíce bez progrese a medián přežití všech nemocných byl 6 měsíců [7]. Ve studii BOND, na jejímž základě byl cetuximab v indikaci metastatického kolorektálního karcinomu registrován, bylo 329 nemocných s metastatickým kolorektálním karcinomem, který progredoval při léčbě nebo do 3 měsíců po ukončení léčby irinotekanem (většina nemocných byla rovněž léčena v minulosti oxaliplatinou), randomizováno na léčbu kombinací irinotekanu a cetuximabu a na monoterapii cetuximabem [3]. Cetuximab byl podáván v počáteční dávce 400 mg/m2 a v následných týdenních dávkách 250 mg/m2. Parciální odpověď byla zaznamenána u 23 % nemocných léčených kombinací cetuximabu a irinotekanu a u 11 % nemocných s monoterapií cetuximabem. Procento objektivní odpovědi se nelišilo u nemocných léčených v minulosti oxaliplatinou i u nemocných se striktně definovanou rezistencí na irinotekan (progrese během léčby nebo do 1 měsíce po léčbě). Podmínkou zařazení do této studie byl imunohistochemický průkaz exprese receptoru epidermálního růstového faktoru, procento objektivní odpovědi bylo však prakticky identické u nemocných s nízkým či vysokým procentem pozitivních buněk nebo s nízkou i vysokou intenzitou exprese. U nemocných s prokazatelnou expresí receptoru epidermálního růstového faktoru je tedy dle dosud dostupných dat účinnost cetuximabu zcela nezávislá na stupni exprese [3]. Navíc byla účinnost léčby cetuximabem prokázána i u nemocných, u kterých bylo imunohistochemické vyšetření exprese receptoru epidermálního růstového faktoru negativní. Například v retrospektivní analýze 16 nemocných s metastatickým kolorektálním karcinomem léčených v Memorial Sloan-Kettering Cancer Center v New Yorku, u kterých byl výsledek imunohistochemického vyšetření exprese receptoru epidermálního růstového faktoru negativní, byla objektivní odpověď pozorována ve 4 případech (25 %) [4], tedy prakticky ve stejném procentu jako v prospektivní studii u nemocných s prokázanou expresí receptoru epidermálního růstového faktoru [3]. Naopak procento objektivní odpovědi bylo výrazně vyšší u nemocných, u kterých se během léčby objevil akneiformní exantém stupně 3 nebo 4 (objektivní odpověď v 59 % při kombinované léčbě a ve 25 % v monoterapii) než u nemocných bez akneiformního exantému (objektivní odpověď v 17 % při kombinační léčbě a v 7 % v monoterapii). Medián trvání odpovědi byl ve studii BOND 6 měsíců u nemocných léčených kombinací a 4 měsíce u nemocných s monoterapií cetuximabem. Medián přežití byl 9 měsíců u nemocných léčených kombinovanou léčbou a 7 měsíců u nemocných léčených cetuximabem v monoterapii. Použití cetuximabu v kombinaci s chemoterapií v léčbě první linie metastatického kolorektálního karcinomu je v současné době předmětem klinických studií.
Karcinomy hlavy a krku
Další skupinou onemocnění, u které byla dokumentována účinnost léčby cetuximabem, jsou karcinomy hlavy a krku. Podobně jako v případě kolorektálního karcinomu, je dokumentována účinnost cetuximabu u nemocných s karcinomy hlavy a krku progredujícími při standardní chemoterapii. Ve studii II. fáze u 96 nemocných s nádory progredujícími při chemoterapii založené na derivátech platiny vedlo přidání cetuximabu k léčbě cisplatinou k objektivní odpovědi u 10 % nemocných a ke kontrole onemocnění (k objektivní odpovědi nebo k stabilnímu onemocnění) u 53 % pacientů s mediánem přežití 6 měsíců [8]. V jiné studii II. fáze byla v případě absence odpovědi při chemoterapii založené na cisplatině (progrese nebo stabilní onemocnění) podána kombinace cetuximabu a cisplatiny [9]. Počet objektivních odpovědí u nemocných se stabilním nebo progredujícím onemocněním se pohyboval mezi 6 % a 20 % a medián přežití mezi 4 a 12 měsíci. V randomizované studii byla srovnávána účinnost radioterapie a radioterapie s konkomitantním podáním cetuximabu u nemocných s pokročilými nádory hlavy a krku [2]. Doba lokoregionální kontroly (24 v. 15 měsíců) i celkové přežití (49 v. 29 měsíců) byly statisticky významně delší u nemocných léčených kombinací cetuximabu a radioterapie. Výsledky této studie se staly podkladem pro nedávnou registraci cetuximabu v indikaci léčby pokročilých karcinomů hlavy a krku.
Ostatní nádorová onemocnění
Receptor epidermálního růstového faktoru hraje roli v progresi řady nádorových onemocnění a klinické studie se uskutečnily i u nemocných s těmito nádory. Z pochopitelných důvodů byly tyto studie provedeny v prvé řadě u nemocných s nádory, které omezeně reagují na cytotoxickou chemoterapii. Nadějné výsledky byly například zveřejněny v indikaci pokročilého karcinomu pankreatu a v této indikaci v současné době probíhají klinické studie [10].
Povzbudivé jsou rovněž výsledky léčby cetuximabem v kombinaci s irinotekanem, 5-fluorouracilem a leukovorinem u nemocných s pokročilým karcinomem žaludku nebo gastroezofageálního spojení [11], zatímco u jiných diagnóz, např. metastatického karcinomu ledviny, byly výsledky léčby cetuximabem v klinických studiích dosud spíše zklamáním [12].
Zařazení do současné palety léčiv
Cetuximab je jednou ze dvou monoklonálních protilátek, které jsou v současné době standardně používány v léčbě onemocnění metastatickým kolorektálním karcinomem. Z dostupných inhibitorů receptoru epidermálního růstového faktoru (erlotinib, gefitinib, cetuximab, panitumumab) je v této indikaci zatím v klinické praxi používán jediný. V posledním desetiletí jsme byli svědky významného pokroku v léčbě pacientů s metastatickým kolorektálním karcinomem. Léčba metastatického onemocnění byla u kolorektálního karcinomu dlouhou dobu považována za léčbu paliativní. To v současné době alespoň u části nemocných neplatí. V kombinaci s chirurgickou léčbou (resekce jater, případně resekce plic) je v současné době možno určitou část nemocných s metastatickým kolorektálním karcinomem trvale vyléčit. Možnost kurativní léčby je dokumentována zejména v případě jaterních metastáz. I když je dosud kurabilita nemocných s metastatickým onemocněním nízká, je významné prodloužení doby přežití těchto nemocných v klinických studiích i v běžné praxi zřejmé. Rozhodujícím faktorem zlepšení prognózy nemocných s metastatickým kolorektálním karcinomem je výrazný pokrok ve farmakoterapii v posledním desetiletí. Vzhledem k možnosti kurativní léčby i vzhledem k významnému prodloužení doby přežití nemocných s metastatickým postižením jater při onemocnění kolorektálním karcinomem jsou účinné režimy kombinované chemoterapie indikovány u významného procenta pacientů. Zatímco od konce padesátých let 20. století byly několik desetiletí jedinou účinnou protinádorovou farmakoterapií při onemocnění metastatickým kolorektálním karcinomem fluoropyrimidiny, po roce 1990 se objevily další účinné látky v této indikaci s odlišným mechanismem účinku. Jednotlivé randomizované studie [13–16] i metaanalýza dat těchto studií [17] již počátkem 90. let 20. století prokázaly, že chemoterapie statisticky významně prodlužuje ve srovnání s podpůrnou léčbou dobu přežití u nemocných s pokročilým (většinou metastatickým) kolorektálním karcinomem. Podání chemoterapie vedlo k prodloužení mediánu přežití z 8 na 12 měsíců, počet žijících pacientů byl při léčbě chemoterapií po 6 a 12 měsících o 16 % vyšší (79 % oproti 63 % a 50 % oproti 34 %).
Následně se ukázalo, že kombinovaná chemoterapie je spojena s dvojnásobně vyšším procentem objektivní odpovědi i s prodloužením doby přežití. Je rovněž zřejmé, že se prognóza nemocných s metastatickým kolorektálním karcinomem zlepšila s dostupností léčby irinotekanem a oxaliplatinou [18] a medián přežití nemocných léčených kombinovanou chemoterapií se pohyboval mezi 18 a 24 měsíci. Kvalitativní skok v léčbě metastatického kolorektálního karcinomu na počátku 21. století znamenalo zavedení dvou monoklonálních protilátek – cetuximabu a bevacizumabu – do léčby. Vzhledem k datům klinických studií je cetuximab v současné době používán v další linii léčby metastatického kolorektálního karcinomu, po selhání kombinované cytotoxické léčby.
Zcela nově byl cetuximab registrován, v kombinaci s radioterapií, pro léčbu pokročilých karcinomů hlavy a krku. Jako karcinomy hlavy a krku označujeme poněkud heterogenní skupinu nádorových onemocnění převážně dlaždicobuněčné histologie vznikajících maligní transformací sliznice dutiny ústní, slinných žláz, dutiny nosní, vedlejších dutin nosních, hltanu a hrtanu. U velké části těchto nádorů je zřejmá etiologická souvislost s kouřením a alkoholismem [19]. Komorbidita spojená s kouřením a alkoholismem (ischemická choroba srdeční, chronická obstrukční choroba plicní a jaterní cirhóza) může být u řady nemocných faktorem limitujícím použití protinádorové léčby. Účinnou léčbou pokročilých nádorů hlavy a krku je radioterapie. Použití systémové chemoterapie u těchto nemocných je samozřejmě komplikováno častou komorbiditou. Mezi nejúčinnější cytotoxické léky u metastatických karcinomů hlavy a krku patří 5-fluorouracil, cisplatina, paklitaxel a ifosfamid [20]. Na základě randomizovaných studií je zřejmé, že systémová chemoterapie vede k mírnému prodloužení (přibližně v řádu 2 měsíců) přežití ve srovnání s pouze podpůrnou léčbou [20]. Kombinovaná chemoterapie vede k vyššímu procentu objektivní odpovědi, prodloužení přežití nebylo však prokázáno. Chemoterapie rovněž potencuje účinnost radioterapie v této indikaci. Indikace cetuximabu v kombinaci s radioterapií je založena na výsledcích randomizované studie srovnávající účinnost samotné radioterapie a radioterapie kombinované s konkomitantním podáním cetuximabu u nemocných s pokročilými nádory hlavy a krku [2]. Doba lokoregionální kontroly (24 v. 15 měsíců) i celkové přežití (49 v. 29 měsíců) byly v této studii statisticky významně delší u nemocných léčených kombinovanou léčbou. Výhodou cetuximabu oproti cytotoxickým látkám (v této indikaci zejména cisplatina) je příznivý profil toxicity.
Indikace
V současné době hlavní registrovanou indikací cetuximabu je metastatický kolorektální karcinom u nemocných s prokázanou progresí po předchozí chemoterapii irinotekanem. Bývá uváděna podmínka prokázané exprese receptoru epidermálního růstového faktoru nádorovými buňkami, klinické zkušenosti však ukazují, že léčba cetuximabem je prakticky stejně účinná i u nemocných s negativním výsledkem imunohistochemického vyšetření receptorů epidermálního růstového faktoru [4].
Zcela novou indikací, pro kterou registrace proběhla v nedávné době, je léčba pokročilého karcinomu hlavy a krku v kombinaci s radioterapií. Klinické studie probíhají v dalších indikacích u jiných nádorových onemocnění a rovněž v první linii léčby metastatického kolorektálního karcinomu i v adjuvantní léčbě.
Kontraindikace
Jako absolutní kontraindikace bývá udávána přecitlivělost na cetuximab. Ta se projevuje tzv. infuzní reakcí. Jak však ukazují naše zkušenosti [21], podání cetuximabu je možné i u nemocných po předchozí těžké infuzní reakci. Je tedy otázkou, zda vůbec existují absolutní kontraindikace podání cetuximabu. Profil toxicity cetuximabu je, podobně jako u jiných biologických léčiv, relativně příznivý, takže například v monoterapii můžeme cetuximab podávat i nemocným, u kterých by podání cytotoxických látek bylo problematické. Kontraindikace cetuximabu tedy jsou, podobně jako u většiny ostatních biologických léčiv, minimální.
Nežádoucí účinky
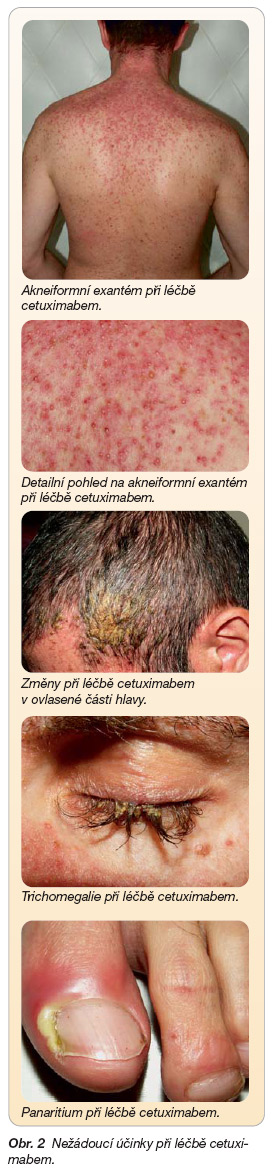
Výhody cílené terapie se projevují rovněž i v oblasti vedlejších účinků. Dráhy přenosu signálu jsou v normálních buňkách redundantní a vyřazení jedné z těchto drah má proto omezený účinek na zdravé tkáně. Spektrum nežádoucích účinků biologických léčiv je také zcela odlišné, než je tomu v případě cytotoxických léčiv. Tyto skutečnosti lze doložit i na příkladu cetuximabu. Nejčastějším vedlejším účinkem je kožní exantém. Kožní eflorescence připomínají akné (akneiformní exantém) a nejčastěji postihují kůži obličeje a trupu. Mezi jiné projevy kožní toxicity patří xerodermie, trichomegalie či paronychia (obr. 2).
Specifickou problematiku představuje postižení oční periorbitální kůže a víček, které bývá spojeno i s konjunktivitidou [22]. Stupeň kožního postižení je nejvýznamnějším prediktivním faktorem účinnosti cetuximabu. Například ve studii BOND bylo procento objektivní odpovědi významně vyšší u nemocných, u kterých se objevil výraznější akneiformní exantém (objektivní odpověď v 59 % při kombinované léčbě a 25 % v monoterapii) než u nemocných bez akneiformního exantému (objektivní odpověď v 17 % při kombinované léčbě a 7 % v monoterapii) [3]. Kožní toxicitu je možno zvládnout lokální terapií nebo perorálním podáváním doxycyklinu. Jen výjimečně jsou projevy kožní toxicity natolik závažné, že vedou k přerušení léčby [23, 24].
Nejzávažnějším a nejdramatičtějším, i když vzácným vedlejším účinkem léčby cetuximabem jsou infuzní reakce [25]. Závažné infuzní reakce se vyskytují pouze u několika procent nemocných léčených cetuximabem. Klinicky se infuzní reakce projevuje zarudnutím kůže a dechovou tísní, při závažných infuzních reakcích se můžeme setkat s přechodnou hypotenzí, ztrátou vědomí, zástavou dechu i oběhu. Na našem pracovišti jsme pozorovali několik případů reakce, po stabilizaci stavu a podání kortikoidů a antihistaminik bylo možné pokračovat v infuzi cetuximabu za monitorování na jednotce intenzivní péče bez další závažných projevů [21]. Etiologie infuzních reakcí není jasná, v literatuře se tyto reakce označují jako hypersenzitivní, anafylaktoidní či alergické. Tyto reakce připomínají reakce po podání jiných monoklonálních protilátek, např. rituximabu a infliximabu, a na základě dostupných informací se zdá, že podobně jako infuzní reakce po podání rituximabu nemá většina těchto příhod po podání cetuximabu alergickou etiologii. Podobně jako v případě rituximabu se může jednat o mohutnou systémovou zánětlivou odpověď. Jako důležitý se jeví poznatek, že za pečlivého monitorování vitálních funkcí na jednotce intenzivní péče je možno pokračovat v léčbě cetuximabem, následující infuze v týdenních intervalech bylo možno podat bez komplikací ambulantně [21]. Kazuistické zkušenosti rovněž ukazují, že je po úspěšně zvládnuté závažné infuzní reakci možno dosáhnout parciální odpovědi [21].
Dalším specifickým účinkem léčby cetuximabem je hypomagnezémie [26]. Pokles hladiny hořčíku v séru může být během léčby cetuximabem poměrně významný a s hypomagnezémií se setkáváme poměrně často, ale pouze vzácně vede pokles hladiny hořčíku v séru ke klinicky významným projevům.
U nemocných léčených cetuximabem se rovněž relativně často setkáváme s průjmy. Tento projev gastrointestinální toxicity léčby cetuximabem není vzácný, ale průjmy po podání cetuximabu v monoterapii jsou málokdy závažné. V klinické praxi je však cetuximab kombinován s irinotekanem, cytotoxickým léčivem, jehož hlavní toxicitou je enterotoxicita, a při kombinační léčbě těmito dvěma léčivy jsou zaznamenány závažné projevy gastrointestinální toxicity (v tomto případě především průjmy) významně častěji.
Lékové interakce
Mezi klinicky významné lékové interakce patří v prvé řadě synergický účinek cetuximabu při podání s cytotoxickými chemoterapeutiky, zejména s irinotekanem. Z klinických dat je zřejmé, že podání cetuximabu může způsobit reverzi rezistence na irinotekan [3]. Farmakokinetické interakce nebyly popsány s cisplatinou, docetaxelem, 5-fluorouracilem nebo s irinotekanem [1].
Těhotenství a kojení
Metastatický kolorektální karcinom je v těhotenství a v průběhu laktace vzácně se vyskytujícím onemocněním. Navíc je cetuximab zatím standardně podáván po selhání kombinované chemoterapie, tedy zpravidla záhy po často dlouhodobé léčbě, která těhotenství do značné míry vylučuje, proto klinické zkušenosti s podáváním léčiva u těhotných a kojících žen prakticky chybějí. Každá takováto zkušenost by samozřejmě zasluhovala kazuistické zpracování, nicméně vzhledem k absenci, byť jen kazuistických, zkušeností s léčbou cetuximabem v těhotenství a laktaci musíme vycházet v doporučeních z teoretických předpokladů. Vzhledem k tomu, že se jedná o protilátku IgG1, lze očekávat, že bude cetuximab procházet placentou. Receptor epidermálního růstového faktoru hraje důležitou roli v organogenezi, blokáda tohoto receptoru tedy může mít za následek vývojové vady. V případě nutnosti léčby cetuximabem u těhotné nemocné je tedy nutno nemocnou poučit o těchto rizicích. Protilátky IgG1 rovněž procházejí do mléka, proto je nutno laktaci při léčbě cetuximabem přerušit.
Dávkování
Standardně je cetuximab podáván v monoterapii i v kombinacích v týdenním dávkování. První podání představuje dávka 400 mg/m2 (loading dose), následně jsou podávány týdenní udržovací dávky 250 mg/m2 [3]. Lék je aplikován bez dalšího ředění infuzními sety s filtry o velikosti pórů 0,2 mm. Podobně jako v případě jiných protinádorových léčiv je cetuximab podáván do progrese onemocnění, případně do momentu dosažení maximálního efektu léčby.
Balení
Cetuximab je dodáván ve formě roztoku ve skleněných lahvičkách s 50 ml roztoku po 100 mg (2 mg/ml) – viz tab. 1.
Stabilita
Cetuximab je ve formě roztoku skladován při teplotě 2–8 °C. Pro přípravu infuze je stanovené množství roztoku cetuximabu bez dalšího ředění přemístěno do infuzního vaku. Takto připravená infuze je stabilní 8 hodin při pokojové teplotě a 12 hodin při teplotě 2–8 °C.
Seznam použité literatury
- [1] Reynolds NA, Wagstaff AJ. Cetuximab in the treatment of metastatic colorectal cancer. Drugs 2004; 64: 109–118.
- [2] Bonner JA, Harari PM, Giralt J, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354: 567–578.
- [3] Cunningham D, Hurnblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotekan in irinotekan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351: 337–345.
- [4] Chung KY, Shia J, Kemeny NE, et al. Cetuximab shows activity in colorectal cancer patients with tumors that do not express the epidermal growth factor receptor by immunohistochemistry. J Clin Oncol 2005; 23: 1803–1810.
- [5] Moroni M, Veronese S, Benvenuti S, et al. Gene copy number for epidermal growth factor receptor (EGFR) and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol 2005; 6: 279–286.
- [6] Baselga J, Pfister D, Cooper MR, et al. Phase I studies of anti-epidermal growth factor receptor chimeric antibody C225 alone and in combination with cisplatin. J Clin Oncol 2000; 18: 904–914.
- [7] Saltz LB, Meropol NJ, Loehrer PJ, et al. Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor. J Clin Oncol 2004; 22: 1201–1208.
- [8] Baselga J, Trigo JM, Bourhis J, et al. Phase II multicenter study of the antiepidermal growth factor receptor monoclonal antibody cetuximab in combination with platinum-based chemotherapy in patients with platinum-refractory meta-static and/or recurrent squamous cell carcinoma of the head and neck. J Clin Oncol 2005; 23: 5568–5577.
- [9] Herbst RS, Arquette M, Shin DM, et al. Phase II multicenter study of the epidermal growth factor receptor antibody cetuximab and cisplatin for recurrent and refractory squamous cell carcinoma of the head and neck. J Clin Oncol 2005; 23: 5578–5587.
- [10] Krempien R, Muenter MW, Huber PE, et al. Randomized phase II – study evaluating EGFR targeting therapy with Cetuximab in combination with radiotherapy and chemotherapy for patients with locally advanced pancreatic cancer – PARC: study protokol (ISRCTN56652283). BMC Cancer 2005; 5: 131.
- [11] Pinto C, Di Fabio F, Siena S, et al. Phase II study of cetuximab in combination with FOLFIRI in patients with untreated advanced gastric or gastroesophageal junction adenocarcinoma (FOLCETUX study). Ann Oncol 2007; 18: 510–517.
- [12] Amato RJ. Renal cell carcinoma: review of novel single-agent therapeutics and combination regimens. Ann Oncol 2005; 16: 7–15.
- [13] Scheithauer W, Rosen H, Kornek GV, et al. Randomised comparison of combination chemotherapy plus supportive care with supportive care alone in patients with metastatic colorectal cancer. Br Med J 1993; 306: 752–755.
- [14] Nordic Gastrointestinal Tumor Adjuvant Therapy Group: Expectancy or primary chemotherapy in patients with advanced colorectal cancer: a randomized trial. J Clin Oncol 1992; 10: 904–911.
- [15] Allen-Mersh TG, Earlam S, Fordy C, et al. Quality of life and survival with continuous hepatic-artery floxuridine infusion for colorectal liver metastases. Lancet 1994; 344: 1255–1260.
- [16] Rougier P, Laplanche A, Huguier M, et al. Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma: Long-term results of a prospective randomized trial. J Clin Oncol 1992; 10: 1112–1118.
- [17] Colorectal Cancer Collaborative Group: Palliative chemotherapy for advanced colorectal can cer: systemic review and meta-analysis. Br Med J 2000; 321: 531–535.
- [18] Grothey A, Sargent D, Goldberg RM, Schmoll HJ. Survival of patients with advanced colorectal cancer improves with the availability of fluorouracil – leucovorin, irinotekan, and oxaliplatin in the course of treatment. J Clin Oncol 2004; 22: 1209–1214.
- [19] Forastiere A, Koch W, Trotti A, Sidransky D. Head and neck cancer. N Engl J Med 2001; 345: 1890–1900.
- [20] Lamont EB, Vokes EE. Chemotherapy in the management of squamous-cell carcinoma of the head and neck. Lancet Oncol 2001; 2: 261–269.
- [21] Melichar B, Cerman J, Malířová E. Successful management of infusion reaction accompanying the start of cetuximab therapy. Support Care Cancer 2007; v tisku.
- [22] Melichar B, Němcová I. Eye complications of cetuximab therapy. Eur J Cancer Care 2007; v tisku.
- [23] Segaert S, Van Cutsem E. Clinical signs, pathophysiology and management of skin toxicity during therapy with epidermal growth factor receptor inhibitors. Ann Oncol 2005; 16: 1425–1433.
- [24] Segaert S, Tabernero J, Chosidow O, et al. Management of skin reaction in cancer patients receiving epidermal growth factor receptor targeted therapies. J Dtsch Dermatol Ges 2005; 3: 599–606.
- [25] Patel DD, Goldberg RM. Cetuximab-associated infusion reactions: pathology and management. Oncology 2006; 20: 1373–1397.
- [26] Schrag D, Chung KY, Flombaum C, Saltz L. Cetuximab therapy and symptomatic hypomagnesemia. J Natl Cancer Inst 2005; 97: 1221–1224.
- [27] Cutsem EV, Cunningham D (edits). Cetuximab (Erbitux) in the treatment of cancer. Oncol Bio-therapeutics 2005; 3: 8–14.