Cinacalceti hydrochloridum
Kalcimimetikum 2. generace, cinacalcet HCl představuje zcela nový terapeutický přístup k léčbě stavů spojených s dlouhodobě vysokou aktivitou příštítných tělísek (sekundární a primární hyperparatyreóza). Preparát se podává perorálně, obvykle jedenkrát denně v dávkách 30 i více mg a jeho hlavní indikací je akcentovaná hyperparatyreóza provázející selhání ledvin. Působí na receptory pro kalcium (CaR) lokalizované na povrchu příštítných tělísek a zvyšuje jejich citlivost na extracelulární koncentraci kalcia. Tím působí pokles sekrece PTH již při nižších hladinách kalcia, než by k potlačení sekrece PTH byly potřebné (posun tzv. set-point doleva). Na rozdíl od ostatních terapeutických přístupů dosud používaných v terapii hyperparatyreózy (aktivní metabolity vitaminu D či jeho analoga) nezvyšuje kalcémii ani fosfatémii, naopak tyto parametry spíše snižuje. Tím představuje jediný způsob, jak dosáhnout souběžně cílových sérových koncentrací PTH i fosforu u pacientů s chronickým onemocněním ledvin podle klinických doporučení K/DOQI pro léčbu poruchy minerálového a kostního metabolismu. Pokles koncentrace kalcia v séru je obvykle mírný a je řešitelný úpravou průvodní terapie (malé dávky aktivního vitaminu D a/nebo suplementace kalciem). Nežádoucí účinky jsou ojedinělé a nezávažné a rozhodně převažuje terapeutický profit
Farmakologická skupina
Cinacalcet HCl je kalcimimetikum neboli látka, která zvyšuje citlivost CaR (calcium senzing receptoru) na povrchu hlavních buněk příštítných tělísek vůči extracelulární koncentraci kalcia. Stimulace CaR snižuje sekreci parathormonu. Kalcimimetika tedy patří mezi antiparatyreoidální prostředky, tj. mezi léky snižující hladinu parathormonu v krvi.
Hyperparatyreóza nastává buď primárně (adenom produkující nekontrolovaně PTH, tzv. primární hyperparatyreóza, výjimečně karcinom příštítných tělísek), nebo sekundárně, v důsledku stimulace příštítných tělísek určitými podněty (dlouhodobá hypokalcémie, hyperfosfatémie, nedostatek aktivního vitaminu D). Typicky nastává sekundární hyperparatyreóza při snížení funkce ledvin a jejich selhání (viz dále).
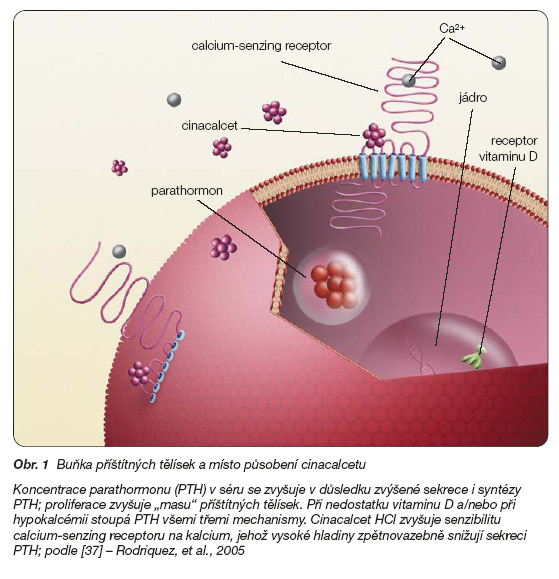
Antiparatyreoidální látky působí obecně dvěma základními mechanismy: přímým ovlivněním receptoru pro vitamin D (VDR) či ovlivněním receptoru pro kalcium (calcium-senzing receptor – CaR) (obr. 1).
Terapeuticky lze ovlivnit VDR syntetickým aktivním vitaminem D3 (kalcitriol) či jeho analogy (např. parikalcitol, viz dále). Na rozdíl od VDR možnost terapeutického ovlivnění CaR dosud v praxi chyběla. Právě tímto mechanismem účinku se cinacalcet HCl stává unikátním přípravkem v léčbě stavů spojených s chronickou nadprodukcí a nadměrnou sekrecí parathormonu (primární a zejména sekundární hyperparatyreóza, léčba hyperkalcémie při karcinomu příštítných tělísek a další stavy).
Chemické a fyzikální vlastnosti
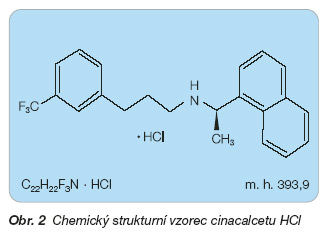
Cinacalcet HCl je chemicky N- (1-(R) – (-) – (1-naphtyl)ethyl)-3-(3-(trifluoromethyl)phenyl)-1-aminopropan hydrochlorid. Cinacalcet HCl je bílá až bezbarvá sloučenina rozpustná v methanolu nebo v 95% alkoholu a velmi málo rozpustná ve vodě, tj. je vysoce lipofilní. Je analogem výchozího kalcimimetika 1. generace (preparátu NPS R 568) neboli představuje 2. generaci kalcimimetik, patří mezi fenylalkylaminy (obr. 2).
Sumární vzorec:
C22H22F3N . HCl (cinacalcet HCl)
C22H22F3N (cinacalcet)
Molekulová hmotnost:
393,9 (cinacalcet HCl)
357,4 g/mol (cinacalcet)
Mechanismus účinku
Hlavním mechanismem působení kalcimimetik je zvýšení citlivosti receptorů pro kalcium (CaR, calcium senzing receptor) na povrchu buněk příštítných tělísek na extracelulární koncentraci kalcia (obr. 1).
Extracelulární koncentrace kalcia je hlavním faktorem, který reguluje sekreci parathormonu. Tato regulace je přímá a zpětnovazebná. Pokud se koncentrace kalcia v séru sníží, sekrece parathormonu stoupá. Naopak při vzestupu kalcémie se za fyziologických okolností sekrece PTH snižuje.
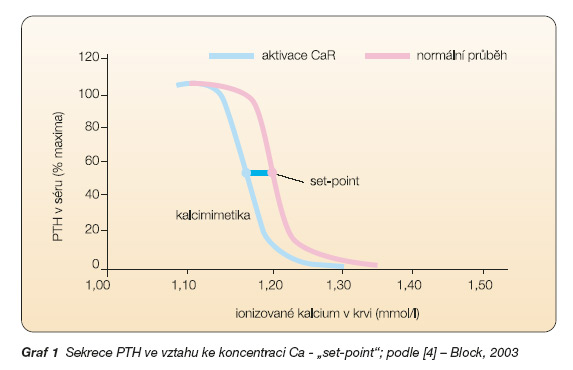
Při selhání ledvin je však k potlačení sekrece parathormonu zapotřebí vyšší koncentrace kalcia, tzv. set-point, tj. koncentrace kalcia potřebná k potlačení sekrece parathormonu o 50 % se posunuje na křivce vztahu mezi kalciem a PTH doprava.
Z toho vyplývá, že při hyperparatyreóze provázející selhání ledvin nezajistí normokalcémie a často ani hyperkalcémie pokles sekrece parathormonu. Příčiny jsou komplexní (viz dále). Kalcimimetika tento narušený vztah mezi kalciem a PTH upravují, zvyšují citlivost CaR na koncentraci kalcia, posunují „set-point" doleva (graf 1), a to v závislosti na podané dávce.
Lze rozlišit dva typy kalcimimetik (I. a II. typ) [34, 14].
Kalcimimetika I. typu
Působí přímo na receptor, na který se navazují. Místem působení je extracelulární část molekuly. Fyziologickým a nejvýznamnějším kalcimimetikem I. typu je extracelulární kalcium. Patří sem další anorganické kationty (například magnezium) a též některé kationty organické.
Kalcimimetika II. typu
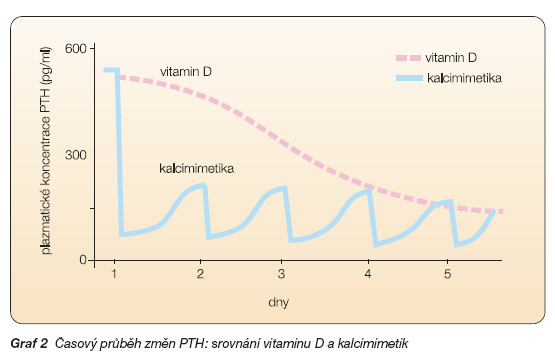
Jedná se o alosterické modulátory receptoru a patří sem některé L-aminokyseliny a fenylalkylaminy. Reagují nikoliv s extracelulární částí, ale s tou částí molekuly receptoru, která protíná buněčný povrch. Nepůsobí přímo aktivaci receptoru, ale zvyšují citlivost receptoru na kalcium. Kalcimimetika II. typu využívaná k terapeutickému výzkumu a nyní i v klinické praxi patří mezi fenylalkylaminy. Reagují s intramembranózním segmentem CaR a zvyšují přenos (transdukci) signálu vyvolaného extracelulárním kalciem (1. posel). Tím dochází ke konformačním změnám ve tvaru a funkci receptoru [18, 37]. Konečným efektem aktivace či modulace CaR je snížení sekrece již vytvořeného parathormonu, a to v časovém odstupu několika málo hodin po podání (graf 2). Jak bude dále vysvětleno, akutní regulace koncentrace parathormonu je řízena CaR, zatímco VDR ovlivňuje dlouhodobý průběh. Biologická odpověď řízená oběma receptory je však vzájemně propojena.
Receptor pro kalcium (calcium-senzing receptor, CaR)
Místem účinku kalcimimetik je CaR. Tento receptor popsal a též klonoval poprvé Brown v roce 1993 [7]. Vyskytuje se zejména na povrchu hlavních buněk příštítných tělísek, ale byl nalezen i v mnoha dalších orgánech (štítná žláza, prekurzory osteoblastů, tubulární ledvinné buňky a další). Má zcela zásadní význam pro kalciovou homeostázu organismu [7, 27, 13, 9, 37].
Receptor je glykoprotein s dlouhým řetězcem aminokyselin (1 078 aminokyselin celkem), který má 3 části [9, 20]. Nejdelší je extracelulární část (přibližně 600 aminokyselin). Prostřední část, která několikrát protíná buněčný povrch (tzv. intramembranózní část), obsahuje přibližně 250 aminokyselin. Intracelulární část směřující do cytoplazmy má rovněž přibližně 250 aminokyselin (obr. 1).
Fyziologicky je CaR aktivován při zvýšení extracelulární koncentrace kalcia. Podstatně menším aktivátorem jsou i koncentrace magnezia a dalších dvou- a trojmocných kationtů.
Po aktivaci receptoru se spouští kaskáda biologických intracelulárních reakcí, jejichž výsledkem v buňkách příštítných tělísek je potlačení sekrece parathormonu z buněk do cirkulace. Hladina PTH v krvi se snižuje, upravují se nežádoucí důsledky hyperparatyreózy. Právě tato biologická funkce v příštítných tělískách je využívána terapeuticky při podávání kalcimimetik.
Další biologické funkce CaR v jiných tkáních v organismu jsou méně prozkoumány [13, 25 ]. Jsou pravděpodobně i celkově méně významné a kalcimimetika zde v součastnosti nemají žádné přímé terapeutické využití. K biologickým funkcím, které jsou známy, avšak nejsou cíleně terapeuticky ovlivňovány, patří například sekrece kalcitoninu v parafolikulárních buňkách štítné žlázy v odpovědi na stimulaci CaR.
K částečně prozkoumaným patří vliv CaR v ledvinách, které se podílejí na regulaci kalciurie. V ledvinných tubulech se za fyziologických okolností v homeostáze kalcia uplatňuje parathormon (zvýšení resorpce kalcia z ledvinných tubulů zpět do krve, tj. zvýšení kalcémie) i pravděpodobně působení kalcia na CaR (stimulace CaR v ledvinách zvyšuje kalciurii, tj. působí protichůdně než parathormon a snižuje kalcémii). Za normálních okolností jsou pravděpodobně obě složky v rovnováze a odpady kalcia do moče (neboli kalciurie) odpovídají potřebám organismu. Při snížení funkce ledvin se tato rovnováha naruší [34]. Terapeutický potenciál kalcimimetik v poruchách renálního vylučování kalcia není znám a není v současné době ani přímo zvažován. Sleduje se však, zda podávání kalcimimetik pacientům s poklesem funkce ledvin, avšak dosud nedialyzovaným, nezvyšuje kalciurii [10].
Znalosti struktury a funkce receptoru pro kalcium a jeho klonování umožnily nejen vývoj terapeutických modulátorů aktivity, ale přinesly i možnost zkoumání mutací genu v lidské patofyziologii [34]. S receptorem CaR, resp. s jeho mutací jsou spojeny některé patologické stavy. Příkladem je tzv. familiární hyperkalcemická hypokalciurie. Je provázena zvýšenou koncentrací PTH v séru, hyperkalcémií a hypokalciurií [13, 14, 37]. Na rozdíl od primární hyperparatyreózy však porucha nespočívá v primárně vysoké sekreci PTH, ale ve snížené citlivosti CaR na extracelulární koncentraci kalcia a tudíž v neschopnosti potlačit sekreci PTH při hyperkalcémii fyziologickou cestou. Heterozygotní forma této mutace genu pro CaR je benigní, stav je pouze důvodem k observaci, paratyreo-idektomie není indikována. Homozygotní forma se však projevuje těžkou hyperparatyreózou vzniklou záhy po narození.
Hlavním orgánem, ve kterém je CaR exprimován, jsou jednoznačně příštítná tělíska a tento receptor má nejen rozhodující roli v regulaci sekrece parathormonu, ale významně zasahuje i do dalších mechanismů, kterými je koncentrace parathormonu regulována. K těmto mechanismům patří součinnost s receptorem pro vitamin D při tvorbě parathormonu a role v regulaci proliferace buněk příštítných tělísek (obr. 1).
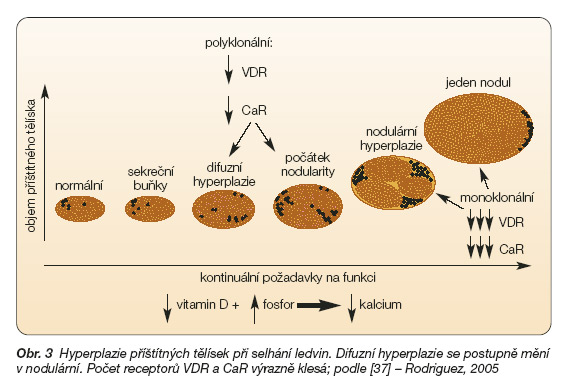
Úroveň stimulace CaR má prokazatelný vliv na proliferaci a diferenciaci buněk a na jejich apoptózu. Porucha počtu či funkce CaR se proto významně podílí na hyperplazii příštítných tělísek při chronickém selhání ledvin. Hyperparatyreóza při selhání ledvin je proto někdy nazývána „disorder of growth" (onemocnění růstu) (obr. 3).
Kalcimimetika ve vztahu k patogenetickým mechanismům sekundární hyperparatyreózy při selhání ledvin
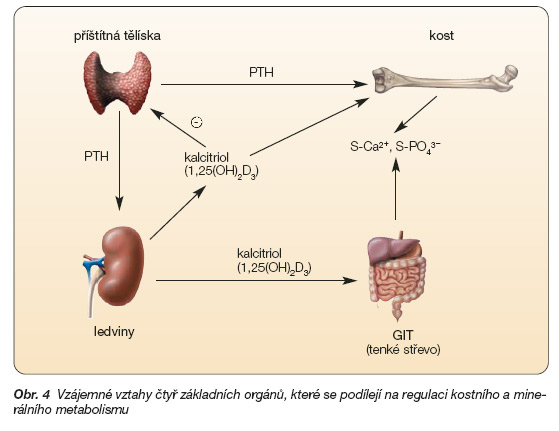
Pro pochopení principu léčby kalcimimetiky je vhodné zopakovat základní mechanismy rozvoje sekundární hyperparatyreózy při selhání ledvin (obr. 4) a způsoby ovlivnění aktivity příštítných tělísek spolu s jejich hlavními vzájemnými vztahy [24, 44, 42, 46, 47].
Činnost příštítných tělísek je řízena dvěma hlavními cestami:
– prostřednictvím jaderného receptoru pro vitamin D (VDR),
– prostřednictvím CaR.
Fyziologické a též farmakologické cesty ovlivnění aktivity příštítných tělísek jsou tedy přinejmenším dvě a jsou vzájemně výrazně odlišné, i když v některých úsecích jejich poměrně složitého působení dochází k interakcím.
Receptory pro VDR regulují tvorbu parathormonu, receptory CaR jeho sekreci z intracelulárního poolu. Ovlivění VDR je již v klinické praxi využíváno (metabolity a analoga vitaminu D). Ovlivnění CaR dosud nebylo možné.
Tvorba parathormonu nastává při transkripci genu pro PTH. Signál pro genovou transkripci vychází z jaderného receptoru pro aktivní vitamin D a tento receptor je tedy zodpovědný za fyziologickou regulaci tvorby parathormonu. Po navázání aktivního vitaminu D, ke kalcitriolu (vytvořeného v ledvinách či podaného ve formě farmakologického přípravku) se genová transkripce snižuje a tvorba parathormonu klesá. Naopak při nedostatku kalcitriolu se genová transkripce zvyšuje a vzniká více pre-pro PTH mRNA, tj. genového transkriptu. Nedostatek aktivního vitaminu D je tedy jedním ze základních faktorů vedoucích ke zvýšené tvorbě parathormonu [42].
Genová odpověď na aktivní vitamin D je značně složitý proces, který trvá několik hodin [15].
Parathormon se po syntéze v buňce shromažďuje v intracelulárních granulích, odkud je podle potřeby akutně uvolňován (secernován) do krve. Podnětem pro sekreci je například hypokalcémie, tento podnět působí prostřednictvím aktivace CaR a odpověď nastává během minut.
Biologické účinky stimulace či inhibice obou receptorů jsou tedy vzájemně propojeny a výsledná koncentrace PTH v krvi je dána nejen množstvím vytvořeného parathormonu, ale i velikostí sekrece z buněk do oběhu.
Extracelulární koncentrace kalcia má kromě řízení sekrece PTH prostřednictvím CaR širší biologické a patofyziologické souvislosti. K nim patří mimo jiné i vliv na stabilitu vytvořené pre-pro-mRNA-PTH neboli genového transkriptu pro PTH. Nízká koncentrace kalcia zvyšuje stabilitu této mRNA. Z toho vyplývá, že nízká hladina kalcia nejen zvyšuje sekreci PTH prostřednictvím působení na CaR, ale zvyšuje i tvorbu PTH prodloužením životnosti genového transkriptu pro PTH. Naopak, při korekci kalcémie se životnost transkriptu snižuje, a klesá tím produkce PTH a též jeho sekrece. Analogicky jako hypokalcémie působí i hyperfosfatémie, tj. zvyšuje tvorbu parathormonu prodloužením životnosti genového transkriptu [36, 39]. Genový transkript je intracelulárně v buňkách příštítných tělísek rozkládán systémem endonukleáz. Endonukleázy, které štěpí genový transkript, jsou však při selhání ledvin obecně sníženy. Uvádí se, že jde o působení blíže neurčené „uremické toxicity". Lze tedy očekávat, že podněty, které by sekreci PTH brzdily, budou ve svém efektu při selhání ledvin slabší než za podmínek normální funkce ledvin, tj. že vlastní stav selhání ledvin již sám o sobě produkci PTH zvyšuje. Lze shrnout, že množství vytvořeného parathormonu se zvyšuje při nedostatku vitaminu D, hypokalcémii, hyperfosfatémii a při „urémii", resp. selhání ledvin [42].
Nedostatek vitaminu D, hypokalcémie a hyperfosfatémie jsou konstantními průvodními jevy při selhání ledvin [29, 16, 24, 42]. Tyto tři odchylky fosfokalciové homeostázy jsou hlavními faktory v patogenezi rozvoje sekundární hyperparatyreózy při selhání ledvin a jejich korekce je základním požadavkem v terapii a prevenci kostního postižení.
Vývoj terapeutických možností a postupů přinesl do klinické praxe účinné postupy, avšak dosud zcela chyběla jakákoliv možnost stimulovat receptor CaR jinak než zvýšením kalcémie. Vysoké koncentrace kalcia však samy o sobě jsou rizikovým faktorem kardiovaskulárního postižení a extraoseálních kalcifikací, a navíc terapie aktivním vitaminem D koncentraci kalcia dále zvyšuje.
Podáváme-li vitamin D (resp. jeho aktivní formu – syntetický metabolit kalcitriol), nevyhneme se totiž riziku souběžného zvýšení kalcémie a i fosfatémie. Hyperkalcémie a hyperfosfatémie jsou limitujícími faktory léčby aktivním vitaminem D (kalcitriol), i když tato léčba účinně snižuje právě tvorbu parathormonu, tj. pro sekreci PTH ze sekrečních granulí je k dispozici celkově menší množství.
Hyperkalcemizující a hyperfosfatemizující účinek kalcitriolu je podstatně nižší u tzv. analog vitaminu D (např. paricalcitol) a tyto léky postupně získaly velmi široké uplatnění v terapii hyperparatyreózy spojené se selháním ledvin (až 60 % pacientů v dialyzačním programu je léčeno některou z forem metabolitů či analog vitaminu D) [49].
Zásah do tvorby parathormonu prostřednictvím cesty jaderného VDR však představuje jen jednu část komplexního mechanismu činnosti příštítných tělísek, receptor CaR je při tomto způsobu léčby neovlivněn.
Ke komplexnímu mechanismu zvýšené tvorby a sekrece parathormonu v důsledku chybění kalcitriolu a poruchy homeostázy kalcia a fosforu ještě patří další patofyziologická a patobiologická změna, a sice hyperplazie příštítných tělísek, ke které vede jejich dlouhodobá stimulace. Znamená to, že se zvyšuje i objem žlázy produkující parathormon (obr. 3).
Zprvu je hyperplazie difuzní. Později, při dalším pokračování stimulace aktivity tělísek, se mění na nodulární. Tato forma hyperplazie jen velmi obtížně reaguje na konzervativní terapii, a to proto, že počet receptorů pro vitamin D i počet receptorů CaR se výrazně snižuje (až o 60 %) [15].
Pro účinné ovlivnění hyperparatyreózy při selhání ledvin je tedy třeba docílit nejen snížení sekrece, ale i produkce parathormonu a zabránit nadměrné proliferaci buněk příštítných tělísek, tj. rozvoji hyperplazie, zejména její nodulární formy.
Farmakodynamické vlastnosti
Preparát moduluje citlivost CaR pro extracelulární kalcium [33].
To znamená, že výsledná stimulace receptoru je vyšší, než by odpovídalo dané aktuální koncentraci kalcia v krvi. Po podání cinacalcetu nastává pokles koncentrace parathormonu v krvi během několika málo hodin.
Další účinky navazují – patří k nim zejména pokles koncentrace kalcia v krvi a dále pokles koncentrace fosforu. Dalším efektem je zvýšení koncentrace kalcitoninu v důsledku účinku na buňky štítné žlázy produkující tento hormon, patřící mezi regulátory koncentrace kalcia v krvi [33].
Celkově tedy lze farmakodynamické vlastnosti shrnout následovně:
– krátce po podání se snižuje koncentrace PTH v krvi,
– následně se snižuje koncentrace kalcia v séru,
– zvyšuje se též hladina kalcitoninu.
Jak již uvedeno výše, pokles koncentrace parathormonu v krvi nastává krátce po podání, a to v důsledku snížení uvolnění již vytvořeného parathormonu z buněk příštítných tělísek do cirkulace. Stupeň poklesu koncentrace PTH v krvi je proporcionální podané dávce preparátu. K poklesu sekrece PTH dochází bez ohledu na tíži hyperfunkce, tj. bez vztahu k iniciální koncentraci PTH v krvi [5].
Pokles koncentrace PTH v krvi nastává již po podání první dávky. Protože maximální koncentrace léku v krvi je dosaženo za 2–6 hodin po podání, je i koncentrace PTH v krvi nejnižší v návaznosti na podání léku. Přibližně v odstupu 12 hodin se opět zvyšuje, avšak většinou zůstává v dalším období snížena pod výchozí koncentraci.
Mechanismus poklesu kalcémie při terapii cinacalcetem není zcela jasný, předpokládá se, že se jedná o důsledek sníženého uvolňování kalcia ze skeletu v důsledku snížených koncentrací PTH. Nelze vyloučit ani přímý vliv cinacalcetu na kostní buňky, neboť receptor CaR byl nalezen v prekurzorech osteoblastů [51]. Je možná i souvislost s indukcí produkce kalcitoninu.
Při terapii kalcimimetiky je zaznamenáván vzestup koncentrace sérového kalcitoninu (produkovaného ve štítné žláze), a to proporcionálně k podané dávce [33].
Stimulace CaR v parafolikulárních buňkách štítné žlázy vede ke zvýšení produkce a následně i krevních hladin tohoto kalcitropního hormonu. Kalcitonin snižuje kalcémii mechanismem zabudování kalcia do skeletu. Proto není vyloučeno, že vzestup kalcitoninu po podání kalcimimetik se podílí na pozorovaném poklesu kalcémie při podání cinacalcetu, přinejmenším na zvířecím modelu [17]. Přibližně po 7 dnech léčby je pozorován stabilní pokles koncentrací PTH v krvi v odstupu 24 hodin od podání poslední dávky. To umožňuje, aby byl cinacalcet podáván chronicky a využíván k dlouhodobé terapii hyperparatyreózy.
Dosud nejvíce zkušeností (více než 1 000 léčených osob) se získalo v léčbě pokročilé sekundární hyperparatyreózy provázející selhání ledvin, tj. u pacientů v dialyzačním programu (hemodialýza i peritoneální dialýza).
Jsou popsány i zkušenosti s léčbou akcentované sekundární hyperparatyreózy v situacích bez selhání ledvin, a to po transplantaci ledviny i v predialyzačním období.
Po transplantaci ledviny se někdy setkáváme s „odbouranou" vysokou aktivitou předtransplantačně rozvinuté, avšak klinicky méně manifestní hyperparatyreózy. V těchto stavech cinacalcet aktivitu příštítných tělísek příznivě ovlivní.
Je popsán jeho příznivý efekt i při primární hyperparatyreóze a i při karcinomech příštítných tělísek u pacientů, kde nebylo možné chirurgické řešení.
Cinacalcet tak představuje vysoce účinný přístup k terapii pokročilých hyperparatyreóz nejrůznější etiologie, a to i těch, kde dosud byla jedinou volbou paratyreoidektomie.
I když receptory CaR jsou přítomny ve více tkáních a orgánech (ledviny, kost, a další), terapeutické využití zaměřené na tyto orgány či tkáně není známo. Cinacalcet pravděpodobně nepůsobí na receptory na ledvinách, resp. tento mechanismus nemá při selhání ledvin uplatnění [33, 13].
Pro posuzování farmakodynamických vlastností a při interpretaci změn koncentrací PTH a kalcémie, tj. při posuzování efektu cinacalcetu, je třeba vzít úvahu čas, kdy je proveden odběr krve na stanovení parathormonu a dalších parametrů fosfokalciového metabolismu. Zatímco maximum snížení hladin PTH je popisováno po 2–4 hodinách po podání, odběr se obvykle provádí před hemodialýzou, tj. až 20–24 hodin po předchozí dávce, kdy již maximum účinku předchozího podání vymizelo a přetrvává jen „zbytková" hladina léku v krvi. Proto skutečná průměrná koncentrace PTH v čase je při léčbě cinacalcetem vždy nižší než aktuálně měřená [20].
Biologický účinek cinacalcetu je širší než samotné snížení sekrece PTH. Bylo ukázáno, že receptor má výraznou roli v regulaci buněčné proliferace a diferenciace. Přinejmenším v experimentu bylo ukázáno, že cinacalcet zabraňuje rozvoji hyperplazie příštítných tělísek [13, 14, 52]. Očekává se, že se tento efekt potvrdí i v klinickém pozorování, k tomu jsou však potřeba dlouhodobá sledování.
Farmakokinetické vlastnosti
Cinacalcet HCl je po perorálním podání rychle absorbován v zažívacím traktu. Nalačno se vstřebá přibližně 25 % podané látky. Absorbované množství se výrazně zvyšuje, je-li preparát podán s jídlem či bezprostředně po jídle, zvýšení absorpce představuje až 50–80 %.
Cinacalcet je z 97 % vázán na bílkoviny. Vazba není ovlivněna případným jaterním či ledvinovým onemocněním. Metabolizuje se přes jaterní enzymatický cyto- chromový systém P-450. Vylučuje se ve formě inaktivních metabolitů zejména ledvinami. Poločas léku má dvě fáze, první trvá přibližně 6 hodin, druhá fáze (tzv. terminální poločas) trvá až 30–40 hodin, proto je možné podání v jedné denní dávce.
Distribuční objem je 1000 l, to znamená, že lék velmi dobře proniká do všech tkání, tj. do hlubokých kompartmentů organismu (je vysoce lipofilní).
Farmakokinetika cinacalcetu HCl se nemění při snížené funkci ledvin ani při jejich selhání, postižení ledvin tedy nevyžaduje žádnou modifikaci dávky. Při závažném hepatálním onemocnění se zvyšuje AUC (area under curve, tj. plocha pod křivkou charakterizující průběh koncentrace léku v krvi v čase), avšak vzhledem k tomu, že doporučené dávkování začíná od malých dávek a zvyšuje se individuálně dle odpovědi, řídíme se u pacientů s onemocněním ledvin laboratorními a klinickými ukazateli stavu fosfokalciového metabolismu stejně jako u ostatních léčených osob.
Klinické zkušenosti
První klinické zkušenosti s kalcimimetiky byly prezentovány v roce 1998 [2], a sice s kalcimimetikem 1. generace, preparátem R568. I přes průkazný účinek na snížení sekrece PTH byl však další vývoj kalcimimetik 1. generace ukončen, protože se ukázalo, že biologická dostupnost je nízká a farmakokinetické vlastnosti velmi variabilní. Dalším důvodem byla výrazná interference s hepatálním cytochromovým systémem P-450, a tudíž možnost četných lékových interakcí.
Další přípravek odvozený od výchozího je kalcimimetikum 2. generace, původně zkoumané pod označením AMG 073. Ukázalo se, že farmakokinetika tohoto preparátu je stabilní a preklinické i klinické zkoušky přivedly tento preparát úspěšně do klinické praxe. Biologická dostupnost je podstatně vyšší a stabilní a predikovatelná je i farmakodynamika. Přípravek AMG 073 je cinacalcet HCl [18, 20, 21].
Klinické zkušenosti byly zprvu získány v krátkodobých studiích, později ověřeny v několika déletrvajících sledováních zahrnujících stovky pacientů. Postupně byl lék uveden do klinické praxe a dnes je již rutinně používán v řadě zemí. Je využíván zejména v léčbě sekundární hyperparatyreózy provázející selhání ledvin u dialyzovaných pacientů.
V prvních krátkodobých klinických studiích byly podávány dávky 25–100 mg/ denně [20]. Koncentrace PTH v krvi poklesla, maximum poklesu bylo zaznamenáno za 2–4 hodiny po podání a stupeň poklesu byl závislý na podané dávce, tj. při podání vyšší dávky se proporcionálně zvyšoval účinek. Účinek vyjádřený jako procentuální pokles koncentrace parathormonu však nebyl závislý na výchozí koncentraci PTH, tzn. preparát působil shodně u různých stadií zvýšené činnosti příštítných tělísek. Shrnuto, cinacalcet působí snížení parathormonu bez ohledu na stupeň hyperparatyreózy, a tento pokles je tím vyšší, čím vyšší dávka cinacalcetu je podána.
Po podání cinacalcetu se měnila i koncentrace kalcia v krvi, a to s časovým odstupem za primárním účinkem, tj. za snížením koncentrace parathormonu v krvi. Přibližně za 8–12 hodin po podání vyšších dávek (75–100 mg) cinacalcetu se snížila kalcémie. Pokles byl přibližně o 0,25 mmol/l a byl asymptomatický.
Další studie byla již placebem kontrolovaná a sledovala 30 hemodialyzovaných pacientů léčených dosud standardní terapií používanou ke kontrole poruchy fosfokalciového metabolismu u dialyzovaných pacientů, tj. vazači fosfátů a aktivním vitaminem D. Koncentrace PTH se snížila o 25–40 % již během prvních 8 dní podávání 25–50 mg kalcimimetika jedenkrát denně. V placebem kontrolované skupině změna PTH nenastala, stejně tak bez ovlivnění hladin PTH byly dávky kalcimimetika 10 mg. Takto nízké dávky (10 mg/denně) tedy nejsou v terapii využívány, nejnižší podávaná dávka v terapii je 30 mg denně.
Podávání kalcimimetika vedlo k poklesu koncentrací kalcia o 5–10 % a poklesu fosforu dokonce o 20–25 % po 8 dnech, což bylo neočekávaným, avšak příznivým nálezem.
Klinické studie fáze II byly provedeny ve dvou 18týdenních prospektivních a dvojitě zaslepených sledováních. Výchozí koncentrace PTH byly vyšší než 300 pg/ml (horní fyziologická mez u zdravých osob je do 65 pg/ml, u hemodialyzovaných pacientů je však současné doporučení udržovat hodnoty v rozmezí je 150–300 pg/ml). Pro zařazení do studie nebylo rozhodující, zda pacient byl či nebyl souběžně léčen vitaminem D. Iniciální dávky cinacalcetu byly nižší (10 mg v jedné studii a 25 mg ve druhé studii) a byly postupně zvyšovány dle odpovědi na léčbu [28, 35].
V jedné z těchto studií se během 6 týdnů výchozí koncentrace PTH snížila průměrně o 26 % a celkem 40 % pacientů dosáhlo snížení PTH o více než 30 %, ve srovnání s pouze 8 % pacientů v kontrolní skupině (léčené placebem, resp. konvenční stávající terapií + placebem). Současně bylo ve skupině léčené kalcimimetikem zaznamenáno snížení koncentrace fosforu v séru o 10 % a fosfokalciového součinu o 17 % [28].
Ve druhé studii, kde byly podávány o něco vyšší dávky cinacalcetu, se laboratorní změny jevily ještě výrazněji: pokles PTH o více než 30 % nastal u více než poloviny pacientů a průměrný pokles koncentrace PTH v krvi ve srovnání s výchozí hodnotou byl 33 %. Souběžně byl zaznamenán jen mírný pokles koncentrace kalcia: kalcémie se snížila průměrně o 0,125 mmol/l (výchozí hodnota 2,40 mmol/l, hodnota po léčbě 2,275 mmol/l).
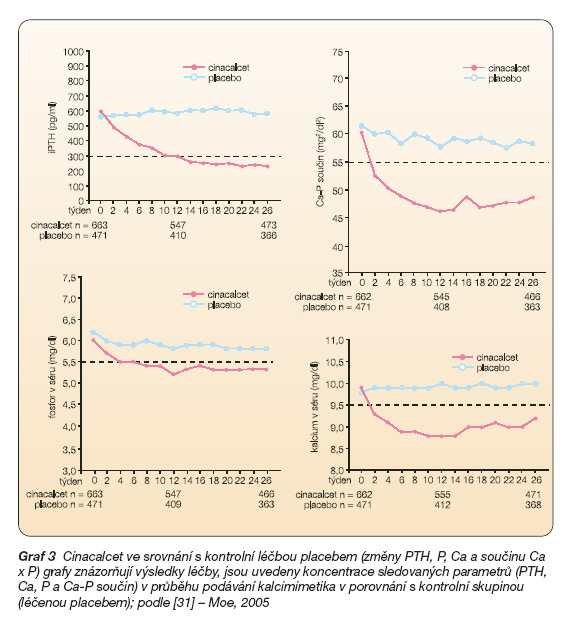
Klinické zkušenosti rozšířily další klinické zkoušky fáze III. Během tří rozsáhlých prospektivních placebem kontrolovaných studií byly hodnoceny podrobně parametry dlouhodobé efektivity a bezpečnosti [28, 35, 5]. Data z těchto studií zahrnujících celkem 1 136 osob ze 182 center Severní Ameriky, Evropy a Austrálie byla zcela nedávno sumárně analyzována i z pohledu dosažitelnosti doporučených cílových koncentrací kalcia, fosforu a PTH dle K/DOQI [31]. Protokol uvedených tří studií byl velmi podobný. Po randomizaci bylo celkem 665 osob léčeno cinacalcetem, 471 osob bylo kontrolováno placebem. Výchozí koncentrace PTH byla dle protokolu u všech osob vstupujících do studie vyšší než 300 pg/ml. Randomizace byla provedena tak, aby respektovala rozdělení podle tíže hyperparatyreózy do tří skupin (koncentrace mezi 300 a 500 pg/ml, mezi 500–800 pg/ml a nad 800 pg/ml) a rovněž dle výchozí hodnoty fosfokalciového součinu do dvou skupin (koncentrace Ca v séru násobena koncentrací fosforu v séru), hranici představovala hodnota tohoto součinu 5,65 mmol2/l2). V prvních 12 (resp. 16) týdnech studie byla hledána optimální dávka cinacalcetu („dosetitration" fáze), v následujícím období (14 týdnů, resp. 10 týdnů) byl sledován dlouhodobý efekt nastavené léčby.
Všichni pacienti pokračovali během klinické zkoušky s cinacalcetem ve své původní terapii (metabolity vitaminu D, vazače fosforu v zažívacím traktu) v nezměněné dávce, resp. s uzpůsobením dle aktuálních hodnot laboratoře. Při zahájení sledování užívaly vitamin D v některé z jeho aktivních forem celkem dvě třetiny pacientů obou větví (cinacalcet vs placebo) a vazače fosfátů byly předepisovány více než 90 % pacientů.
Při výrazné hypokalcémii bylo možné zvýšit dávky aktivního vitaminu D. Naopak při nadměrné supresi PTH či při hyperfosfatémii (P v séru vyšší než 2,1 mmol/l před hemodialýzou či zvýšení fosfokalciového produktu nad 5,65) protokol připouštěl jejich vysazení.
Iniciální dávka cinacalcetu byla 30 mg/ den v jedné dávce per os. V případě potřeby byla postupně zvyšována, a to v intervalech 3–4 týdny dle protokolu. Koncentrace PTH, při kterých se dávka zvyšovala, byly vyšší než 200 pg/ml. Pro zvýšení dávky léku však bylo současně nutné zajistit, aby koncentrace kalcia v krvi byla alespoň 1,95 mmol/l. To znamená, že při hypokalcémii nemohla být dávka cinacalcetu zvyšována. Nejvyšší povolená dávka cinacalcetu byla 180 mg/den. Při poklesu PTH pod 100 pg/ml a/nebo při opakované hypokalcémii byl lék vysazen.
Velká většina pacientů dosáhla cílového efektu (pokles PTH pod 200 pg/ml) při dávce 30–60 mg/den (medián dávky byl 30 mg/den). Proto se dávka 30 až 60 mg cinacalcetu HCl denně považuje za standardní dávku v léčbě hyperparatyreózy provázející selhání ledvin [5, 31] (graf 3).
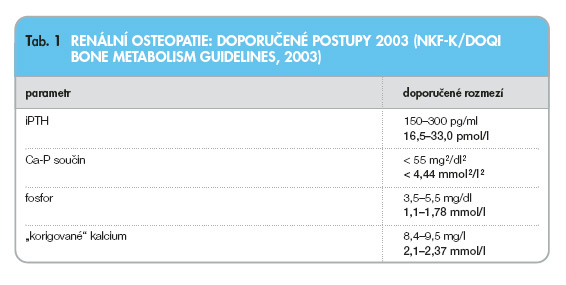
Pro posuzování úspěšnosti korekce poruchy fosfokalciového metabolismu používáme v současné době kritéria podle doporučení K/DOQI (tab. 1).
Je známo, že dosavadní terapeutické postupy nedovolují dosažení cílových hodnot u velké části pacientů (viz dále).
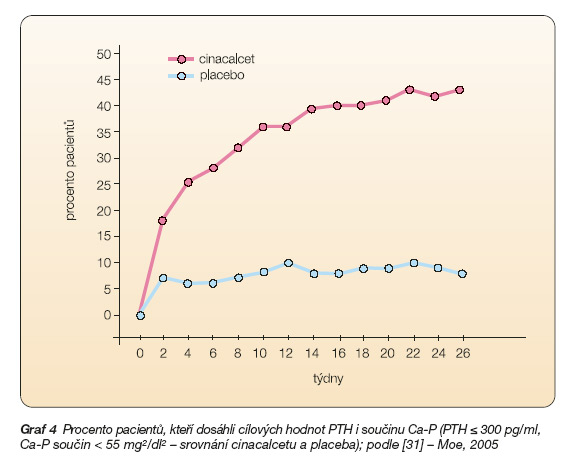
Graf 4 uvádí srovnání skupiny léčených pacientů a pacientů užívajících placebo z hlediska dosažení doporučených cílových hladin koncentrací PTH, kalcia, fosforu, fosfokalciového součinu a dále souběžné dosažení doporučených koncentrací PTH a fosfokalciového součinu. Je zřejmý velký rozdíl mezi oběma skupinami: zatímco při běžné terapii (bez cinacalcetu) dosahuje cílové hodnoty součinu Ca-P a souběžně cílové koncentrace PTH pouze 6 % léčených osob, ve skupině léčené cinacalcetem je to 41 %, tj. výrazně více. Cinacalcet tedy představuje možnost, jak cílové hodnoty dle K/DOQI dosáhnout.
Toto zjištění patří k nejvýznamnějším a charakterizuje hlavní terapeutický potenciál cinacalcetu ve srovnání s dosud užívanými postupy (viz dále, tab. 2).
Cinacalcet HCl je registrován pro léčbu primární hyperparatyreózy a pro léčbu sekundární hyperparatyreózy pacientů se selháním ledvin léčených hemodialýzou či peritoneální dialýzou. Byl však klinicky zkoušen i v jiných situacích. K nim patří:
– sekundární hyperparatyreóza při snížení renálních funkcí (pacienti s poškozenou funkcí ledvin dosud nevyžadující dialýzu),
– léčba hyperparatyreózy po transplantaci ledvin,
– úprava hyperkalcémie při karcinomu příštítných tělísek.
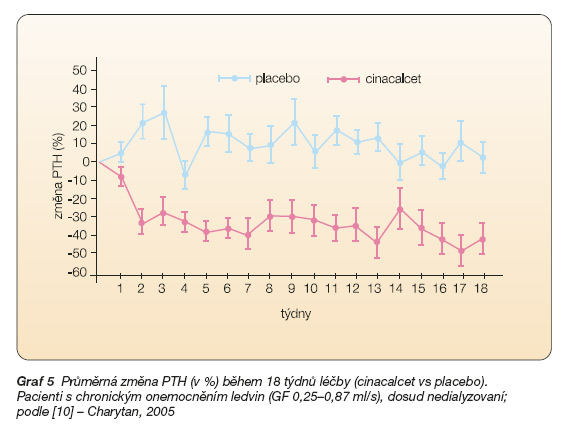
Ve studii sledující efekt cinacalcetu na hyperparatyreózu pacientů se sníženou funkcí ledvin byl cinacalcet porovnáván s placebem. Graf 5 znázorňuje procentuální změny koncentrace PTH ve srovnání s výchozí koncentrací (243 pg/ml ve skupině léčené cicacalcetem, n = 27; 237 pg/ ml ve skupině léčené placebem; n = 27) v průběhu 18 týdnů sledování [10]. Je patrné, že zatímco při podávání placeba se koncentrace PTH prakticky neměnila (nárůst o 6 %), při léčbě cinacalcetem se snížila významně již po jednom týdnu a toto snížení přetrvávalo po celou dobu léčby, dosahovalo průměrně 32 %. Přitom více než polovina léčených osob dosáhla primárního cíle, tj. snížení koncentrace PTH o 30 a více procent.
Na rozdíl od pacientů v dialyzačním programu, kde je reziduální funkce ledvin již nulová či zanedbatelná, je nutno u pacientů se zachovalou zbytkovou reziduální funkcí sledovat, zda kalcimimetikum nezvýší kalciurii. Nadměrné vylučování kalcia do moči může hypoteticky vést k indukci nefrolitiázy. Kalciurie se při podávání kalcimimetika skutečně zvýšila, toto zvýšení však nepřesáhlo „kritickou" hodnotu.
Cinacalcet ovlivnil i koncentraci fosforu. Ta se zvýšila, pravděpodobně v důsledku snížení fosfaturie (hyperparatyreóza působí fosfaturicky, snížení parathormonu tento účinek ruší). Zde je základní rozdíl v působení cinacalcetu na fosfatémii mezi dialyzovanými a dosud nedialyzovanými pacienty. Zatímco u dialyzovaných cinacalcet hladinu fosforu snižuje, v predialyzačním období při léčbě cinacalcetem ke snížení fosfatémie nedochází, ale naopak fosfatémie stoupá. Tento jev je spíše negativní, avšak pravděpodobně korigovatelný (vazače fosforu). Cinacalcet v léčbě hyperparatyreózy pacientů s chronickým onemocněním ledvin stadia III a IV (tj. „predialýza") dosud není registrován a jsou zapotřebí další studie.
Zcela nově byly popsány první zkušenosti s cinacalcetem v léčbě potransplantační hyperkalcémie [38]. Tato hyperkalcémie má původ v akcentované hyperparatyreóze, která se po transplantaci „odbrzdí" (úprava uremického prostředí, tj. pravděpodobně zrušení tzv. rezistence skeletu na parathormon a současně již natolik vystupňovaná sekrece parathormonu, kterou endogenní produkce aktivního vitaminu D nedokáže korigovat). V pilotní studii trvající 10 týdnů byl cinacalcet podáván 11 pacientům v dávce 15–60 mg s velmi dobrým efektem (pokles PTH i pokles kalcémie). V této indikaci má cinacalcet výhledově velké uplatnění, neboť analoga vitaminu D i jiné dosud užívané přípravky jsou zde neúčinné či dokonce kontraindikované (vitamin D pro hyperkalcémii). Dosud připadala v úvahu jen chirurgická paratyreoidektomie, nyní se jeví možné efektivní konzervativní řešení.
Zařazení do současné palety léčiv
Současné farmakologické postupy v terapii sekundární hyperparatyreózy při selhání ledvin zahrnují tři kategorie postupů (viz též tab. 2):
korekce fosfatémie:
– kalciové vazače fosforu v zažívacím traktu (kalcium karbonát; kalcium acetát)
– nekalciové vazače fosforu v zažívacím traktu (sevelamer hydrochlorid; lanthanum carbonicum) [22, 23],
suplementace kalcia dle aktuálních hodnot:
– rozpustné tablety kalcia,
podávání aktivního vitaminu D:
– suplemetace chybějícího kalcitriolu – malé dávky kalcitriolu či jeho prekurzoru denně či obden per os
– suprese příštítných tělísek aktivním vitaminem D (kalcitriol parenterálně) či jeho analogy (parikalcitol).
Uvedené tři terapeutické přístupy se vzájemně kombinují.
Vliv na příštítná tělíska výše uvedených postupů je přímý či nepřímý. Úprava kalcémie a fosfatémie patří k nepřímým cestám, přímý vliv na příštítná tělíska má podávání metabolitů či analog vitaminu D, a to mechanismem působení na receptor pro vitamin D.
S léčbou sekundární hyperparatyreózy metabolity a analogy vitaminu D jsou rozsáhlé zkušenosti [41, 43, 49]. Hlavním nežádoucím účinkem je hyperkalcémie a hyperfosfatémie. Tyto látky totiž zvyšují souběžně vstřebávání vápníku v zažívacím traktu a do určité míry zvyšují i gastrointestinální resorpci fosforu. Analoga vitaminu D mají tento hyperkalcemizující a hyperfosfatemizující účinek nižší [45].
Jak již uvedeno v tab. 1, při aplikaci tří výše uvedených postupů se řídíme v praxi podle doporučení K/DOQI (National Kidney Foundation 2003), pochopitelně s přihlédnutím ke klinickému obrazu a laboratorním nálezům v časovém vývoji daného pacienta. Zpřísnění požadavků na přípustnou koncentraci fosforu se opírá o prokázanou souvislost mezi hyperfosfatémií a kardiovaskulárními komplikacemi, dále i o zvýšené riziko mortality při stoupající koncentraci fosforu u dialyzovaných pacientů [3, 1].
Koncentraci fosforu ovlivňujeme současně i dietou s omezením fosforu (omezení konzumace zejména mléčných výrobků, sýrů a ryb) a kvalitně provedenou dialýzou (pozor na skrytou malfunkci cévního přístupu s rizikem poddialyzovanosti a vysoké koncentrace fosforu v séru).
Ve svém souhrnu jsou výše uvedené postupy účinné, zejména je-li terapie zahájena včas, tj. před rozvojem nodulární hyperplazie. Mají však rizika omezující jejich terapeutický potenciál a zvyšující jejich rizikovost. Jak uvedeno, těmito riziky jsou hyperkalcémie a/nebo hyperfosfatémie. Proto stávající terapeutické postupy neumožňují, aby cílových koncentrací parametrů fosfokalciového metabolismu pacientů se selháním ledvin bylo dosaženo u většiny pacientů.
Riziko hyperkalcémie či hyperfosfatémie nemůže z výše uvedených preparátů nastat pouze u nekalciových vazačů fosforu [23]. Z těchto přípravků je v rutinním klinickém používání dosud pouze sevelamer hydrochlorid. Zdá se, že kromě snížení koncentrace fosforu by mohl mít i protektivní vliv na kardiovaskulární aparát, v tomto smyslu jsou však zapotřebí další studie [11].
Všechny ostatní (tj. kalciové vazače, metabolity vitaminu D i jeho analoga) v sobě nesou riziko hyperkalcémie. Vitamin D (metabolity i analoga) v sobě nesou navíc i riziko hyperfosfatémie. Tato rizika jsou však podstatně menší při užívání analog vitaminu D než při užívání metabolitů [8].
Protože cinacalcet HCl snižuje kalcémii, nabízí se otázka, zda tento preparát není vhodné doplňovat kalciovými vazači fosforu [48]. Pokud bychom považovali za potřebné skutečně kalcium do organismu doplnit, lze tento postup doporučit, avšak je třeba se vyvarovat nevyváženě pozitivní kalciové bilance, která akcentuje extraoseální a zejména cévní kalcifikace [4].
Jak uvedeno, v současnosti nejsou žádné léky schopné ovlivnit přímo sekreci PTH bez ovlivnění sérové kalcémie. Nekalciové vazače fosforu upravují fosfatémii bez rizika hyperkalcémie, ale nepůsobí samy o sobě snížení PTH. Kalcimimetika jsou v tomto smyslu jediným terapeutickým postupem, kdy souběžně nastává pokles PTH i pokles fosfatémie a kalcémie, resp. hodnot fosfokalciového součinu. Tab. 2 názorně ukazuje srovnání vlivu jednotlivých přípravků používaných v terapii poruchy kostního a minerálového metabolismu při selhání ledvin, je patrný unikátní efekt kalcimimetik.
Je však vhodné doplnit, že samotná kalcimimetika nepokryjí fyziologickou cestu ovlivnění produkce PTH prostřednictvím receptoru pro vitamin D. Experti v dané problematice považují dokonce za optimální postup souběžné zajištění efektu na oba receptory, tj. kombinaci kalcimimetik a analog vitaminu D, pochopitelně u pacientů s akcentovanou sekundární hyperparatyreózou [13].
I když kalcimimetika zcela výrazně obohacují arzenál prostředků ke zvládnutí hyperparatyreózy pacientů se selháním ledvin, stále platí, že nejúčinnějším způsobem je včasná prevence, tj. důraz na korekci poruchy fosfokalciového metabolismu již v iniciální fázi poklesu funkce ledvin. Současně je třeba si uvědomit, že i když potřeba paratyreoidektomie jako způsobu řešení jinak nezvládnutelné hyperparatyreózy pravděpodobně po zavedení kalcimimetik dále poklesne, nelze zatím úplně vyloučit, že v některých situacích ji bude nutno indikovat [26].
Indikace
Nemoci a stavy, kde je potřeba terapeuticky snížit nadměrnou koncentraci parathormonu, resp. její důsledky (primární a sekundární hyperparatyreóza).
Registrovanou indikací je sekundární hyperparatyreóza při selhání ledvin a karcinom příštítných tělísek.
Při sekundární hyperparatyreóze je cílem léčby ovlivnit aktivitu příštítných tělísek, potlačit onemocnění. Cinacalcet HCl se podává jedenkrát denně. Doporučuje se začínat s nižšími dávkami a postupně je titrovat. Iniciální doporučená dávka je 30 mg jedenkrát denně. Dle odpovědi se zvyšuje, maximální denní dávka je 180 mg, ve velké většině případů stačí dávky nižší. Léčba může být dlouhodobá, v závislosti na klinickém a laboratorním nálezu.
Lék lze s velkou výhodou užít u akcentovaných případů hyperparatyreózy nereagujících na stávající terapii („refrakterní hyperPTH"), resp. při kontraindikaci konvenční terapie metabolity či analogy vitaminu D z důvodu hyperkalcémie a/nebo hyperfosfatémie. Pro pokročilé případy je kombinace konvenční terapie a cinacalcetu výhodná. Lék lze však použít i jako preparát první volby.
V terapii karcinomu příštítných tělísek je cílem upravit hyperkalcémii. Lék se podává i vícekrát denně, jednotlivé dávky jsou prakticky shodné s léčbou sekundární hyperparatyreózy [13]. K dalším situacím, kdy se lék může příznivě uplatnit, avšak zatím zůstává indikace ve fázi klinických zkoušek, je hyperparatyreóza při chronickém onemocnění ledvin stadia III a IV (CKD klasifikace dle K/DOQI), hyperparatyreóza s hyperkalcémií po transplantaci ledviny a primární hyperparatyreóza.
Při primární hyperparatyreóze je uváděno podávání dvakrát denně [40], event. i vícekrát, dle hladin kalcémie. Ovlivnění hyperkalcémie je zde hlavním terapeutickým cílem.
Nežádoucí účinky
Cinacalcet HCl je obvykle dobře tolerován, a to v dávkách až do 180 i více mg/denně.
V klinických studiích se však vyskytly některé nežádoucí účinky. Byly vždy hodnoceny jako mírné či středně závažné a trvaly přechodnou dobu [5, 31, 28].
Mohou se vyskytnout:
– hypokalcémie
– nauzea, zvracení, dyspepsie
– myalgie.
Při vysvětlení mechanismu hypokalcémie se zvažuje možnost, že snáze nastane u pacientů s deficitem vitaminu D, resp. že při současné terapii vitaminem D by její výskyt mohl být nižší, ale tento předpoklad je třeba prověřit v klinických studiích. Zatím se zdá, že celkově frekvence hypokalcémií není odlišná v závislosti na podávání vitaminu D. Je zapotřebí vyloučit hypokalcémii před zahájením léčby cinacalcetem.
Hypokalcémie je obvykle asymptomatická, tj. jde o laboratorní nález. Může však být i symptomatická (parestezie, křeče, výjimečně i poruchy srdečního rytmu). Myalgie může být průvodním klinickým projevem hypokalcémie.
Nauzea a zvracení se vyskytují u 1–10 % léčených pacientů, příznaky jsou obvykle přechodné, výjimečně však vedly k vysazení léku.
Jiné závažné klinické nežádoucí účinky nebyly popsány.
Kontraindikace
Stavy, kdy je další snížení koncentrace PTH a/nebo kalcémie nežádoucí (hypoparatyreóza; hypokalcémie; adynamické formy kostní nemoci při selhání ledvin).
Lékové interakce
Lék je metabolizován komplexem jaterních enzymů CYP-450. Částečně je metabolizován enzymem CYP 3A4. Tento enzym je silně inhibován ketoconazolem. Při souběžném podávání se hladina cinacalcetu přibližně zdvojnásobuje. Induktorem tohoto enzymu je například rifampicin a souběžné podávání by naopak mohlo hladiny snížit. Proto při souběžném podávání léků ovlivňujících tento enzym je třeba zvýšená opatrnost. Dále je cinacalcet částečně metabolizován enzymem CYP 1A2. Tento enzym je zvýšeně indukován u kuřáků a bylo zjištěno, že clearance (eliminace) cinacalcetu je u kuřáků o něco vyšší než u nekuřáků. Inhibitorem tohoto enzymu je například ciprofloxacin, ale současné podávání s cinacalcetem nebylo studováno. Stejně jako u léků ovlivňujících CYP 3A4 je i zde na místě zvýšená pozornost. Uvedené enzymy (CYP 3A4 a CYP 1A2) však cinacalcet neovlivňuje, není ani jejich induktorem, ani inhibitorem.
Cinacalcet je přímý silný inhibitor enzymu CYP 2D6 a léky, které jsou tímto enzymem degradovány, mohou vyžadovat úpravu dávkování (například metoprolol).
Farmakokinetika ani farmakodynamika warfarinu není cinacalcetem ovlivněna. Farmakokinetika cinacalcetu není ovlivněna při současném podávání kalciových vazačů fosfátů v zažívacím traktu, ani při souběžném podávání sevelameru HCl (nekalciový vazač fosfátů v zažívacím traktu).
Předávkování
Dávky až do 300 mg denně jsou u hemodialyzovaných pacientů obvykle dobře tolerovány. Při předávkování preparátu u dialyzovaných pacientů může nastat zejména hypokalcémie. Na místě je vysazení preparátu a monitorování sérových hladin kalcia (zejména ioniozované frakce, která je odvislá mimo jiné od stavu acidobazické rovnováhy, acidóza zvyšuje ionizovaný podíl), při těžších stavech monitorování vitálních funkcí, registrace EKG. V případě, že vysazení preparátu samo o sobě nestačí, upravujeme kalcémii aktivně, a to v mírnějších případech suplementací per os, v těžkých symptomatických případech parenterálně v pomalé přísně nitrožilní infuzi, případně použitím vyšší koncetrace kalcia v dialyzačním roztoku [50].
Preparát je vysoce vázán na bílkoviny a tato vazba je zachována při poruchách funkce jater i ledvin. Hemodialyzační léčba ani jiné mimotělní eliminační metody neovlivní plazmatické koncentrace léku a nezmění jeho biologický poločas, proto v terapii předávkování nejsou indikovány.
Dávkování
Iniciální doporučená dávka v léčbě sekundární hyperparatyreózy provázející selhání ledvin je 30 mg per os jedenkrát denně. Tato dávka se upravuje dle odpovědi na léčbu, tj. podle klinického stavu a laboratorních hodnot, zejména koncentrací PTH. Intervaly, ve kterých se dávka upravuje, jsou podle současných zkušeností získaných z klinických studií přibližně 3–4 týdny. Zvýšení je o 30 mg denně. Takto lze postupně dávku zvýšit až do maximální doporučené dávky 180 mg/den. K dosažení cílového efektu však u většiny pacientů klinické studie stačí dávka do 60 mg/den, nicméně i vyšší dávky jsou bezpečné a jsou na místě v případech, kdy pokles koncentrace PTH do cílového rozmezí při nižších dávkách nenastal [5].
Při léčbě hyperkalcémie při primární hyperparatyreóze je podle dosavadních zkušeností lék podáván ve větších dávkách, a to dvakrát denně, výjimečně i vícekrát denně (až čtyřikrát denně). Iniciální dávka je 2 x 30 mg denně, lze ji zvýšit na 60 mg, event. na 90 mg podávaných dvakrát i vícekrát denně [40].
Léčba hyperparatyreózy je dlouhodobá, dávky jsou průběžně upravovány dle koncentrací PTH a dalších laboratorních parametrů (zejména kalcémie). Při nadměrné či příliš rychlé supresi PTH se dávka vysazuje či snižuje a pokračuje se v laboratorních kontrolách s případným opětným nasazením léku či zvýšením dávky dle odpovědi.
Cinacalcet HCl lze podávat s dalšími preparáty používanými v léčbě hyperparatyreózy, a to zejména s vazači fosforu na kalciové bázi a s aktivním vitaminem D [14, 31].
Hypokalcémie se koriguje, resp. se tomuto stavu předchází suplementací kalcia či podáváním kalciových preparátů vázajících fosfor v zažívacím traktu (při současné potřebě korekce hyperfosfatémie), je vhodné podat i aktivní vitamin D k vysycení receptoru pro vitamin D v gastrointestinálním traktu i v příštítných tělískách.
Léčba hyperparatyreózy může být dlouhodobá, je ji však vždy třeba individuálně titrovat podle aktuálních laboratorních a klinických nálezů.
Balení
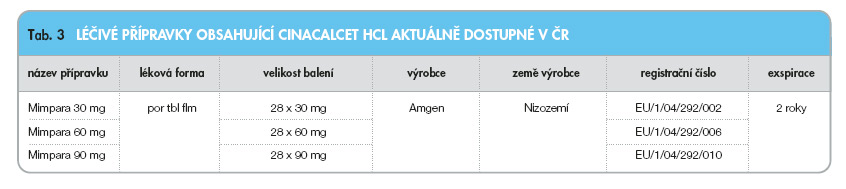
Cinacalcet je v tabletách , které jsou světle zelené. Z jedné strany je název firmy, z druhé údaj o mg účinné látky, které tableta obsahuje (30, 60, resp. 90 mg účinné látky, tj. 33, 66 a 99 mg cinacalcetu HCl). Balení viz tab. 3.
Lék nevyžaduje žádné zvláštní podmínky pro skladování.
Seznam použité literatury
- [1] Amann K, Gross ML, London G, et al. Hyperphosphataemia – a silent killer of patients with renal failure. Nephrol Dial Transplant 1999; 14: 2085–2087.
- [2] Antonsen JE, Sherrard DJ, Andress DL. A calcimimetic agent acutely suppresses parathyroid hormone levels in patients with chronic renal failure. Rapid communication. Kidney Int 1998; 53:223–227.
- [3] Block GA, Hulbert-Shearon TE, Levin NW, et al. Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic hemodialysis patients: a national study. Am J Kidney Dis 1998; 31: 607–617.
- [4] Block GA. The impact of calcimimetics on mineral metabolism and secondary hyperparathyroidism in end-stage renal disease. Kidney Int 2003; 64: 131–136.
- [5] Block GA, Martin KJ, de Francisco ALM, et al. Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis. N Engl J Med 2004; 350: 1520–1529.
- [6] Block G, Port FK. Calcium phosphate metabolism and cardiovascular disease in patients with chronic kidney disease. Semin Dial 2003; 16: 140–147.
- [7] Brown EM, Gamba G, Richardi D, et al. Cloning and characterization of an extracellular Ca2+ sensing receptor from bovine parathyroid. Nature 1993; 366: 575–580.
- [8] Brown AJ. Vitamin D analogues. Am J Kidney Dis 1998; 32 (suppl. 2): S25–S39.
- [9] Canaff L, Hendy GN. Human calcium-sensing receptor gene. J Biol Chem 2002; 277: 30337–30350. (www.jbc.org)
- [10] Charytan Ch, Coburn JW, Chonchol M, et al. Cinacalcet hydrochloride is an effective treatment for secondary hyperparathyroidism in patients with CKD not receiving dialysis. Am J Kidney Dis 2005; v tisku.
- [11] Chertow GM, Burke SK, Raggi P, et al. Sevelamer attenuates the progression of coronary and aortic calcification in hemodialysis patients. Kidney Int 2002; 62: 245–252.
- [12] Collins JT, Skarulis MC, Bilezikian JP, et al. Treatment of hypercalcemia secondary to parathyroid carcinoma with a novel calcimimetic agent. J Clin Endocrinol Metab 1998; 83: 1083–1088.
- [13] Drueke TB. Modulation and action of the calcium-sensing receptor. Nephrol Dial Transplant 2004; 19 (Suppl.5): 20–26.
- [14] Drueke TB. Calcimimetics versus vitamin D. What are their relative roles? Blood Purif 2004; 22: 38–43.
- [15] Dusso A, Brown AJ. Mechanism of vitamin D action and its regulation. Am J Kidney Dis 1998; 32 (Suppl.2): S13–S24.
- [16] Elder G. Patophysiology and recent advances in the management of renal osteodystrophy. JBMR 2002; 17: 2094–2115.
- [17] Fox J, Lowe SH, Conklin RL, et al. Calcimimetic compound NPS R 568 stimulates calcitonin secretion but selectively targets parathyroid gland Ca2+ receptor in rats. J Pharmacol Exp Ther 1999; 290: 480–486.
- [18] Goodman WG, Frazao JM, Goodkin DA, et al. A calcimimetic agent lowers plasma parathyroid hormone levels in patients with secondary hyperparathyroidism. Kidney Int 58; 2000: 436–445.
- [19] Goodman WG, Hladik GA, Turner SA, et al. The calcimimetic agent AMG 073 lowers plasma parathyroid hormone levels in hemodialysis patients with secondary hyperparathyroidism. J Am Soc Nephrol 2002; 13: 1017–1024.
- [20] Goodman WG. Calcium-sensing receptors. Semin Nephrol 2004; 24: 17–24.
- [21] Goodman WG. Calcimimetic agents for the treatment of secondary hyperparathyreoidism. Semin Nephrol 2004; 24: 460–463.
- [22] D´Haese P, Spasovski GB, Aikolw A, et al. A multicenter study on the effect of lanthanum carbonate (Fosrenol ®) on renal bone disease in dialysis patients. Kidney Int 2003; 63 (Suppl.85): S73–S78.
- [23] Henderson J, Altmann P. Sevelamer. Nephron Clin Pract 2003; 94: c53–c58.
- [24] Hruska KA, Teitelbaum SL. Renal osteodystrophy. N Engl J Med 1995; 333: 155–174.
- [25] House MG, Kohlmeier I, Chattopadhyay N, et al. Expression of an extracellular calcium-sensing receptor in human and mouse bone marrow cells. J Bone Miner Res 1997; 12: 1959–1970.
- [26] Jofre R,Gomez JML, Menarguez J, et al. Parathyreoidectomy: whom and when. Kidney Int 2003; 63 (Suppl. 85): S97–S100.
- [27] Kos Ch, Karaplis AC, Peng JB, et al. The calcium sensing receptor is reguired for normal calcium homeostasis independent of parathyroid hormone. J Clin Invest 2003; 111: 1021–1028.
- [28] Lindberg JS, Moe SM, Goodman WG, et al. The calcimimetic AMG 073 reduces parathyroid hormone and calcium x phosphorus in secondary hyperparathyroidism. Kidney Int 2003; 63: 248–254.
- [29] Locatelli F, Cannata-Andia JB, Drueke TB, et al. Management of disturbances of calcium and phosphorus metabolism in chronic renal insufficiency, with emphasis on the control of hyperphosphataemia. Nephrol Dial Transplant 2002; 17: 723–731.
- [30] Martin D, Miller G, Colloton M, et al. Cinacalcet HCl decreases parathyroid hyperplasia in a rodent model of chronic renal insufficiency. J Am Soc Nephrol 2003; 14: 462A.
- [31] Moe SM, Chertow GM, Coburn JW, et al. Achieving NKF-K/DOQI™ bone metabolism and disease treatment goals with cinacalcet HCl. Kidney Int 2005; 67: 760–761.
- [32] National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003; 42 (Suppl.3): S1–S202.
- [33] Nemeth EF, Newton WH, Miller M, et al. Pharmacodynamics of the typ II calcimimetic compound cinacalcet HCl: J Pharmacol Exp Ther 2004; 308: 627–635.
- [34] Ott SM. Calcimimetics – new drugs with the potential to control hyperparathyreoidism. Editorial. J Clin Endocrin Metab 1998; 83: 1080–1082.
- [35] Quarles LD, Sherrard DJ, Adler S, et al. The calcimimetic AMG 073 as a potential treatment for sescondary hyperparathyroidism of end-stage renal disease. J Am Soc Nephrol 2003; 14: 575–583.
- [36] Ritter CS, Martin DR, Lu Y, et al. Reversal of secondary hyperparathyroidism by phosphate restriction restores parathyroid celcium-sensing receptor expression and function. J Bone Miner Res 2002; 17: 2206–2213.
- [37] Rodriguez M, Nemeth E, Martin D. The calcium-sensing receptor: a key factor in the pathogenesis of secondary hyperparathyroidism. Am J Physiol Renal Physiol 2005; 288: F253–F264.
- [38] Serra A, Schwarz AA, Wick FH, et al. Successful treatment of hypercalcemia with cinacalcet in renal transplant recipients with persistent hyperparathyroidism. Nephrol Dial Transplant 2005; 20: 1315–1319.
- [39] Silver J. Molecular mechanisms of secondary hyperparathyroidism. Nephrol Dial Transplant 2000; 15 (Suppl.5): S2–S7.
- [40] Shoback D, Bilezikian JP, Turner SA, et al. The calcimimetic cinacalcet normalizes serum calcium in subjects with primary hyperparathyroidism. J Clin Endocrin Metab 2003; 88: 5644–5649.
- [41] Slatopolsky E, Weerts C, Thielan J, et al. Marked suppression of secondary hyperparathyroidism by intravenous administration of 1,25 dihyd roxycholecalciferol in uremic patients. J Clin Invest 1984; 84: 2136–2143.
- [42] Slatopolsky E, Brown A, Dusso A. Pathogenesis of secondary hyperparathyreoidism. Kidney Int 1999; 56 (suppl.73): S14–S19.
- [43] Slatopolsky E, Brown AJ. Vitamin D analogs for the treatment of secondary hyperparathyroidism. Blood Purif 2002; 20: 109–112.
- [44] Slatopolsky E. The role of calcium, phosphorus and vitamin D metabolism in the development of secondary hyperparathyreoidism. Nephrol Dial Transplant 1998; 13 (suppl.3): 3–8.
- [45] Sprague SM, Llach F, Amdahl M, et al. Paricalcitol versus calcitriol in the treatment of secondary hyperparathyreoidism. Kidney Int 2003; 63: 1483–1490.
- [46] Sulková S. Hemodialýza. Praha, Maxdorf, 2000.
- [47] Sulková S, Fořtová M, Válek M. Renální kostní choroba. Vnitřní Lék 2003; 49: 403–408.
- [48] Szczech LA. The impact of calcimimetic agents on the use of different classes of phosphate binders: Results of recent clinical trials. Kidney Int 2004; 66 (Suppl.90): S46–S48.
- [49] Teng M, Wolf M, Ofsthun MN, et al. Activated injectable Vitamin D and hemodialysis survival: a historical cohort study. J Am Soc Nephrol 2005; 16: 1115–1125.
- [50] Touam M, Menoyo V, Attaf D, et al. High dialysate calcium may improve the efficacy of calcimimetic treatment in hemodialysis patients with severe hyperparathyroidism. Letter to editor. Kidney Int 2005; 67: 2065–2068.
- [51] Yamaguchi T, Chattopadhyay N, Kifor O, et al. Expression of extracellular calcium-senzing receptor in human osteoblastic MG-63 cell line. Am J Physiol 2001; 280: 382–393.
- [52] Wada M, Furuya Y, Sakiyama JI, et al. The calcimimetic compound NPS R-568 suppresses parathyroid cell proliferation in rats with renal insufficiency: control of parathyroid cell growth via a calcium receptor. J Clin Invest 1997; 100: 2977–2983.