Dimethyl fumarát
Dimethyl fumarát představuje novou perorální léčebnou volbu pro pacienty s relabující-remitující roztroušenou sklerózou, zánětlivým onemocněním CNS, v jehož patogenezi se uplatňují autoimunitní děje vedoucí ve svém důsledku k neurodegeneraci. Dimethyl fumarát (a jeho aktivní metabolit monomethyl fumarát) vedou ke zmírnění zánětu a k omezení rozsahu poškození myelinu a neuronů, a to cestou nukleárního faktoru Nrf2 a potlačením cesty NFκB. Dochází ke snížení počtu relapsů nemoci o 49 %, k oddálení invalidity a potlačení aktivity nemoci patrné na magnetické rezonanci. Nežádoucí účinky zahrnují především gastrointestinální obtíže při zahájení léčby a zrudnutí po podání dávky, které je zprostředkováno zřejmě prostaglandiny. Zvýšený výskyt infekcí ani oportunní infekce nebyly ve studiích pozorovány.
Farmakologická skupina
Dimethyl fumarát patří do farmakologické skupiny jiná léčiva nervového systému, ATC kód N07XX09.
Chemické a fyzikální vlastnosti
Dimethyl fumarát neboli dimethyl ester kyseliny fumarové je chemicky dimethyl-(E)-butendionát (obr. 1). Jeho chemické a fyzikální vlastnosti jsou stanoveny vůči aktivní substanci. Dimethyl fumarát je bílý prášek vysoce rozpustný ve vodě (cca 1 mg/ml), který se rozpouští nezávisle na pH, s vysokou permeabilitou. Bod varu dimethyl fumarátu je 192–193 °C. 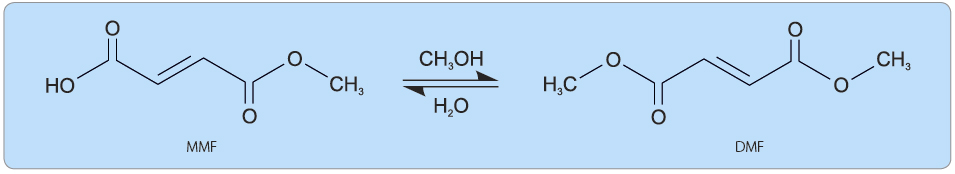
Sumární vzorec: C6H8O4
Relativní molekulová hmotnost: 144 g/mol
Mechanismus účinku, farmakodynamika
Přesný mechanismus účinku odpovědný za terapeutický efekt u pacientů s roztroušenou sklerózou (RS) není znám ani pro dimethyl fumarát (DMF), ani pro jeho aktivní metabolit monomethyl fumarát (MMF). Preklinický výzkum však naznačuje, že tento mechanismus zahrnuje aktivaci transkripční cesty nukleárního faktoru označovaného jako Nrf2, tedy nuclear factor (erythroid-derived 2)-like 2 [1]. Tato cesta je zásadní součástí odpovědi na buněčný a metabolický stres (obr. 2).
MMF se přímo váže na inhibitor Keap1 (kelch-like ECH-associated protein 1), což vede ke stabilizaci Nrf2 a jeho translokaci do jádra. Zvyšuje se exprese genů kódujících detoxikační enzymy, jako je NAD(P)H chinon oxidoreduktáza-1 (NQO1), což vede ke zvýšení buněčného obsahu glutathionu, který vychytává velkou část kyslíkových radikálů v buňce [2]. Působení DMF na Nrf2 se děje zřejmě cestou epige![Obr. 2 Předpokládaný mechanismus účinku dimethyl fumarátu; podle [31] – Lee, et al., 2012. Preklinický výzkum naznačuje, že jeden z mechanismů účinku DMF zahrnuje aktivaci transkripční cesty nukleárního faktoru Nrf2. Tato cesta je součástí odpovědi na buněčný a metabolický stres. MMF se váže na inhibitor Keap1, což vede ke stabilizaci Nrf2 a jeho translokaci do jádra. Zvyšuje se exprese genů kódujících detoxikační a antioxidační enzymy (NQO1, GSC, GST). Aktivace cesty Nrf2 vede také k inhibici translokace nukleárního faktoru NF-κB do jádra. Důsledkem je inhibice exprese prozánětlivých cytokinů. DMF – dimethyl fumarát; MMF – monomethyl fumarát ; Nrf2 – nuclear factor (erythroid-derived 2)-like 2; Keap1 – kelch-like ECH-associated protein 1; NF-κB – nukleární faktor kappa B; ARE – antioxidant response element; NQO1 – NAD(P)H chinon oxidoreduktáza-1; GCS – γ-glutamyl cystein syntetáza; GST – glutathion- -S-transferáza](https://www.remedia.cz/photo-a-29707---.jpg) netickou – DMF modifikuje expresi histon deacetylázy (HDAC) v krysích astrocytech. Prozánětlivé cytokiny zvyšují expresi a množství HDAC. V přítomnosti prozánětlivých cytokinů DMF snižuje hladinu mRNA pro histon deacetylázu i její aktivitu, způsobuje dlouhodobé změny v genové expresi [3]. DMF i MMF chrání astrocyty proti oxidačnímu stresu in vitro a zvyšují jejich životaschopnost po expozici peroxidu vodíku. Stejný efekt má dimethyl fumarát u neuronů [1, 2]. Pokud se zkoumaly buňky s omezeným nebo eliminovaným Nrf2, nebyl tento efekt pozorován, což podporuje představu mechanismu účinku cestou Nrf2. Mitochondriální dysfunkce je stále častěji uváděnou součástí patogeneze RS. V mitochondriích astrocytů MMF zvyšuje množství adenosin trifosfátu a zvyšuje membránový potenciál, takže omezuje mitochondriální dysfunkci [2].
netickou – DMF modifikuje expresi histon deacetylázy (HDAC) v krysích astrocytech. Prozánětlivé cytokiny zvyšují expresi a množství HDAC. V přítomnosti prozánětlivých cytokinů DMF snižuje hladinu mRNA pro histon deacetylázu i její aktivitu, způsobuje dlouhodobé změny v genové expresi [3]. DMF i MMF chrání astrocyty proti oxidačnímu stresu in vitro a zvyšují jejich životaschopnost po expozici peroxidu vodíku. Stejný efekt má dimethyl fumarát u neuronů [1, 2]. Pokud se zkoumaly buňky s omezeným nebo eliminovaným Nrf2, nebyl tento efekt pozorován, což podporuje představu mechanismu účinku cestou Nrf2. Mitochondriální dysfunkce je stále častěji uváděnou součástí patogeneze RS. V mitochondriích astrocytů MMF zvyšuje množství adenosin trifosfátu a zvyšuje membránový potenciál, takže omezuje mitochondriální dysfunkci [2].
U myšího modelu experimentální autoimunitní encefalomyelitidy (EAE) vyvolané podáním myelinového oligodendrocytárního glykoproteinu (MOG) došlo k oddálení nástupu klinických příznaků u zvířat léčených MMF [1] a ke snížení zánětlivé odpovědi – zmenšení infiltrátů v CNS, zvýšení sérové hladiny protizánětlivého cytokinu interleukinu 10 (IL-10) [4]. Přestože u zvířat s již chronickou formou EAE nedošlo ke snížení rozsahu infiltrátů, byla rovněž u nich pozorována určitá ochrana myelinu, axonů i neuronů, pokud nebyly Nrf2-deficientní [1].
Aktivace cesty Nrf2 vede také k inhibici translokace nukleárního faktoru kappa B (NF-κB) do jádra [5]. Důsledkem je inhibice exprese různých prozánětlivých cytokinů, chemokinů a adhezních molekul. Dimethyl fumarát inhibuje aktivitu NF-κB supresí extracelulárním signálem regulované kinázy 1 a 2 (ERK1/2). Dimethyl fumarát navíc blokuje translokaci a fosforylaci podjednotky NF-κB – p65, která je nutná ke stimulaci transkripční aktivity NF-κB [6]. Zvýšené množství nitrobuněčného glutathionu může indukovat expresi protizánětlivého proteinu hemoxygenázy-1 [7]. Studie na zvířatech podporují představu o působení DMF jak cestou Nrf2, tak mechanismy, které jsou na ní nezávislé [8].
Estery kyseliny fumarové včetně dimethyl fumarátu prokázaly in vitro schopnost přepnout cytokinový profil buňky ze vzorce pomocných T buněk (Th) 1 či 17 (s produkcí interferonu gama – IFNγ, tumor nekrotizujícího faktoru alfa – TNFα, interleukinu 12 – IL-12) na vzorec Th2 (s produkcí interleukinu 4 – IL-4, interleukinu 5 – IL-5, interleukinu 10 – IL-10) [9, 6, 10]. I u člověka bylo při podávání esterů fumarátu zjištěno zvýšení produkce IL-10 periferními CD4+ lymfocyty [11].
Díky snížené translokaci transkripčního faktoru NF-κB do jádra a snížené expresi antiapoptotické molekuly BCL-2 (B-cell lymphoma 2) má dimethyl fumarát také určitý proapoptotický efekt [5, 12]. Po šesti týdnech podávání se zvýšila míra apoptózy všech lymfocytů z 12 % na 17 %, CD4+ lymfocytů pak ze 7 % na 11 %. Tento jev je po přerušení léčby vratný a částečně vysvětluje určitý pokles počtu lymfocytů, který během terapie vidíme v krevním obraze pacientů [11]. MMF funguje in vitro jako antagonista nikotinového receptoru [13]. Stimuluje tvorbu PGE v izolovaných keratinocytech cestou GPR109A a COX-2 [14]. To by mohlo pomoci vysvětlit časté zrudnutí kůže u pacienta po aplikaci dimethyl fumarátu.
Farmakokinetické vlastnosti
Po perorální aplikaci podléhá dimethyl fumarát rychlé presystémové hydrolýze esterázami buněk zažívacího traktu a je konvertován na svůj aktivní metabolit monomethyl fumarát [13, 15], obr. 1. Samotný DMF nelze v plazmě po podání per os detekovat, proto všechny farmakokinetické analýzy byly prováděny s plazmatickými koncentracemi MMF [13]. Data byla získána z výsledků studií se zdravými dobrovolníky [16] a pacienty s RS.
DMF pro perorální podání je k dispozici ve formě enterosolventních tvrdých tobolek, které obsahují mikrotablety s acidorezistentním obalem. Díky této lékové formě začíná absorpce přípravku až ve chvíli, kdy opouští žaludek, obvykle za méně než jednu hodinu po podání. Farmakokinetika MMF je lineární. MMF se v těle
 neakumuluje. Podávání DMF s jídlem oddálí nástup maximální koncentrace (cmax) o 2–5,5 hodiny, ale jídlo nemá klinicky relevantní vliv na celkovou expozici DMF [13]. Doporučuje se však užívat DMF s jídlem, protože se tím zlepšuje tolerance nežádoucích účinků, zejména gastrointestinálních, a návalů horka. Základní farmakokinetické vlastnosti DMF shrnuje tab. 1.
neakumuluje. Podávání DMF s jídlem oddálí nástup maximální koncentrace (cmax) o 2–5,5 hodiny, ale jídlo nemá klinicky relevantní vliv na celkovou expozici DMF [13]. Doporučuje se však užívat DMF s jídlem, protože se tím zlepšuje tolerance nežádoucích účinků, zejména gastrointestinálních, a návalů horka. Základní farmakokinetické vlastnosti DMF shrnuje tab. 1.Klinické zkušenosti
Historicky byly estery kyseliny fumarové (fumaric acid esthers, FAE) poprvé použity ke zmírnění projevů psoriázy ve formě masti, kterou vyvinula k léčbě této autoimunitní kožní nemoci zprostředkované T buňkami malá švýcarská lékárna. Před více než čtyřiceti lety biochemik W. Schweckendiek léčil úspěšně svoji vlastní psoriázu pomocí esterů kyseliny fumarové [17]. Nevelké studie pak vedly k tomu, že přípravek s obsahem DMF a solí monoethyl fumarátu (kalciová, zinková a magneziová sůl monoethyl fumarátu) byl v roce 1994 zaregistrován v Německu jako lék druhé linie pro těžkou systémovou psoriázu. Limitem užití byly gastrointestinální obtíže, redukce indexu rozsahu a závažnosti psoriázy dle PASI (Psoriasis Area Severity Index) však dosahovala až 80 % [18].
Estery kyseliny fumarové ukázaly profylaktický i terapeutický efekt u experimentální autoimunitní encefalomyelitidy [4]. Hlavním histologickým efektem byla ochrana myelinu a integrity axonů během chronické fáze nemoci. První otevřená prospektivní studie RS hodnotila efekt směsi dimethyl fumarátu a tří dalších esterů kyseliny fumarové u 10 pacientů s RS [11]. Cílem studie bylo posouzení aktivity onemocnění na magnetické rezonanci (MR). Bylo dosaženo významného snížení počtu a objemu lézí vychytávajících gadolinium. Tato pilotní studie otevřela cestu systematickému zkoumání esterů kyseliny fumarové v léčbě RS. V další studii již byl testován pouze dimethyl fumarát (studijní označení BG-12).
Studie fáze II (C1900) zkoumala bezpečnost a účinnost BG-12 podávaného v dávkách 120 mg 1krát denně (n = 64), 120 mg 3krát denně (n = 64), 240 mg 3krát denně (n = 64) a zjištěné hodnoty porovnávala s kontrolní skupinou, v níž pacienti dostávali placebo (n = 65). Studie byla navržena tak, aby kontrola placebem probíhala prvních 24 týdnů, poté byli pacienti ze všech čtyř studijních skupin převedeni na léčbu BG-12, která trvala dalších 24 týdnů. Primárním cílem byl vliv na aktivitu RS hodnocenou pomocí MR.
Do studie bylo randomizovaně rozděleno celkem 257 pacientů, celou studii dokončilo 219 z nich. Analýza MR výsledků ukázala signifikantní a na dávce závislou redukci aktivity RS: došlo ke snížení gadolinium vychytávajících lézí o 70 %, nové, zvětšující se T2 léze a nové T1 léze (odrážející finální poškození tkáně) byly redukovány o polovinu. Hodnocení klinického efektu nemělo dostatečnou statistickou sílu (plánovaně se nejednalo o primární cíl), přesto došlo při podávání dávky 720 mg/den ke snížení počtu relapsů asi o jednu třetinu; 13 % pacientů ze skupiny, kde byla podávána nejvyšší dávka BG-12, studii předčasně ukončilo. Gastrointestinální obtíže a zrudnutí, které se objevovaly v různém časovém odstupu od podání léku, se zmírnily ve druhé části studie. Nebyly pozorovány žádné závažné nežádoucí účinky.Na základě této studie byl klinický efekt DMF u relabující-remitující RS (RR RS) hodnocen ve dvou rozsáhlých dvouletých dvojitě zaslepených, placebem kontrolovaných mezinárodních studiích fáze III – DEFINE a CONFIRM [20, 21].
Základní c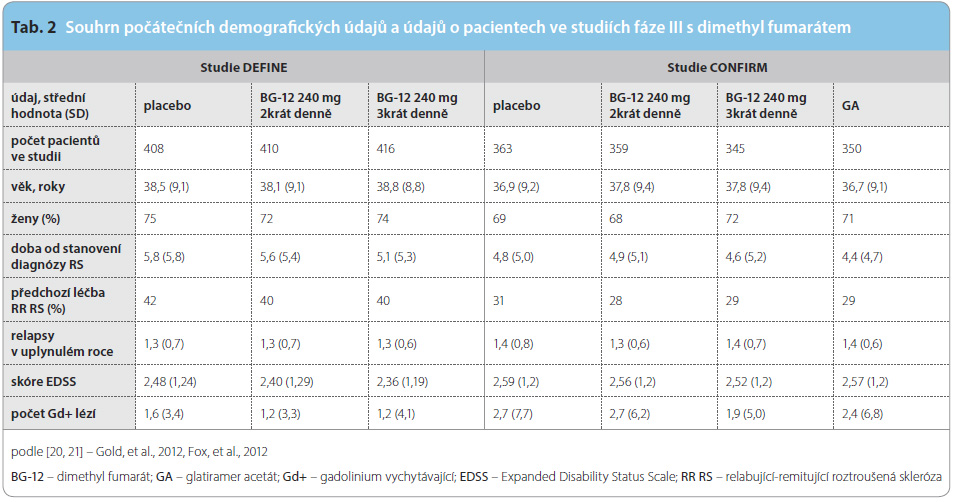 harakteristiky studií i pacientů zařazených do těchto studií jsou přehledně uvedeny v tab. 2. Podskupina 540 randomizovaných pacientů ze studie DEFINE a 681 pacientů ze studie CONFIRM se zároveň účastnila MR podstudie. Základní charakteristiky této podskupiny se nelišily od celé zkoumané populace ve studiích. Ve studii CONFIRM byl zvolen jako komparátor glatiramer acetát užívaný jako injekční lék první volby. Studie neměla statistickou sílu prokázat superioritu či noninferioritu DMF oproti glatiramer acetátu, ani to nebylo jejím cílem, přímo lze porovnat pouze glatiramer acetát s placebem.
harakteristiky studií i pacientů zařazených do těchto studií jsou přehledně uvedeny v tab. 2. Podskupina 540 randomizovaných pacientů ze studie DEFINE a 681 pacientů ze studie CONFIRM se zároveň účastnila MR podstudie. Základní charakteristiky této podskupiny se nelišily od celé zkoumané populace ve studiích. Ve studii CONFIRM byl zvolen jako komparátor glatiramer acetát užívaný jako injekční lék první volby. Studie neměla statistickou sílu prokázat superioritu či noninferioritu DMF oproti glatiramer acetátu, ani to nebylo jejím cílem, přímo lze porovnat pouze glatiramer acetát s placebem.
Roztroušená skleróza je chronické onemocnění, a proto je velmi důležité zjistit, zda je dlouhodobá terapie pro pacienty přínosná. Proto bylo všem pacientům nabídnuto vstoupit do otevřené pokračovací fáze studie, která byla pod názvem ENDORSE zahájena v roce 2009 a je naplánována do roku 2016. Do této následné fáze bylo iniciálně zahrnuto 1736 pacientů: ti, kteří dostávali v původní studii 240 mg DMF 2krát denně a 240 mg DMF 3krát denně, pokračují v užívání těchto dávek, ti, kteří původně dostávali placebo nebo glatiramer acetát, byli randomizovaně rozděleni k užívání jedné z uvedených dvou dávek DMF [22]. Obě dávky použité ve studiích DEFINE a CONFIRM dosáhly statisticky významného zlepšení v primárních i sekundárních cílech studií vyjma oddálení progrese disability v porovnání s placebem ve studii CONFIRM. Efekt obou dávek byl potvrzen i v předem specifikované integrované analýze dat z obou studií. Protože vyšší dávka neprokázala žádný přidaný prospěch, byla pro klinické použití schválena dávka 2krát 240 mg denně.
Účinek na výskyt relapsů
Ve srovnání s placebem redukoval DMF riziko relapsu ve studii DEFINE o 49 % (primární cíl studie DEFINE; poměr rizika, hazard ratio – HR: 0,51; interval spolehlivosti, confidence interval – 95% CI: 0,40–0,66; p < 0,001) a o 34 % ve studii CONFIRM (HR: 0,66; 95% CI: 0,51–0,86; p ≤ 0,01). DMF signifikantně snížil roční počet relapsů (primární cíl studie CONFIRM) o 44 % a ve studii DEFINE o 53 %. Integrovaná analýza dat obou studií podpořila zjištění účinku DMF: ve srovnání s placebem byl roční počet relapsů redukován o 49 % a riziko vzniku relapsu o 43 % během dvou let. Efekt bylo možno pozorovat již po 10 týdnech studií a během dvou let tento účinek neklesal [23]. Snížení výskytu relapsů nezáviselo na geografické oblasti, vstupních charakteristikách pacientů ani nemoci (pohlaví, věk, předchozí anamnéza relapsů, McDonaldova kritéria, předchozí léčba, objem T2 lézí dle EDSS –Expanded Disability Status Scale, škála umožňující popis stavu pacienta s RS, přítomnost gadolinium vychytávajících lézí) [24].
DMF redukoval podle integrované analýzy dat potřebu steroidní léčby relapsů ve srovnání s placebem o 48 % a roční potřebu hospitalizací v důsledku relapsů o 34 %. Glatiramer acetát také významně snižoval roční počet relapsů a podíl pacientů s relapsem během dvou let ve srovnání s placebem ve studii CONFIRM. Srovnání post hoc neukázalo rozdíl v ročním výskytu relapsů nebo v podílu počtu pacientů s relapsem při léčbě DMF a glatiramer acetátem, studie však ani nebyla z hlediska statistické síly k podobnému srovnání navržena.Doba do prvního relapsu (25. percentil) byla ve studiích DEFINE a CONFIRM 87 (72) týdnů ve skupině s DMF ve srovnání s 38 (30) týdny ve skupině s placebem.Předběžná analýza výsledků studie ENDORSE ukázala, že efekt DMF je v průběhu čtyř let setrvalý. Po dvou letech trvání studie ENDORSE činil u pacientů, kteří pokračovali v léčbě DMF, roční počet relapsů 0,142. Podíl pacientů s relapsem byl během čtyř let 36,2 %. U pacientů, kteří přešli z podávání placeba na léčbu DMF, dosahoval roční počet relapsů po dvou letech studie ENDORSE 0,126, u pacientů, kteří přešli z léčby glatiramer acetátem na léčbu DMF, představoval roční počet relapsů 0,128.
Účinek na progresi disability
Progrese disability byla definována klasicky jako zvýšení o nejméně 1 stupeň EDSS škály u pacientů se vstupním EDSS vyšším než 1 (EDSS > 1) nebo jako zvýšení o 1,5 stupně EDSS u pacientů se vstupním EDSS rovnajícím se nule (EDSS = 0). Zvýšené EDSS skóre muselo přetrvávat alespoň 12 týdnů. Ve studii DEFINE redukovala léčba DMF riziko potvrzené progrese RS ve srovnání s placebem o 38 % během dvou let (HR: 0,62; 95% CI: 0,44 – 0,87; p < 0,005). Tento výsledek nebyl potvrzen ani pro DMF, ani pro glatiramer acetát ve studii CONFIRM. Stojí za zmínku, že podíl pacientů s konfirmovanou progresí činil v placebové skupině ve studii CONFIRM 17 %, zatímco podíl pacien-
tů s progresí onemocnění, kteří byli zařazeni do skupiny s placebem ve studii DEFINE, byl 27 %. V integrované analýze dat redukoval DMF riziko potvrzené progrese o 32 % v porovnání s placebem (p = 0,0034). Ačkoli integrovaná analýza byla předem specifikovaná, je třeba k tomuto výsledku přistupovat obezřetně, především kvůli rozdílnému chování placebových skupin ve studii DEFINE a CONFIRM.
Po čtyřech letech kontinuální léčby DMF mělo 15,4 % pacientů potvrzenu progresi disability. U pacientů, kteří přešli z podávání placeba na léčbu DMF ve studii ENDORSE, došlo k progresi onemocnění v 19,9 % případů, u pacientů, kteří přešli z léčby glatiramer acetátem na léčbu DMF, nastala progrese ve 23,1 % případů [22].
Účinek na parametry magnetické rezonance
DMF významně redukoval počet nových a zvětšujících se T2 lézí během dvou let podávání: o 85 % ve studii DEFINE a o 71 % ve studii CONFIRM. Počet nových T1 vážených lézí byl také významně redukován. Redukce pravděpodobnosti výskytu gadolinium vychytávajících lézí činila 90 % a 74 % (DEFINE, CONFIRM). Po dvou letech studie nemělo 93 % pacientů léčených DMF ve studii DEFINE žádné gadolinium vychytávající léze, z pacientů dostávajících placebo dosáhlo tohoto stavu pouze 62 %. MR skeny byly provedeny při zahájení studie a dále po 6, 12 a 24 měsících. Analýza podskupin ve studii CONFIRM ukázala, že efekt DMF na MR parametry nebyl ovlivněn předchozí léčbou ani charakteristikami pacientů či nemoci při vstupu do studie.
Také glatiramer acetát redukoval ve srovnání s placebem počet nových a zvětšujících se hyperintenzních ložisek na T2 vážených obrazech MR, počet gadolinium vychytávajících lézí a nových T1 hypointenzních lézí během dvou let ve studii CONFIRM. Ačkoli záměrem studie nebylo srovnávat glatiramer acetát a DMF, dosáhl DMF významnějších výsledků než glatiramer acetát, s výjimkou nových T1 lézí. Ve studii DEFINE redukoval DMF nárůst mozkové atrofie a objemu lézí. Od 6. do 24. měsíce byl postup atrofie redukován o 30 % ve srovnání s placebem. Objem T2 lézí byl u pacientů léčených DMF redukován o 6,2 %, ve skupině s placebem se naopak o 20,1 % zvýšil (p < 0,0001). Ve studii DEFINE v podskupině 392 pacientů byla také významně zlepšena hodnota MTR (magnetization transfer ratio), odpovídající větší koncentraci myelinu a axonů. Oproti placebu představovala průměrná změna v celém mozku +0,129 % vs. –0,389 % (p = 0,0027) a v normálně vypadající bílé hmotě +0,190 % vs. –0,392 % (p = 0,0006).
V obou studiích byly měřeny parametry kvality života pomocí dotazníků SF-36 a EQ-5D. Podávání dimethyl fumarátu bylo spojeno se zlepšením fyzické komponenty dotazníků, a to dlouhodobě. Mentální komponenta se nemě-
nila [25].
Zařazení do současné palety léčiv
Léky první linie (interferon beta a glatiramer acetát) jsou dlouhodobě účinné bohužel pouze u přibližně jedné třetiny pacientů. Navíc se jedná o injekční přípravky, což zhoršuje adherenci k léčbě, lokální reakce u některých pacientů nemají tendenci k ústupu a únava provázející léčbu interferony má vliv na kvalitu života. Proto je velkou snahou posledních let přinést na trh léky podávané per os. Vzhledem k tomu, že v porovnání s placebem má dimethyl fumarát efekt vyšší, než bylo pozorováno ve studiích s léky první volby, a jeho spektrum nežádoucích účinků je příznivé, není důvod, aby nebyl použit v první linii léčby relabující-remitující RS [26, 27]. Tak bychom ho rádi viděli jako kliničtí lékaři. O skutečném místě v paletě léčiv však rozhodují plátci.
Indikace
Dimethyl fumarát je indikován pro léčbu relabující-remitující roztroušené sklerózy u dospělých pacientů.
Kontraindikace
Kontraindikací léčby dimethyl fumarátem je dlouhodobá lymfopenie.
Nežádoucí účinky
Snášenlivost DMF byla ve studiích velmi dobrá [19–21]. Výskyt nežádoucích účinků a jejich četnost byly v obou studiích fáze III ve skupinách s DMF i s placebem srovnatelné. Pacienty léčené DMF nejvíce obtěžovaly gastrointestinální příznaky (27 %), které zahrnovaly průjem, bolest v epigastriu, nauzeu a zvracení a zrudnutí (návaly horka, 32 %). Gastrointestinální příznaky, objevující se především v prvních třech měsících léčby, vedly k ukončení léčby ve 4 % , zrudnutí ve 3 % případů. U tří pacientů mělo zrudnutí až ráz anafylaktoidní reakce. V klinickém užití se doporučuje pokusit se příznaky ovlivnit obvyklou symptomatickou léčbou.
Výskyt infekce včetně závažných infekcí se u pacientů, jimž byl podáván DMF či placebo, nelišil a zahrnoval především nazofaryngitidu, infekce horních cest dýchacích a močové infekce. Ve studiích se nevyskytla žádná oportunní infekce.
V souvislosti s léčbou přípravkem obsahujícím estery kyseliny fumarové nebo magistraliter připravenou směsí esterů kyseliny fumarové bylo v minulosti hlášeno 5 případů progresivní multifokální leukoencefalopatie (PML) u pacientů s psoriázou [28]. Tito pacienti však měli rizikové faktory pro vznik PML a/nebo protrahovanou těžkou lymfopenii.
DMF snižuje počet lymfocytů, u většiny pacientů však pouze na dolní mez normy; 6 % pacientů ve studiích DEFINE a CONFIRM mělo počet lymfocytů nižší než 0,5 × 109/l (III. stupeň toxicity) oproti méně než 1 % pacientů ze skupiny placeba, II. stupeň toxicity s počtem lymfocytů 0,5–0,8 × 109/l mělo 22 % pacientů (vs. 2 % pacientů ze skupiny placeba). U žádného z těchto pacientů se však neobjevily klinické nežádoucí účinky, které by vedly k ukončení léčby.
DMF může vést ke zvýšení aktivity jaterních enzymů. Ve studii DEFINE se zvýšení hodnot ALT nad trojnásobek horní hranice normy objevilo u 6 % pacientů léčených DMF a 3 % pacientů léčených placebem, ve studii CONFIRM to bylo v obou případech u 6 % pacientů. Zvýšení aktivity transamináz se většinou objevuje v prvních šesti měsících léčby.
Lékové interakce
Dříve než se DMF v lidském těle dostane do krevního oběhu, dochází k jeho rozsáhlé metabolizaci esterázami. Další metabolizace nastává v rámci cyklu kyseliny trikarboxylové bez zapojení systému cytochromu P450 (CYP). Studie CYP inhibice in vitro, indukční studie, studie P-glykoproteinu ani studie proteinové vazby dimethyl fumarátu a monomethyl fumarátu nezjistily potenciální rizika vzájemného působení jednotlivých léčivých přípravků. Léčba akutních atak kortikosteroidy nevedla ve studiích ke zvýšení rizika nežádoucích účinků. Vliv na tvorbu protilátek při vakcinaci nebyl zkoumán.
Těhotenství a kojení
Studie na zvířatech prokázaly reprodukční toxicitu. Podávání dimethyl fumarátu se v těhotenství a u žen ve fertilním věku, které nepoužívají vhodnou antikoncepci, nedoporučuje. Americký úřad FDA (Food and Drug Administration) označil DMF za „pregnancy category C”. Zdá se, že riziko pro plod se nezvýší, je-li v prvním trimestru exponován DMF, jak ukázala analýza 37 těhotenství ve studiích [29]. K získání dalších dat byl založen registr těhotných. Není známo, zda se DMF nebo jeho metabolity vylučují do mateřského mléka u člověka. Riziko pro novorozence a kojence nelze vyloučit. Údaje z předklinických studií nenaznačují, že by dimethyl fumarát snižoval fertilitu.
Dávkování
Počáteční dávka DMF je 120 mg dvakrát denně, po 7 dnech se pak zvýší na doporučenou dávku 240 mg dvakrát denně. Při výskytu gastrointestinálních nežádoucích účinků lze dávku přechodně snížit na úvodní, do měsíce by ale mělo být dosaženo plné dávky. Doporučuje se podávat tobolky s jídlem. Zrudnutí lze omezit krátkodobým používáním malé dávky kyseliny acetylsalicylové (325 mg), která se podává půl hodiny před užitím DMF [30]. Před zahájením léčby, po 3 a 6 měsících, a dále po 6–12 měsících se doporučuje provést vyšetření krevního obrazu, funkce ledvin a hodnot jaterních transamináz.
Závěr
Dimethyl fumarát představuje novou perorální možnost léčby relabující-remitující RS. Lékařům přibývá další zbraň v jejich boji s touto zákeřnou nemocí, pacientům možnost léčby účinnějším přípravkem, než jsou dosavadní léky první volby. Znalost mechanismu účinku, nežádoucích účinků a spolupráce při léčbě je však základní podmínkou úspěchu. Pacient s RS přestal být pasivním článkem v managementu své choroby a má svá nová práva, ale také povinnosti. Jen tak lze ze všech nových léků, které výzkum na pole RS přináší, zajistit maximální prospěch.
Práce byla podpořena programem PRVOUK-P26/LF1/4.
Seznam použité literatury
- [1] Linker RA, Lee DH, Ryan S, et al. Fumaric acid esters exert neuroprotective effects in neuroinflammationvia activation of the Nrf2 antioxidant pathway. Brain 2011; 134: 678–692.
- [2] Scannevin RH, Chollate S, Jung MY, et al. Fumarates promote cytoprotection of central nervous system cells against oxidative stress via the nuclear factor (erythroid-derived 2)-like 2 pathway. J Pharmacol Exp Ther 2012; 341: 274–284.
- [3] Kalinin S, Polak PE, Lin SX, et al. Dimethyl fumarate regulates histone deacetylase expression in astrocytes. J Neuroimmunol 2013; 263: 13–19.
- [4] Schilling S, Goelz S, Linker R, et al. Fumaric acid esters are effective in chronic experimental autoimmune encephalomyelitis and suppress macrophage infiltration. Clin Exp Immunol 2006; 145: 101–107.
- [5] Li W, Khor TO, Xu C, et al. Activation of Nrf2-antioxidant signaling attenuates NFkappaB-inflammatory response and elicits apoptosis. Biochem Pharmacol 2008; 76: 1485–1489.
- [6] Peng H, Guerau-de-Arellano M, Mehta VB, et al. Dimethyl fumarate inhibits dendritic cell maturation via nuclear factor kappaB (NF-kappaB) and extracellular signal-regulated kinase 1 and 2 (ERK1/2) and mitogen stress-activated kinase 1 (MSK1) signaling. J Biol Chem 2012; 287: 28017–28026.
- [7] Lin SX, Lisi L, Dello Russo C, et al. The anti-inflammatory effects of dimethyl fumarate in astrocytes involve glutathione and haem oxygenase-1. ASN Neuro 2011; 3 (2). pii: e00055.
- [8] Schulze-Topphoff U, Varrin Doyer M, Pekarek R, et al. Dimethyl fumarate utilizez Nrf2-independent and Nrf2 dependent pathways for immun modulation [abstract No P565]. 29th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; 2-5 Oct 2013; Copenhagen.
- [9] Phillips JT, Fox RJ. BG-12 in multiple sclerosis. Semin Neurol 2013; 33: 56–65.
- [10] Ghoreschi K, Brück J, Kellerer C, et al. Dimethyl fumarate regulates histone deacetylase expression in astrocytes. J Neuroimmunol 2013; 263: 13–19.
- [11] Schimrigk S, Brune N, Hellwig K, Lukas C, et al. Oral fumaric acid esters for the treatment of active multiple sclerosis: an open-label, baseline-controlled pilot study. Eur J Neurol 2006; 13: 604–610.
- [12] Treumer F, Zhu K, Glaser R, et al. Dimethylfumarate is a potent inducer of apoptosis in human T cells. J Invest Dermatol 2003; 121: 1383–1388.
- [13] Biogen Idec Inc. Tecfidera (dimethyl fumarate): US prescribing information; 2013. http://www.tecfidera.com/pdfs/full-prescribing- information.pdf. Accessed 14 Feb 2014.
- [14] Hanson J, Gille A, Zwykiel S, et al. Nicotinic acid- and mono-methyl fumarate-induced flushing involves GPR109A expressed by keratinocytes and COX-2 dependent prostanoid formation in mice. J Clin Invest 2010; 120: 2910–2919.
- [15] Van Horssen J, de Vries HE. Dimethyl fumarate: a novel oral front-line therapy for multiple sclerosis treatment. Future Neurol 2013; 8: 247–254.
- [16] Litjens NH, Burggraaf J, van Strijen E, et al. Pharmacokinetics of oral fumarates in healthy subjects. Br J Clin Pharmacol 2004; 58: 429–432.
- [17] Schweckendiek W. Treatment of psoriasis vulgaris. Med Monatsschr 1959; 13: 103–104.
- [18] Mrowietz U, Christophers E, Altmeyer P. Treatment of psoriasis with fumaric acid esters: results of a prospective multicentre study. German Multicentre Study. Br J Dermatol 1998; 138: 456–460.
- [19] Kappos L, Gold R, Miller DH, et al. Efficacy and safety of oral fumarate in patients with relapsing-remitting multiple sclerosis: a multicentre, randomised, double-blind, placebo-controlled phase IIb study. Lancet 2008; 372: 1463–1472.
- [20] Gold R, Kappos L, Arnold D, et al. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med 2012; 367: 1098–1107.
- [21] Fox RJ, Miller DH, Phillips JT, et al. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012; 367: 1087–1097.
- [22] Gold R, Phillips JT, Bar-Or A, et al. Four-year follow-up of BG-12 (dimethyl fumarate) treatment in relapsing remitting multiple sclerosis (RRMS): integrated clinical efficacy data from the DEFINE, CONFIRM, and ENDORSE studies [abstract no. P1004 plus poster]. 29th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; 2-5 Oct 2013; Copenhagen.
- [23] Kappos L, Giovannoni G, Gold R, et al. Timecourse of treatment effects of BG-12 (dimethyl fumarate) for relapsing-remitting multiple sclerosis [abstract no. DX40 plus poster]. Fifth Cooperative Meeting of the Consortium of Multiple Sclerosis 55. Centers and the Americas Committee for Treatment and Research in Multiple Sclerosis; 16–23 Mar 2013; Orlando, FL.
- [24] Hutchinson M, Fox RJ, Miller DH, et al. Clinical efficacy of BG-12 (dimethyl fumarate) in patients with relapsing-remitting multiple sclerosis: subgroup analyses of the CONFIRM study. J Neurol 2013; 260: 2286–2296.
- [25] Kita M, Fox RJ, Phillips JT, et al. Effects of BG-12 (dimethyl fumarate) on health-related quality of life in patients with relapsing-remitting multiple sclerosis: findings from the CONFIRM study. Mult Scler 2014; 20: 253–257.
- [26] Havrdova E, Hutchinson M, Kurukulasuriya NC, et al. Oral BG-12 (dimethyl fumarate) for relapsing-remitting multiple sclerosis: a review of DEFINE and CONFIRM. Evaluation of: Gold R, Kappos L, Arnold D, et al. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med 2012; 367: 1098–1107; and Fox RJ, Miller DH, Phillips JT, et al. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012; 367: 1087–1097. Expert Opin Pharmacother 2013; 14: 2145–2156.
- [27] Hutchinson M, Fox RJ, Havrdova E, et al. Efficacy and safety of BG-12 (dimethyl fumarate) and other disease modifying therapies for the treatment of relapsing-remitting multiple sclerosis: a systematic review and mixed treatment comparison. Curr Med Res Opin 2014; 30: 613–627.
- [28] van Oosten BW, Killestein J, Barkhof F, et al. PML in a patient treated with dimethyl fumarate from a compounding pharmacy. N Engl J Med 2013; 368: 1658–1659.
- [29] Gold R, Philis JT, Havrdová E, et al. Oral BG-12 (dimethyl fumarate) and pregnancy: preclinical studies and pregnancy outcomes reported during the clinical development programme [abstract no. P991]. 29th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; 2-5 Oct 2013; Copenhagen.
- [30] Sheikh SI, Nestorov I, Russell H, et al. Tolerability and pharmacokinetics of delayed-release dimethyl fumarate administered with and without aspirin in healthy volunteers. Clin Ther 2013; 35: 1582–1594.e9.
- [31] Lee DH, Gold R, Linker RA. Mechanisms of Oxidative Damage in Multiple Sclerosis and Neurodegenerative Diseases: Therapeutic Modulation via Fumaric Acid Esters. Int J Mol Sci 2012; 13: 11783–11803.