Edoxaban – nový inhibitor FXa
Souhrn:
Edoxaban je dalším novým perorálním přímým inhibitorem aktivovaného faktoru X. V článku je podán přehled o jeho účinnosti ve srovnání s warfarinem při prevenci ischemického iktu a systémové embolizace u nemocných s nevalvulární fibrilací síní, při léčbě a prevenci rekurence hluboké žilní trombózy nebo plicní embolie. V obou těchto indikacích je edoxaban nyní registrován i v České republice. Dále jsou zde uvedeny poznámky k jeho použití v klinické praxi včetně postupu při krvácení a možnost laboratorní detekce.
Key words: edoxaban – anti‑FXa – atrial fibrillation – deep vein thrombosis – pulmonary embolism.
Summary:
V současné době dochází i v České republice k rozšíření skupiny nových perorálních antikoagulancií o další přípravek, který se užívá jen jedenkrát denně. Je to přímý inhibitor aktivovaného faktoru X (FXa) edoxaban. V databázi léků Státního ústavu pro kontrolu léčiv je edoxaban řazen do skupiny Jiná antitrombotika, ATC kód: B01AF03, pod názvem Lixiana [1].Léčivý přípravek je registrován ve třech různých silách, kdy jedna potahovaná tableta obsahuje edoxabanum tosilatum v dávce 15 mg, 30 mg a nebo 60 mg.
V současné době dochází i v České republice k rozšíření skupiny nových perorálních antikoagulancií o další přípravek, který se užívá jen jedenkrát denně. Je to přímý inhibitor aktivovaného faktoru X (FXa) edoxaban. V databázi léků Státního ústavu pro kontrolu léčiv je edoxaban řazen do skupiny Jiná antitrombotika, ATC kód: B01AF03, pod názvem Lixiana [1].
Léčivý přípravek je registrován
ve třech různých silách, kdy jedna potahovaná tableta
obsahuje edoxabanum tosilatum v dávce 15 mg,
30 mg a nebo 60 mg.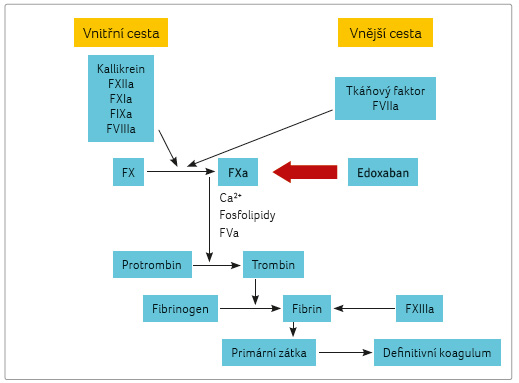
Mechanismus účinku
Edoxaban je vysoce selektivní, přímý a reverzibilní inhibitor FXa (obr. 1). Inhibuje jak volný FXa, tak i aktivitu protrombinázy. Dochází tak ke snížení tvorby trombinu, k prodloužení doby srážení krve a snižuje se riziko vzniku trombu [1,2]. Při vyšetření testem generace trombinu bylo zjištěno, že edoxaban inhibuje tvorbu trombinu třikrát účinněji než další inhibitor FXa fondaparinux [3].
Edoxaban po požití per os má
velmi rychlý nástup farmakodynamických účinků (do 1−2
hodin), kdy je dosaženo jeho maximální expozice. V tabulce 1
je uvedeno srovnání farmakologických účinků edoxabanu
v porovnání s dalšími takzvanými novými přímými
perorálními antikoagulancii (non vitamin K antagonist
oral anticoagulants, NOAC), která jsou již u nás používána.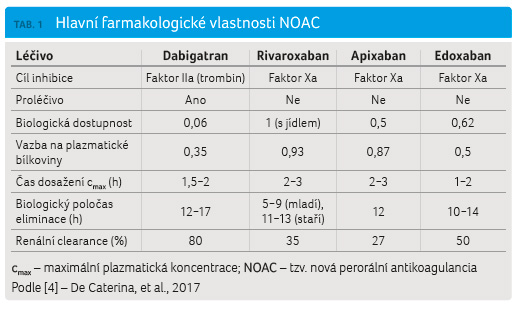
Indikace edoxabanu a jeho dávkování
Edoxaban je zatím schválen Evropskou lékovou agenturou (EMA) k léčbě v těchto dvou indikacích:
a) Prevence cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní (NVAF) s jedním nebo více rizikovými faktory, jakými jsou kongestivní srdeční selhání, hypertenze, věk 75 let a více, diabetes mellitus, předchozí cévní mozková příhoda nebo tranzitorní ischemická ataka.
b) Léčba hluboké žilní trombózy
(deep vein thrombosis, DVT), plicní embolie (PE) a prevence
rekurentních DVT a PE u dospělých pacientů
(s výjimkou u hemodynamicky nestabilních
pacientů s PE).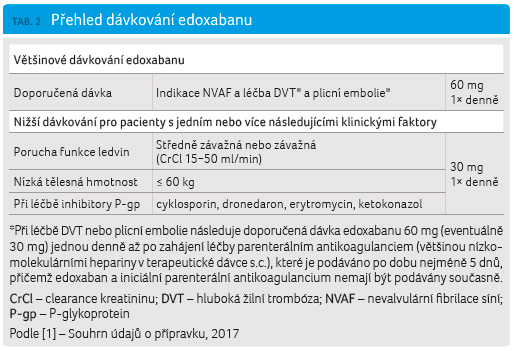
Dávkování edoxabanu podle Souhrnu údajů o přípravku (SPC) [1] je uvedeno v tabulce 2.
Zvláštní pozornost při léčbě
Níže jsou popsány zvláštní populace a situace, kde je při léčbě edoxabanem třeba přihlížet k uvedeným faktorům [1].
Renální funkce
Renální funkce se má posoudit před zahájením léčby u všech pacientů výpočtem clearance kreatininu (CrCl) podle Cockcrofta a Gaulta, aby bylo možné vyloučit pacienty v konečném stadiu renálního onemocnění (tj. CrCl < 15 ml/min), podat správnou dávku přípravku pacientům s CrCl 15−50 ml/min (30 mg jednou denně) a pacientům s CrCl > 50 ml/min (60 mg jednou denně) a aby bylo možné rozhodnout o použití přípravku u pacientů se zvýšenou CrCl, jak bude uvedeno dále. Renální funkce se má posoudit před léčbou, při podezření na změnu renální funkce v průběhu léčby (např. při hypovolemii, dehydrataci, v případě souběžného použití některých léčivých přípravků) anebo v případě krvácení nebo přerušení léčby před operací.
Funkce jater
Edoxaban je kontraindikován u pacientů s jaterním onemocněním, které je spojeno s koagulopatií a klinicky relevantním rizikem krvácení. U pacientů s těžkou poruchou funkce jater se použití přípravku také nedoporučuje a u pacientů s mírnou až středně těžkou poruchou funkce jater se doporučená dávka edoxabanu má používat s opatrností. Lze se řídit výsledky laboratorního vyšetření hodnot jaterních enzymů. Nemocní s více než dvojnásobnými hodnotami ALT/AST (alaninaminotransferázy/aspartátaminotransferázy) oproti hornímu limitu normálu nebo s hodnotami celkového bilirubinu ≥ 1,5násobku horního limitu normálu byli ze studií vyloučeni. Proto se má edoxaban u této populace používat s opatrností. Před zahájením léčby je žádoucí provést funkční jaterní testy.
Věk a pohlaví
U starších osob není ani s ohledem na rozdílnost pohlaví nutné snížení dávky, děti a osoby mladší 18 let byly z klinického hodnocení vyloučeny.
Souběžné použití edoxabanu s dalšími léky
U pacientů, kteří souběžně užívají edoxaban a následující inhibitory P glykoproteinu (P gp) – cyklosporin, dronedaron, erytromycin nebo ketokonazol –, je doporučená dávka edoxabanu 30 mg jednou denně. Podávání edoxabanu s jinými inhibitory P gp včetně inhibitorů HIV proteázy nebylo zkoumáno. Při souběžném použití amiodaronu, chinidinu nebo verapamilu však není nutné snížení dávky.
Přerušení léčby z důvodu chirurgického zákroku a jiných intervencí
Je li nutné přerušit antikoagulační léčbu, aby se snížilo riziko krvácení při chirurgických či jiných zákrocích, má se ukončit podávání přípravku co nejdříve, pokud možno nejméně 24 hodin před zákrokem. Při rozhodování, zda by měl být zákrok odložen až do doby, kdy uplyne 24 hodin od podání poslední dávky edoxabanu, se má zvážit zvýšené riziko krvácení vzhledem k naléhavosti intervence. Přípravek je možno po chirurgických či jiných zákrocích začít znovu podávat, jakmile je zajištěna odpovídající hemostáza, přičemž doba do nástupu antikoagulačního léčebného účinku edoxabanu je 1−2 hodiny.
Změna antikoagulační terapie
Přechod z léčby jinými antikoagulancii na léčbu edoxabanem:
- z warfarinu: ukončit podávání antagonisty vitaminu K a edoxaban začít podávat, když je hodnota INR (international normalized ratio) ≤ 2,5;
- z NOAC (dabigatranu, rivaroxabanu nebo apixabanu): ukončit jejich podávání a edoxaban začít podávat v době, kdy by měla být podána další dávka NOAC;
- z parenterálních antikoagulancií:
- V případě nízkomolekulárních heparinů a fondaparinuxu ukončit subkutánní podávání antikoagulancia a v době, kdy měla být podána jeho další dávka, začít podávat edoxaban.
- Při i.v. podávání nefrakcionovaného heparinu (UFH) přerušit infuzi a o 4 hodiny později začít podávat edoxaban.
Přechod z léčby edoxabanem na léčbu warfarinem:
- pacientům, kteří v současnosti užívají dávku 60 mg, je třeba podávat dávku 30 mg jednou denně spolu s vhodnou dávkou warfarinu;
- pacientům, kteří užívají dávku 30 mg, je však spolu s warfarinem třeba jednou denně podávat edoxaban v dávce 15 mg. Doporučuje se zde použít léčebný algoritmus pro warfarin a jeho kontrolu stanovením INR v souladu s místní praxí. Podávání edoxabanu se má ukončit, jakmile je dosaženo stabilní hodnoty INR ≥ 2,0.
Kontraindikace
Léčba edoxabanem je kontraindikována v následujících případech [1]:
- hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku v tabletě;
- klinicky významné aktivní krvácení;
- jaterní onemocnění spojené s koagulopatií a klinicky relevantním rizikem krvácení;
- léze nebo stav, který je považován za významné riziko závažného krvácení; mohou mezi ně patřit: současné nebo nedávno prodělané ulcerace gastrointestinálního traktu, přítomnost maligních novotvarů s vysokým rizikem krvácení, nedávno prodělané poranění mozku nebo míchy, operace mozku, míchy nebo oka v nedávné době, intrakraniální krvácení v nedávné době, jícnové varixy nebo podezření na ně, arteriovenózní malformace, cévní aneuryzma nebo významné cévní abnormality v míše nebo mozku;
- nekontrolovaná těžká hypertenze;
- souběžná léčba jinými antikoagulačními přípravky, např. UFH, nízkomolekulárními hepariny, fondaparinuxem, perorálními antikoagulancii (warfarinem, dabigatran etexilátem, rivaroxabanem, apixabanem atd.) se nedoporučuje s výjimkou specifické situace, kdy je pacient převáděn z perorální antikoagulační léčby warfarinem nebo když je podáván UFH v dávkách nezbytných pro udržení průchodnosti centrálního žilního nebo arteriálního katétru;
- těhotenství a kojení.
Klinická hodnocení fáze III vedoucí k registraci přípravku
ENGAGE AF TIMI 48
Studie ENGAGE AF TIMI 48 byla zaměřena na prevenci mozkové příhody a systémové embolizace u nemocných s nevalvulární fibrilací síní se středním až vysokým rizikem vzniku mozkové příhody a systémových embolických příhod (SEE); klinické hodnocení porovnávalo podávání edoxabanu a warfarinu [5]. Jednalo se o příhodami řízenou, multicentrickou, randomizovanou, dvojitě zaslepenou a maskovanou studii fáze III s paralelními skupinami, která měla prokázat účinnost a bezpečnost dvou různých dávek edoxabanu (60 mg nebo 30 mg) proti warfarinu. Do této studie bylo zařazeno 21 105 subjektů s průměrným skóre CHADS2 2,8.
Pacienti z obou léčebných skupin s edoxabanem užívali poloviční dávku 30 mg, pokud byl přítomen jeden nebo více z následujících klinických faktorů: středně závažná porucha funkce ledvin (CrCl 30−50 ml/min), nízká tělesná hmotnost (≤ 60 kg) nebo souběžné použití specifických inhibitorů P gp (verapamilu, chinidinu, dronedaronu).
Medián expozice hodnocenému léku u obou léčebných skupin s edoxabanem v dávce 60 mg a 30 mg byl 2,5 roku. Medián následného sledování ve studii u obou léčebných skupin s edoxabanem v dávce 60 mg a 30 mg byl 2,8 roku. Medián doby terapeutického rozmezí INR 2,0−3,0 (percent time in therapeutic INR range, TTR) byl u nemocných léčených warfarinem 68,4 %.
Primárním cílovým ukazatelem
účinnosti byl výskyt mozkové příhody a SEE. Sekundární
cílové ukazatele účinnosti představovaly: mozkové příhody,
SEE a úmrtnost z kardiovaskulárních příčin; nebo
závažná kardiovaskulární nežádoucí příhoda, která
zahrnovala infarkt myokardu bez fatálních následků, mozkovou
příhodu bez fatálních následků, SEE bez fatálních následků
a úmrtí z kardiovaskulárních příčin nebo v důsledku
krvácení a mozkové příhody, SEE a úmrtnost
z jakýchkoliv příčin.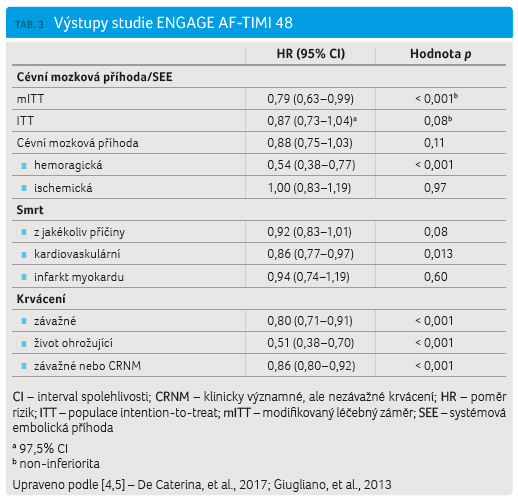
Hlavní analýza účinnosti byla zaměřena na průkaz non inferiority edoxabanu oproti warfarinu při první mozkové příhodě nebo SEE, které se objevily v průběhu léčby nebo do 3 dnů od poslední užité dávky v modifikované populaci podle původního léčebného záměru (modified intention to treat, mITT). Primárním cílovým ukazatelem bezpečnosti bylo závažné krvácení.
Výstupy studie ENGAGE AF TIMI 48 s edoxabanem 60 mg/30 mg vs. warfarin shrnující účinnostní a bezpečnostní ukazatele jsou přehledově uvedeny v tabulce 3 [4].
Některé subanalýzy výsledků studie ENGAGE AF TIMI 48 vedly k nálezu trendu nižší relativní účinnosti edoxabanu při prevenci ischemického iktu ve srovnání s warfarinem u nemocných s velmi dobrou funkcí ledvin a s vyšší hodnotou CrCl, tj. > 95 ml/min (HR 1,36; 95% CI 0,88−2,10; p = 0,08). Po přezkoumání všech dat je však zjištěno, že ačkoliv při vyšších hodnotách CrCl byl patrný pokles relativní účinnosti edoxabanu (je z 50 % vylučován ledvinami), bezpečnost léčby a čistý klinický přínos edoxabanu ve srovnání s warfarinem byly nakonec konzistentní v celém rozsahu funkce ledvin [6]. Přesto se dle SPC má použití edoxabanu u pacientů s NVAF a s vysokou hodnotou CrCl (> 95 ml/min) volit po pečlivém posouzení individuálního rizika vzniku tromboembolie a krvácení u každého takového případu.
Hokusai VTE
Klinická studie Hokusai VTE byla zaměřena na účinnost edoxabanu v léčbě DVT nebo PE a v prevenci rekurentní DVT a PE [7]. Pro klinické sledování bylo 8 292 subjektů randomizovaně rozděleno do skupiny s počáteční léčbou heparinem (enoxaparinem nebo nefrakcionovaným heparinem) podávaným 5 dní a s následnou léčbou edoxabanem v dávce 60 mg jednou denně, nebo do skupiny s heparinem a warfarinem, který byl kontrolován do cílové hodnoty INR 2,0–3,0. Poté pokračovala jen léčba warfarinem. Délka léčby se pohybovala od 3 do 12 měsíců a byla určena hodnotitelem. Edoxaban v dávce 30 mg jednou denně byl pak použit u nemocných s jedním nebo více následujícími klinickými faktory: středně závažná porucha funkce ledvin (CrCl 30−50 ml/min); tělesná hmotnost nižší než 60 kg; souběžné použití specifických inhibitorů P gp.
Primárním cílovým ukazatelem
účinnosti byla rekurence symptomatické VTE definovaná jako
reku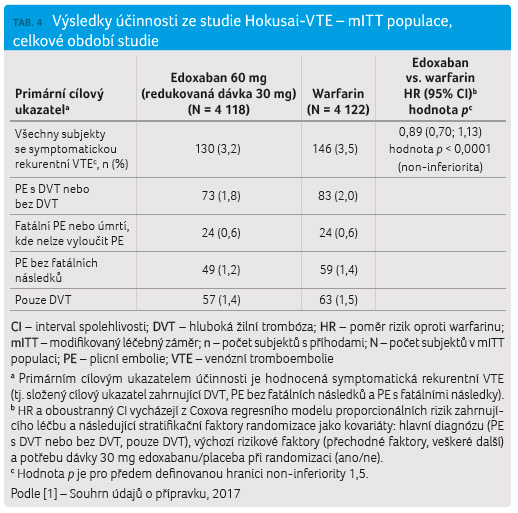 rentní symptomatická DVT, nebo symptomatická PE bez fatálních
následků, či PE s fatálními následky v průběhu
12měsíčního období. Sekundární parametry účinnosti
zahrnovaly kompozitní klinický parametr složený z rekurentní
VTE a úmrtnost z jakýchkoliv příčin.
rentní symptomatická DVT, nebo symptomatická PE bez fatálních
následků, či PE s fatálními následky v průběhu
12měsíčního období. Sekundární parametry účinnosti
zahrnovaly kompozitní klinický parametr složený z rekurentní
VTE a úmrtnost z jakýchkoliv příčin.
Studií Hokusai VTE bylo
prokázáno, že edoxaban je non inferiorní vůči warfarinu
v primárním parametru účinnosti, rekurentní VTE (p < 0,0001
pro non inferioritu). Rozdíly mezi oběma skupinami nebyly
zjištěny ani v sekundárním složeném 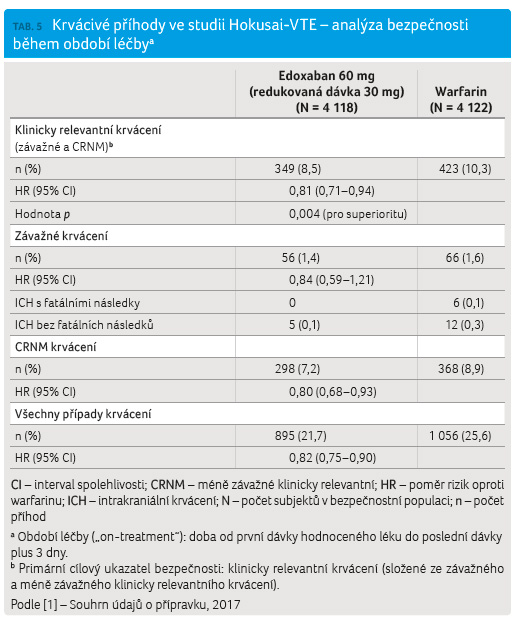 cílovém ukazateli
(rekurentní VTE a úmrtnost z jakýchkoliv příčin), ani
v úmrtnosti z jakýchkoliv příčin. Podobné nálezy
byly u nemocných léčených pro PE. Přehled je uveden
v tabulce 4.
cílovém ukazateli
(rekurentní VTE a úmrtnost z jakýchkoliv příčin), ani
v úmrtnosti z jakýchkoliv příčin. Podobné nálezy
byly u nemocných léčených pro PE. Přehled je uveden
v tabulce 4.
Při hodnocení bezpečnosti léčby edoxabanem vůči léčbě warfarinem, kde primárním cílovým ukazatelem bezpečnosti bylo klinicky relevantní krvácení (závažné nebo méně závažné klinicky relevantní), bylo zjištěno, že při léčbě edoxabanem došlo k významnému snížení rizika krvácení (p = 0,004 pro superioritu). Výsledky jsou uvedeny v tabulce 5.
Doporučený postup při krvácení během léčby edoxabanem
K nežádoucím účinkům každého antikoagulancia patří krvácení. K tomu může dojít i při léčbě edoxabanem. V takových případech je třeba léčbu edoxabanem na základě posouzení klinické závažnosti krvácení přerušit, nebo oddálit. Specifické antidotum blokující farmakodynamický účinek edoxabanu není zatím k dispozici, i když se předpokládá brzké schválení specifického antidota inhibitorů FXa andexanetu alfa, s kterým již proběhly klinické zkoušky fáze III [8]. V případě předávkování edoxabanem lze za účelem snížení jeho absorpce zvážit včasné podání aktivního uhlí [1]. Léčba krvácení by pak měla být individuální podle jeho závažnosti a lokalizace. Je zde třeba použít i vhodnou symptomatickou léčbu, jako jsou mechanická komprese, chirurgická hemostáza se zajištěním kontroly krvácení, náhrada tekutin a zajištění hemodynamické podpory, eventuálně i krevní deriváty (erytrocyty nebo čerstvá zmražená plazma, v závislosti na přidružené anémii nebo koagulopatii), nebo trombocyty. Při život ohrožujícím krvácení je nyní třeba podat čtyřfaktorový koncentrát protrombinového komplexu (4F PCC). Ten v dávce 50 IU/kg zvrátil účinky edoxabanu za 30 minut po dokončení infuze. Vhodná je však konzultace s odborníkem na koagulaci, pokud je dostupný. Potřebné údaje o obecném postupu při krvácení vyvolaném přímými perorálními inhibitory FXa jsou uvedeny v konsenzuálním postupu [9], který lze nalézt na webových stránkách České společnosti pro trombózu a hemostázu ČLS JEP [10].
Možnosti laboratorního sledování antikoagulačního účinku edoxabanu
Podobně jako u jiných u nás používaných přímých perorálních inhibitorů FXa (rivaroxabanu, apixabanu) není třeba antikoagulační účinek edoxabanu během léčby laboratorně sledovat. Přesto existují situace, kdy je nutné se o jeho antikoagulačním účinku dozvědět více – při krvácení, v případě nutné operace, eventuálně i posoudit, zda pacient lék užívá.
Antikoagulační (farmakodynamický) účinek edoxabanu lze odhadnout pomocí kalibrované kvantitativní analýzy aktivity anti FXa. Jiné koagulační testy, např. protrombinový čas (PT), INR a aktivovaný parciální tromboplastinový čas (aPTT), mohou být prodlouženy, což je důsledkem inhibice FXa, ale změny těchto koagulačních testů jsou při očekávané léčebné dávce malé, velmi kolísají, a nelze je tedy ke sledování antikoagulačního účinku edoxabanu použít [1,11].
Vzhledem k vysoké závislosti
eliminace edoxabanu na funkci ledvin je důležitá i současná
laboratorní kontrola renálních funkcí léčeného pacienta.
Antikoagulační aktivita, respektive inhibice FXa navozená
edoxabanem dle výsledků klinických studií ENGAGE AF TIMI 48
a Hokusai VTE, je uvedena v tabulce 6. Při
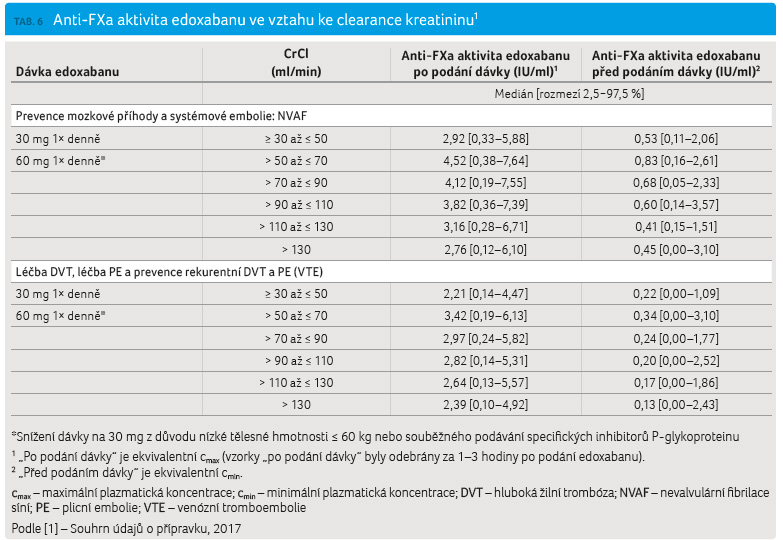 posuzování farmakodynamického účinku edoxabanu lze
však tyto údaje použít jen pro orientaci. Jsou také závislé
na dávce edoxabanu a na aktuální hodnotě CrCl,
kterou je k tomu nutné zjistit. Z údajů uvedených
v tabulce vyplývá, že hodnoty inhibice FXa jsou v začátku
léčby edoxabanem vždy vyšší než ty, které známe z vyšetření
aktivity anti FXa při léčbě nízkomolekulárními hepariny
(zde se v krvi odebrané za 3 hodiny po s.c. aplikaci
terapeutické dávky nízkomolekulárního heparinu pohybují
v rozmezí 0,6–1,2 IU/ml anti-FXa). Pro interpretaci
laboratorního vyšetření anti FXa je také nutno znát dobu,
kdy nemocný požil dávku edoxabanu; jeho poločas je asi 10−14
hodin, s maximem antikoagulačního účinku za 1−2
hodiny po podání. Lze tedy očekávat, že inhibice FXa bude
maximální během prvních hodin po požití edoxabanu. Poté
již bude klesat, s minimem v době, kdy měla být podána
další dávka.
posuzování farmakodynamického účinku edoxabanu lze
však tyto údaje použít jen pro orientaci. Jsou také závislé
na dávce edoxabanu a na aktuální hodnotě CrCl,
kterou je k tomu nutné zjistit. Z údajů uvedených
v tabulce vyplývá, že hodnoty inhibice FXa jsou v začátku
léčby edoxabanem vždy vyšší než ty, které známe z vyšetření
aktivity anti FXa při léčbě nízkomolekulárními hepariny
(zde se v krvi odebrané za 3 hodiny po s.c. aplikaci
terapeutické dávky nízkomolekulárního heparinu pohybují
v rozmezí 0,6–1,2 IU/ml anti-FXa). Pro interpretaci
laboratorního vyšetření anti FXa je také nutno znát dobu,
kdy nemocný požil dávku edoxabanu; jeho poločas je asi 10−14
hodin, s maximem antikoagulačního účinku za 1−2
hodiny po podání. Lze tedy očekávat, že inhibice FXa bude
maximální během prvních hodin po požití edoxabanu. Poté
již bude klesat, s minimem v době, kdy měla být podána
další dávka.
Závěr
K prevenci ischemického iktu u nemocných s nevalvulární fibrilací síní [12] nebo k léčbě hluboké žilní trombózy a hemodynamicky stabilní plicní embolie [13] je nyní doporučeno k použití další přímé perorální antikoagulancium – edoxaban; podobně jako rivaroxaban se i edoxaban podává v jedné denní dávce. Při použití edoxabanu dochází ve srovnání s warfarinem v obou indikacích k jasně dokumentovanému snížení výskytu závažného krvácení při shodném protitrombotickém efektu. Ukazuje se však také, že u nemocných s fibrilací síní je možné podávat edoxaban podobně jako warfarin se shodným výsledkem i při elektrické kardioverzi (studie ENSURE AF) [14]. Ve srovnání s warfarinem se nyní vyhodnocuje antitrombotický účinek edoxabanu i u nemocných s fibrilací síní, kteří měli zavedenu chlopenní bioprotézu a byli zařazeni mezi další nemocné ve studii ENGAGE AF TIMI 48 [15]. První výsledky ukazují, že edoxaban může být v této indikaci bezpečnou alternativou warfarinu s tím, že ve skupině nemocných léčených nižší dávkou (30 mg) edoxabanu byl navíc zjištěn nižší výskyt krvácivých příhod (0,76 % oproti 6,27 % u warfarinu, HR 0,12, 95% CI 0,01−0,95).
Podpořeno Institucionální podporou
MZ ČR RVO VFN64165.
Seznam použité literatury
- [1] Lixiana. Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv. Dostupné na: http://www.ema.euro-
- [2] Lip GYH, Agnelli G. Edoxaban: focused review of its clinical pharmacology. Eur Heart J 2014; 35: 1844−1855.
- [3] Samama MM, Mendell J, Guinet C, et al. In vitro study of the anticoagulant effects of edoxaban and its effect on thrombin generation in comparison to fondaparinux. Thrombosis Research 2012; 129: e77−e82.
- [4] De Caterina R, Ageno W, Boriani G, et al. Edoxaban in atrial fibrillation and venous thromboembolism – ten key questions and answers: a practical guide. Adv Ther 2017 Feb 13. doi: 10.1007/
- [5] Giugliano RP, Ruff CT, Braunwald E, et al. ENGAGE AF‑TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369: 2093–2104.
- [6] Bohula EA, Giugliano RP, Ruff CT, et al. Impact of renal function on outcomes with edoxaban in the ENGAGE AF‑TIMI 48 trial. Circulation 2016; 134: 24–36.
- [7] The Hokusai‑VTE Investigators. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013; 369: 1406–1415.
- [8] Connolly SJ. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors. N Engl J Med 2016; 375: 1131–1141.
- [9] Kvasnička J, Balík M, Binder T, et al. Peripartální život ohrožující krvácení – mezioborové konsenzuální stanovisko. Vnitřní lékařství 2012; 58: 661–664.
- [10] Česká společnost pro trombózu a hemostázu. Dostupné na: www.csth.cz
- [11] Cuker A, Husseinzadeh H. Laboratory measurement of the anticoagulant activity of edoxaban: a systematic review. J Thromb Thrombolysis 2015; 39: 288–294.
- [12] Heidbuchel H, Verhamme P, Alings M, et al. Updated European Heart Rhythm Association practical guide on the use of non‑vitamin‑K antagonist anticoagulants in patiens with non‑valvular atrial fibrillation: executive summary. Europace 2015; 17: 1467–1507.
- [13] Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and expert panel report. Chest 2016; 149: 315–352.
- [14] Goette A, Merino JL, Ezekowitz MD, et al. on behalf of the ESURE‑AF investigators. Edoxaban versus enoxaparin‑warfarin in patiens undergoing cardioversion of atrial fibrillation (ENSURE‑AF): a randomised, open‑label, phase 3b trial. Lancet 2016; 388: 1995–2003.
- [15] Carnicelli AP, De Caterina R, Halperin JL, et al., on behalf of the ENGAGE AF‑TIMI 48 investigators. Edoxaban for the prevention of thromboembolism in patients with atrial fibrillation and bioprosthetic valves. Circulation 2017 Feb 16. https://doi.org/10.1161/CIRCULATIONAHA.116.026714.