Elotuzumab v léčbě mnohočetného myelomu
Souhrn:
Elotuzumab je monoklonální protilátka s afinitou k antigenu SLAM F7 na buňkách mnohočetného myelomu. Výsledky léčby elotuzumabem známe z klinických studií zaměřených na relabující mnohočetný myelom. Monoterapie elotuzumabem neprokázala efektivitu. Kombinovaná léčba s lenalidomidem a dexametazonem vykázala vysoký počet léčebných odpovědí a signifikantně prodloužila přežití bez progrese ve srovnání s lenalidomidem a dexametazonem samotným. Účinnost terapie kombinované s jinými přípravky či účinnost primoterapie elotuzumabem nebyla doposud potvrzena a vyžaduje další analýzy v rámci klinických studií. Toxicita elotuzumabu je mírná, reprezentovaná především nežádoucími infuzními či hematologickými reakcemi. Tento článek přináší souhrn dosavadních preklinických a klinických dat o léčbě mnohočetného myelomu elotuzumabem.
Key words: multiple myeloma – elotuzumab – SLAM F7 – monoclonal antibody.
Summary:
Elotuzumab is a monoclonal antibody with affinity to SLAM F7 antigen on multiple myeloma cells. Treatment outcomes with elotuzumab are known from clinical trials in relapsed multiple myeloma. Monotherapy with elotuzumab have not shown efficacy. In combination with lenalidomide and dexamethasone, high response rates have been demonstrated and progression‑free survival was also increased compared to lenalidomide and dexamethasone alone. The efficacy of combination therapy with other agents or first‑line elotuzumab has not been confirmed and requires further analyses in clinical trials. The toxicity of elotuzumab is described as mild, represented mainly by infusion‑related and hematological reactions. This review summarizes present preclinical and clinical data regarding elotuzumab treatment in multiple myeloma.
Úvod
Mnohočetný myelom (MM) je druhé nejčastější nádorové onemocnění krvetvorby. Incidence MM v České republice je 4/100 000 osob. Choroba je způsobena nekontrolovanou proliferací maligně transformovaných plazmocytů v kostní dřeni [1].
Léčba MM prodělává za posledních 15 let velmi dynamický rozvoj. Rutinní použití inhibitorů proteazomu (proteasome inhibitor, PI) a imunomodulačních léků (immunomodulatory drug, IMID) zásadním způsobem zlepšilo prognózu jak nově diagnostikovaných nemocných, tak nemocných s relapsem [2]. Efektivita léčebných protokolů založených na PI a IMID v kombinaci s autologní transplantací kostní dřeně dokonce vedla k názoru, že MM může být zcela vyléčen [3]. Ačkoliv nyní velká většina nově diagnostikovaných pacientů dosahuje po indukční léčbě remise onemocnění, téměř u všech dochází po čase k relapsu choroby. Relabující onemocnění je považováno za nevyléčitelné a s dalšími relapsy se stává rezistentním jak na terapii PI, tak na terapii IMID. Prognóza pacientů s takto pokročilou chorobou je velmi špatná a medián celkového přežití je pouze devět měsíců [4]. V současnosti je především v rámci klinických studií dostupná celá řada nových léčiv majících potenciál zlepšit prognózu pacientů s relabujícím MM. Jedná se jak o nové generace PI (carfilzomib, ixazomib) či IMID (pomalidomid), tak o nové lékové skupiny – inhibitory histondeacetyláz (panobinostat, vorinostat) a monoklonální protilátky (daratumumab, elotuzumab) [5].
Tento přehledový článek má za cíl shrnout dosavadní poznatky o použití monoklonální protilátky elotuzumab v léčbě MM.
SLAM F7 – vazebný cíl elotuzumabu
Molekula SLAM F7 (signaling lymphocytic activation molecule F7, CD319) je členem rodiny tzv. self ligand povrchových receptorů SLAM. Jsou aktivovány při interakci imunitních buněk (hetero či homotypické) v závislosti na přítomnosti cytoplazmatických adaptorových proteinů (EAT 2, SAP). Modulují aktivaci a diferenciaci různých druhů imunitních buněk a regulují spojení adaptivní a vrozené imunity [6]. Nacházejí se především na plazmocytech a na NK buňkách. Jsou taktéž exprimovány na transformovaných plazmatických buňkách MM. Protein SLAM F7 je důležitý pro přežívání myelomových buněk a jejich interakci s prostředím kostní dřeně [7]. U NK buněk obsahujících intracelulárně protein EAT 2 zprostředkovává SLAM F7 stimulační signály [6].
Struktura a mechanismus účinku
Elotuzumab (EmplicitiTM) je humanizovaná monoklonální protilátka typu IgG2a, která se váže na extracelulární doménu proteinu SLAM F7 [8]. Vazba elotuzumabu na SLAM F7 přítomný na povrchu buněk MM aktivuje protilátkově závislou, buňkami mediovanou cytotoxicitu (antibody dependent cell mediated cytotoxicity, ADCC) a znemožňuje vazbu buněk MM ke stromatu kostní dřeně, která je důležitá pro jejich přežívání [9,10].
Výsledky preklinických studií
předpokládají, že NK buňky jsou klíčové pro efektivitu
elotuzumabu in vitro.
Vazbou na receptor SLAM F7 přítomný na NK buňkách
elotuzumab dále zvyšuje jejich aktivaci a produkci interferonu
gama či granzymu (obr. 1)
[11].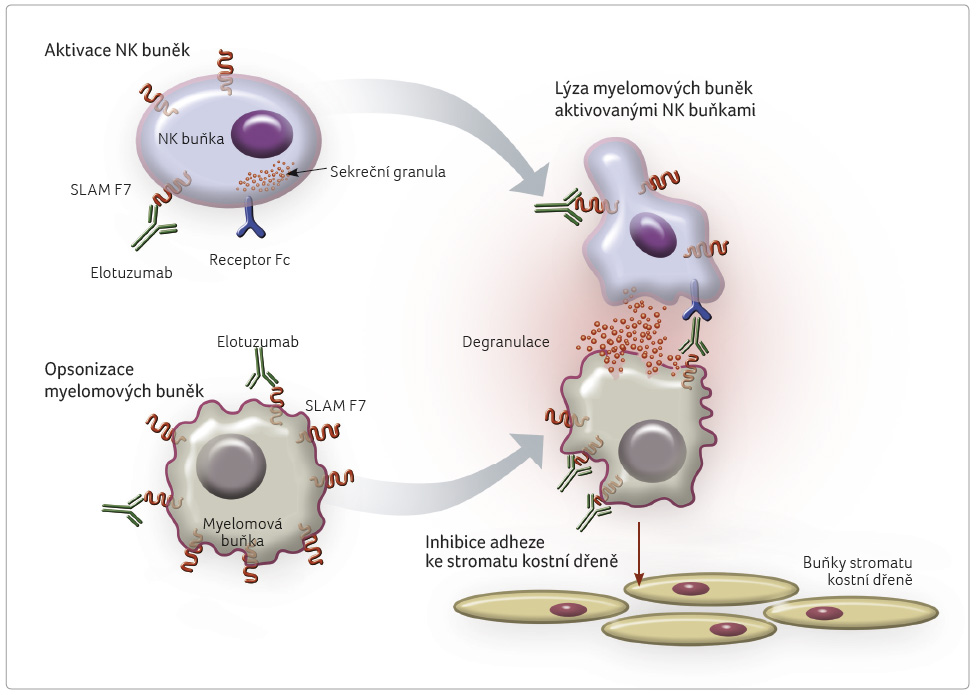
Farmakokinetika a indikace
Elotuzumab je podáván v intravenózní infuzi v dávce 10 mg/kg. Jeho biologická dostupnost je okamžitá a úplná. Po třech měsících od vysazení léčiva zůstávají v plazmě pouze 3 % jeho původního množství. Na vylučování elotuzumabu nemají vliv věk, pohlaví, sérový albumin a funkce ledvin. Při nezávažné hepatopatii zůstává eliminace léčiva beze změny.
V kombinaci s lenalidomidem a dexametazonem je elotuzumab indikován k léčbě MM u dospělých pacientů, kteří podstoupili nejméně jednu předchozí terapii [8].
Monoterapie elotuzumabem v klinických studiích
První multicentrickou studii fáze I s elotuzumabem publikovali Zonder a kol. v roce 2012 [12]. Elotuzumab v monoterapii byl podán celkem 34 silně předléčeným pacientům (medián počtu předchozích linií léčby byl 4,5) s relabujícím/refrakterním MM. Elotuzumab byl podáván v dávkovém rozmezí 0,5‒20 mg/kg. Maximální tolerované dávky nebylo dosaženo. Po mediánu dvou cyklů podávané léčby dosáhlo jen devět pacientů stability onemocnění a žádný nemocný nedosáhl léčebné odpovědi. Je však nutno zmínit, že v této studii dostávali dávku 10 mg/kg elotuzumabu schválenou Úřadem pro kontrolu potravin a léčiv (FDA) pouze tři pacienti [12].
Kombinovaná léčba elotuzumabem v klinických studiích
Vzhledem k neprokázané aktivitě elotuzumabu v monoterapii byla jeho účinnost dále analyzována pouze v kombinované léčbě s IMID či PI.
Studie fáze II hodnotila elotuzumab v dávce 10 mg/kg či 20 mg/kg v kombinaci s lenalidomidem a dexametazonem (režim RD) u celkem 73 pacientů s relabujícím/refrakterním MM (1‒3 předchozí linie léčby). Léčebné odpovědi (parciální remise a lepší) dosáhlo celkem 84 % pacientů. Kompletní remise (complete remission, CR) a stringentní kompletní remise (stringent complete remission, sCR) dosáhlo 14 %, velmi dobré parciální remise (very good partial remission, VGPR) 42 % a parciální remise (partial remission, PR) 27 % nemocných. Ve skupině s dávkou 10 mg/kg elotuzumabu dosáhlo léčebné odpovědi 92 % a ve skupině s 20 mg/kg elotuzumabu 76 % pacientů. Medián trvání léčebné odpovědi byl 34,8 měsíce u skupiny s dávkou 10 mg/kg elotuzumabu a 29,0 měsíce u skupiny s dávkou 20 mg/kg. Medián času do progrese byl 32,5 měsíce u skupiny léčené 10 mg/kg elotuzumabu a 25,0 měsíce u skupiny léčené 20 mg/kg [13].
Efektivitu elotuzumabu v kombinaci s lenalidomidem a dexametazonem (ERD) ve srovnání s režimem RD analyzovala randomizovaná studie fáze III ELOQUENT 2. Bylo do ní zahrnuto celkem 646 pacientů s relabujícím/refrakterním MM s mediánem dvou předchozích linií léčby. Celkem 70 % pacientů bylo předléčeno bortezomibem, 48 % talidomidem a pouze 6 % nemocných lenalidomidem. Jedna třetina (32 %) pacientů byli nositelé vysoce rizikové cytogenetické aberace del(17p).
Elotuzumab byl podáván v dávce 10 mg/kg jednou týdně po dobu dvou cyklů trvajících 28 dní. Od třetího cyklu byl elotuzumab podáván jednou za 14 dní. Lenalidomid byl podáván ve standardním dávkování 25 mg po dobu 21 dnů a dexametazon v dávce 40 mg jednou týdně.
Léčebné odpovědi (PR a lepší) dosáhlo 79 % pacientů léčených režimem ERD oproti 66 % pacientů léčených režimem RD (p < 0,001). Ve skupině léčených režimem ERD dosáhla CR 4 % pacientů oproti 7 % ve skupině kontrolní. Velmi dobré parciální remise dosáhlo ve skupině s elotuzumabem 28 % nemocných a v kontrolní skupině 21 % nemocných.
Medián doby do progrese onemocnění (progression free survival, PFS) byl 19,4 měsíce u skupiny léčené režimem ERD oproti 14,9 měsíce (p < 0,001) v kontrolní skupině léčené RD. Analýza podskupin prokázala, že největší prospěch v podobě prodloužení intervalu PFS měli ti pacienti, jimž byla choroba diagnostikována v době před 3,5 a více lety před zařazením do studie (HR [hazard ratio] 0,68; 95% CI [interval spolehlivosti] 0,4‒0,70). U těchto nemocných byl medián PFS ve skupině léčené režimem ERD 26,0 měsíce a režimem RD 17,3 měsíce (p < 0,0001). Z léčby elotuzumabem měli rovněž prospěch nemocní s vysoce rizikovou cytogenetickou aberací del(17p) (HR 0,65; 95% CI 0,45‒0,94) [14].
Účinnost elotuzumabu v kombinaci s bortezomibem a dexametazonem analyzovala randomizovaná studie fáze II. Celkem do ní bylo zahrnuto 152 pacientů s 1‒3 předchozími liniemi léčby. Celkem 77 osob bylo randomizováno do ramene elotuzumab/bortezomib/dexametazon (EVD) a 75 osob do kontrolního ramene s bortezomibem a dexametazonem (VD). Léčebné odpovědi (PR a lepší) dosáhlo 66 % pacientů v rameni s EVD a 63 % pacientů v kontrolním rameni. Medián PFS byl 9,7 měsíce ve skupině s EVD a 6,9 měsíce v kontrolním rameni (p = 0,09). Zajímavým zjištěním při analýze podskupin bylo, že pacienti léčení elotuzumabem, kteří byli homozygotní pro vysoce afinní receptor FcyRIIIa, měli výrazně delší medián PFS (22,3 měsíce) oproti pacientům homozygotním pro nízce afinní receptor FcyRIIIa (9,8 měsíce). Typ receptoru FcyRIIIa nehrál roli u nemocných léčených v kontrolním rameni [15].
Nežádoucí účinky elotuzumabu v klinických studiích
Nejčastějšími nežádoucími účinky elotuzumabu v monoterapii jsou infuzní reakce. V klinické studii s elotuzumabem v monoterapii byly zastoupeny jako zimnice (32 %) a subfebrilie (17,6 %), nebyly však závažné (stupeň 1‒2 dle National Cancer Institute, NCI) [12].
V kombinované léčbě s lenalidomidem a dexametazonem ve studii ELOQUENT 2 byla toxicita převážně hematologická. Závažná lymfopenie (stupeň 3–4 dle NCI) se vyskytla u 77 % pacientů léčených v režimu ERD a u 49 % pacientů z kontrolní skupiny. Výskyt závažné anémie (19 % versus 21 %), trombocytopenie (19 % vs. 20 %) a neutropenie (34 % vs. 44 %) byl srovnatelný. Nehematologická toxicita léčby byla lehká (stupeň 1–2 dle NCI) a srovnatelná u obou skupin. V rameni s elotuzumabem se vyskytly únavnost (47 %), průjmy (47 %), subfebrilie (37 %), kašel (31 %), křeče (30 %) a otoky (26 %). Infuzní reakce charakterizované teplotou, třesem a hypertenzí se objevily u 10 % pacientů a u většiny z nich nebyly závažné. Převážná část z nich (70 %) se projevila v průběhu prvního podání přípravku. Jejich průběh bylo možné snadno ovlivnit podáním kortikosteroidů či antihistaminik [14]. Při kombinované léčbě s bortezomibem a dexametazonem nedošlo k navýšení výskytu senzomotorických neuropatií [15].
Diskuse a závěr pro praxi
Rutinní použití nových léčiv u MM znamenalo výrazné zlepšení prognózy postižených pacientů. Většina nemocných i přes léčbu PI či IMID relabuje a potřebuje novou terapii, pokud možno s jiným mechanismem účinku [2,3,5].
Z preklinických studií je zřejmé, že aktivita protinádorové imunity a mikroprostředí kostní dřeně jsou klíčové pro přežívání buněk MM [16,17]. Terapie ovlivňující tyto mechanismy jiným způsobem tak hypoteticky může překonat rezistenci na stávající léky [17]. V současnosti zažívají monoklonální protilátky v léčbě MM svou renesanci [18].
Podle poznatků doposud publikovaných klinických studií je účinnost elotuzumabu známa především z kombinované léčby a u pacientů s relabující chorobou. V klinické studii s elotuzumabem v monoterapii u relabujících pacientů nebyla prokázána signifikantní účinnost. Nicméně je nutné zmínit, že v této studii bylo nejefektivnější dávkou (10 mg/kg) léčeno pouze minimum pacientů [12].
Výsledky kombinované terapie IMID a kortikosteroidy jsou podstatně slibnější než výsledky monoterapie [13‒15]. Přidáním elotuzumabu ke kombinaci lenalidomid/dexametazon přežívají bez progrese pacienti s relabujícím MM téměř o šest měsíců déle. Elotuzumab také zásadním způsobem nenavyšuje toxicitu léčby lenalidomidem [14].
V kombinované léčbě s bortezomibem a dexametazonem dosahuje elotuzumab u podobně předléčeného souboru pacientů horších výsledků než v kombinaci s lenalidomidem a dexametazonem. Je však nutné dodat, že ve studii analyzující kombinaci elotuzumab/bortezomib/ dexametazon byla polovina nemocných již předléčena bortezomibem [15]. Ve studii ELOQUENT 2 hodnotící kombinaci elotuzumab/lenalidomid/dexametazon bylo lenalidomidem předléčeno minimum pacientů (6 %) [14]. Z téhož důvodu nelze v současnosti říci, zda elotuzumab překonává refrakteritu na lenalidomidové režimy.
V klinických studiích u pacientů s relabujícím MM aktuálně tvoří režim lenalidomid/dexametazon platformu pro kombinovanou léčbu novými léčivy. Inhibitor proteazomu carfilzomib zvýšil jak četnost dosažené léčebné odpovědi (pro PR a lepší 87,1 % vs. 66,7 %; p < 0,001), tak délku PFS (26,3 měsíce vs. 17,6 měsíce; p < 0,0001) [19]. Perorální inhibitor proteazomu ixazomib v kombinaci s režimem RD taktéž prodloužil PFS oproti standardní léčbě (medián PFS 20,6 měsíce vs. 14,7 měsíce; p < 0,001) [20]. Stejně tak monoklonální protilátka daratumumab v kombinaci s režimem RD zaznamenala vyšší četnost léčebných odpovědí (PR a lepší 92,9 % vs. 76,4 %; p < 0,001) [21]. Nejinak tomu je v případě elotuzumabu.
Soubory pacientů v jednotlivých studiích se však liší stupněm předléčenosti a též počtem pacientů refrakterních na léčbu, a proto je srovnání délky intervalů PFS mezi jednotlivými novými léčivy zavádějící. Nebyla provedena žádná randomizovaná studie porovnávající tato nová léčiva mezi sebou. Kombinovaná léčba novými léčivy se rovněž liší spektrem nežádoucích účinků.
Nabízí se tedy otázka, kdy a u jakého pacienta by byla kombinovaná léčba elotuzumabem nejvhodnější? Z klinických studií máme doposud data pouze od relabujících pacientů. Účinnost elotuzumabu v kombinaci s lenalidomidem a dexametazonem v primoterapii MM analyzuje studie fáze III ELOQUENT 1 (NCT01335399). Dále studie fáze III GMMG HD6 (NCT02495922) hodnotí efektivitu přidání elotuzumabu k indukčnímu režimu bortezomib/lenalidomid/dexametazon. Na výsledky obou hodnocení teprve čekáme.
V případě relabujících pacientů máme pouze omezené množství dat pro monoterapii. V případě kombinované léčby elotuzumabem s IMID či PI již nyní víme, že je elotuzumab přínosný [14,15].
Nemáme však doposud jasně definovanou skupinu pacientů, kteří budou mít z léčby elotuzumabem větší prospěch než z terapie jinými novými léčivy. Poměrně zajímavé zjištění je, že pacienti homozygotní pro vysoce afinní receptor FcyRIIIa mají výrazně větší prospěch z léčby kombinací elotuzumab/bortezomib/dexametazon. Medián PFS u této podskupiny byl více než dvojnásobný oproti ostatním pacientům léčeným stejnou kombinací [15]. Tato data však potřebují další analýzu, především pak pro kombinovanou terapii s lenalidomidem, která se jeví být efektivnější než kombinace s bortezomibem [14].
Z výsledků studie ELOQUENT 2 víme, že kombinovaná léčba elotuzumabem s lenalidomidem a dexametazonem je výhodná i pro nemocné s vysoce rizikovými cytogenetickými aberacemi [14].
V současnosti není jasné postavení elotuzumabu v kombinované léčbě u silně předléčených pacientů. Nyní probíhá randomizovaná studie (NCT02726581) hodnotící kombinovanou terapii režimem elotuzumab/nivolumab/pomalidomid/dexametazon u nemocných s refrakterním a relabujícím MM. První analýzy této studie však budou dostupné nejdříve v listopadu roku 2018.
Přes veškerá pozitiva je u elotuzumabu, stejně jako u jiných nových léčiv, nejvíce limitujícím faktorem jeho cena. Elotuzumab je sice v České republice registrován v kombinaci s lenalidomidem a dexametazonem pro pacienty s relabujícím MM, nemá však stanovenou úhradu. Tato skutečnost brání možnosti širšího využití elotuzumabu v klinické praxi. Nezbývá nám tedy než doufat, že na extenzivnější použití jak elotuzumabu, tak ostatních nových léčiv nebudeme muset dlouho čekat.
Seznam použité literatury
- [1] Kyle RA, Rajkumar SV. Multiple myeloma. Blood 2008; 111: 2962–2972.
- [2] Rajkumar SV, Kumar S. Multiple myeloma: diagnosis and treatment. Mayo Clin Proc 2016; 91: 101–119.
- [3] San‑Miguel JF, Mateos MV. Can multiple myeloma become a curable disease? Haematologica 2011; 96: 1246–1248.
- [4] Kumar SK, Lee JH, Lahuerta JJ, et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: a multicenter international myeloma working group study. Leukemia 2012; 26: 149–157.
- [5] Bianchi G, Richardson PG, Anderson KC. Promising therapies in multiple myeloma. Blood 2015; 126: 300–310.
- [6] Veillette A, Guo H. CS1, a SLAM family receptor involved in immune regulation, is a therapeutic target in multiple myeloma. Crit Rev Oncol Hematol 2013; 88: 168–177.
- [7] Hsi ED, Steinle R, Balasa B, et al. CS1, a potential new therapeutic antibody target for the treatment of multiple myeloma. Clin Cancer Res 2008; 14: 2775–2784.
- [8] Empliciti (elotuzumab). Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv, květen 2016. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003967/WC500206673.pdf
- [9] Rice A, Dillon M, van Abbema A, et al. Eradication of tumors in pre‑clinical models of multiple myeloma by anti‑CS1 monoclonal antibody HuLuc63: mechanism of action studies. Blood 2006; 108: 3503–3503.
- [10] Tai YT, Dillon M, Song W, et al. Anti‑CS1 humanized monoclonal antibody HuLuc63 inhibits myeloma cell adhesion and induces antibody‑dependent cellular cytotoxicity in the bone marrow milieu. Blood 2008; 112: 1329–1337.
- [11] Collins SM, Bakan CE, Swartzel GD, et al. Elotuzumab directly enhances NK cell cytotoxicity against myeloma via CS1 ligation: evidence for augmented NK cell function complementing ADCC. Cancer Immunol Immunother 2013; 62: 1841–1849.
- [12] Zonder JA, Mohrbacher AF, Singhal S, et al. A phase 1, multicenter, open‑label, dose escalation study of elotuzumab in patients with advanced multiple myeloma. Blood 2012; 120: 552–559.
- [13] Richardson PG, Jagannath S, Moreau P, et al. Elotuzumab in combination with lenalidomide and dexamethasone in patients with relapsed multiple myeloma: final phase 2 results from the randomised, open‑label, phase 1b‑2 dose‑escalation study. Lancet Haematol 2015; 2: e516–527.
- [14] Lonial S, Dimopoulos M, Palumbo A, et al. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med 2015; 373: 621–631.
- [15] Palumbo A, Offidani M, Pégourie B, et al. Elotuzumab plus bortezomib and dexamethasone versus bortezomib and dexamethasone in patients with relapsed/refractory multiple myeloma: 2‑year follow‑up. Blood 2015; 126: 510.
- [16] Flodr P, Latalova P, Pusciznova P, et al. Multiple myeloma and bone marrow microenvironment immunohistochemical study of the expression of 15 proteins related to myeloma bone disease. Blood 2015; 126: 5318.
- [17] Gooding S, Edwards CM. New approaches to targeting the bone marrow microenvironment in multiple myeloma. Curr Opin Pharmacol 2016; 28: 43–49.
- [18] Touzeau C, Moreau P, Dumontet C. Monoclonal antibody therapy in multiple myeloma. Leukemia 2017; 31: 1039–1047.
- [19] Stewart AK, Rajkumar SV, Dimopoulos MA, et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015; 372: 142–152.
- [20] Moreau P, Masszi T, Grzasko N, et al. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016; 374: 1621–1634.
- [21] Dimopoulos MA, Oriol A, Nahi H, et al. Daratumumab, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016; 375: 1319–1331.