Erenumab
Souhrn:
Erenumab je prvním přípravkem ze zcela nové skupiny léčiv pro epizodickou a chronickou migrénu, která se nyní dostávají do klinické praxe. Jedná se o skupinu humanizovaných nebo humánních protilátek proti receptoru pro CGRP (calcitonin gene‑related peptide) nebo proti samotnému neuropeptidu CGRP. Přípravek se dostává na trh pod názvem Aimovig jak v zemích Evropské unie, tak v USA. Erenumab je humánní monoklonální protilátka, která se váže na receptor CGRP nacházející se v místech relevantních pro patofyziologii migrény, jako je například ganglion trigeminale. CGRP je neuropeptid, který moduluje nociceptivní signalizaci, a vazodilatátor spojovaný s patofyziologií migrény. Během ataky migrény byl pozorován významný nárůst koncentrací CGRP v krvi z vena jugularis. Pro klinickou účinnost a bezpečnost podání erenumabu svědčí výsledky dvou aktuálně publikovaných studií. Podle Souhrnu údajů o přípravku je erenumab určen k profylaxi migrény u dospělých, kteří jí trpí nejméně čtyři dny v měsíci. Je podáván v subkutánních injekcích obvykle jednou za čtyři týdny. Nežádoucími účinky jsou nejčastěji reakce v místě aplikace hodnocené podle intenzity jako mírné nebo střední.
Key words: erenumab, CGRP, CGRP antagonists, migraine prophylaxis.
Summary:
Erenumab is a novel, first‑in‑class drug for the treatment of episodic and chronic migraine, now entering the clinical practice. This new class of drugs is formed by humanized or human antibodies against the CGRP (calcitonin gene‑related peptide) receptor or against the neuropeptide CGRP itself. Erenumab, manufactured as Aimovig, is now being launched in both European Union and the U.S.A. It is a human monoclonal antibody targeting the CGRP receptor at sites relevant for the pathophysiology of migraine such as the trigeminal ganglia. CGRP is a neuropeptide modulating nociceptive signaling and also a vasodilating agent associated with the pathophysiology of migraine. Significant rise in the level of CGRP has been detected in blood samples taken from the jugular vein during migraine attacks. The clinical effectiveness and safety of erenumab have been demonstrated in two recently published trials. According to SPC, erenumab can be used for the prophylaxis of migraine in adults suffering from migraine attacks at least 4 days a month. It is applied subcutaneously, usually once in 4 weeks. Adverse effects may consist of application site reactions, usually of mild or moderate severity.
Erenumab je prvním přípravkem řazeným do zcela nové skupiny léčiv pro terapii epizodické a chronické migrény, která se nyní dostávají do klinické praxe. Tuto skupinu tvoří humanizované nebo humánní protilátky proti receptoru pro CGRP (calcitonin gene related peptide) nebo proti samotnému neuropeptidu CGRP. Erenumab je na trhu dostupný pod názvem Aimovig jak v zemích Evropské unie, tak ve Spojených státech amerických.
Mechanismus účinku
Erenumab je humánní monoklonální
protilátka, která se váže na receptor pro CGRP. Receptor pro
CGRP se nachází v místech relevantních pro patofyziologii
migrény, jako je například ganglion
trigeminale. Erenumab silně a specificky soutěží
o vazebné místo s CGRP, inhibuje jeho vliv na receptor
pro CGRP a současně nevykazuje významnou aktivitu vůči
jiným receptorům kalcitoninové rodiny (obr. 1)
[1]. CGRP je neuropeptid, který moduluje nociceptivní signalizaci,
a vazodilatátor spojovaný s patofyziologií migrény.
Na rozdíl od jiných neuropeptidů byl během ataky
migrény pozorován významný nárůst koncentrací CGRP s úlevou
od bolestí hlavy po návratu jeho hodnoty k normálu.
Intravenózní infuze CGRP indukovala u pacientů bolest hlavy
podobnou migréně.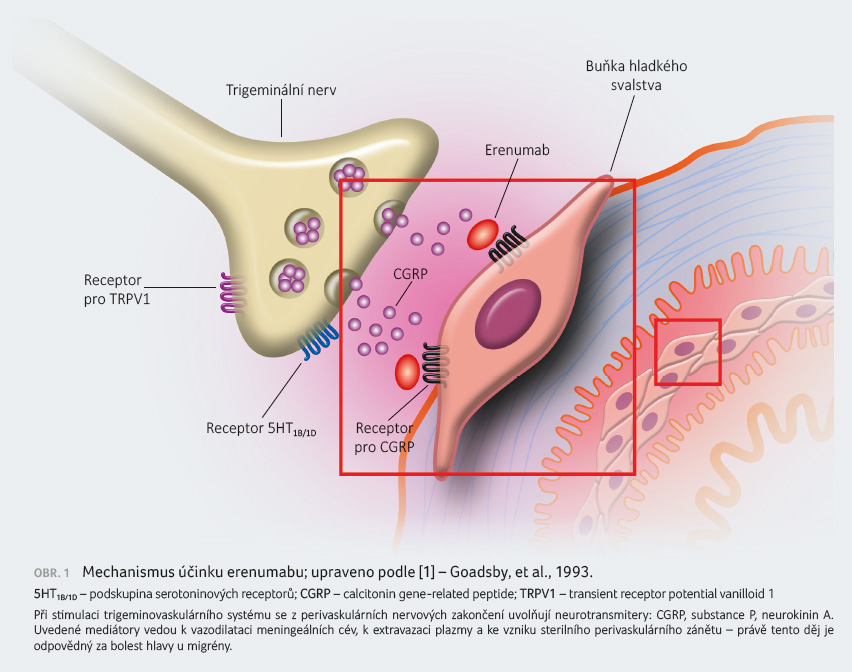
Klinické zkušenosti
Přípravek Aimovig (erenumab) byl hodnocen jako profylaxe migrény ve dvou pivotních studiích u chronické a epizodické migrény. Do obou klinických sledování byli zařazeni pacienti s nejméně dvanáctiměsíční anamnézou migrény (s aurou nebo bez aury) podle diagnostických kritérií International Classification of Headache Disorders 3 (ICHD 3).
Chronická migréna
Erenumab byl hodnocen v monoterapii jako profylaxe chronické migrény v randomizované multicentrické, dvanáctitýdenní, placebem kontrolované, dvojitě zaslepené klinické studii u pacientů trpících migrénou s aurou nebo migrénou bez aury (≥ 15 dní v měsíci s bolestmi hlavy a ≥ 8 dní v měsíci s migrénou) [2], graf 1.
Celkem 667 pacientů bylo randomizováno
v poměru 3 : 2 : 2 k podávání placeba (n = 286)
či erenumabu v dávce 70 mg (n=191) nebo 140 mg (n = 190).
Nemocní byli stratifikováni podle nadužívání akutní
analgetické medikace (doloženo u 41 % z celkového
počtu pacientů). Nemocným bylo během studie povoleno užívat při
bolestech hlavy záchrannou analgetickou medikaci.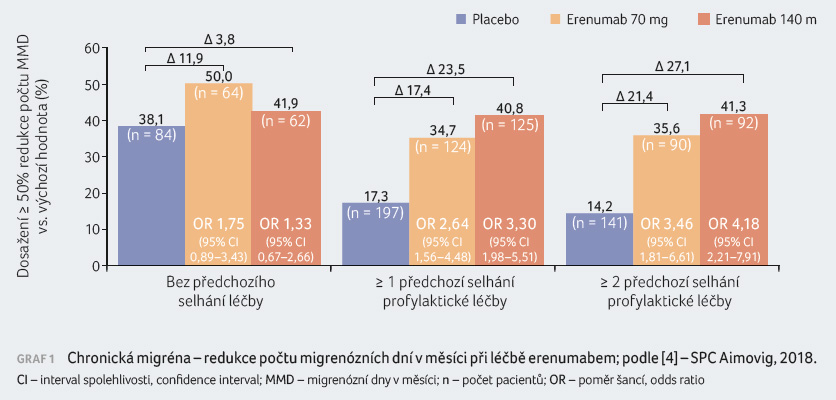
Průměrná četnost migrény před zahájením léčby představovala přibližně 18 migrenózních dní v měsíci. Celkově u 68 % osob selhala jedna nebo více předchozích profylaktických medikací pro nedostatek účinnosti nebo kvůli nízké toleranci, u 49 % osob selhaly dvě nebo více předchozích profylaktických medikací pro nedostatek účinnosti nebo z důvodu nízké tolerance. Studii dokončilo celkem 366 (96 %) pacientů v rameni s erenumabem a 265 (93 %) pacientů s placebem. Snížení průměrného počtu migrenózních dní v měsíci v porovnání s placebem bylo v rámci měsíční analýzy pozorováno od měsíce 1 a v následné analýze po týdnech byl nástup účinku erenumabu pozorován od prvního týdne podávání.
U pacientů, u nichž selhala jedna nebo více profylaktických medikací, činil rozdíl v léčbě pozorovaný mezi erenumabem v dávce 140 mg a placebem v redukci počtu migrenózních dní v měsíci (MMD) ‒3,3 dne a mezi erenumabem v dávce 70 mg a placebem ‒2,5 dne. U pacientů, u nichž selhaly dvě nebo více přechozích profylaktických medikací, činil rozdíl v léčbě pozorovaný mezi erenumabem v dávce 140 mg a placebem v redukci MMD ‒4,3 dne a mezi erenumabem v dávce 70 mg a placebem ‒2,7 dne. V porovnání s placebem byl ve skupině léčené erenumabem v dávce 140 mg větší podíl osob, které dosáhly nejméně 50% snížení MMD (40,8 % u dávky 140 mg vs. 34,7 % u dávky 70 mg vs. 17,3 % u placeba). U pacientů, u nichž selhaly dvě nebo více přechozích profylaktických medikací, představoval tento poměr 41,3 % u dávky 140 mg a 35,6 % u dávky 70 mg versus 14,2 % u placeba.
Přibližně 41 % pacientů nadužívalo analgetickou medikaci. Rozdíl v léčbě pozorovaný mezi erenumabem v dávce 140 mg a placebem a mezi erenumabem v dávce 70 mg a placebem v redukci MMD činil u těchto pacientů v obou případech ‒3,1 dne a v případě redukce počtu dní s užitím akutních specifických antimigrenik představoval ‒2,8 dne při podávání dávky 140 mg a ‒3,3 dne u dávky 70 mg. V porovnání s placebem byl ve skupině léčené erenumabem větší podíl pacientů, kteří dosáhli nejméně 50% snížení MMD (34,6 % u dávky 140 mg, 36,4 % u dávky 70 mg vs. 17,7 % u placeba).
Účinnost přetrvávala až jeden rok v otevřené extenzi studie 1, v níž pacienti dostávali 70 mg a/nebo 140 mg erenumabu. Celkem 74,1 % pacientů dokončilo 52týdenní extenzi. Při souhrnném hodnocení obou dávek bylo po 52 týdnech pozorováno snížení o 9,3 MMD v porovnání s hodnotami před léčbou v základní studii. V posledním měsíci studie dosáhlo 50% odpovědi 59 % pacientů, kteří hodnocení dokončili.
Epizodická migréna
Erenumab byl hodnocen v profylaxi
epizodické migrény v klinické studii kontrolované placebem
u pacientů trpících migrénou s aurou nebo bez ní (4–14
migrenózních dní v měsíci) [3], graf 2.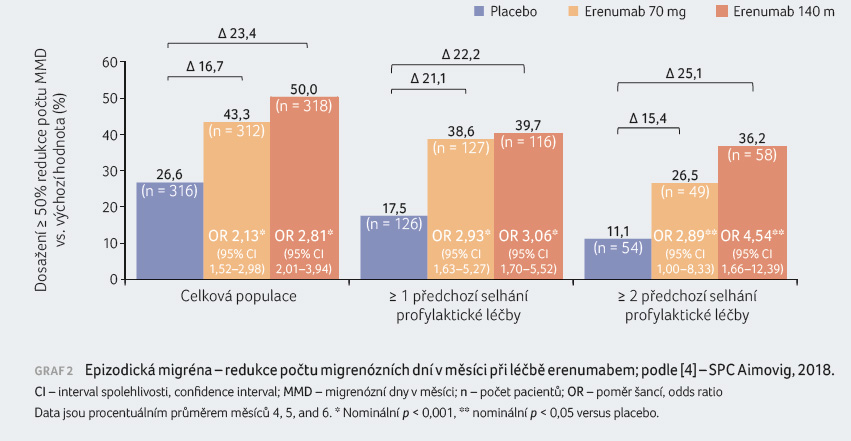
Celkem 955 pacientů bylo randomizováno v poměru 1 : 1 : 1 k léčbě erenumabem v dávce 140 mg (n = 319) nebo 70 mg (n = 317) nebo k podávání placeba (n = 319). Nemocným bylo během studie povoleno užívat při bolestech hlavy analgetickou akutní medikaci.
Průměrná četnost migrény před zahájením léčby byla přibližně osm migrenózních dní v měsíci. Celkem u 39 % osob selhala jedna nebo více přechozích profylaktických medikací kvůli nedostatečné účinnosti nebo špatné toleranci. Dvojitě zaslepenou fázi studie dokončilo celkem 292 (92 %) pacientů v rameni s dávkou 140 mg erenumabu, 284 (90 %) pacientů s dávkou 70 mg erenumabu a 282 (88 %) pacientů s placebem.
Pacienti léčení erenumabem vykazovali klinicky relevantní a statisticky významné snížení četnosti migrenózních dní v měsících 4‒6 oproti hodnotám před léčbou v porovnání s pacienty v placebové větvi. Rozdíl oproti placebu byl pozorován od měsíce 1.
Farmakokinetické vlastnosti
Erenumab vykazuje nelineární kinetiku jako důsledek vazby na receptor pro CGRP. Nicméně v odpovídajících terapeutických dávkách po subkutánním podání každé čtyři týdny je vzhledem k saturaci vazby na receptor pro CGRP farmakokinetika erenumabu převážně lineární. Subkutánní podání dávky 140 mg jednou měsíčně a podání dávky 70 mg jednou měsíčně zdravým dobrovolníkům znamenalo průměrnou hodnotu maximální plazmatické koncentrace (cmax [SD, směrodatná odchylka]) 15,8 (4,8) μg/ml a 6,1 (2,1) μg/ml a průměrnou hodnotu plochy pod křivkou plazmatické koncentrace (AUClast [SD]) 505 (139) den.μg/ml a 159 (58) den.μg/ml. Po podání dávky 140 mg každé čtyři týdny byla pozorována méně než dvojnásobná kumulace údolní sérové koncentrace a ustálenému stavu se údolní sérová koncentrace přiblížila během 12 týdnů léčby.
Absorpce
Po jednorázové subkutánní dávce 140 mg nebo 70 mg erenumabu podané zdravým dospělým bylo mediánu nejvyšší koncentrace dosaženo během 4‒6 dní a odhadovaná absolutní biologická dostupnost činila 82 %.
Distribuce
Po jednorázové intravenózní dávce 140 mg erenumabu byl průměrný distribuční objem (SD) během terminální fáze (Vz) odhadován na 3,86 (0,7) litru.
Biotransformace a eliminace
U erenumabu byly pozorovány dvě eliminační fáze. Při nízkých koncentracích probíhá eliminace převážně přes saturační vazbu na cíl (receptor pro CGRP), zatímco při vyšších koncentracích je erenumab z velké části eliminován nespecifickou proteolytickou cestou. Během doby podávání je erenumab převážně eliminován nespecifickou proteolytickou cestou s efektivním poločasem 28 dní.
Zvláštní populace
Pacienti s těžkou poruchou funkce ledvin (odhadovaná glomerulární filtrace [eGFR] < 30 ml/min/1,73 m2) nebyli sledováni. Populační farmakokinetická analýza integrovaných dat z klinických studií s přípravkem Aimovig neodhalila rozdíly ve farmakokinetice erenumabu u pacientů s mírnou až středně těžkou poruchou funkce v porovnání s pacienty s normální funkcí ledvin.
U pacientů s poruchou funkce jater nebyly provedeny žádné studie. Erenumab jako humánní monoklonální protilátka není metabolizován enzymy cytochromu P450 a hepatální clearance není pro erenumab převažující metabolickou cestou.
Bezpečnost
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
Studie karcinogenity nebyly s erenumabem provedeny. Erenumab není farmakologicky aktivní u hlodavců. Vykazuje biologickou aktivitu u opic rodu Cynomolgus, nicméně tento druh není vhodným modelem pro hodnocení tumorigenního rizika. Mutagenní potenciál erenumabu nebyl hodnocen, avšak u monoklonálních protilátek se nepředpokládá vliv na DNA nebo chromozomy.
V toxikologických studiích s opakovanými dávkami nebyly u pohlavně zralých opic pozorovány nežádoucí účinky po dávkách do 150 mg/kg podávaných subkutánně dvakrát týdně po dobu až šesti měsíců při systémových expozicích až do 123násobku a 246násobku klinické dávky 140 mg a 70 mg podané každé čtyři týdny (hodnoceno podle AUC). V těchto studiích rovněž nebyly pozorovány nežádoucí účinky na náhradní markery fertility (anatomicko patologické nebo histopatologické změny reprodukčních orgánů).
V reprodukčních studiích u opic rodu Cynomolgus nebyl pozorován vliv na březost, embryofetální nebo postnatální vývoj (až do šesti měsíců věku), pokud byl erenumab podáván během březosti v expozičních hodnotách přibližně 17krát a 34krát vyšších než u pacientů léčených erenumabem v dávce 140 mg a 70 mg každé čtyři týdny (hodnoceno podle AUC). U mláďat opic po porodu byly v séru nalezeny měřitelné koncentrace erenumabu, což potvrzuje skutečnost, že erenumab ‒ podobně jako jiné IgG protilátky – prochází placentární bariérou.
Indikace
Přípravek Aimovig je indikován k profylaxi migrény u dospělých, kteří trpí migrénou nejméně čtyři dny v měsíci [4].
Dávkování a způsob podání
Léčba musí být zahájena lékařem se zkušeností v diagnostice a terapii migrény. Léčba je určena pro pacienty, kteří při zahájení terapie přípravkem Aimovig trpí migrénou nejméně čtyři dny v měsíci. Doporučená dávka je 70 mg erenumabu každé čtyři týdny. U některých pacientů může být prospěšné podat dávku 140 mg každé čtyři týdny. Klinické studie prokázaly, že u většiny nemocných odpovídajících na léčbu se dostavil klinický přínos během tří měsíců terapie. U pacientů, kteří neodpovídají na léčbu po třech měsících terapie, je nutné zvážit přerušení léčby. Následně se doporučuje pravidelně vyhodnocovat nutnost pokračování v terapii.
Podávání erenumabu u starších osob (65 let a více) nebylo hodnoceno. Úprava dávky není nutná, protože farmakokinetika erenumabu není ovlivněna věkem. U pacientů s mírnou až středně těžkou poruchou funkce ledvin nebo jater není úprava dávky nutná. Bezpečnost a účinnost podávání erenumabu u dětí a dospívajících ve věku do 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje [4].
Přípravek Aimovig je určen k subkutánnímu podání, pacient jej může aplikovat sám v domácích podmínkách, po příslušném zaškolení. Injekci je možné aplikovat do břicha, hýždí nebo vnější části paže. Místa vpichu je nutné měnit.
Interakce s jinými léčivými přípravky a jiné formy interakce
Vzhledem k metabolickým cestám monoklonálních protilátek se neočekává vliv na expozici současně podaným léčivým přípravkům. Ve studii na zdravých dobrovolnících nebyla pozorována interakce s perorálními kontraceptivy (ethinylestradiol/norgestimát).
Fertilita, těhotenství a kojení
Údaje o podávání erenumabu těhotným ženám jsou omezené. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky. Podávání přípravku Aimovig v těhotenství se z preventivních důvodů nedoporučuje.
Není známo, zda je erenumab vylučován do lidského mateřského mléka. O lidském IgG je známo, že je vylučován do mateřského mléka prvních několik dní po porodu, následně jeho koncentrace klesá na nízké hodnoty, což nicméně znamená, že během tohoto krátkého období riziko pro kojené dítě nelze vyloučit. Proto je o používání přípravku Aimovig během kojení možné uvažovat pouze v případech, kdy je to klinicky nezbytné.
Studie na zvířatech neprokázaly vliv na ženskou ani mužskou fertilitu [4].
Nežádoucí účinky
Celkem bylo přípravkem Aimovig v registračních studiích léčeno více než 2 500 pacientů. Z nich bylo více než 1 300 osob erenumabu exponováno nejméně 12 měsíců. Hlášenými nežádoucími účinky u dávky 70 mg a 140 mg erenumabu byly reakce v místě vpichu (5,6 %/4,5 %), zácpa (1,3 %/3,2 %), svalové křeče (0,7 %/2,0 %) a pruritus (1,0 %/1,8 %). Většina reakcí byla mírné až středně závažné intenzity. Méně než 2 % osob v těchto studiích přerušilo účast kvůli výskytu nežádoucích účinků.
Závěr
Erenumab je velmi nadějným novým typem léku, který je dle dokumentovaných studií účinný v prevenci frekventní epizodické i chronické migrény a vykazuje dobrou toleranci a dobrý bezpečnostní profil s minimem popsaných nežádoucích účinků terapie.
Seznam použité literatury
- [1] Goadsby PJ, Edvinsson L. The trigeminovascular system and migraine: studies characterizing cerebrovascular and neuropeptide changes seen in humans and cats. Ann Neurol 1993; 33: 48‒56.
- [2] Tepper S, Ashina M, Reuter U, et al. Safety and efficacy of erenumab for preventive treatment of chronic migraine: A randomised, double‑blind, placebo‑controlled phase 2 trial. Lancet Neurol 2017; 16: 425–434.
- [3] Dodick DW, Ashina M, Brandes JL, et al. ARISE: A Phase 3 randomized trialof erenumab for episodic migraine. Cephalalgia 2018; 38: 1026‒1037.
- [4] Aimovig. SPC, EMA, 2018. Dostupné na: https://www.ema.europa.eu/documents/product‑information/aimovig‑epar‑product‑information_cs.pdf