Esomeprazol
Esomeprazol je S-enantiomer omeprazolu s vylepšeným farmakodynamickým a farmakokinetickým profilem v porovnání s racemickým omeprazolem. Snášenlivost a výskyt nežádoucích účinků při léčbě esomeprazolem jsou srovnatelné s ostatními inhibitory protonové pumpy a byla prokázána jeho bezpečnost při podávání u dětí i u seniorů. Výhodou esomeprazolu je rychlejší nástup a delší doba účinku a nižší variabilita farmakokinetiky v populaci z důvodu genetického polymorfismu CYP 2C19 v porovnání s racemickým omeprazolem i ostatními inhibitory protonové pumpy.
Farmakologická skupina
Esomeprazol (S-omeprazol) je inhibitor protonové pumpy (PPI), který snižuje sekreci žaludeční kyseliny inhibicí gastrické H+/K+ adenozin trifosfatázy (ATPáza) neboli protonové pumpy. Je to první inhibitor protonové pumpy, který byl vyvinut jako samostatný enantiomer s cílem optimalizovat farmakodynamické a farmakokinetické vlastnosti racemického omeprazolu. Na rozdíl od omeprazolu, který je směsí R- a S-enantiomerů, je esomeprazol tvořen pouze S-izomerem [1–4].
Esomeprazol (registrace Food and Drug Administration v roce 2001) je řazen do skupiny inhibitorů protonové pumpy, ATC kód je A02BC05.
Chemické a fyzikální vlastnosti
Chemicky se jedná o (S)-5-methoxy-2-[(4-methoxy-3,5-dimethylpyridin-2-yl) methylsulfinyl]-3H-benzimidazol (obr. 1).
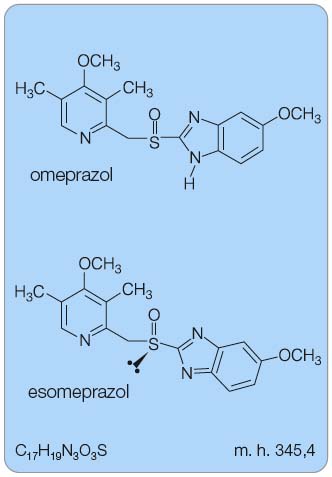 Sumární vzorec: C17H19N3O3S
Sumární vzorec: C17H19N3O3S
Molární hmotnost: 345,417 g/mol
Je to bílý nebo téměř bílý prášek těžce rozpustný ve vodě, dobře rozpustný v dichlormethanu, mírně rozpustný v 96% ethanolu a v methanolu. Rozpouští se ve zředěných roztocích alkalických hydroxidů.
Mechanismus účinku, farmakodynamika
Tak jako ostatní PPI inhibuje esomeprazol sekreci žaludeční kyseliny z gastrických parietálních buněk. PPI jsou slabé báze, jejich pKa1 se pohybuje v rozmezí 3,8–4,9, jsou minimálně ionizovány v neutrálním prostředí, ale maximálně ve vysoce kyselém prostředí. To je za fyziologických podmínek přítomno v organismu pouze intracelulárně v parietálních buňkách a v lumen žaludku. Po přestupu neaktivní látky do kyselého prostředí parietální buňky (pH ~ 1) spouští ionizace dusíku pyridinové skupiny sled reakcí, na jehož konci je po druhé ionizaci stabilní cyklický sulfonamidový kation, aktivní forma PPI. Esomeprazol jako ostatní inhibitory protonové pumpy je tedy proléčivo přeměňované na vlastní účinnou látku působením vysoce kyselého prostředí. Aktivní léčivo se následně permanentně váže na cysteinovou skupinu na luminálním povrchu H+/K+ ATPázy a zabraňuje tvorbě kyseliny chlorovodíkové [1, 2, 5].
Kovalentní vazba PPI na H+/K+ ATPázu způsobuje, že účinek PPI přetrvává déle, než by se dalo usuzovat na základě jejich plazmatických koncentrací [5].
Farmakokinetické vlastnosti
Obecně se PPI vstřebávají po perorálním podání v horní části tenkého střeva. Aby se zabránilo předčasné přeměně neaktivní látky na látku aktivní v kyselém prostředí žaludku, mají jejich perorální lékové formy acidorezistentní úpravu. Vstřebávání pak začíná až při vyšších hodnotách pH v duodenu a téměř kompletně dojde ke vstřebání v tenkém střevě [5].
Esomeprazol je k dispozici ve formě perorální suspenze a v enterosolventních tabletách, v České republice pouze jako enterosolventní tablety.
Po perorálním podání u zdravých dobrovolníků je esomeprazol rychle absorbován a dosahuje maximálních plazmatických koncentrací (cmax) za 0,5 hodiny v případě perorální suspenze 20 mg a v rozmezí 1–3,5 hodiny v případě 40mg enterosolventní kapsle.
Ve studiích na zdravých dobrovolnících byl průměrný plazmatický eliminační poločas (t1/2) 0,75 h po jednorázovém podání 20 mg a 0,85 h po jednorázovém podání 40 mg esomeprazolu. Po pěti dnech podávání byly hodnoty t1/2 1,01 h pro 20 mg a 1,25 h pro 40 mg. Ve studii na pacientech s refluxní chorobou jícnu byl medián t1/2 po pěti dnech podávání 20 mg esomeprazolu 1,3 h a pro dávku 40 mg představoval 1,6 h [2].
Systémová dostupnost esomeprazolu je silně ovlivněna současným příjmem potravy, která zpožďuje a oddaluje vstřebání. Čas k dosažení maximální plazmatické koncentrace (cmax) byl u zdravých dobrovolníků přibližně zdvojnásoben v případě podávání 40 mg esomeprazolu ve formě enterosolventní kapsle užité 15 minut před požitím tučného jídla. Potrava nicméně nemá vliv na celkovou biodostupnost léčiva, ať je podáváno ve formě enterosolventních tablet, nebo perorální suspenze.
Při podávání esomeprazolu nazogastrickou sondou je dosahováno obdobné systémové dostupnosti jako při perorálním podání [6].
Systémová expozice vyjádřená plochou pod křivkou (AUC) je závislá na dávce v případě jednorázového podání a zvyšuje se nelineárním způsobem v případě opakovaného podání u zdravých dobrovolníků. Během 5 dnů od počátku podávání esomeprazolu v dávce 20 mg jednou denně vzrostla průměrná AUC o 90 %, průměrný cmax o 43 % a celková biodostupnost z 50 % na 68 %. Nárůst sledovaných parametrů byl markantnější v případě esomeprazolu 40 mg podávaného jednou denně, kdy se AUC zvýšila o 159 % a cmax o 95 % během stejné doby 5 dnů. Tyto změny jsou přičítány snížené systémové clearance a sníženému „first-pass“ metabolismu po opakovaném podání.
Při podání perorálního roztoku esomeprazolu v dávkách 20 mg a 40 mg došlo u zdravých dobrovolníků k vyšší systémové expozici než v případě podání R-enantiomeru omeprazolu nebo racemické směsi, a to v případě jednorázového i opakovaného podání. Po pětidenním perorálním podávání dávky 20 mg jednou denně byly hodnoty AUC 1,52, 0,62 a 1,04 mmol h/l pro esomeprazol, R-omeprazol a racemickou směs. V případě perorální dávky 40 mg byly odpovídající hodnoty 2,84, 0,68 a 1,63 mmol h/l pro esomeprazol, R-omeprazol a racemickou směs [7].
Pokud byla podána jednorázová dávka 40 mg esomeprazolu těsně před požitím tučného jídla, průměrný t1/2 byl stanoven na 1,53 h oproti 1,07 h v případě podání na lačný žaludek [2, 8].
 Esomeprazol je z 97 % vázán na plazmatické proteiny a jeho distribuční objem v rovnovážném stavu je 16 l. Esomeprazol vykazuje vysokou míru chirální stability, pouze 0,4 % konvertují na R-izomer [3].
Esomeprazol je z 97 % vázán na plazmatické proteiny a jeho distribuční objem v rovnovážném stavu je 16 l. Esomeprazol vykazuje vysokou míru chirální stability, pouze 0,4 % konvertují na R-izomer [3].
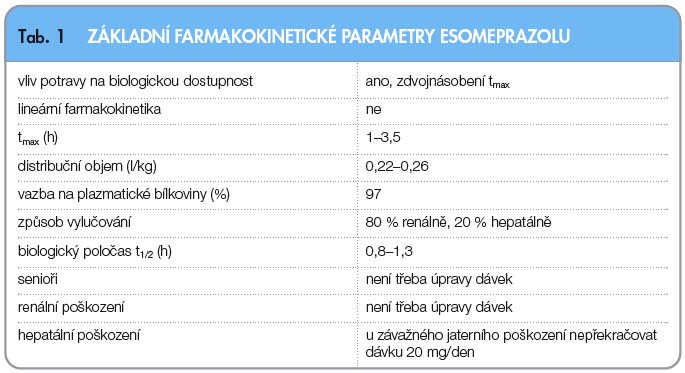
Souhrnný přehled farmakologických vlastností esomeprazolu zobrazuje tab. 1.
Metabolismus a eliminace
Esomeprazol je extenzivně metabolizován v játrech systémem cytochromu P-450 na antisekrečně neúčinné metabolity. Látka je primárně metabolizována izoformou CYP 2C19 na hydroxylované a desmetylované metabolity a v menší míře izoformou CYP 3A4 na sulfonové metabolity. Tak jako ostatní PPI i esomeprazol nebo jeho sulfonové metabolity inhibují CYP 2C19, čímž je vysvětlována na dávce závislá nelineární farmakokinetika těchto látek [1–4].
U pacientů s normální funkcí CYP 2C19 je esomeprazol metabolizován pomaleji než racemická směs omeprazolu. V porovnání s jednotlivou dávkou po vícenásobném podání esomeprazolu se eliminace pomocí CYP 2C19 snížila přibližně o polovinu, zatímco tvorba sulfonových metabolitů CYP 3A4 vzrostla o přibližně 40 % a poměr omeprazol sulfonu k 5-hydroxyomeprazolu se zvýšil ze 7,9 na 19,3. Dochází zde pravděpodobně k metabolickému posunu směrem k CYP 3A4. V případě esomeprazolu je tedy při srovnání s ostatními PPI předpokládána nižší variabilita v jeho farmakokinetice z důvodu nižší závislosti na genetickém polymorfismu CYP 2C19 v populaci [10].
U pomalých metabolizátorů (kteří nevykazují funkční formu CYP 2C19) nebyly prokázány ve studiích změny ve farmakokinetice esomeprazolu [2, 3].
Z údajů získaných na zdravých dobrovolnících vyplývá, že přibližně 80 % podané dávky esomeprazolu je vyloučeno močí jako inaktivní metabolity a malá část stolicí. V moči bylo detekováno méně než 1 % mateřské látky. Technologická úprava perorální tablety nebo složení perorální suspenze neměly vliv na t1/2 [1–3].
Farmakokinetika esomeprazolu nebyla v klinicky významné míře změněna ve stáří ani u pacientů s poškozením ledvin [2, 11]. Ke změnám nedochází ani u pacientů s mírným až středně závažným jaterním poškozením ani mezi pohlavími a není třeba v těchto případech upravovat dávky [2, 3].
Ve skupině pacientů se závažným jaterním poškozením jsou plazmatické koncentrace esomeprazolu zvýšené a nedoporučuje se v těchto případech překračovat dávku 20 mg esomeprazolu denně [12].
Přechodná vyšší hladina gastrinu nemá klinický ani prognostický význam a lze ji prokázat nejen při podávání PPI, ale i blokátorů H2-receptorů.
Klinické zkušenosti
Randomizovaná studie porovnávající esomeprazol s pantoprazolem prokázala 24hodinovým ambulantním měřením hodnot intragastrického pH vyšší účinnost esomeprazolu podávaného per os 2krát denně 40 mg než pantoprazolu 2krát denně 40 mg. Esomeprazol byl schopen udržet intragastrické pH větší než 4 po dobu více než 16 h denně [13].
Za použití stejné metody 24hodinového intragastrického měření pH bylo prokázáno, že esomeprazol podávaný per os 40 mg jednou denně signifikantně více snižuje gastrickou sekreci u pacientů užívajících COX-2 selektivní i neselektivní nesteroidní antiflogistika (NSAID) než lansoprazol 30 mg nebo pantoprazol 40 mg [14].
Ze závěrů studie porovnávající efekt rabeprazolu a esomeprazolu na 24hodinové intragastrické pH vyplývá, že 20 mg rabeprazolu je účinnějších než 20 mg esomeprazolu po jednorázovém i opakovaném podání. Jednotlivé dávky rabeprazolu 10 mg a 20 mg jsou ekvivalentní dávkám 20 mg a 40 mg esomeprazolu v 24hodinovém působení na intragastrické pH; účinek esomeprazolu nastupuje rychleji, zatímco rabeprazol působí dlouhodoběji [15].
Esomeprazol podaný intravenózně (i.v.) 40 mg jednou denně zajišťuje rychlejší a lepší kontrolu intragastrické acidity (kontinuální 24hodinové měření) v porovnání s i.v. pantoprazolem 40 mg jednou denně [16].
Lepší účinek i.v. esomeprazolu v dávce 40 mg byl potvrzen i v porovnání s i.v. lansoprazolem 30 mg [17].
Dávka 40 mg esomeprazolu denně efektivně léčí refluxní chorobu jícnu, nebyly pozorovány výhody v dělení celkové dávky do více dílčích. Přítomnost H. pylori nemá na výsledky léčby po 8 týdnech vliv. Esomeprazol byl ve všech studiích prokázán jako účinný v úlevě od pyrózy [2].
Esomeprazol v dávce 40 mg denně je v rychlé úlevě od pyrózy u endoskopicky prokázané refluxní choroby jícnu účinnější než esomeprazol podávaný v dávce 20 mg, pantoprazol 40 mg a lansoprazol 30 mg denně. Po osmitýdenní léčbě nebyly nalezeny rozdíly mezi omeprazolem, pantoprazolem, lansoprazolem a esomeprazolem v účinku na úlevu od symptomů [18].
Esomeprazol je v dávce 40 mg denně účinnější v léčbě středně závažné až závažné erozivní ezofagitidy (Los Angeles klasifikace C nebo D) než lansoprazol 30 mg denně. Také signifikantně více ulevuje od symptomů v porovnání s lansoprazolem [19].
Klinická studie porovnávající esomeprazol 40 mg denně a pantoprazol 40 mg denně s cílem dosažení kompletní remise gastroezofageálního refluxu při délce léčby 4, 8 nebo 12 týdnů neprokázala rozdíly v účinnosti obou PPI [20].
Metaanalýza randomizovaných kontrolovaných studií porovnávající esomeprazol s ostatními PPI (omeprazol, lansoprazol, pantoprazol) konstatuje, že esomeprazol obecně dosahuje lepších výsledků při hojení refluxní ezofagitidy po 8 týdnech [21].
U pacientů s gastroezofageálním refluxem udrží esomeprazol během pětidenní léčby hodnotu intragastrického pH vyšší než 4 (pH > 4) signifikantně déle v porovnání se standardními dávkami ostatních PPI. Esomeprazol 40 mg denně po osmitýdenní léčbě erozivní gastroezofageální choroby dosahuje lepších výsledků v léčbě a v úlevě od symptomů než omeprazol 20 mg, lansoprazol 30 mg nebo pantoprazol 40 mg denně. V případě udržovací léčby zhojené erozivní gastroezofageální refluxní choroby (GERD) je esomeprazol 20 mg denně účinnější než lansoprazol 15 mg nebo pantoprazol 20 mg denně [22].
V případě udržovací léčby refluxní ezofagitidy byla dávka 20 mg esomeprazolu denně prokázána jako dostatečně účinná. V šestiměsíční studii porovnávající jednotlivé PPI v udržovací terapii byl esomeprazol v dávce 20 mg denně účinnější než lansoprazol 15 mg denně. Pantoprazol 20 mg jednou denně nebyl prokázán jako účinnější než esomeprazol 20 mg denně [2].
V případě redukce symptomů (pyróza, epigastrická bolest, regurgitace) v šestiměsíční studii udržovací léčby refluxní ezofagitidy byl esomeprazol stejně účinný nebo účinnější než lansoprazol a pantoprazol [2].
Šestiměsíční podávání esomeprazolu v dávce 20 mg pravidelně jednou denně bylo v udržovací terapii refluxní ezofagitidy prokázáno jako účinnější než léčba esomeprazolem podávaným jen v případě potřeby („on demand therapy“), pacienti potřebují konzistentnější míru suprese gastrické sekrece pro úspěšné setrvání v remisi [23].
Esomeprazol v dávkách 20 mg nebo 40 mg denně zabraňoval u rizikových pacientů (věk 60 a více let a/nebo vředová choroba v anamnéze) užívajících COX-2 selektivní i neselektivní NSAID vředové chorobě signifikantně více než placebo [24].
Studie zahrnující populaci pacientů se žaludeční nebo duodenální vředovou chorobou a s kontinuální terapií COX-2 selektivními i neselektivními NSAID prokázala vyšší účinnost esomeprazolu 40 mg nebo 20 mg denně na hojení vředů v porovnání s ranitidinem 150 mg dvakrát denně během osmitýdenní léčby [25].
Účinnost 20 mg a 40 mg esomeprazolu denně při šestiměsíčním podávání byla prokázána i ve zvýšení úlevy od gastrointestinálních symptomů (pyróza, bolest v epigastriu, dyskomfort) spojených s užíváním COX-2 selektivních i neselektivních NSAID. Esomeprazol byl signifikantně účinnější než placebo jak ve zmírnění symptomů, tak ve vlivu na kvalitu života [26].
Esomeprazol podávaný v dávkách 20 mg nebo 40 mg denně prokazatelně snižuje riziko výskytu peptických vředů u rizikových pacientů užívajících nízké dávky kyseliny acetylsalicylové (75–325 mg). Účinnost 20 mg nebo 40 mg esomeprazolu je v tomto případě srovnatelná [27].
Esomeprazol prokázal svoji účinnost v kombinaci s dvojicí antimikrobních látek v eradikaci H. pylori v sedmidenních nebo desetidenních režimech. Míra eradikace při dávkování 2krát denně 20 mg nebo jednou denně 40 mg se pohybuje v rozmezí 74–94 %. Účinnost se signifikantně neliší od režimů obsahujících omeprazol nebo rabeprazol. Je však vyšší než u pantoprazolu podávaného v dávce 40 mg dvakrát denně [2].
Závěrem provedené metaanalýzy je, že trojkombinace obsahující esomeprazol je vysoce účinná v eradikaci H. pylori a srovnatelně účinná jako kombinace obsahující omeprazol [28].
Zařazení do současné palety léčiv
Nespornou výhodou esomeprazolu je jeho rychlý nástup účinku a tím i rychlejší ovlivnění subjektivních symptomů. Navíc jeho lékové interakce nejsou dle stávajících studií nijak klinicky významné, takže lze předpokládat, že esomeprazol bude lékem první volby u GERD, zvláště u závažnějších stadií nemoci, kde se ukázal přibližně o 15 % lepší efekt oproti PPI 1. generace. Protože esomeprazol je lékem zatím s nejlepším ovlivněním a kontrolou žaludeční sekrece, je lékem první volby u pacientů s obtížně hojitelnými vředy, především žaludečními. Jistě není výhodnějším lékem oproti ostatním PPI, pokud jde o eradikaci infekce H. pylori. Esomeprazol lze podávat dětem.
Indikace
V České republice je esomeprazol schválen pro použití v diagnózách GERD, v kombinaci s příslušnými antibakteriálními režimy k eradikaci H. pylori a k prevenci a léčbě peptických vředů souvisejících s H. pylori, k prevenci a léčbě žaludečních a dvanáctníkových vředů v souvislosti s užíváním NSAID, k prevenci opětovného krvácení ze žaludečních a dvanáctníkových vředů jako pokračování intravenózní léčby a k terapii Zollingerova-Ellisonova syndromu [29].
Kontraindikace
Kontraindikací léčby je pouze známá přecitlivělost na esomeprazol nebo na některý ze substituovaných benzimidazolů.
Nežádoucí účinky
Data o bezpečnosti esomeprazolu a nežádoucích účincích spojených s léčbou esomeprazolem pocházejí z klinických studií zahrnujících dohromady více než 17 000 subjektů a trvajících od dvou týdnů po 3 roky. Obecně dosahovala snášenlivost a výskyt nežádoucích účinků u esomeprazolu stejné míry jako u ostatních zástupců PPI (omeprazol, pantoprazol, lansoprazol, rabeprazol). Jako nejčastější jsou uváděny průjem a bolest hlavy, vyskytující se přibližně u 4–5 % pacientů. Esomeprazol nebyl ve studiích spojen s klinicky významnými změnami laboratorních parametrů [1, 2].
V rozsáhlé studii u kohorty pacientů s refluxní chorobou jícnu (n = 5228) se nežádoucí účinky vyskytly u 11 % pacientů užívajících esomeprazol 40 mg jednou denně a u 10 % pacientů užívajících lansoprazol 30 mg jednou denně. Léčba byla z těchto důvodů ukončena v 1,8 % a 1,9 %. Z nežádoucích účinků se ve skupině pacientů užívajících esomeprazol vyskytly bolesti hlavy (6 %), průjem (4 %), infekce dýchacích cest (3 %), bolesti břicha (3 %), plynatost (2 %) a nevolnost (2 %) [2].
Kombinovaná terapie esomeprazolem 20 mg dvakrát denně nebo 40 mg jednou denně, klarithromycinem a amoxicilinem po dobu 7 nebo 10 dnů určená k eradikaci H. pylori byla pacienty dobře tolerována a výskyt nežádoucích účinků se nelišil významně od terapie samotným esomeprazolem. Snášenlivost a výskyt nežádoucích účinků se neliší mezi režimy obsahujícími pantoprazol, omeprazol nebo rabeprazol [2].
Obecně byl esomeprazol dobře snášen i ve vysokých dávkách (do 240 mg/den) ve studii u pacientů se Zollingerovým-Ellisonovým syndromem nebo s idiopatickou gastrickou hypersekrecí. Výskyt nežádoucích účinků byl i vzhledem k podávaným dávkám vyšší, jednalo se o průjem (29 %), nevolnost (24 %), kašel (24 %) a bolest hlavy (19 %) [30].
Metaanalýza zpracovávající data z 31 klinických studií, do kterých bylo zařazeno více než 16 000 pacientů užívajících esomeprazol, nepotvrdila souvislost mezi užíváním esomeprazolu a zvýšeným výskytem komunitních respiračních infekcí včetně pneumonie. Výskyt těchto obtíží se významně nelišil od ostatních PPI (omeprazol, lansoprazol), H2-blokátorů (ranitidin) nebo placeba [31].
Lékové interakce
Esomeprazol má nízký interakční potenciál vůči ostatním léčivům. Studie in vitro a in vivo neprokázaly inhibiční efekt esomeprazolu na CYP 1A2, CYP 2A6, CYP 2C9, CYP 2D6 a CYP 2E1, a proto se nepředpokládají lékové interakce s léčivými látkami metabolizovanými těmito izoenzymy [2, 3].
Esomeprazol je metabolizován z 30 % CYP 3A4 a ze 70 % CYP 2C19, proto je možno očekávat lékové interakce s léčivými látkami, které jsou induktory nebo inhibitory těchto izoenzymů.
Současné podávání esomeprazolu s inhibitorem CYP 2C19 a 3A4 vorikonazolem vede ke zdvojnásobení AUC esomeprazolu. Obdobně se AUC esomeprazolu zdvojuje při současném podávání s klarithromycinem. Tyto změny ale nejsou považovány za klinicky významné a nevyžadují úpravy dávkování [2].
Esomeprazol může interagovat s léčivými látkami metabolizovanými CYP 2C19 (fenytoin, R-warfarin, diazepam), ale ani v těchto případech nejsou interakce považovány za klinicky významné. Současné podávání esomeprazolu s neselektivními (naproxen) i se selektivními (rofekoxib) NSAID ve studiích na zdravých dobrovolnících neprokázalo změny ve farmakokinetice esomeprazolu ani ve farmakokinetice současně podávaných NSAID [2].
Stejně jako v případě ostatních léčivých přípravků ze skupiny PPI může i esomeprazol snížením produkce žaludeční kyseliny ovlivnit systémovou biodostupnost léčiv závislých na pH žaludku (antiretrovirotika, přípravky s obsahem železa, ketokonazol). Systémová biodostupnost atazanaviru je snížena při současném podávání PPI. Obdobně při současném podávání léčivých přípravků zvyšujících pH žaludku dochází ke snížení plazmatických koncentrací indinaviru, lopinaviru a tipranaviru. Léčivé přípravky zvyšující pH žaludku naopak zvyšují systémovou dostupnost saquinaviru. Esomeprazol nemá vliv na farmakokinetiku amprenaviru [32].
Několik publikovaných studií upozornilo na snížení účinnosti protidestičkového léčiva klopidogrelu u pacientů užívajících PPI. Klopidogrel je proléčivo přeměňované na účinnou látku cytochromem P-450 2C19, který je pravděpodobně inhibován současným podáním PPI. Snížení metabolismu klopidogrelu na jeho aktivní formu může vést ke zvýšenému výskytu trombotických příhod včetně infarktu myokardu. Studie naznačily, že riziko je nejvyšší pro omeprazol a esomeprazol. Evropská léková agentura (EMA) vydala 29. 5. 2009 vyjádření k této problematice, kde doporučuje přehodnotit započetí či podávání PPI u pacientů užívajících klopidogrel.
Nedávno publikované práce a metaanalýza však význam popsané lékové interakce do jisté míry zpochybňují. Byla provedena prospektivní, dvojitě zaslepená, randomizovaná studie COGENT, do které bylo zařazeno 3761 pacientů s duální protidestičkovou léčbou klopidogrelem 75 mg denně a kyselinou acetylsalicylovou. Pacienti byli randomizováni do skupiny současně užívající 20 mg omeprazolu (směs R- a S-enantiomeru) a do skupiny užívající placebo. Studie byla předčasně ukončena. Ve skupině užívající omeprazol došlo k signifikantnímu snížení výskytu gastrointestinálních krvácivých příhod, avšak nebyl potvrzen předpokládaný zvýšený výskyt kardiovaskulárních příhod a autoři studie uzavírají problematiku popisované lékové interakce jako klinicky nesignifikantní [33].
Hypoteticky zde má významnou roli genetický polymorfismus CYP 2C19 a u některých osob se nižší efektivita klopidogrelu projeví bez vazby na současně podávaný PPI.
Práce sumarizující doposud publikované články na toho téma konstatuje, že jednotlivé studie byly povětšinou nerandomizované, interpretované post hoc a zatížené nevyvážeností a statistickým bias. Nedoporučuje automatické vysazování PPI u pacientů užívajících klopidogrel, rozhodujícím faktorem by mělo být riziko gastrointestinálních krvácivých příhod u konkrétního pacienta [34].
Metaanalýza zpracovávající výsledky jedné randomizované a 24 nerandomizovaných studií, do kterých bylo zahrnuto přes 159 000 pacientů, konstatuje, že nelze vyloučit zvýšené riziko kardiovaskulárních příhod u pacientů užívajících klopidogrel a PPI, nicméně mortalita ovlivněna není. Naopak riziko krvácení do gastrointestinálního traktu se snižuje zhruba na polovinu. Léková interakce PPI a klopidogrelu nepředstavuje pravděpodobně „class effect“ celé skupiny PPI. Některé studie zahrnuté do metaanalýzy popisují negativní efekt PPI nezávisle na současném užívání klopidogrelu [35].
Použití u speciálních skupin
Použití v graviditě
Inhibitory protonové pumpy jsou obecně považovány za bezpečné pro použití v těhotenství v léčbě refluxní choroby jícnu, infekce H. pylori, peptického vředu, Zollingerova-Ellisonova syndromu a také v prevenci těhotenské nevolnosti a zvracení, jež postihují až 80 % těhotných žen [36].
Dosud publikované práce a metaanalýza ovšem berou v úvahu omeprazol jako racemickou směs, pro použití S-enantiomeru v těhotenství není k dispozici dostatek dat, a tak by látka měla být podávána těhotným ženám s opatrností. O podávání esomeprazolu v laktaci není taktéž dostatek dat [2].
Použití u dětí
Stejně jako u dospělých jedinců byla účinnost a bezpečnost esomeprazolu prokázána i u dětí. Dvě práce zahrnuly do výzkumu kohortu dětí od 1 do 11 let věku [37, 38]. Použití u adolescentů ve věkovém rozmezí 12–17 let popisuje studie [39].
U mladších dětí byla popsána vyšší rychlost metabolismu esomeprazolu [38]. Toto bylo popsáno obecně u skupiny PPI, pravděpodobně z důvodu vyšší metabolické aktivity CYP 2C19 a CYP 3A4 v tomto vývojovém období [1].
Dávkování
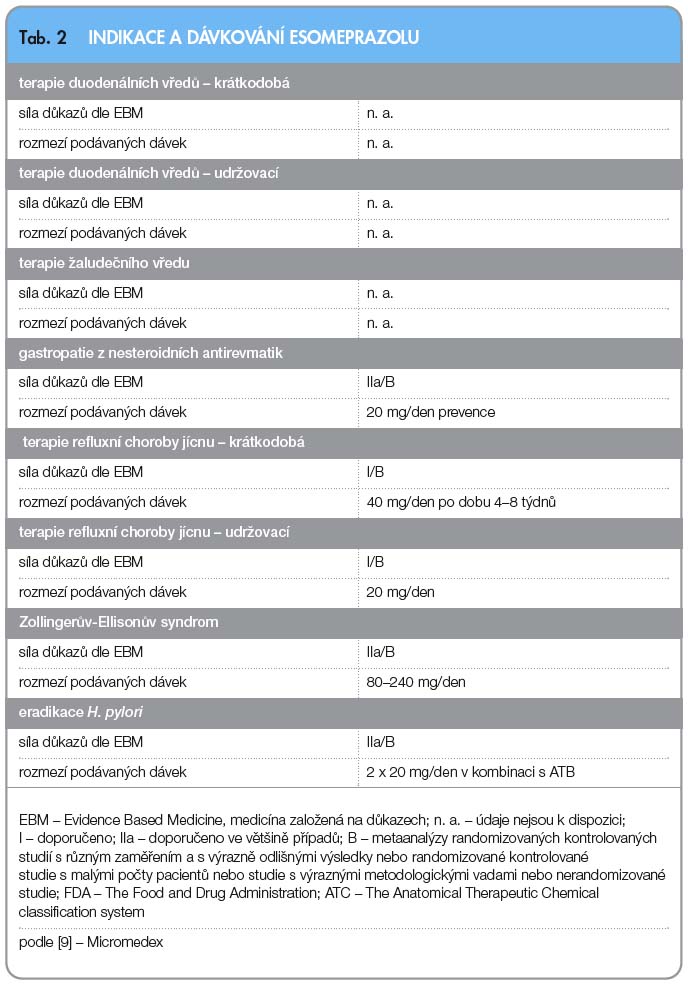 Dávkování esomeprazolu u jednotlivých indikací dle FDA a sílu důkazů dle EBM (Evidence Based Medicine) shrnuje tab. 2.
Dávkování esomeprazolu u jednotlivých indikací dle FDA a sílu důkazů dle EBM (Evidence Based Medicine) shrnuje tab. 2.
Balení
V České republice jsou k dispozici enterosolventní lékové formy (nejčastěji tobolky) s obsahem 20 mg nebo 40 mg esomeprazolu.
Seznam použité literatury
- [1] Scott LJ, Dunn CJ, Mallarkey G, Sharpe M. Esomeprazole: a review of its use in the management of acid-related disorders. Drugs 2002; 62: 1503–1538.
- [2] McKeage K, Blick SK, Croxtall JD, et al. Esomeprazole: a review of its use in the management of gastric acid-related diseases in adults. Drugs 2008; 68: 1571–607.
- [3] Andersson T, Hassan-Alin M, Hasselgren G, et al. Pharmacokinetic studies with esomeprazole, the (S)-isomer of omeprazole. Clin Pharmacokinet 2001; 40: 411–426.
- [4] Abelö A, Andersson TB, Antonsson M, et al. Stereoselective metabolism of omeprazole by human cytochrome P450 enzymes. Drug Metab Dispos 2000; 28: 966–972.
- [5] Shin JM, Sachs G. Pharmacology of proton pump inhibitors. Curr Gastroenterol Rep 2008; 10: 528–534.
- [6] Sostek MB, Chen Y, Skammer W, et al. Esomeprazole administered through a nasogastric tube provides bioavailability similar to oral dosing. Aliment Pharmacol Ther 2003; 18: 581–586. Erratum in: Aliment Pharmacol Ther 2004; 19: 615.
- [7] Hassan-Alin M, Andersson T, Niazi M, Röhss K. A pharmacokinetic study comparing single and repeated oral doses of 20 mg and 40 mg omeprazole and its two optical isomers, S-omeprazole (esomeprazole) and R-omeprazole, in healthy subjects. Eur J Clin Pharmacol 2005; 60: 779–784.
- [8] Sostek MB, Chen Y, Andersson T. Effect of timing of dosing in relation to food intake on the pharmacokinetics of esomeprazole. Br J Clin Pharmacol 2007; 64: 386–390.
- [9] Micromedex® Healthcare Series [intranet database]. Version 1.0.
- [10] Schwab M, Klotz U, Hofmann U, et al. Esomeprazole-induced healing of gastroesophageal reflux disease is unrelated to the genotype of CYP2C19: evidence from clinical and pharmacokinetic data. Clin Pharmacol Ther 2005; 78: 627–634.
- [11] Hasselgren G, Hassan-Alin M, Andersson T, et al. Pharmacokinetic study of esomeprazole in the elderly. Clin Pharmacokinet 2001; 40: 145–150.
- [12] Sjövall H, Björnsson E, Holmberg J, et al. Pharmacokinetic study of esomeprazole in patients with hepatic impairment. Eur J Gastroenterol Hepatol 2002; 14: 491–496.
- [13] Miehlke S, Madisch A, Kirsch C, et al. Intragastric acidity during treatment with esomeprazole 40 mg twice daily or pantoprazole 40 mg twice daily – a randomized, two-way crossover study. Aliment Pharmacol Ther 2005; 21: 963–967.
- [14] Goldstein JL, Miner PB Jr, Schlesinger PK, et al. Intragastric acid control in non-steroidal anti-inflammatory drug users: comparison of esomeprazole, lansoprazole and pantoprazole. Aliment Pharmacol Ther 2006; 23: 1189–1196.
- [15] Norris V, Baisley K, Dunn K, et al. Combined analysis of three crossover clinical pharmacology studies of effects of rabeprazole and esomeprazole on 24-h intragastric pH in healthy volunteers. Aliment Pharmacol Ther 2007; 25: 501–510.
- [16] Wilder-Smith CH, Röhss K, Bondarov P, et al. Esomeprazole 40 mg i.v. provides faster and more effective intragastric acid control than pantoprazole 40 mg i.v.: results of a randomized study. Aliment Pharmacol Ther 2004; 20: 1099–1104.
- [17] Pisegna JR, Sostek MB, Monyak JT, Miner PB Jr. Intravenous esomeprazole 40 mg vs. intravenous lansoprazole 30 mg for controlling intragastric acidity in healthy adults. Aliment Pharmacol Ther 2008; 27: 483–490.
- [18] Zheng RN. Comparative study of omeprazole, lansoprazole, pantoprazole and esomeprazole for symptom relief in patients with reflux esophagitis. World J Gastroenterol 2009; 15: 990–995.
- [19] Fennerty MB, Johanson JF, Hwang C, Sostek M. Efficacy of esomeprazole 40 mg vs. lansoprazole 30 mg for healing moderate to severe erosive oesophagitis. Aliment Pharmacol Ther 2005; 21: 455–463.
- [20] Bardhan KD, Achim A, Riddermann T, Pfaffenberger B. A clinical trial comparing pantoprazole and esomeprazole to explore the concept of achieving 'complete remission' in gastro-oeso-phageal reflux disease. Aliment Pharmacol Ther 2007; 25: 1461–1469.
- [21] Edwards SJ, Lind T, Lundell L. Systematic review: proton pump inhibitors (PPIs) for the healing of reflux oesophagitis – a comparison of esomeprazole with other PPIs. Aliment Pharmacol Ther 2006; 24: 743–750.
- [22] Kalaitzakis E, Björnsson E. A review of esomeprazole in the treatment of gastroesophageal reflux disease (GERD). Ther Clin Risk Manag 2007; 3: 653–663.
- [23] Sjöstedt S, Befrits R, Sylvan A, et al. Daily treatment with esomeprazole is superior to that taken on-demand for maintenance of healed erosive oesophagitis. Aliment Pharmacol Ther 2005; 22: 183–191.
- [24] Scheiman JM, Yeomans ND, Talley NJ, et al. Prevention of ulcers by esomeprazole in at-risk patients using non-selective NSAIDs and COX-2 inhibitors. Am J Gastroenterol 2006; 101: 701–710.
- [25] Goldstein JL, Johanson JF, Suchower LJ, Brown KA. Healing of gastric ulcers with esomeprazole versus ranitidine in patients who continued to receive NSAID therapy: a randomized trial. Am J Gastroenterol 2005; 100: 2650–2657.
- [26] Hawkey CJ, Talley NJ, Scheiman JM, et al.; NASA/SPACE author group. Maintenance treatment with esomeprazole following initial relief of non-steroidal anti-inflammatory drug-associated upper gastrointestinal symptoms: the NASA2 and SPACE2 studies. Arthritis Res Ther 2007; 9: R17.
- [27] Scheiman JM, Devereaux PJ, Herlitz J, et al. Prevention of peptic ulcers with esomeprazole in patients at risk of ulcer development treated with low-dose acetylsalicylic acid: a randomised, controlled trial (OBERON). Heart 2011; 97: 797–802.
- [28] Gisbert JP, Pajares JM. Esomeprazole-based therapy in Helicobacter pylori eradication: a meta-analysis. Dig Liver Dis 2004; 36: 253–259.
- [29] MV-AISLP – ČR 2011.3
- [30] Metz DC, Sostek MB, Ruszniewski P, et al. Effects of esomeprazole on acid output in patients with Zollinger-Ellison syndrome or idiopathic gastric acid hypersecretion. Am J Gastroenterol 2007; 102: 2648–2654.
- [31] Estborn L, Joelson S. Occurrence of community-acquired respiratory tract infection in patients receiving esomeprazole: retrospective analysis of adverse events in 31 clinical trials. Drug Saf 2008; 31: 627–636.
- [32] Falcon RW, Kakuda TN. Drug interactions between HIV protease inhibitors and acid-reducing agents. Clin Pharmacokinet 2008; 47: 75–89.
- [33] Bhatt DL, Cryer BL, Contant CF, et al; COGENT Investigators. Clopidogrel with or without ome-prazole in coronary artery disease. N Engl J Med 2010; 363: 1909–1917.
- [34] Tantry US, Kereiakes DJ, Gurbel PA. Clopidogrel and proton pump inhibitors: influence of pharmacological interactions on clinical outcomes and mechanistic explanations. JACC Cardiovasc Interv 2011; 4: 365–380.
- [35] Siller-Matula JM, Jilma B, Schrör K, et al. Effect of proton pump inhibitors on clinical outcome in patients treated with clopidogrel: a systematic review and meta-analysis. J Thromb Haemost 2010; 8: 2624–2641.
- [36] Gill SK, O'Brien L, Einarson TR, Koren G. The safety of proton pump inhibitors (PPIs) in pre-gnancy: a meta-analysis. Am J Gastroenterol 2009; 104: 1541–1545.
- [37] Tolia V, Youssef NN, Gilger MA, et al. Esomeprazole for the treatment of erosive esophagitis in children: an international, multicenter, randomized, parallel-group, double-blind (for dose) study. BMC Pediatr 2010; 10: 41.
- [38] Zhao J, Li J, Hamer-Maansson JE, et al. Pharmacokinetic properties of esomeprazole in children aged 1 to 11 years with symptoms of gastroesophageal reflux disease: a randomized, open-label study. Clin Ther 2006; 28: 1868–1876.
- [39] Li J, Zhao J, Hamer-Maansson JE, et al. Pharmacokinetic properties of esomeprazole in adolescent patients aged 12 to 17 years with symptoms of gastroesophageal reflux disease: A randomized, open-label study. Clin Ther 2006; 28: 419–427.