Exenatid
Exenatid byl americkým úřadem FDA (Food and Drug Administration) povolen v USA pro léčbu diabetiků 2. typu v dubnu 2005 a v Evropě získal souhlas začátkem roku 2007. Bezpečnost léčby exenatidem byla dostatečně prokázána v experimentálních i preklinických studiích. Celkově označují klinické studie snášenlivost exenatidu jako všeobecně dobrou. Exenatid je prvním představitelem nové třídy léčiv zvaných inkretinová mimetika, která jsou určena pro terapii pacientů s diabetem mellitem 2. typu. Vykazuje při subkutánním podání stejnou účinnost jako humánní inkretinový hormon GLP-1. Ve srovnání s dosud dostupnými perorálními antidiabetiky a inzulinem v léčbě DM 2. typu má exenatid čtyři klinicky významné přednosti: a) samotný lék nezpůsobuje hypoglykémie; b) podporuje sekreci inzulinu i u nemocných, kteří již nereagují zvýšením sekrece inzulinu na popud sulfonylureových PAD; c) snižuje zvýšené hladiny glukagonu; d) významně snižuje hmotnost u obézních diabetiků. Po podání exenatidu dochází dále ke snížené motilitě žaludku a k potlačení sekrece žaludečních kyselin spolu se snížením motility tenkého střeva; to vše má za následek redukci v absorpci živin v gastrointestinálním traktu a snížení postprandiálních fluktuací glykémií. Nevýhodou subkutánně podávaného analoga GLP-1 exenatidu s poločasem 2,4 hod. je jeho krátký hypoglykemizující efekt (6–8 hodin), který znamená nutnost podávání léku dvakrát denně.
Farmakologická skupina
Exenatid je první látkou ze skupiny inkretinových mimetik, nové třídy antidiabetických léčiv. Inkretinová mimetika snižují hladiny krevního cukru stejným mechanismem jako přirozené lidské hormony nazývané inkretiny. Jejich hlavním působením je stimulace schopnosti organismu uvolňovat dostatečné množství inzulinu na popud zvýšené glykémie a inhibovat uvolňování glukagonu. ATC kód exenatidu je A10BX04.
Chemické a fyzikální vlastnosti
Exenatid je polypeptid složený z 39 aminokyselin (obr. 1), původně objevený jako exendin 4 ve slinách ještěrky korovce jedovatého (Heloderma suspectum, Gila monster). Pro farmaceutické účely je syntetizován metodami 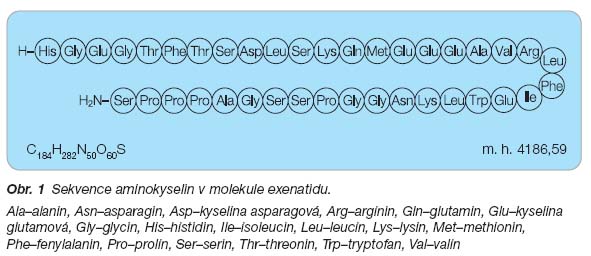
 chemie peptidů.
chemie peptidů.
Sumární vzorec: C184H282N50O60S
Molekulová hmotnost: 4186,59
Exenatid je snadno rozpustný ve vodě a v řadě dalších polárních rozpouštědel. Samotný exenatid váže vzdušnou vlhkost (je hygroskopický). Léčivý přípravek obsahuje exenatid ve formě vodného roztoku, jenž je součástí pera.
Mechanismus účinku, farmakodynamika
Inkretiny v diabetologii
Po požití jídla nedochází pouze k sekrečním změnám v endokrinní části slinivky břišní (regulace uvolňování inzulinu a glukagonu), ale také k uvolnění řady gastrointestinálních hormonů, které se pak účinně zapojují do regulace motility střeva, sekrece žaludeční kyseliny, sekrece pankreatických enzymů, kontrakční schopnosti žlučníku a absorpce živin. Toto spojení mezi endokrinní částí slinivky břišní a střevními působky je běžně označováno jako entero-inzulární osa.
V poslední době je jednoznačně prokázáno, že uvolněné střevní působky/hormony také významně urychlují využití vstřebávané glukózy, protože samy stimulují sekreci inzulinu v β-buňkách pankreatických ostrůvků. Pokud podáme  zdravé osobě stejné množství glukózy perorálně a intravenózně, dojde po perorálním podání k významně vyšší sekreci inzulinu. Látky, které jsou za tento efekt zodpovědné, se nazývají inkretiny. Prvním identifikovaným inkretinem byl GIP (původně nazývaný gastrický inhibiční peptid a nyní známý jako na glukóze závislý inzulinotropní polypeptid). Druhým prokázaným inkretinovým hormonem je GLP-1 (glukagon-like peptid 1), který je tvořen v endokrinních L-buňkách distálního ilea a v tlustém střevě. Oba výše jmenované inkretiny působící vazbou na specifické buněčné membranózní receptory mají v organismu velmi krátký poločas svého účinku, protože jsou rychle inaktivovány enzymy – dipeptidyl peptidázami 4 (DPP-4).
zdravé osobě stejné množství glukózy perorálně a intravenózně, dojde po perorálním podání k významně vyšší sekreci inzulinu. Látky, které jsou za tento efekt zodpovědné, se nazývají inkretiny. Prvním identifikovaným inkretinem byl GIP (původně nazývaný gastrický inhibiční peptid a nyní známý jako na glukóze závislý inzulinotropní polypeptid). Druhým prokázaným inkretinovým hormonem je GLP-1 (glukagon-like peptid 1), který je tvořen v endokrinních L-buňkách distálního ilea a v tlustém střevě. Oba výše jmenované inkretiny působící vazbou na specifické buněčné membranózní receptory mají v organismu velmi krátký poločas svého účinku, protože jsou rychle inaktivovány enzymy – dipeptidyl peptidázami 4 (DPP-4).
Z diabetologického hlediska je GLP-1 nejdůležitějším inkretinem, který významně ovlivňuje glukózový metabolismus (viz tab. 1). Přitom u nemocných s diabetem mellitem (DM) 2. typu je inkretinový efekt významně snížen. Po jídle je u diabetiků zaznamenávána střední redukce hladin GLP-1, ale jeho působení je relativně zachováno. Pokud byl diabetikům 2. typu podáván GLP-1, zlepšila se (nebo se normalizovala) celá řada mechanismů účinků GLP-1 na glukózový metabolismus, které byly u těchto nemocných inhibovány. Protože nelze použít terapeuticky nativní molekulu GLP-1 (poločas cca 4 minuty), hledal farmaceutický průmysl možnost syntézy takové molekuly, která by byla analogem GLP-1 s jeho podobnými (nebo identickými) účinky a přitom by byla rezistentní k degradačnímu účinku DPP-4 [1–3].
Inkretinová mimetika
Vývoj GLP-1 analoga urychlil objev látky ve slinách americké ještěrky korovce jedovatého, která byla označena jako exendin 4. Tato látka obsahuje přibližně 50 % z aminokyselinové sekvence celého řetězce totožných se savčím GLP-1 a váže se na lidské receptory pro glukagon-like peptid 1. Prokazuje obdobné stimulační účinky jako GLP-1 (s déle trvajícím působením než přirozený GLP-1). Molekula exendinu 4 byla vyrobena synteticky pod názvem exenatid. Tento agonista GLP-1 receptorů má cirkulující poločas 60–90 minut a zvýšení jeho koncentrace v plazmě trvá 4–6 hodin po jedné subkutánní injekci. Vzhledem k tomu, že analoga GLP-1 „napodobují“ fyziologickou činnost humánních hormonů inkretinů, které jsou běžně přítomny v organismu, nazývá se tato nová léčebná skupina inkretinová mimetika. Exenatid je prvním inkretinovým mimetikem, které bylo uvedeno na trh pro léčbu diabetiků 2. typu [4–10].
Exenatid
Primární hypoglykemizující účinek exenatidu zahrnuje jeho akutní vliv a chronický účinek. Po podání exenatidu dochází okamžitě k následujícím dějům:
- zvýšení sekrece inzulinu v b-buňkách pankreatických ostrůvků na podnět glukózy v krvi,
- normalizace porušené bifázické inzulinové odpovědi,
- potlačení neadekvátně zvýšené produkce glukagonu,
- zpomalení vyprazdňování žaludečního obsahu.
Pokud je exenatid podáván dlouhodobě, uplatňují se následující pochody:
- snížení příjmu potravy (díky snížené chuti k jídlu),
- redukce hmotnosti nemocného,
- zvýšení inzulinové citlivosti periferních tkání,
- podpora syntézy proinzulinu vyvolaná glykémií.
Důležité je zdůraznit, že exenatid stimuluje uvolňování inzulinu z inzulinových granul pouze tehdy, když je hladina glukózy zvýšená. Když se hladina glukózy 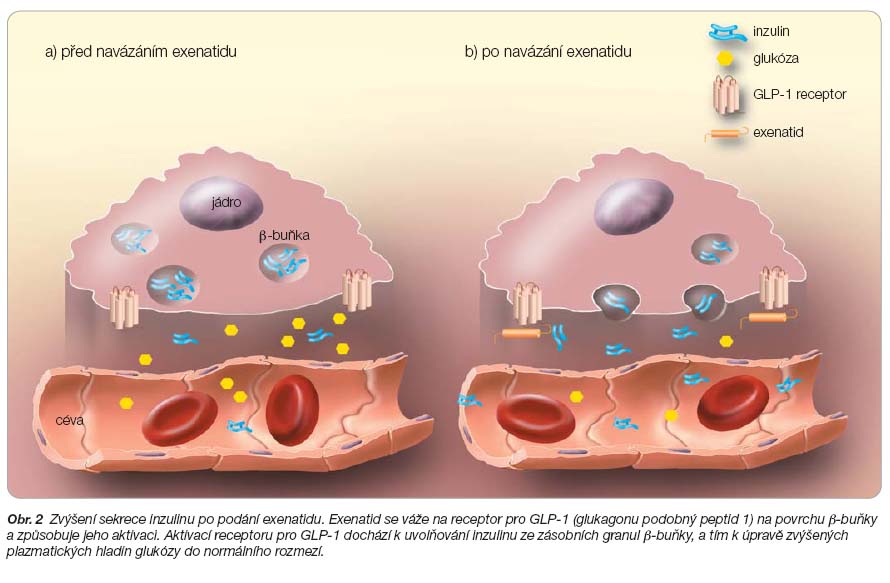 v krvi vrátí do normálního rozmezí, sérová hladina inzulinu se vrací k bazální úrovni. Obdobně ovlivňuje exenatid i hladiny glukagonu. Snižuje sekreci glukagonu pouze v situaci jeho zvýšených hladin. V případě hypoglykémie u nemocného není sekrece glukagonu ani jeho účinek potlačen. Subkutánně podaný exenatid zpomaluje vyprazdňování žaludku. Za normální situace je zpomalení provokováno zvýšením glykémií, ale u diabetiků tato vazba často chybí. Přitom rychlost pasáže živin z žaludku do střeva je limitujícím faktorem glukózové absorpce. U diabetiků 2. typu, kdy nedochází ke zpomalení vyprazdňování žaludku vyvolanému hyperglykémií, dochází k významným zvýšením postprandiálních hladin krevního cukru. Podáním exenatidu se významně snižují postprandiální exkurze glykémií [1, 6–8, 11, 12].
v krvi vrátí do normálního rozmezí, sérová hladina inzulinu se vrací k bazální úrovni. Obdobně ovlivňuje exenatid i hladiny glukagonu. Snižuje sekreci glukagonu pouze v situaci jeho zvýšených hladin. V případě hypoglykémie u nemocného není sekrece glukagonu ani jeho účinek potlačen. Subkutánně podaný exenatid zpomaluje vyprazdňování žaludku. Za normální situace je zpomalení provokováno zvýšením glykémií, ale u diabetiků tato vazba často chybí. Přitom rychlost pasáže živin z žaludku do střeva je limitujícím faktorem glukózové absorpce. U diabetiků 2. typu, kdy nedochází ke zpomalení vyprazdňování žaludku vyvolanému hyperglykémií, dochází k významným zvýšením postprandiálních hladin krevního cukru. Podáním exenatidu se významně snižují postprandiální exkurze glykémií [1, 6–8, 11, 12].
Farmakokinetické vlastnosti
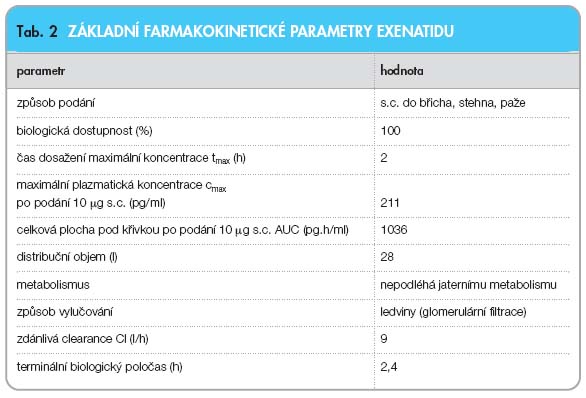 Biologická dostupnost exenatidu po subkutánním podání je obdobná při aplikaci do paže, břicha nebo hýždě. Medián dosažení maximální koncentrace v krvi je dvě hodiny. Plocha pod křivkou (AUC) se proporcionálně zvyšuje se zvyšující se dávkou exenatidu (5–10 µg). Distribuční objem exenatidu po subkutánním podání jednorázové dávky je 28 litrů. Vylučování exenatidu z organismu probíhá výlučně ledvinami, glomerulární filtrací s následnou proteolytickou inaktivací v tubulech. Terminální biologický poločas exenatidu je 2,4 hodiny (viz tab. 2) [8, 11, 12].
Biologická dostupnost exenatidu po subkutánním podání je obdobná při aplikaci do paže, břicha nebo hýždě. Medián dosažení maximální koncentrace v krvi je dvě hodiny. Plocha pod křivkou (AUC) se proporcionálně zvyšuje se zvyšující se dávkou exenatidu (5–10 µg). Distribuční objem exenatidu po subkutánním podání jednorázové dávky je 28 litrů. Vylučování exenatidu z organismu probíhá výlučně ledvinami, glomerulární filtrací s následnou proteolytickou inaktivací v tubulech. Terminální biologický poločas exenatidu je 2,4 hodiny (viz tab. 2) [8, 11, 12].
Klinické zkušenosti
U diabetiků 2. typu zajistil exenatid normalizaci kvality inzulinové sekrece (první i druhé fáze) v odpovědi na zvýšení glykémie podáním i.v. glukózy [13].Tři pivotní studie v rámci III. fáze klinického zkoušení (multicentrické, paralelní, randomizované, dvojitě, resp. trojitě slepé a placebem kontrolované), které trvaly 30 týdnů, přinesly velmi slibné výsledky. Exenatid byl v dávce 5 µg nebo 10 µg 2krát denně přidáván ke stávající léčbě sulfonylureovými deriváty nebo metforminem či ke kombinaci těchto antidiabetik (tab. 3). Kromě snížení koncentrace glykovaného hemoglobinu (HbA1c) o 0,8–1,0 absolutního procenta prokázal exenatid i pozitivní vliv na hmotnost (snížení o 1,5–3 kg při dávkování 10 µg 2krát denně) [14–17]. Otázku, zda pozitivní účinky exenatidu přetrvávají dlouhodobě, zodpověděla otevřená pozorování pacientů po ukončení studií fáze III. V otevřeném pozorování, které trvalo 52 týdnů a zahrnulo 222 pacientů, přetrvávalo snížení HbA1c a hmotnosti dosažené na konci randomizovaných studií [18]. V jiném otevřeném sledování 314 pacientů po dobu 52 týdnů bylo pozorováno významné snížení hladin triglyceridů, zvýšení HDL cholesterolu a snížení diastolického krevního tlaku neboli rizikových faktorů aterosklerózy [19, 20]. Zlepšení HbA1c, které bylo zaznamenáno v prvních 30 týdnech, přetrvalo nezměněno po dobu 3 let (-1,1 %). Vstupní hladiny HbA1c byly v průměru 8,2 (0,1) % a za 3 roky dosáhlo 46 % z 217 sledovaných pacientů cílových hladin 7 % (30 % nemocných v souboru mělo HbA1c < 6,5 %). Progresivně a statisticky významně se zvyšoval úbytek hmotnosti: v prvních 30 týdnech -2,4 kg a po třech letech -5,3 kg. Tato otevřená studie prodloužená na 3 roky prokázala přetrvávající zlepšení kompenzace diabetu a progresivní redukci hmotnosti [3, 20].
Další subanalýza výsledků prodloužené studie zjistila příznivé ovlivnění biomarkerů poškození jaterních funkcí. U nemocných s normální vstupní 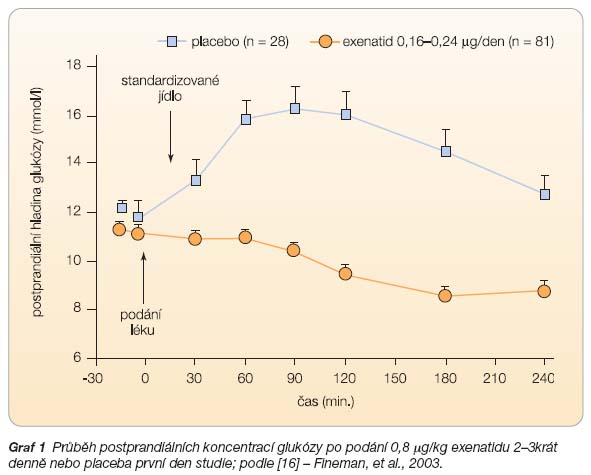 hladinou ALT nebyly zaznamenány žádné změny. U nemocných se zvýšenou hladinou ALT před zahájením léčby exenatidem došlo ke statisticky signifikantnímu snížení těchto hladin a 39 % nemocných dosáhlo po 82týdenní léčbě normálních hodnot ALT. Přitom vstupní hladiny ALT stejně jako změny hodnot při léčbě exenatidem minimálně korelovaly se změnami hmotnosti [21]. Můžeme tedy konstatovat, že dlouhodobá přídatná léčba exenatidem u diabetiků 2. typu léčených perorálními antidiabetiky významně zlepšuje kompenzaci diabetu a sledované rizikové faktory makroangiopatických komplikací. Exenatid významně snižuje postprandiální hyperglykémie u diabetiků 2. typu, které jsou často obtížně ovlivnitelné běžnou farmakologickou léčbou [16]. Přitom je všeobecně přijímáno signifikantní riziko postprandiálně zvýšených glykémií pro rozvoj aterosklerózy (graf 1).
hladinou ALT nebyly zaznamenány žádné změny. U nemocných se zvýšenou hladinou ALT před zahájením léčby exenatidem došlo ke statisticky signifikantnímu snížení těchto hladin a 39 % nemocných dosáhlo po 82týdenní léčbě normálních hodnot ALT. Přitom vstupní hladiny ALT stejně jako změny hodnot při léčbě exenatidem minimálně korelovaly se změnami hmotnosti [21]. Můžeme tedy konstatovat, že dlouhodobá přídatná léčba exenatidem u diabetiků 2. typu léčených perorálními antidiabetiky významně zlepšuje kompenzaci diabetu a sledované rizikové faktory makroangiopatických komplikací. Exenatid významně snižuje postprandiální hyperglykémie u diabetiků 2. typu, které jsou často obtížně ovlivnitelné běžnou farmakologickou léčbou [16]. Přitom je všeobecně přijímáno signifikantní riziko postprandiálně zvýšených glykémií pro rozvoj aterosklerózy (graf 1).
Po celé 3 roky trvání studie byl exenatid dobře tolerován, z vedlejších účinků byla nejčastější nauzea (jako v předchozích kratších studiích), která ale nedosáhla takového stupně, aby nemocní byli nuceni opustit studii.
V současné době není jediným požadavkem při léčbě perorálními antidiabetiky nebo inzulinem snížit hladiny krevního cukru, ale zároveň jde 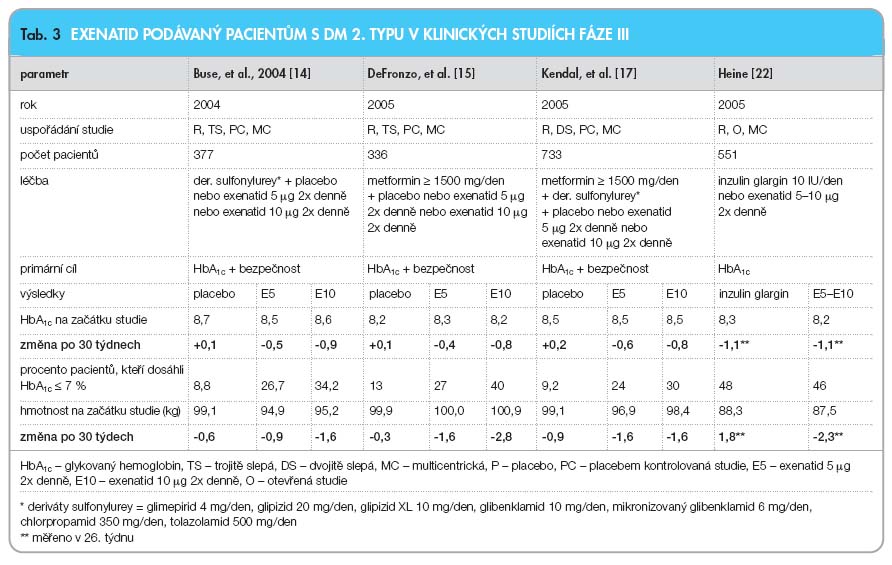 také o to pozitivně ovlivnit riziko kardiovaskulárních příhod u uživatelů těchto léčiv. Exenatid je sice krátkou dobu na trhu (v USA od roku 2005), ale i v tomto ohledu jsou prozatímní výsledky slibné. Ve výše zmíněné prodloužené studii se ukázalo, že zlepšení kardiovaskulárních rizikových faktorů bylo závislé na snížení hmotnosti při podávání exenatidu. Nemocní s největší redukcí své hmotnosti zaznamenali nejvýraznější snížení krevního tlaku, hladin triglyceridů a zvýšení hladiny HDL cholesterolu. Z klinického hlediska jsou jistě zajímavé také výsledky 2 studií, které srovnávaly úroveň hypoglykemizujícího vlivu exenatidu s inzulinem (glargin nebo biaspart). Dosažené snížení hladin glykémií a zlepšení hodnoty HbA1c
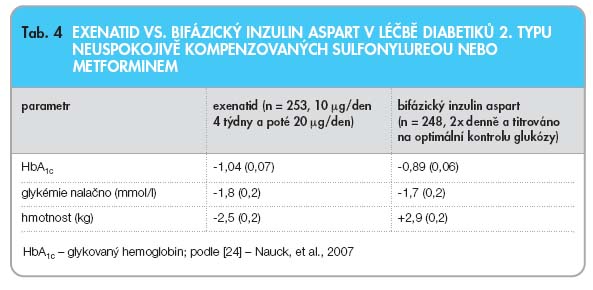
také o to pozitivně ovlivnit riziko kardiovaskulárních příhod u uživatelů těchto léčiv. Exenatid je sice krátkou dobu na trhu (v USA od roku 2005), ale i v tomto ohledu jsou prozatímní výsledky slibné. Ve výše zmíněné prodloužené studii se ukázalo, že zlepšení kardiovaskulárních rizikových faktorů bylo závislé na snížení hmotnosti při podávání exenatidu. Nemocní s největší redukcí své hmotnosti zaznamenali nejvýraznější snížení krevního tlaku, hladin triglyceridů a zvýšení hladiny HDL cholesterolu. Z klinického hlediska jsou jistě zajímavé také výsledky 2 studií, které srovnávaly úroveň hypoglykemizujícího vlivu exenatidu s inzulinem (glargin nebo biaspart). Dosažené snížení hladin glykémií a zlepšení hodnoty HbA1c 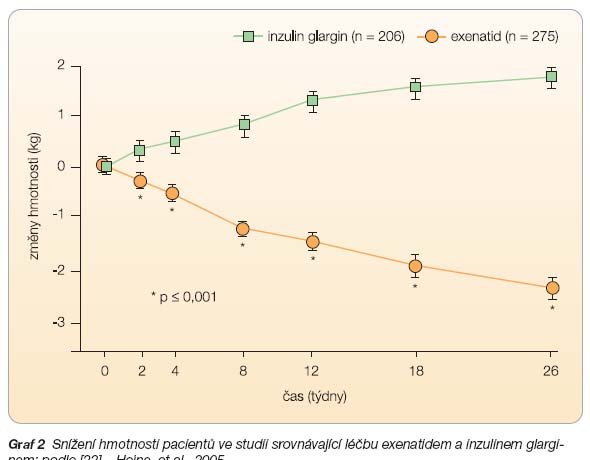 bylo u obou terapeutických přístupů srovnatelné. Po 26 týdnech podávání inzulinu glarginu nebo exenatidu se průměrné hodnoty HbA1c snížily o 1,1 % (viz tab. 3). Nicméně, zásadní rozdíl byl zaznamenán ve změnách hmotnosti. Nemocní, kteří dostávali inzulin glargin, přibrali během 26 týdnů 2–3 kg, zatímco nemocní užívající exenatid snížili svoji hmotnost průměrně o 1,8 kg (graf 2) [22, 23]. Změny v kompenzaci diabetu a hmotnosti při srovnání léčby exenatidem a bifázickým aspartem (inzulinový analog) ověřila otevřená studie s 501 diabetiky 2. typu trvající 52 týdnů [24]. Výsledky ukazuje tab. 4.
bylo u obou terapeutických přístupů srovnatelné. Po 26 týdnech podávání inzulinu glarginu nebo exenatidu se průměrné hodnoty HbA1c snížily o 1,1 % (viz tab. 3). Nicméně, zásadní rozdíl byl zaznamenán ve změnách hmotnosti. Nemocní, kteří dostávali inzulin glargin, přibrali během 26 týdnů 2–3 kg, zatímco nemocní užívající exenatid snížili svoji hmotnost průměrně o 1,8 kg (graf 2) [22, 23]. Změny v kompenzaci diabetu a hmotnosti při srovnání léčby exenatidem a bifázickým aspartem (inzulinový analog) ověřila otevřená studie s 501 diabetiky 2. typu trvající 52 týdnů [24]. Výsledky ukazuje tab. 4.
 Doplněná analýza výsledků studie porovnávající účinnost inzulinového analoga glarginu a exenatidu potvrdila, že ovlivnění glykémie nalačno bylo při obou léčebných přístupech obdobné. Rozdílné bylo ovlivnění glykémií postprandiálně. V porovnání s inzulinem glarginem byl exenatid spojen se signifikantním snížením exkurze glykémií 2 hodiny po jídle a s celodenními exkurzemi glykémií [25].
Doplněná analýza výsledků studie porovnávající účinnost inzulinového analoga glarginu a exenatidu potvrdila, že ovlivnění glykémie nalačno bylo při obou léčebných přístupech obdobné. Rozdílné bylo ovlivnění glykémií postprandiálně. V porovnání s inzulinem glarginem byl exenatid spojen se signifikantním snížením exkurze glykémií 2 hodiny po jídle a s celodenními exkurzemi glykémií [25].
Zařazení do současné palety léčiv
 Exenatid je antidiabetikum snižující zvýšené hladiny krevního cukru u diabetiků 2. typu. Neovlivňuje primárně inzulinovou rezistenci, ale zlepšuje sekreční činnost b-buněk pankreatických ostrůvků zároveň s potlačením zvýšené produkce glukagonu v a-buňkách. Předností exenatidu je jeho pozitivní ovlivnění hmotnosti především u obézních nemocných. Předběžné výsledky poukazují na potenciál exenatidu snižovat riziko kardiovaskulárních komplikací včetně snížení postprandiálních glykémií, koncentrace volných mastných kyselin a triacylglycerolů. Celkově příznivý vliv exenatidu sumarizuje tab. 5. Nemocní s DM 2. typu trpí deficiencí inkretinového systému, a proto je léčebné zvýšení hladin inzulinotropních hormonů populárním a slibným terapeutickým cílem [12, 26–33]
Exenatid je antidiabetikum snižující zvýšené hladiny krevního cukru u diabetiků 2. typu. Neovlivňuje primárně inzulinovou rezistenci, ale zlepšuje sekreční činnost b-buněk pankreatických ostrůvků zároveň s potlačením zvýšené produkce glukagonu v a-buňkách. Předností exenatidu je jeho pozitivní ovlivnění hmotnosti především u obézních nemocných. Předběžné výsledky poukazují na potenciál exenatidu snižovat riziko kardiovaskulárních komplikací včetně snížení postprandiálních glykémií, koncentrace volných mastných kyselin a triacylglycerolů. Celkově příznivý vliv exenatidu sumarizuje tab. 5. Nemocní s DM 2. typu trpí deficiencí inkretinového systému, a proto je léčebné zvýšení hladin inzulinotropních hormonů populárním a slibným terapeutickým cílem [12, 26–33]
Indikace
Exenatid je indikován k léčbě diabetu mellitu 2. typu v kombinaci s metforminem či s deriváty sulfonylurey nebo jako přídatná léčba do již stávající kombinace metformin + sulfonylurea u pacientů, u nichž není dosaženo uspokojivé kompenzace diabetu při podávání maximálních tolerovaných dávek perorálních přípravků.
Kontraindikace
Absolutní kontraindikací léčby je přecitlivělost na exenatid nebo na kteroukoliv pomocnou látku tohoto přípravku.
Léčba exenatidem není doporučována nemocným se závažným renálním selháváním a s těžkými gastrointestinálními chorobami. Exenatid by neměl být použit u nemocných s diabetem mellitem 1. typu nebo u diabetiků 2. typu, kteří pro selhání funkce b-buněk vyžadují léčbu inzulinem.
Nežádoucí účinky
Nejčastějšími vedlejšími účinky léčby exenatidem jsou gastrointestinální problémy. Na prvním místě je nutno zmínit nauzeu (40–50 % pacientů). Dalšími nežádoucími účinky jsou zřídka se vyskytující zvracení nebo průjmy. Tyto potíže se objevují především v úvodních dnech až týdnech léčby a postupně se zmírňují (nebo vymizí). Výjimečně byly důvodem k přerušení léčby. V méně než 10 % se přechodně vyskytly neurčité bolesti břicha, abdominální distenze či dyspepsie.Hypoglykémie mírnějšího stupně byly zaznamenány pouze u nemocných, kteří užívali během léčby exenatidem původní perorální antidiabetika sulfonylureového typu. U 40–50 % nemocných, kteří dostávali exenatid, se vyvinuly protilátky s velmi slabou afinitou a v nízkých titrech. Tvorba těchto protilátek nebyla v žádném vztahu k antidiabetickému působení exenatidu.
Lékové interakce
Mezi účinky exenatidu, které se podílejí na snížení hyperglykémií po jídle, je i zpomalení vyprazdňování žaludku. To může ovlivnit rozsah a rychlost absorpce perorálně podávaných léčiv. Jestliže musí být předepsané léky podávány společně s jídlem, měli by je nemocní užívat s jídlem, kdy není podáván exenatid. Antibiotika by měli nemocní užívat alespoň 1 hodinu před aplikací exenatidu. Během zahájení léčby exenatidem a zvyšování dávky by měla být u pacientů užívajících warfarin a/nebo kumarinové deriváty hodnota INR pečlivě monitorována.
Těhotenství a kojení
V současné době nejsou k dispozici informace o možnosti bezpečného podávání exenatidu těhotným ženám, a proto není tato léčba po dobu gravidity povolena. Není známo, zda je exenatid vylučován do lidského mateřského mléka. Kojící matky by si neměly exenatid aplikovat.
Dávkování
Podávání exenatidu by mělo být zahájeno dávkou 5 µg 2krát denně alespoň po dobu jednoho měsíce, aby pacient léčbu lépe snášel. Potom může být dávka zvýšena na 10 µg 2krát denně pro další zlepšení kontroly glykémie. Dávky vyšší než 10 µg 2krát denně se nedoporučují. Exenatid může být podán v libovolnou dobu v časovém intervalu 60 minut před ranním a večerním jídlem (nebo před jakýmikoli dvěma hlavními jídly během dne, oddělenými intervalem alespoň 6 hodin). Exenatid nesmí být podán po jídle. Jestliže je podání dávky opomenuto, léčba by měla pokračovat až s následujícím jídlem. Jednotlivá dávka by měla být podána ve formě subkutánní injekce do stehna, břišní oblasti nebo do horní části paže. Exenatid přidaný ke stávající léčbě metforminem nevyžaduje změnu dávkování metforminu. Jestliže je exenatid přidán k derivátům sulfonylurey, může vyvstat potřeba snížit dávku derivátů sulfonylurey pro riziko hypoglykémie.
Balení
Exenatid (léčivý přípravek Byetta, výrobce Eli Lilly) je pro okamžitou subkutánní aplikaci dostupný v předplněném peru (s dávkami buď 5 µg nebo 10 µg exenatidu). Jedno předplněné pero obsahuje 60 dávek sterilního roztoku s konzervačními přísadami. Jedno balení obsahuje 1 nebo 3 pera (tab. 6).
Seznam použité literatury
- [1] Amori RE, Lau J, Pitas AG. Efficacy and safety of incretin therapy in type 2 diabetes. JAMA 2007; 298: 194–206.
- [2] Perušičová J. Nové léky pro diabetiky 2. typu do klinické praxe? Zdravotnické noviny – Lékařské listy 2007; 4: 18–20.
- [3] Perušičová J. Nová strategie léčby nemocných s diabetes mellitus 2. typu – inkretinový systém. In: Diabetologie 2007, edit. J. Perušičová; 117–133, Triton, 2007.
- [4] Agerso/ H, Jensen LB, Elbro/nd B, et al. The pharmacokinetics, pharmacodynamics, safety and tolerability of NN2211, a new long-acting GLP-1 derivative, in healthy men. Diabetologia 2002; 45: 195–202.
- [5] Byetta. P&T QUIK Reports. July 2005. Available at: http://www.thomsonhc.com. Accessed March 14, 2006.
- [6] Drucker DJ. Biological actions and therapeutic potential of the glucagon-like peptides. Gastroenterology 2002; 122: 531–544.
- [7] Iltz JL, Baker DE, Setter SM, et al. Exenatide: An incretin mimetic for the treatment of type 2 diabetes mellitus. Clin Ther 2006; 28: 652–664.
- [8] Keating GM. Exenatide. Drugs 2005; 65: 1681–1692.
- [9] Kolterman OG, Buse JB, Fineman MS, et al. Synthetic exendin-4 (exenatide) significantly reduces postprandial and fasting plasma glucose in subjects with type 2 diabetes. J Clin Endocrinol Metab 2003; 88: 3082–3089.
- [10] SPC Byetta – Dostupné z: www.emea.europa.eu. Navštíveno: 22. 2. 2008.
- [11] Bray GM. Exenatide. Am J Health Syst Pharm 2006; 63: 411–418.
- [12] Cvetkovič RS, Plosker GL. Exenatide. a review of its use in patients with type 2 diabetes mellitus (as an adjunct to merformin and/or sulfonylurea). Drugs 2007; 67: 936–949.
- [13] Fehse F, Trautman M, Holst JJ, et al. Exenatide augments first and second phase insulin secretion in response to intravenous glucose in subjects with type 2 diabetes. J Clin Endocrinol Metab 2005; 90: 5991–5997.
- [14] Buse JB, Henry RR, Han J, et al., for the Exenatide-113 Clinical Study Group. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in sulphonylurea-treated patients with type 2 diabetes. Diabetes Care 2004; 27: 2628–2635.
- [15] DeFronzo RA, Ratner RE, Han J, et al. Effects of exenatide (exendin-4) on glycemic control and weight over 30 weeks in metformin treated patients with type 2 diabetes. Diabetes Care 2005; 28: 1092–1100.
- [16] Fineman MS, Bicsak TA, Shen LZ, et al. Effect of glycemic control of exenatide (synthetic exendin 4) additive to existing metformin and/or sulphonylurea treatment in patients with type 2 diabetes. Diabetes Care 2003; 26: 2370–2377.
- [17] Kendall DM, Riddle MC, Rosenstock J, et al. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and sulphonylurea. Diabetes Care 2005; 28: 1083–1091.
- [18] Riddle MC, Henry RR, Poon TH, et al. Exenatide elicits sustained glycaemic control and progressive reduction of body weight in patients with type 2 diabetes inadequately controlled by sulphonylureas with or without metformin. Diabetes Metab Res Rev 2006; 22: 483–491.
- [19] Blonde L, Klein EJ, Han J, et al. Interim analysis of the effects of exenatide treatment on A1C, weight and cardiovascular risk factors over 82 weeks in 314 overweight patients with type 2 diabetes. Diabetes Obes Metab 2006; 8: 436–447.
- [20] Buse J, Macconell L, Stonehouse A, et al. Exenatide maintained glycemic control with associated weight reduction over three years in patients with type 2 diabetes. 67th ADA scientific sessions, abstract A-1982.
- [21] Buse JB, Klonoff DC, Nielsen LL, et al. Metabolic effects of two years of exenatide treatment on diabetes, obesity and hepatic biomarkers in patients with type 2 diabetes: an interim analysis of data from the open-label, uncontrolled extension of three double-blind, placebo controlled trials. Clin Ther 2007; 29: 139–153.
- [22] Heine RJ, VanGall LF, Johns D, et al. Exenatide versus insulin glargine in patients with suboptimally controlled type 2 diabetes: a randomized trial. Ann Intern Med 2005; 143: 559–569.
- [23] Secnik BK, Matza LS, Oglesby A, et al. Patient-reported outcomes in a trial of exenatide and insu lin glargine for the treatment of type 2 diabetes. Health Qual Life Outcomes 2006; 11: 80–85.
- [24] Nauck MA, Duran S, Kim D, et al. A comparison of twice daily exenatide and biphasic insulin aspart in patients with type 2 diabetes who were suboptimally controlled with sulfonylurea and metformin: a non-inferiority study. Diabetologia 2007; 50: 259–267.
- [25] Barnett AH, Burger J, Johns D, et al. Tolerability and efficacy of exenatide and titrated insulin glargine in adult patients with type 2 diabetes previously uncontrolled with metformin or a sulfonylurea: a multinational, randomized, open-label, two-period, crossover noninferiority trial. Clin Ther 2007; 29: 2333–2348.
- [26] Buteau J, El-Assaad W, Rhodes CJ, et al. Glucagon-like peptide-1 prevents beta cell glucolipotoxicity. Diabetologia 2004; 47: 806–815.
- [27] Doggrell SA. Recent evidence of sustained benefit with exenatide in type 2 evidence. Expert Opin Pharmacother 2006; 7: 2003–2006.
- [28] Gedulin BR, Nikoulina SE, Smith PA, et al. Exenatide (exendin 4) improves insulin sensitivity and b-cell mass in insulin resistant obese fa/fa Ucker rats independent of glycemia and body weight. Endocrinology 2005; 146: 2069–2076.
- [29] Li L, El-Kholy W, Rhodes CJ, et al. Glucagon-like peptide-1 protects beta cells from cytokine-induced apoptosis and necrosis: role of protein kinase B. Diabetologia 2005; 48: 1339–1349.
- [30] Meier JJ, Gethmann A, Goetze, O, et al. Glucagon-like peptide 1 (GLP-1) abolishes the postprandial rise in triglyceride concentrations and lowers free fatty acid levels in humans. Diabetologia 2006; 49: 452–458.
- [31] Ratner RE, Maggs D, Nielsen LL, et al. Long term effects of exenatide therapy over 82 weeks on glycemic control and weight in over-weight metformin-treated patients with type 2 diabetes mellitus. Diabetes Obes Metab 2006; 8: 419–428.
- [32] Visbo/ll T, Krarup T, Deacon CF, et al. Reduced postprandial concentrations of intact biologically active glucagons-like peptide 1 in type 2 diabetic patients. Diabetes 2001; 50: 609–613.
- [33] Visbo/ll T, Holst JJ. Incretins, insulin secretion and type 2 diabetes mellitus. Diabetologia 2004; 47: 357–366.