Febuxostat
Febuxostat je silný, nepurinový selektivní inhibitor enzymu xanthinoxidázy. Tento enzym katalyzuje přeměnu hypoxanthinu a xanthinu na kyselinu močovou, konečný produkt degradace purinových nukleotidů u člověka. Hyperurikemie je patologický stav zvýšené hladiny kyseliny močové v séru. Příčinou hyperurikemie může být zvýšená produkce kyseliny močové a/nebo její snížené vylučování z organismu. Klinickým důsledkem hyperurikemie může být dna, metabolická porucha spojená s ukládáním krystalů natrium urátu v různých tkáních. Febuxostat je indikován k léčbě chronické hyperurikemie u pacientů s chronickou tofózní dnavou artritidou, tedy u stavů, kdy již došlo k vytvoření urátových depozit v různých tkáních. Zkušenosti z klinických studií prokazují superioritu febuxostatu v dávce 80 mg a 120 mg podávané jednou denně v dosažení a udržení hladiny kyseliny močové v séru pod hodnotu 6 mg/dl (360 μmol/l) v porovnání s allopurinolem. Léčba febuxostatem je indikována zejména u pacientů, u kterých léčba allopurinolem nevedla k dostatečnému snížení hladiny kyseliny močové v séru nebo u kterých vedla tato léčba k výskytu nežádoucích příhod nebo kde léčba byla kontraindikována. Léčba hyperurikemie febuxostatem je vhodná i u pacientů s mírnou až středně těžkou ledvinnou nedostatečností a též u starších pacientů.
Úvod
Hyperurikemie je patologický stav zvýšené hladiny kyseliny močové v séru. Příčinou může být zvýšená produkce kyseliny močové a/nebo její snížené vylučování z organismu. Klinickým důsledkem hyper-urikemie může být dna, metabolická porucha spojená s ukládáním krystalů natrium urátu v různých tkáních. Dnavá artritida je klinický revmatologický syndrom, který vzniká u jedinců s hyperurikemií a představuje zánětlivé postižení pohybového aparátu spojené s přítomností krystalů natrium urátu. Dnavá artritida postihuje 1–2 % dospělé populace ve vyspělých státech a její výskyt v posledních desetiletích narůstá [1]. Je nejčastější příčinou artritidy u mužů. S narůstajícím věkem její výskyt stoupá. Hyperurikemie a dna, spojená se zvýšeným výskytem metabolického syndromu a kardiovaskulárních chorob, představují závažný medicínský problém.
Farmakologická skupina
Na český trh přichází nové léčivo určené k léčbě hyperurikemie – febuxostat. Je indikován zejména u pacientů s chronickou hyperurikemií spojenou s klinickou manifestací dny, především s projevy chronické tofózní dnavé artritidy, tedy u stavů, kdy již došlo k vytvoření urátových depozit [2]. Febuxostat je řazen do ATC skupiny léků potlačujících tvorbu kyseliny močové (M04AA03), spolu s jediným zástupcem této skupiny na českém trhu allopurinolem.
Chemické a fyzikální vlastnosti
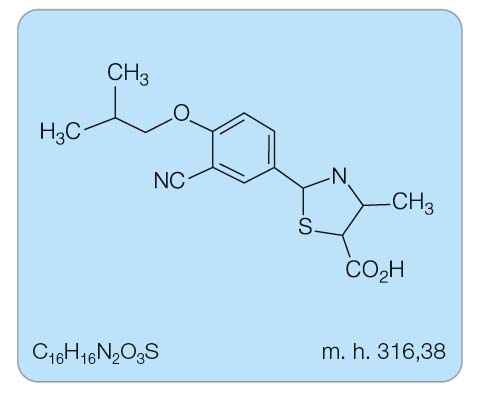 Febuxostat je 2-arylthiazolový derivát. Jeho chemický název je kyselina 2-(3-cyano-4-(2-methyl-propoxy)phenyl)-4-methylthiazol-5-karboxylová (obr. 1).
Febuxostat je 2-arylthiazolový derivát. Jeho chemický název je kyselina 2-(3-cyano-4-(2-methyl-propoxy)phenyl)-4-methylthiazol-5-karboxylová (obr. 1).
Sumární vzorec: C16H16N2O3S
Molekulová hmotnost: 316,38 [3]
Mechanismus účinku
U člověka je kyselina močová cílovým produktem metabolismu purinů. Vytváří se v kaskádě hypoxanthin Æ xanthin Æ kyselina močová. Oba kroky ve výše uvedeném metabolickém procesu jsou katalyzovány enzymem xanthinoxidázou (XO) (obr. 2). Febuxostat je 2-arylthiazolový derivát, který dosahuje svého terapeutického účinku, tedy snížení hladiny kyseliny močové v séru, selektivní inhibicí enzymu XO. Febuxostat je silný, nepurinový selektivní inhibitor XO s hodnotou Ki in vitro nižší než 1 nmol. Bylo prokázáno, že silně inhibuje jak oxidované, tak redukované formy XO, zatímco 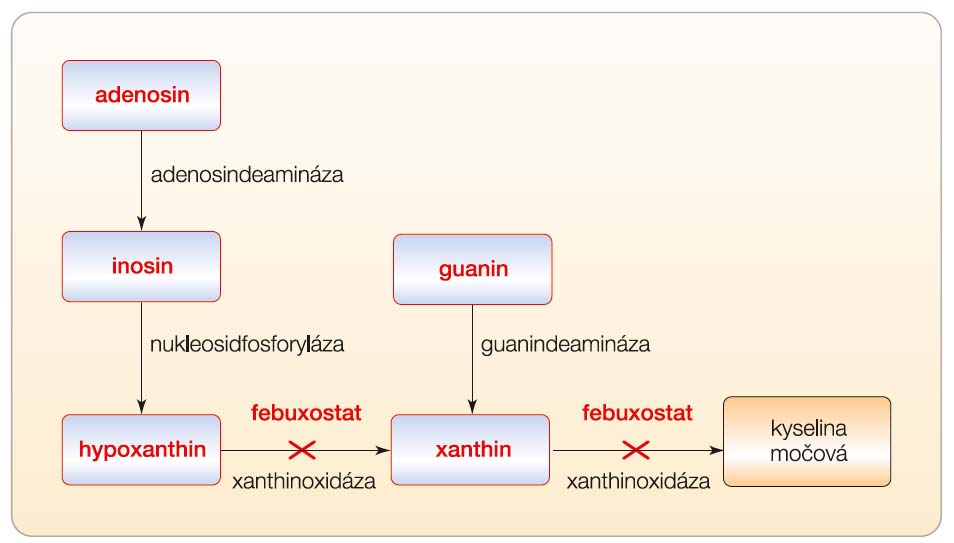 aktivní metabolit allopurinolu, oxypurinol, inhibuje pouze redukovanou formu XO [4, 5]. Febuxostat je tedy ve srovnání s allopurinolem účinnějším a selektivnějším inhibitorem XO. Při terapeutických koncentracích neinhibuje další enzymy účastnící se metabolismu purinů a pyrimidinů, jako jsou guaninde-amináza, hypoxanthin guaninfosforibosyl-transferáza, orotát fosforibosyltransferáza, orotidin monofosfátdekarboxyláza nebo purin nukleosidfosforyláza.
aktivní metabolit allopurinolu, oxypurinol, inhibuje pouze redukovanou formu XO [4, 5]. Febuxostat je tedy ve srovnání s allopurinolem účinnějším a selektivnějším inhibitorem XO. Při terapeutických koncentracích neinhibuje další enzymy účastnící se metabolismu purinů a pyrimidinů, jako jsou guaninde-amináza, hypoxanthin guaninfosforibosyl-transferáza, orotát fosforibosyltransferáza, orotidin monofosfátdekarboxyláza nebo purin nukleosidfosforyláza.
Farmakokinetické vlastnosti
U zdravých subjektů se maximální plazmatické koncentrace (cmax) a plocha pod křivkou koncentrace a času (AUC) febuxostatu zvyšují úměrně s dávkou po jednorázových a opakovaných podáních 10–120 mg [2]. U dávek 120 mg a 300 mg bylo pozorováno vyšší než úměrné zvý-šení AUC. Pokud jsou dávky 10–240 mg podávány každých 24 hodin, nedochází k žádné výrazné kumulaci febuxostatu. Febuxostat má zdánlivý eliminační poločas (t1/2) přibližně 5–8 hodin.
Populační farmakokinetické/farmakodynamické analýzy byly provedeny u 211 pacientů s hyperurikemií a dnou léčených febuxostatem v dávce 40–240 mg denně. Farmakokinetické parametry febuxostatu jsou podle odhadů z těchto analýz obecně shodné s parametry získanými u zdravých subjektů, což ukazuje na to, že zdraví jedinci jsou reprezentativní skupinou pro farmakokinetické/farmakodynamické hodnocení febuxostatu u populace pacientů s hyperurikemií a dnou.
Absorpce
Febuxostat se rychle (tmax 1,0–1,5 h) a dobře vstřebává (minimálně 84 %). Po jednorázové nebo opakované perorální dávce 80 mg a 120 mg jednou denně do-sahuje cmax asi 2,8–3,2 µg/ml, respektive 5,0–5,3 µg/ml.
Po opakovaných perorálních dávkách 80 mg jednou denně nebo po jednorázové dávce 120 mg podané spolu s jídlem s vysokým obsahem tuků došlo ke 49%, respektive ke 38% snížení cmax a k 18% a 16% snížení AUC. U testovaných případů však nebyla pozorována žádná klinicky významná změna v míře snížení sérové koncentrace kyseliny močové. Febuxostat tedy může být užíván nezávisle na jídle.
Distribuce
Zdánlivý ustálený distribuční objem (Vdss/F) febuxostatu se pohybuje od 29 l do 75 l po perorálních dávkách 10–300 mg. Vazba na plazmatické bílkoviny, primárně na albumin, je asi 99,2 % a je konstantní v koncentračním rozmezí dosaženém při podávání dávek 80 mg a 120 mg denně.
Metabolismus
Febuxostat se rozsáhle metabolizuje konjugací v enzymatickém systému uridin difosfát glukuronosyltransferázy (UDPGT) a oxidací v systému cytochromu P450 (CYP). Byly identifikovány čtyři farmakologicky aktivní hydroxylové metabolity, z nichž tři se vyskytují v plazmě u člověka. Studie in vitro s humánními jaterními mikrosomy ukázaly, že tyto oxidativní metabolity se tvořily primárně v systémech CYP1A1, CP1A2, CYP2C8 nebo CYP2C9 a febuxostat glukuronid se tvořil primárně v systémech UGT 1A1, 1A8 a 1A9.
Eliminace
Febuxostat se vylučuje játry i ledvinami. Po perorálním podání 14C-značeného febuxostatu v dávce 80 mg se asi 49 % dávky objevilo v moči jako: nezměněný febuxostat (3 %), acylglukuronid účinné látky (30 %), jeho známé oxidativní metabolity a jejich konjugáty (13 %) a další neznámé metabolity (3 %). Kromě vylučování do moči se asi 45 % dávky objevilo ve stolici jako: nezměněný febuxostat (12 %), acylglukuronid účinné látky (1 %), jeho známé oxidativní metabolity a jejich konjugáty (25 %) a další neznámé metabolity (7 %).
Farmakokinetické vlastnosti u specifických populací
Po opakovaných dávkách 80 mg febuxostatu u pacientů s mírnou, středně závažnou nebo závažnou renální insuficiencí se cmax febuxostatu nezměnila v porovnání se subjekty s normální funkcí ledvin. Průměrná celková AUC se zvýšila asi 1,8krát, ze 7,5 mg/h/ml ve skupině s normální funkcí ledvin na 13,2 µg/h/ml ve skupině se závažnou renální insuficiencí; cmax a AUC účinných metabolitů se zvýšily 2–4násobně. U pacientů s mírnou až středně závažnou poruchou funkce ledvin však není nutná žádná úprava dávky.
Po opakovaných dávkách 80 mg febuxostatu u pacientů s mírným nebo středně závažným poškozením funkce jater (Childovo-Pughovo skóre A, B) se cmax a AUC febuxostatu a jeho metabolitů významně nezměnily ve srovnání se subjekty s normální funkcí jater.
Nebyly pozorovány žádné významné změny cmax a AUC febuxostatu nebo jeho metabolitů po jeho opakovaném perorálním podání starším pacientům ve srovnání s mladšími zdravými subjekty. Rovněž nebyly pozorovány významné rozdíly ve farmakokinetických parametrech při podání febuxostatu ženám nebo mužům [6].
Klinické zkušenosti
Účinnost febuxostatu byla prokázána ve třech pilotních studiích fáze III (APEX, FACT a CONFIRMS), které byly provedeny u 4101 pacientů s hyperurikemií a dnou [7–9]. Ve všech zmíněných studiích prokázal febuxostat lepší schopnost snižovat a udržovat sérové hladiny kyseliny močové ve srovnání s allopurinolem. Primárním sledovaným parametrem účinnosti ve studiích APEX a FACT byl podíl pacientů, jejichž sérové hladiny kyseliny močové byly za poslední tři měsíce studie nižší než 6,0 mg/dl (360 mmol/l). Ve studii CONFIRMS byl primárně sledovaným cílem účinnosti podíl pacientů, kteří měli při závěrečné návštěvě sérové hladiny kyseliny močové < 6,0 mg/dl (360 µmol/l).
APEX byla randomizovaná, dvojitě zaslepená, multicentrická, allopurinolem a placebem kontrolovaná studie sledující účinnost febuxostatu s trváním 28 týdnů [7]. Do studie bylo randomizováno celkem 1072 pacientů – 134 pacientů dostávalo placebo, 267 dostávalo febuxostat 80 mg denně, 269 dostávalo febuxostat 120 mg denně a 134 pacientů dostávalo febuxo-stat 240 mg denně; 258 pacientů s výchozí hladinou kreatininu v séru ≤ 133 mmol/l bylo léčeno allopurinolem 300 mg denně a 10 pacientů s výchozí hladinou kreatininu v séru > 133 mmol/l a ≤ 177 mmol/l bylo léčeno 100 mg allopurinolu denně. Bezpečnostní hodnocená dávka v této studii byla 2krát vyšší, než je doporučená nejvyšší dávka, tedy 240 mg febuxostatu.![Průměrné sérové hladiny kyseliny močové v klinických studiích fáze III (APEX a FACT); podle [7, 8] – Schumacher, et al., 2008, Becker, et al., 2005.](https://www.remedia.cz/photo-a-28781---.jpg) Studie APEX prokázala, že febuxostat v denních dávkách 80 mg a 120 mg je ve srovnání s allopurinolem 300 mg/100 mg významně účinnější ve snížení sérové hladiny kyseliny močové pod hodnotu 6 mg/dl (360 mmol/l; graf 1, tab. 1). Studie APEX dále hodnotila účinnost febuxostatu u 40 pa-cientů s poruchou funkce ledvin (výchozí sérová hladina kreatininu > 133 mmol/l a ≤ 177 mmol/l). U pacientů s poruchou funkce ledvin, kteří byli randomizováni do léčebné větve s allopurinolem, byla nejvyšší dávka snížena na 100 mg denně. Primárně sledovaný parametr účinnosti byl dosažen u 44 % pacientů (užívajících febuxostat 80 mg denně), u 46 % pacientů (febuxo-stat v dávce 120 mg denně) a u 60 % pa-cientů (febuxostat 240 mg d
Studie APEX prokázala, že febuxostat v denních dávkách 80 mg a 120 mg je ve srovnání s allopurinolem 300 mg/100 mg významně účinnější ve snížení sérové hladiny kyseliny močové pod hodnotu 6 mg/dl (360 mmol/l; graf 1, tab. 1). Studie APEX dále hodnotila účinnost febuxostatu u 40 pa-cientů s poruchou funkce ledvin (výchozí sérová hladina kreatininu > 133 mmol/l a ≤ 177 mmol/l). U pacientů s poruchou funkce ledvin, kteří byli randomizováni do léčebné větve s allopurinolem, byla nejvyšší dávka snížena na 100 mg denně. Primárně sledovaný parametr účinnosti byl dosažen u 44 % pacientů (užívajících febuxostat 80 mg denně), u 46 % pacientů (febuxo-stat v dávce 120 mg denně) a u 60 % pa-cientů (febuxostat 240 mg d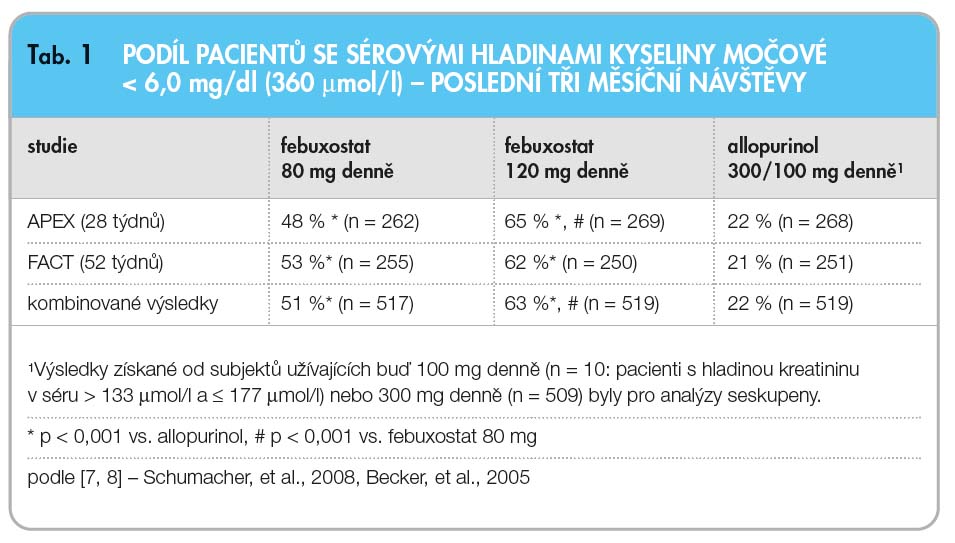 enně) ve srovnání s 0 % pacientů ve skupinách, kde byl podáván allopurinol v dávce 100 mg denně, a v placebové skupině (graf 2). Nebyly pozorovány žádné klinicky významné rozdíly v podílu pacientů, kteří dosáhli cílového snížení koncentrace kyseliny močové v séru, mezi pacienty bez renální insuficience a s renální insuficiencí (58 % vs. 55 %).
enně) ve srovnání s 0 % pacientů ve skupinách, kde byl podáván allopurinol v dávce 100 mg denně, a v placebové skupině (graf 2). Nebyly pozorovány žádné klinicky významné rozdíly v podílu pacientů, kteří dosáhli cílového snížení koncentrace kyseliny močové v séru, mezi pacienty bez renální insuficience a s renální insuficiencí (58 % vs. 55 %).
![Studie APEX – podíl pacientů s renální insuficiencí (sérový kreatinin v rozmezí 133–177 μmol/l), kteří měli při posledních třech měsíčních návštěvách hladinu kyseliny močové v séru < 6,0 mg/dl (< 360 μmol/l); podle [7] – Schumacher, et al., 2008.](https://www.remedia.cz/photo-a-28783---.jpg)
Během 8týdenního období profylaxe vyžadovalo léčbu akutních dnavých záchvatů vyšší procento pacientů (36 %) ve skupině léčené febuxostatem 120 mg než ve skupině léčené febuxostatem 80 mg (28 %), allopurinolem 300 mg (23 %) nebo placebem (20 %). Výskyt záchvatů akutní dnavé artritidy se po období profylaxe zvýšil a postupně s časem klesal. Mezi 8. a 28. týdnem bylo pro dnavé záchvaty léčeno 46–55 % subjektů. Během posledních 4 týdnů studie (24.–28. týden) byly dnavé záchvaty pozorovány u 15 % (febuxo-stat 80 mg a 120 mg), u 14 % (allopurinol300 mg) a u 20 % (placebo) pacientů. FACT byla randomizovaná, dvojitě zaslepená, multicentrická, allopurinolem kontrolovaná 52týdenní studie, do které bylo randomizováno 760 pacientů: jedna skupina užívala febuxostat 80 mg denně (n = 256), další febuxostat v dávce 120 mg denně (n = 251), nebo allopurinol 300 mg denně (n = 253) [8]. Výsledky studie rovněž prokázaly statisticky významnou superioritu obou dávek febuxostatu (80 mg a 120 mg denně) oproti allopurinolu 300 mg denně ve snížení a udržení hladiny kyseliny mo-čové v séru nižší než 6 mg/dl (360 mmol/l; graf 1, tab. 1).
![Kombinovaná data z klinických studií fáze III (APEX a FACT) – podíl pacientů se vstupní hladinou kyseliny močové v séru ≥ 10,0 mg/dl (≥ 600 μmol/l) kteří při posledních třech měsíčních návštěvách dosáhli hladiny kyseliny močové v séru < 6,0 mg/dl (< 360 μmol/l); podle [7, 8] – Schumacher, et al., 2008, Becker, et al., 2005.](https://www.remedia.cz/photo-a-28784---.jpg) Asi 40 % pacientů (ve studiích APEX a FACT) mělo výchozí hladinu kyseliny mo-čové v séru ≥ 10 mg/dl (600 mmol/l). V této podskupině dosáhl febuxostat primárního cílového ukazatele účinnosti u 41 % pa-cientů (při dávkování 80 mg denně), u 48 % (120 mg denně) a u 66 % pacientů (240 mg denně) ve srovnání s 9 % pacientů ve skupině s allopurinolem podávaným v dávce 300 mg a 100 mg denně a oproti 0 % pa-cientů ve skupině placeba (graf 3).
Asi 40 % pacientů (ve studiích APEX a FACT) mělo výchozí hladinu kyseliny mo-čové v séru ≥ 10 mg/dl (600 mmol/l). V této podskupině dosáhl febuxostat primárního cílového ukazatele účinnosti u 41 % pa-cientů (při dávkování 80 mg denně), u 48 % (120 mg denně) a u 66 % pacientů (240 mg denně) ve srovnání s 9 % pacientů ve skupině s allopurinolem podávaným v dávce 300 mg a 100 mg denně a oproti 0 % pa-cientů ve skupině placeba (graf 3).
Ve studii FACT během 8týdenního období profylaxe vyžadovalo léčbu akutních dnavých záchvatů vyšší procento pacientů (36 %) ve skupině léčené febuxostatem v dávce 120 mg než ve skupině léčené febuxostatem 80 mg (22 %) a ve skupině léčené allopurinolem 300 mg (21 %). Po 8týdenním období profylaxe se výskyt záchvatů akutní dnavé artritidy rovněž zvýšil a poté postupně s časem klesal. V 8.–52. týdnu studie bylo pro dnavé záchvaty léčeno 64 % (při dávce febuxo-statu 80 mg), 70 % (febuxostat 120 mg) a 64 % (allopurinol) pacientů. Během posledních 4 týdnů studie (49.–52. týden) byly akutní dnavé záchvaty pozorovány u 6–8 % (febuxostat 80 mg a 120 mg) a u 11 % (allopurinol 300 mg) pacientů.
Studie dále hodnotila velikost vybraného dnavého tofu v průběhu terapie febuxostatem a allopurinolem. Medián hodnot zmenšení velikosti vybraného dnavého tofu dosahoval 83 % a 66 % u pacientů léčených febuxostatem 80 mg, respektive 120 mg, a 50 % u pacientů léčených allopurinolem. K výraznější redukci velikosti dnavých tofů přitom docházelo u pacientů, kteří dosáhli nižší cílové hladiny kyseliny močové v séru.
CONFIRMS byla randomizovaná, kontrolovaná 26týdenní studie fáze III, jejímž cílem bylo zhodnotit bezpečnost a účinnost 40 mg a 80 mg febuxostatu podávaného jednou denně v porovnání s 300 mg nebo 200 mg allopurinolu, který byl podáván denně pacientům s dnou a hyperurikemií [9]. Do studie bylo randomizováno 2269 pa-cientů užívajících: febuxostat 40 mg jednou denně (n = 757), febuxostat 80 mg jednou denně (n = 756) nebo allopurinol 300/200 mg jednou denně (n = 756). Nejméně 65 % pacientů zařazených do studie mělo mírné až střední poškození ledvinných funkcí (clearance kreatininu 30–89 ml/min). Po dobu 26 týdnů byla ve studii povinně podávána profylaktická léčba záchvatů akutní dnavé artritidy. Podíl pacientů, kteří při závěrečné návštěvě měli sérové hladiny kyseliny močové < 6,0 mg/dl (360 mmol/l), činil 45 % při léčbě dávkou 40 mg febuxostatu, 67 % při podávání dávky 80 mg febuxostatu a 42 % u pacientů léčených allopurinolem v dávce 300/200 mg jednou denně.
Ve studii CONFIRMS byla prospektivně definována podskupina pacientů s dnou a poškozením ledvinných funkcí, která ukázala, že u pacientů s dnou a mírnou až střední renální insuficiencí byl ve snížení sérových hladin kyseliny močové pod hodnotu 6 mg/dl (360 mmol/l) významně účinnější febuxostat než allopurinol 300/200 mg podávaný jednou denně.
Ve studii CONFIRMS činil podíl pacientů s výchozí sérovou hladinou kyseliny močové ≥ 10 mg/dl (600 mmol/l), kteří dosáhli primárního cílového ukazatele účinnosti, 27 % (febuxostat 40 mg/den), 49 % (febuxostat 80 mg/den) a 31 % (allopurinol 300/200 mg/den).
Podíl pacientů vyžadujících léčbu akutních dnavých záchvatů (1. den až 6. měsíc) ve studii CONFIRMS činil 31 % ve skupině s febuxostatem 80 mg a 25 % ve skupině s allopurinolem. Mezi skupinami léčenými febuxostatem 80 mg a 40 mg nebyl pozorován žádný rozdíl.
Dlouhodobé otevřené klinické studie
EXCEL byla tříletá otevřená, multicentrická, randomizovaná studie fáze III kontrolovaná allopurinolem, určená pro pacienty, kteří dokončili účast v klinických hodnoceních APEX a FACT [10]. Studie se zúčastnilo celkem 1086 pacientů, kteří byli léčeni febuxostatem 80 mg jednou denně (n = 649), febuxostatem 120 mg jednou denně (n = 292) a allopurinolem v dávce 300/100 mg jednou denně (n = 145).
Při vstupu do studie dostávali všichni pacienti febuxostat 80 mg denně. Dávka mohla být zvýšena na 120 mg denně při nedostatečném účinku a následně mohla být i snížena v závislosti na dosažené hladině kyseliny močové v séru, výskytu ne-žádoucích příhod, případně na základě rozhodnutí investigátora. Přibližně 69 % pacientů nevyžadovalo pro dosažení konečné stabilní léčby žádnou změnu v dávce febuxostatu. Pacienti po úpravě léčby, kteří měli 3krát po sobě sérovou hladinu kyseliny močové > 6,0 mg/dl (360 mmol/l), byli vyřazeni z hodnocení.
Primárního cíle studie, snížení hladiny kyseliny močové v séru pod 6,0 mg/dl (360 mmol/l) po jednom měsíci od zahájení léčby, dosáhlo 81 % pacientů léčených febuxostatem 80 mg denně, 87 % pacientů léčených febuxostatem 120 mg denně ve srovnání se 46 % pacientů léčených allopurinolem. Celkem 91 % pacientů původně léčených febuxostatem 80 mg a 93 % pacientů původně léčených febuxostatem 120 mg mělo sérové hladiny kyseliny močové < 6 mg/dl (360 mmol/l) ve 36. měsíci sledování.
![Studie EXCEL – podíl pacientů vyžadujících v průběhu studie léčbu akutní ataky dnavé artritidy; podle [10] – Becker, et al., 2009.](https://www.remedia.cz/photo-a-28785---.jpg) Léčbu akutních dnavých záchvatů vy-žadovala v průběhu tříletého sledování (období od 16. do 24. měsíce a od 30. do 36. měsíce) méně než 4 % pacientů zařazených do studie (graf 4). U 46 % pacientů při konečné stabilní léčbě 80 mg febuxostatu jednou denně a u 38 % pacientů léčených 120 mg febuxostatu jednou denně v období od úvodní do závěrečné návštěvy zcela vymizel primárně sledovaný dnavý tofus.
Léčbu akutních dnavých záchvatů vy-žadovala v průběhu tříletého sledování (období od 16. do 24. měsíce a od 30. do 36. měsíce) méně než 4 % pacientů zařazených do studie (graf 4). U 46 % pacientů při konečné stabilní léčbě 80 mg febuxostatu jednou denně a u 38 % pacientů léčených 120 mg febuxostatu jednou denně v období od úvodní do závěrečné návštěvy zcela vymizel primárně sledovaný dnavý tofus.
FOCUS byla 5letá otevřená, multicentrická studie fáze II určená pro pacienty, kteří dokončili 4týdenní dvojitě zaslepenou dávkovou studii s febuxostatem TMX-00--004 [11, 12]. Do studie bylo zařazeno 116 pacientů, kteří zpočátku dostávali febuxostat v dávce 80 mg jednou denně; 62 % pacientů nevyžadovalo pro udržení sérové hladiny kyseliny močové < 6 mg/dl (360 mmol/l) žádnou úpravu dávky febuxo-statu. Podíl pacientů se sérovými hladinami kyseliny močové < 6,0 mg/dl (360 mmol/l) při závěrečné návštěvě činil při podávání všech dávek febuxostatu více než 80 % (81–100 %).
Dalšími sledovanými parametry ve studii FOCUS byl podíl pacientů s atakou akutní dnavé artritidy vyžadující léčbu v průběhu sledování. Podíl pacientů vyžadujících léčbu ataky akutní dnavé artritidy v průběhu léčby klesal. V úvodu činil 28 % pacientů a na konci sledování 0 % pacientů. Dále byla sledována velikost dnavých tofů. Při vstupu do studie mělo 26 pacientů prokazatelný nejméně jeden dnavý tofus. U 18 z nich (69 %) dnavý tofus v průběhu studie vymizel.
Autoři klinické studie konstatovali, že dlouhodobé snížení hladiny kyseliny močové v séru < 6,0 mg/dl (360 mmol/l) pomáhá předcházet vzniku depozit krystalů na-trium urátu. Febuxostat účinně snižoval výskyt záchvatů akutní dnavé artritidy a redukoval velikost a počet dnavých tofů.
Nežádoucí účinky
Preklinické údaje
Nežádoucí účinky febuxostatu v preklinických studiích byly obecně pozorovány po expozicích výrazně převyšujících maximální dávky u člověka [2].
U dospělých potkanů bylo zjištěno statisticky významné zvýšení výskytu nádorů močového měchýře v souvislosti s xanthinovými konkrementy ve skupině s vysokým dávkováním (11násobně vyšší expozice než u člověka). Nebyl pozorován zvýšený výskyt žádného dalšího typu nádoru u samců nebo samic myší a potkanů.
Standardní série testů genotoxicity ne-odhalila žádné biologicky významné geno-toxické účinky febuxostatu. Dále bylo zjištěno, že perorální dávky febuxostatu až do 48 mg/kg/den nemají žádný účinek na fertilitu a reprodukční schopnosti samců a samic potkanů. Neobjevily se žádné důkazy o poruše fertility, teratogenních účincích nebo nežádoucích účincích na plod v důsledku užívání febuxostatu.
Klinické údaje
V klinických studiích bylo léčeno minimál-ně jednou dávkou febuxostatu 10–300 mg celkem 4072 pacientů [7–9]. Nežádoucí účinky pozorované v těchto studiích v souvislosti s léčbou byly většinou hodnoceny jako mírné nebo středně závažné. Mezi nejčastěji hlášené nežádoucí účinky patřily abnormality funkce jater (5,0 %), průjem (2,7 %), nevolnost (1,3 %), bolest hlavy (1,2 %) a vyrážka (1,2 %). Jak již bylo uvedeno výše, byly v klinických studiích brzy po zahájení léčby a během prvních měsíců léčby běžně pozorovány akutní dnavé záchvaty. V následujícím období léčby se frekvence dnavých záchvatů snižovala, a to v závislosti na čase. Jako u jiných léčivých přípravků snižujících hladinu urátů je proto při léčbě febuxostatem doporučována profylaxe akutních dnavých záchvatů.
Ve studiích APEX a FACT byl ve skupinách pacientů léčených febuxostatem pozorován oproti skupině s allopurinolem vyšší výskyt kardiovaskulárních příhod, zahrnujících kardiovaskulární úmrtí, nefatální infarkt myokardu a nefatální cévní mozkovou příhodu (1,3 vs. 0,3 příhody na 100 pacientů a rok) [7, 8]. Ve studii CONFIRMS takový rozdíl pozorován nebyl [9]. Výskyt kardiovaskulárních příhod ve všech studiích fáze III byl 0,7 oproti 0,6 události na 100 pacientů a rok ve skupi-ně léčené febuxostatem a allopurinolem. V dlouhodobých otevřených studiích byl výskyt hlášených kardiovaskulárních příhod 1,2 pro febuxostat a 0,6 pro allopurinol na 100 pacientů a rok. Rozdíly nebyly statisticky významné a nebyla definována žádná příčinná souvislost s léčbou febuxostatem. Mezi rizikové faktory prokazované u pacientů s vyšším výskytem kardiovas-kulárních příhod patřily anamnéza aterosklerózy, infarktu myokardu nebo městnavého srdečního selhání.
Během klinických studií fáze III byly pozorovány mírné abnormality jaterních testů u pacientů léčených febuxostatem (5,0 %). Tento výskyt byl podobný jako u allopurinolu (4,2 %). V dlouhodobých otevřených studiích byly u pacientů uží-vajících febuxostat (5,5 %) a u pacientů užívajících allopurinol (5,8 %) pozorovány zvýšené hodnoty thyreotropního hormonu (TSH > 5,5 mIU/ml).
Indikace
Febuxostat je indikován k léčbě chronické hyperurikemie u pacientů s chronickou tofózní dnavou artritidou, tedy u stavů, kdy již došlo k vytvoření urátových depozit prokazatelných při klinickém vyšetření nebo zmiňovaných v anamnéze. Febuxostat je indikován zejména u pacientů s hyperurikemií, u kterých dosavadní léčba allopurinolem nevedla k dosažení cílové hladiny kyseliny močové v séru nižší než 6 mg/dl (360 mmol/l), dále u nemocných, u nichž byla léčba allopurinolem spojena s výskytem nežádoucích příhod, nebo v případech, kdy je léčba allopurinolem kontraindikována.
Kontraindikace a lékové interakce
Absolutní kontraindikací použití febuxostatu je známá hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku přípravku.
Se zvýšenou opatrností je nutno přistupovat k indikaci léčby febuxostatem u pa-cientů s kardiovaskulárními chorobami. Léčba febuxostatem není doporučena u pacientů s ischemickou chorobou srdeční nebo s městnavým srdečním selháním.
U pacientů s nadprodukcí kyseliny mo-čové (např. maligní onemocnění a jeho léčba, Leschův-Nyhanův syndrom) by mohlo ve vzácných případech dojít k nárůstu koncentrace xanthinu v moči s rizikem ukládání xanthinových depozit v močovém traktu. Protože u těchto pacientů není žádná zkušenost s febuxostatem, není zde jeho použití doporučeno.
Ačkoli interakční studie s febuxostatem nebyly provedeny, je známo, že inhibice XO vyvolává zvýšení hladin 6-merkaptopurinu nebo azathioprinu. Na základě těchto skutečností není použití febuxostatu u pacientů užívajících současně 6-merkaptopurin nebo azathioprin doporučeno.
Febuxostat, ale i jiné inhibitory XO mohou vyvolat zvýšení hladiny theofylinu. Proto by febuxostat měl být používán s opatrností u pacientů současně léčených theofylinem a hladiny theofylinu by měly být v úvodu léčby febuxostatem monitorovány.
V klinických studiích fáze III byly u pa-cientů léčených febuxostatem pozorovány mírné abnormality jaterních funkcí (5,0 % pacientů). Před zahájením léčby febuxo-statem a periodicky v průběhu léčby je po-dle uvážení indikujícího lékaře doporučeno pravidelné provádění jaterních testů. Bylo rovněž pozorováno zvýšení hladin TSH (> 5,5 mIU/ml) u 5,5 % pacientů. U pacientů s poruchou funkce štítné žlázy je při léčbě febuxostatem doporučována opatrnost.
Léčiva, která inhibují glukuronidaci, jako jsou nesteroidní antiflogistika nebo probenecid, by mohla teoreticky ovlivnit eliminaci febuxostatu. U zdravých subjektů bylo současné užívání febuxostatu a naproxe-nu v dávce 250 mg dvakrát denně spojeno se zvýšením expozice febuxostatu (cmax o 28 %, AUC o 41 % a t1/2 o 26 %). V klinických studiích nebylo pozorováno v souvislosti s užíváním naproxenu nebo jiných nesteroidních antiflogistik včetně inhibitorů cyklooxygenázy-2 (COX-2) žádné klinicky významné zvýšení výskytu nežádoucích příhod [13, 14].
Naopak silné induktory glukuronidace (např. karbamazepin, rifampicin, fenobarbital, fenytoin, dexamethason) mohou vést ke zvýšené degradaci a snížené účinnosti febuxostatu. Jeden až dva týdny po zahájení léčby silným induktorem glukuronidace je tudíž doporučeno sledování hladiny kyseliny močové v séru. Naopak ukončení léčby induktorem glukuronidace může vést ke zvýšení plazmatických hladin febuxostatu.
Febuxostat může být podáván současně s kolchicinem, hydrochlorothiazidem nebo s warfarinem bez nutnosti úpravy dávky. U zdravých jedinců nemělo souběžné podávání febuxostatu (80 mg nebo 120 mg jednou denně) s warfarinem žádný vliv na jeho farmakokinetiku.
Bylo prokázáno, že současné užití antacida obsahujícího hydroxid hořečnatý a hlinitý prodlužuje absorpci febuxostatu (přibližně 1 hodina) a vyvolává 32% snížení cmax bez významné změny AUC febuxo-statu. Febuxostat může být tudíž užíván bez ohledu na užívání antacid.
Těhotenství a kojení
Údaje u velmi omezeného počtu těhotenství neprokázaly žádné nežádoucí účinky febuxostatu na těhotenství nebo na zdraví plodu a novorozence. Studie na zvířatech neukazují přímé ani nepřímé nežádoucí účinky s ohledem na březost, vývoj embrya, plodu nebo porod. Potenciální riziko pro člověka není známo. Z důvodu nedostatku informací by však febuxostat neměl být užíván během těhotenství. Není rov-něž známo, zda se febuxostat vylučuje do mateřského mléka. Studie na zvířatech prokázaly vylučování febuxostatu do mateřského mléka a poruchu vývoje kojených mláďat. Riziko pro kojené dítě není možné vyloučit. Febuxostat by tedy neměl být užíván během kojení.
Dávkování a způsob podání
Doporučená perorální dávka febuxo-statu je 80 mg podaných v jedné dávce nezávisle na příjmu stravy. Pokud po 2 až 4 týdnech léčby febuxostatem přetrvávají zvýšené sérové hladiny kyseliny močové (> 6 mg/dl, 360 µmol/l), může být dávka zvýšena na 120 mg jednou denně. Nástup účinku febuxostatu je dostatečně rychlý, aby umožnil opakované testování hladiny kyseliny močové v séru již po dvou týdnech od zahájení léčby. Terapeutickým cílem je tedy snížit a dlouhodobě udržet hladinu kyseliny močové v séru nižší než 6 mg/dl (360 µmol/l).
Léčba febuxostatem by neměla být zahájena v průběhu akutního dnavého záchvatu. Podobně jako u jiných přípravků snižujících sérovou hladinu kyseliny močové se mohou během zahájení léčby febuxostatem objevit v důsledku změny sérových hladin kyseliny močové záchvaty dnavé artritidy způsobené mobilizací urátů z tkáňových depozit. Při zahájení léčby febuxostatem je proto doporučena profylaxe záchvatů dnavé artritidy nesteroidními antiflogistiky nebo kolchicinem po dobu minimálně šesti měsíců. Pokud se objeví záchvat dny během léčby febuxo-statem, neměla by být léčba přerušena. Záchvat dny by měl být léčen současně v závislosti na individuálním stavu pacienta. Kontinuální dlouhodobá léčba febuxo-statem snižuje frekvenci a intenzitu záchvatů dnavé artritidy.
U pacientů s mírným nebo středně závažným poškozením funkce ledvin není nutná žádná úprava dávkování. Účinnost a bezpečnost však nebyla hodnocena u pacientů se závažnou poruchou funkce ledvin (clearance kreatininu < 30 ml/min).
Doporučené dávkování u pacientů s mírným poškozením funkce jater je 80 mg denně. U pacientů se středně závažnou poruchou funkce jater jsou k dispozici omezené informace. Účinnost a bezpečnost febuxostatu nebyla hodnocena u pa-cientů se závažnou poruchou funkce jater (Childovo-Pughovo skóre C).
U starších pacientů není nutná žádná úprava dávkování.
Vzhledem k chybějícím zkušenostem s použitím u dětí a dospívajících není febuxostat u těchto skupin pacientů doporučen. Rovněž u pacientů po orgánové transplantaci není použití febuxostatu, z důvodu nedostatku zkušeností, doporučeno.
Zařazení do současné palety léčiv
Febuxostat je silný, nepurinový selektivní inhibitor XO, která katalyzuje přeměnu hypoxanthinu a xanthinu na kyselinu močovou. Je indikován k léčbě chronické hyper-urikemie u pacientů s chronickou tofózní dna-vou artritidou. Rozšiřuje ATC skupinu léků potlačujících tvorbu kyseliny močové, které jsou v současnosti v České republice zastoupeny pouze jediným zástupcem – allopu-rinolem. Oproti allopurinolu je febuxostat nepurinovým, vysoce selektivním a účinnějším inhibitorem XO. Silně inhibuje jak oxidované, tak redukované formy XO, zatímco aktivní metabolit allopurinolu, oxypurinol, inhibuje pouze redukovanou formu XO. Febuxostat, v porovnání s allopurinolem, rychleji a účinněji snižuje sérovou hladinu kyseliny močové bez nutnosti titrace dávky. Dlouhodobé podávání febuxostatu snižuje výskyt dnavých záchvatů a redukuje velikost a počet dnavých tofů. Na rozdíl od allopurinolu není u pacientů s mírným nebo středně závažným poškozením funkce ledvin nutná redukce jeho dávky.
Seznam použité literatury
- [1] Annemans L, Spaepen E, Gaskin M, et al. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005. Ann Rheum Dis 2008; 67: 960–966.
- [2] European Medicines Agency. Adenuric (febuxo-stat): summary of product characteristics [online]. Available from URL: http://www.emea.europa.eu/humandocs/PDFs/EPAR/aden uric/H-777- -en1.pdf
- [3] Bruce SP. Febuxostat: a selective xanthine oxidase inhibitor for the treatment of hyperuricemia and gout. Ann Pharmacother 2006; 40: 2187–2194.
- [4] Okamoto K, Eger BT, Nishino T, et al. An extremely potent inhibitor of xanthine oxidoreductase. Crystal structure of the enzyme-inhibitor complex and mechanism of inhibition. J Biol Chem 2003; 278: 1848–1855.
- [5] Okamoto K, Nishino T. Crystal structures of mammalian xanthine oxidoreductase bound with various inhibitors: allopurinol, febuxostat, and FYX-051. J Nippon Med Sch 2008; 75: 2–3.
- [6] Khosravan R, Kukulka MJ, Wu JT, et al. The effect of age and gender on pharmacokinetics, pharmacodynamics, and safety of febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase. J Clin Pharmacol 2008; 48: 1014–1024.
- [7] Schumacher HR Jr, Becker MA, Wortmann RL, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum 2008; 59: 1540–1548.
- [8] Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat compared with allopurinol in pa-tients with hyperuricemia and gout. N Engl J Med 2005; 353: 2450–2461.
- [9] FDA Advisory Committee Meeting 2008 for Febuxostat. Briefing Document for Advisory Committee. Takeda Pharmaceuticals North America, Inc NDA 21-856.
- [10] Becker MA, Schumacher HR, MacDonald PA, et al. Clinical efficacy and safety of successful long term urate lowering with febuxostat or allopurinol in subjects with gout. J Rheumatol 2009; 36: 1273–1282.
- [11] Schumacher HR Jr, Becker MA, Lloyd E, et al. Febuxostat in the treatment of gout: 5-year findings of the FOCUS efficacy and safety study. Rheumatology 2009; 48: 188–194.
- [12] Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebo-controlled, dose-response clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum 2005; 52: 916–923.
- [13] Mukoyoshi M, Nishimura S, Hoshide S, et al. In vitro drug-drug interaction studies with febuxo-stat, a novel non-purine selective inhibitor of xan-thine oxidase: plasma protein binding, identification of metabolic enzymes and cytochrome P450 inhibition. Xenobiotica 2008; 38: 496–510.
- [14] Khosravan R, Wu JT, Joseph-Ridge N, Vernillet L. Pharmacokinetic interactions of concomitant administration of febuxostat and NSAIDs. J Clin Pharmacol 2006; 46: 855–866.