Fixní kombinace glekaprevir/pibrentasvir
Souhrn:
Glekaprevir a pibrentasvir představují novou generaci přímo působících antivirotik účinných proti viru hepatitidy C (HCV). Glekaprevir je inhibitorem HCV proteázy NS3/4A, pibrentasvir je inhibitorem HCV proteinu NS5A, tzv. replikačního komplexu. Glekaprevir i pibrentasvir mají vysokou protivirovou účinnost proti všem genotypům viru hepatitidy C. Fixní kombinace glekapreviru a pibrentasviru v jedné tabletě nabízí možnost krátké léčby v trvání 8 týdnů pro dosud neléčené dospělé pacienty bez cirhózy bez ohledu na genotyp viru hepatitidy C. U pacientů s cirhózou nebo u pacientů infikovaných genotypem 3 po selhání léčby interferonovým režimem se doporučuje léčba trvající 12, resp. 16 týdnů. Kombinace glekapreviru a pibrentasviru je kontraindikována u pacientů s dekompenzovanou cirhózou jater. Glekaprevir i pibrentasvir se minimálně vylučují ledvinami, a proto jejich fixní kombinace může být bezpečně používána k léčbě pacientů s chronickým onemocněním ledvin včetně pacientů hemodialyzovaných. Kombinací glekaprevir/pibrentasvir lze léčit i pacienty po transplantaci jater a ledviny a pacienty s koinfekcí HCV/HIV. Kombinace glekapreviru a pibrentasviru vykazuje vynikající bezpečnostní profil, ve studiích fáze II a III byly nejčastějšími nežádoucími účinky (≥ 10 %) bolest hlavy a únava. Přítomnost kompenzované cirhózy nemá vliv na typ a závažnost nežádoucích účinků.
Key words: hepatitis C, cirrhosis , direct‑acting antivirals, pangenotypic activity, sustained virological response, haemodialysis.
Summary:
Glecaprevir and pibrentasvir represent the next‑generation of antivirals indicated for treatment of hepatitis C. Glecaprevir is an HCV NS3/4A protease inhibitor, pibrentasvir is the inhibitor of NS5A replication complex. Glecaprevir as well as pibrentasvir have a high antiviral activity against all HCV genotypes. The fixed‑dose combination of glecaprevir and pibrentasvir in one pill represents a possibility of a short, 8‑weeks treatment for treatment‑naive patients without cirrhosis regardless of HCV genotype. In patients with cirrhosis or in patients with liver cirrhosis and genotype 3 in whom an interferon‑based treatment had failed, 12 and 16 weeks of therapy are indicated, respectively. The regimen is contraindicated in patients with decompensated liver cirrhosis. Glecaprevir and pibrentasvir have a minimal kidney excretion, it is possible to administer the combination to the patients with kidney disease including patients on maintenance hemodialysis. The combination can be used in kidney and liver transplant recipients and patients with HIV coinfection. The glecaprevir/pibrentasvir combination has an excellent safety profile, the most common side effects in phase II and III clinical trials (≥ 10%) were headache and fatigue. The presence of compensated liver cirrhosis does not increase the frequency of adverse events.
Úvod
Bezinterferonové režimy v léčbě chronické hepatitidy C představují bezpochyby největší pokrok v klinické hepatologii za posledních 20 let [1]. Předchozí léčba kombinující pegylovaný interferon α (PEG IFN) a ribavirin (RBV) spočívala v nespecifické imunostimulaci vedoucí k eliminaci viru a byla málo účinná a obtížně tolerovaná [2,3]. Zbavit se virové infekce se podařilo nejvýše polovině léčených pacientů. Závažné nežádoucí účinky limitovaly použití léčby u pacientů s velmi pokročilou cirhózou jater, ale i u pacientů hemodialyzovaných a pacientů po orgánových transplantacích. Bezinterferonové režimy spočívají v podávání dvou nebo více antivirotik, která přímo zasahují v různých místech procesu replikace viru. Léčbou trvající jen 8–12 týdnů se daří zbavit infekce více než 95 % léčených pacientů. Obrovským přínosem je zejména vynikající tolerance a bezpečnost bezinterferonové léčby. Její účinnost nesnižuje přítomnost pokročilé cirhózy jater ani hemodialýza nebo současné podávání imunosupresiv [1]. Zatímco umění léčit chronickou hepatitidu C dříve spočívalo ve výběru vhodných pacientů, v předcházení vzniku nežádoucích účinků a v jejich léčbě, nyní spočívá ve výběru režimu pro pacienta nejvhodnějšího dle genotypu viru, pokročilosti choroby jater a dle dalších chorob a užívaných léčiv. Do klinické praxe nyní přicházejí nové režimy, jejichž účinnost se blíží 100 %, a navíc jsou účinné proti všem genotypům viru (tzv. pangenotypové režimy). Právě takovým režimem je kombinace glekapreviru (GLE) a pibrentasviru (PIB) v jedné tabletě [4].
Farmakologická skupina
Glekaprevir i pibrentasvir jsou přímo působící antivirotika účinná proti viru hepatitidy C (HCV). ATC kód fixní kombinace je J05AP57 [4].
Mechanismus účinku a farmakodynamika
Glekaprevir je inhibitorem HCV proteázy NS3/4A. Tato proteáza po svém odštěpení z velkého virového polyproteinu činností buněčných proteáz pokračuje v jeho dalším štěpení na aktivní virové proteiny, inhibice proteázy NS3/4A zastavuje replikaci HCV [5].
Pibrentasvir je inhibitorem HCV proteinu NS5A, replikačního komplexu, na němž probíhá syntéza virové RNA a skládání virových partikulí. Inhibice proteinu NS5A též zastavuje replikaci HCV [5].
Farmakokinetické vlastnosti
Po podání obvyklé denní dávky 300 mg GLE a 120 mg PIB (3 tablety přípravku Maviret) spolu s jídlem je maximální plazmatické koncentrace dosaženo za pět hodin, maximální plazmatická koncentrace GLE je 597 ng/ml a maximální plazmatická koncentrace PIB je 110 ng/ml. Na základě populačních farmakokinetických modelů pro GLE/PIB u pacientů s chronickou hepatitidou C byly hodnoty plochy pod křivkou plazmatické koncentrace za 24 hodin (AUC24) při ustáleném stavu pro GLE a PIB 4 800 ng∙h/ml a 1 430 ng∙h/ml u pacientů bez cirhózy (n = 1 804) a 10 500 ng∙h/ml, resp. 1 530 ng∙h/ml u pacientů s cirhózou (n = 280). Biologická dostupnost PIB při současném podávání s GLE je trojnásobná v porovnání s PIB v monoterapii. Glekaprevir je v nízkém rozsahu ovlivněn současným podáváním PIB.
Glekaprevir je vázán na plazmatické bílkoviny z 97,5 %, PIB z více než 99,9 %, poměr krev/plazma je 0,57 pro GLE a 0,62 pro PIB. Biologický poločas GLE je 6 hodin a PIB 13 hodin. PIB je vylučován nezměněný, GLE podléhá sekundární oxidaci CYP3A4. Hlavní cestou vylučování GLE a PIB je biliární exkrece. Biliární přenos GLE je zprostředkován přenašeči P-glykoproteinem (P gp), BCRP (breast cancer resistance protein) a OATP1B1/3 (organic anion transporting polypeptide 1B1/3), PIB je přenášen pomocí P gp a BCRP. Stolicí je následně vylučováno 92,7 % GLE a 96,6 % PIB; 0,7 %, GLE je vylučováno močí. U nemocných s poruchou funkce ledvin včetně hemodialyzovaných pacientů nebyly proto shledány klinicky významné rozdíly farmakokinetických parametrů [4,6,7].
Klinické zkušenosti
Účinnost režimu GLE/PIB byla testována ve studiích fáze II a III u dospělých pacientů dříve neléčených, u nichž selhala předchozí léčba včetně přímo působících antivirotik (direct acting antivirals, DAA), u pacientů bez cirhózy i u nemocných s kompenzovanou cirhózou na podkladě HCV infekce [1,4].
Surveyor I byla randomizovaná, otevřená studie fáze II hodnotící účinnost, bezpečnost a farmakokinetiku GLE v kombinaci s PIB s podáním nebo bez podání RBV u pacientů s HCV infekcí a s genotypy 1, 4, 5 a 6, včetně pacientů s kompenzovanou cirhózou [8]. Do studie byli zařazeni i nemocní, u nichž selhala léčba PEG IFN a RBV.
Surveyor II byla randomizovaná, otevřená studie fáze II hodnotící účinnost, bezpečnost a farmakokinetiku GLE v kombinaci s PIB s podáním nebo bez podání RBV u pacientů s HCV infekcí a s genotypy 2, 3, 4, 5 nebo 6, včetně pacientů s kompenzovanou cirhózou [8]. Rovněž do této studie byli zařazeni i nemocní, u nichž selhala léčba PEG IFN a RBV. Primárním cílovým ukazatelem obou studií Surveyor byla účinnost, tedy dosažení setrvalé virologické odpovědi ve 12. týdnu po léčbě (sustained virologic response, SVR12). Pacienti s genotypem HCV 1 byli léčeni GLE 200 mg spolu s PIB 120 mg celkem 12 týdnů. Pacienti s genotypem HCV 3 byli randomizováni v poměru 1 : 1 a dostávali 300 mg GLE se 120 mg PIB s RBV nebo bez RBV ve fixní dávce 800 mg denně.
Obě studie byly otevřené a neměly větev s placebem. Celkem bylo hodnoceno 27 pacientů s genotypem 1 (z nichž byla většina infikována subtypem 1a) a 55 pacientů s genotypem 3. Všichni pacienti dokončili plánovaných 12 týdnů léčby. U pacientů s genotypem 1 byla účinnost 96 % (26/27 léčených dosáhlo SVR). U pacientů s genotypem 3 léčených GLE 300 mg byla účinnost 96 % (27/28 léčených dosáhlo SVR12); SVR12 dosáhlo 100 % (27/27) pacientů s cirhózou a s genotypem 3, kteří užívali GLE 300 mg a PIB 120 mg spolu s 800 mg RBV. Celkem 74 % pacientů ve studii zaznamenalo v průběhu 12týdenní léčby nežádoucí účinky, ale většina z nich byla nezávažných nebo středně závažných. Nejčastějšími nežádoucími účinky byly bolesti hlavy, průjem a únava. Nežádoucí účinky byly významně častější u pacientů, kteří byli léčeni GLE, PIB a RBV. Závažné nežádoucí účinky byly popsány u pěti pacientů, u čtyř z nich nebyla doložena souvislost s terapií. U žádného pacienta s cirhózou nedošlo v průběhu studie k dekompenzaci onemocnění [8].
Studie Surveyor zahrnuly pacienty, kteří jsou v dnešní době považováni za obtížně léčitelné, zejména pak jde o pacienty s genotypem 3 a s cirhózou, u nichž předchozí léčba selhala. Protivirová kombinace GLE s PIB prokázala vysokou protivirovou účinnost i u této skupiny nemocných [8].
Studie Endurance 1 fáze III hodnotila protivirovou účinnost a bezpečnost kombinace GLE 300 mg a PIB 120 mg u pacientů s genotypem 1 bez cirhózy [9]. Doba léčby byla 8 týdnů nebo 12 týdnů. Zařazeni byli jak pacienti naivní, tak ti, u nichž selhala léčba PEG IFN a RBV nebo léčba sofosbuvirem a RBV s PEG IFN nebo bez PEG IFN. Primárním cílovým ukazatelem bylo dosažení SVR12. Do osmitýdenní větve bylo randomizováno 351 pacientů, dvanáctitýdenní léčbu dostalo celkem 352 pacientů. Krátkou, osmitýdenní léčbou dosáhlo SVR12 99 % nemocných (348/351) s genotypem 1. Osmitýdenní léčba nebyla méně účinná než léčba 12týdenní, jejíž účinnost byla 99,7 % (331/332 léčených dosáhlo SVR12). Nežádoucí účinky byly pozorovány u 62 % a 66 % pacientů v průběhu 8týdenní, resp. 12týdenní léčby, závažné nežádoucí účinky nebyly zjištěny v souvislosti s podávanou léčbou (celkem 1 % v obou větvích).
Endurance 2 byla dvojitě zaslepená, placebem kontrolovaná multicentrická studie fáze III hodnotící účinnost a bezpečnost fixní kombinace GLE 300 mg a PIB 120 mg. Do studie byli zařazeni pacienti s genotypem HCV 2, bez cirhózy, naivní nebo již dříve léčení [10]. Celkem 202 pacientů zahájilo bezprostředně léčbu, která trvala 12 týdnů. U 100 pacientů byla léčba odložena, bylo jim podáváno placebo a účinnou látku obdrželi následně, opět na 12 týdnů. SVR12 dosáhlo 99 % (195/196) hodnocených pacientů, jeden případ selhání byl klasifikován jako nevirologické selhání a pacient dosáhl SVR [10]. Nežádoucí účinky byly zaznamenány u 65 % pacientů ve větvi, která zahájila léčbu ihned, a u 58 % pacientů z větve, kde bylo nejdříve podáváno placebo. Nikdo ze zařazených neukončil léčbu pro nežádoucí účinky, nejčastějšími nežádoucími účinky byly bolest hlavy a únava. Závažný nežádoucí účinek byl popsán shodně u 1 % léčených v obou větvích [10].
Endurance 3 byla randomizovaná multicentrická studie fáze III hodnotící účinnost a bezpečnost fixní kombinace GLE 300 mg a PIB 120 mg podávané po dobu 8 týdnů nebo 12 týdnů ve srovnání s kombinací sofosbuvir 400 mg a daklatasvir 60 mg (doba léčby 12 týdnů) u pacientů s genotypem 3 dosud neléčených a bez cirhózy [9]. V osmitýdenní větvi dosáhlo SVR 149/157 pacientů (SVR 95 %), stejná účinnost – 95 % – byla popsána ve větvi 12týdenní [9].
Magellan 1 byla randomizovaná, otevřená multicentrická studie fáze II hodnotící účinnost a bezpečnost GLE s PIB u pacientů s genotypem 1 bez cirhózy, u nichž došlo k selhání předchozí léčby DAA [11]. Mohlo jít o selhání DAA v průběhu léčby nebo o relaps nemoci po jejím ukončení. Primárním cílovým ukazatelem hodnocení bylo dosažení SVR12. Pacienti byli léčeni fixní kombinací GLE 300 mg a PIB 120 mg denně, randomizováni byli k podávání RBV v poměru 1 : 1. Doba léčby byla 12 týdnů. V původním protokolu byla větev s nižší dávkou GLE 200 mg, do níž byl nábor zastaven po randomizaci šesti pacientů. Zařazení pacienti byli stratifikováni podle subtypu HCV (1a vs. 1b) a podle předchozí léčby: selhání při léčbě inhibitorem NS5A nebo NS3/4. Padesát pacientů bylo randomizováno a obdrželo alespoň jednu dávku studijní medikace; 84 % pacientů bylo infikováno subtypem viru 1a, 50 % pacientů dostávalo v předchozí léčbě inhibitor NS5A, 84 % inhibitor NS3/4A, 54 % polymerázový inhibitor NS5B.
Podle analýzy intent to treat dosáhlo SVR12 celkem 92 % pacientů (46/50), kteří byli léčeni kombinací GLE 300 mg a PIB 120 mg s RBV nebo bez RBV. Ve větvi s nižší dávkou GLE 200 mg byla SVR12 100 %. Ve větvi GLE/PIB + RBV dosáhlo SVR 95 % pacientů (21/22), zatímco ve větvi bez RBV dosáhlo SVR pouze 86 % pacientů (19/22). Virologické selhání bylo popsáno u jednoho pacienta v každé z větví, ostatní pacienti, kteří dle protokolu nedosáhli SVR, se nedostavili na plánovanou kontrolu v týdnu 12 po ukončení léčby. Pokud se vyřadí z hodnocení pacienti, kteří SVR nedosáhli z důvodu nevirologického selhání, pak je SVR 100 % (redukovaná dávka GLE/PIB), 95 % při léčbě GLE/PIB a 95 % při léčbě GLE/PIB/RBV.
Ve studii byla zaznamenána dvě virologická selhání. Oba pacienti dodržovali léčebný režim a měli v průběhu léčby adekvátní sérové koncentrace podávaných léků. U prvního pacienta došlo k fenoménu průlomu v osmém týdnu terapie GLE 300 mg/PIB 120 mg. Tento pacient měl již před léčbou substituce asociované s rezistencí (resistance associated substitutions, RAS) v oblasti NS3 (Y56H, D168A/T) i NS5A (M28V, Q30R a H58C). V okamžiku selhání léčby byly prokázány další RAS V36M v oblasti NS3 a M28G v oblasti NS5A. Pacient trpěl Crohnovou chorobou, užíval imunosupresivní léčbu a v minulosti podstoupil ileocekální resekci. Druhý pacient, u kterého léčba selhala, prodělal relaps v týdnu 4 po ukončení terapie GLE 300 mg/PIB 120 mg/RBV 800 mg. U tohoto pacienta byly prokázány bazální RAS NS5A L31M a H58D, v oblasti NS3 nebyly RAS zjištěny. V okamžiku relapsu byly prokázány léčbou indukované RAS A156V v oblasti NS3 a Q30R v oblasti NS5A.
Pokud hodnotíme pravděpodobnost dosažení SVR na základě přítomnosti RAS před léčbou při hranici detekce RAS 15 %, pak pacienti bez RAS dosáhli SVR ve 100 % (10/10), pokud měli RAS pouze v jedné z oblastí, pak byla SVR 100 % (14/14) v případě RAS v oblasti NS3, 91 % (10/11) v případě RAS v oblasti NS5A a 93 % (14/15), pokud byly RAS detekovány v obou oblastech.
Zařazení do současné palety léčiv
Kombinace GLE/PIB je novou generací protivirových léčiv proti HCV infekci, výhodou je vysoká účinnost na všechny genotypy HCV, vynikající bezpečnost i tolerance [1,4]. Výhodou je i léčba trvající pouhých osm týdnů, jež dostačuje k vyléčení pacientů bez cirhózy, kteří dosud žádnou protivirovou léčbu nedostávali nebo byli dříve léčeni kombinací PEG IFN a RBV (včetně kombinace se sofosbuvirem). Lze předpokládat, že režimy účinné na všechny genotypy HCV postupně nahradí režimy starší, účinné jen na jeden nebo dva genotypy HCV.
Indikace
Kombinace GLE/PIB je indikována k léčbě dospělých pacientů s chronickou virovou hepatitidou C infikovaných genotypy HCV 1–6 bez cirhózy nebo s kompenzovanou cirhózou jater, kteří dosud nebyli léčeni žádnou protivirovou léčbou. Kombinace GLE/PIB je indikována i k léčbě nemocných, u nichž selhala předchozí léčba založená na PEG IFN. Kombinaci GLE/PIB lze bez úpravy dávkování použít i u pacientů s poruchou funkce ledvin včetně pacientů se selháním ledvin léčených hemodialýzou. Kombinací GLE/PIB lze léčit i pacienty po transplantaci jater a ledviny a pacienty s koinfekcí HCV/HIV (virus lidského imunodeficitu) [1,4,12].
Kontraindikace
Léčba kombinací GLE/PIB se nedoporučuje u pacientů se středně těžkou poruchou funkce jater (Childovo–Pughovo skóre B) a je kontraindikována u pacientů s těžkou poruchou funkce jater (Childovo–Pughovo skóre C) [4]. Progrese dysfunkce jater u pacientů s pokročilostí klasifikovanou jako Childovo–Pughovo skóre B nebo C byla popsána i po jiných kombinacích DAA. Příčinou není přímá hepatotoxicita, ale nejspíše přechodná imunitní dysregulace po eliminaci HCV. Zmíněná imunitní dysregulace může vést též k reaktivaci chronické infekce virem hepatitidy B (HBV) u pacientů s koinfekcí HCV/HBV. Fatální reaktivace HBV během léčby nebo po léčbě jinými DAA byly též popsány. Vyšetření markerů HBV má být provedeno vždy před zahájením léčby GLE/PIB. Pacienti s koinfekcí HCV/HBV mají být sledováni nebo mají dostávat profylaktickou léčbu reaktivace HBV dle standardních doporučených postupů pro prevenci reaktivace HBV. Kombinace GLE/PIB není doporučena pro opakovanou léčbu pacientů po předchozím selhání léčby inhibitory NS3/4A a/nebo NS5A. Důvodem je vysoké riziko opětného selhání léčby u pacientů infikovaných genotypy HCV 1 a 4, u pacientů infikovaných genotypy 2, 3, 5 nebo 6 nejsou pro opakovanou léčbu k dispozici dostatečná data.
Lékové interakce
GLE a PIB jsou inhibitory P gp,
BCRP a OATP1B1/3. Současné podávání jiných léčiv
s kombinací GLE/PIB může zvýšit plazmatickou
koncentraci léčiv, která jsou substráty P gp
(dabigatran etexilát, digoxin), BCRP (rosuvastatin) nebo
OATP1B1/3 (atorvastatin, lovastatin, pravastatin, rosuvastatin,
simvastatin). GLE a PIB jsou in
vivo slabými inhibitory cytochromu P450 izoenzymů CYP3A,
CYP1A2 a uridin difosfát glukuronosyltransferázy
(UGT) 1A1. U citlivých substrátů CYP3A (midazolam, felodipin)
nebo UGT1A1 (raltegravir) nebyla pozorována klinicky významná
zvýšení expozice při současném podávání GLE/PIB. GLE i PIB
in vitro inhibují
exportní pumpu žlučových kyselin (BSEP). U pacientů
léčených antagonisty vitaminu K může dojít během léčby
GLE/PIB díky změně funkce jater (obvykle zlepšení) k potřebě
úpravy dávkování. Proto je nutné monitorování protrombinového
času. Nejzávažnější lékové interakce GLE/PIB jsou shrnuty
v tabulce 1
[1,4].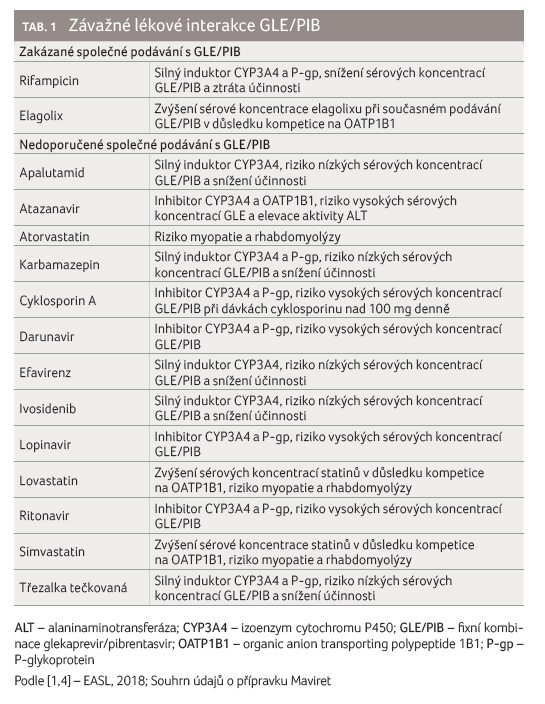
Nežádoucí účinky
Kombinace GLE/PIB vykazuje vynikající bezpečnostní profil. Hodnocení vycházela ze studií fáze II a III, které zahrnuly přibližně 2 300 pacientů bez cirhózy nebo s kompenzovanou cirhózou léčených po dobu 8, 12 nebo 16 týdnů [4,13]. Nejčastějšími nežádoucími účinky (≥ 10 %) byly bolest hlavy a únava. Méně než 0,1 % léčených pacientů mělo závažné nežádoucí účinky (tranzitorní ischemická ataka). K trvalému ukončení léčby v důsledku nežádoucích účinků došlo u 0,1 % pacientů. Přítomnost kompenzované cirhózy neměla vliv na typ a závažnost nežádoucích účinků. Nejčastějšími nežádoucími účinky u pacientů s těžkou poruchou funkce ledvin ve studii Expedition 4 byly pruritus (17 %) a únava (12 %). Nežádoucí účinky pozorované u 5 % nebo více pacientů po transplantaci jater nebo ledviny po dobu 12 týdnů léčby GLE/PIB byly bolest hlavy (17 %), únava (16 %), nauzea (8 %) a pruritus (7 %). Bezpečnostní profil pacientů s koinfekcí HCV/HIV 1 (studie ENDURANCE 1 a EXPEDITION 2) byl srovnatelný jako u pacientů pouze s monoinfekcí HCV [1,4,9,12].
Těhotenství a kojení
Léčba kombinací GLE/PIB není během těhotenství doporučena [4]. Údaje týkající se podávání GLE a PIB gravidním ženám (méně než 300 dokončených těhotenství) jsou nedostatečné. Studie reprodukční toxicity na zvířatech prokázaly embryofetální ztráty po podávání GLE u králíků, naopak u potkanů a myší neměly GLE a PIB přímé ani nepřímé toxické účinky. Není známo, zda se GLE nebo PIB vylučují do lidského mateřského mléka. Riziko pro kojené děti však nelze vyloučit. Při nutnosti zahajovat léčbu kombinací GLE/PIB v době laktace je nutno zvážit a porovnat riziko ukončení kojení pro dítě a riziko odložení léčby GLE/PIB pro matku.
Ovlivnění pozornosti
Kombinace GLE/PIB nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Pacienty je však nutno upozornit na riziko únavy během léčby [4].
Dávkování a délka léčby
Doporučená perorální dávka je
300 mg GLE a 120 mg PIB (tři tablety přípravku Maviret à
100 mg/40 mg) jednou denně s jídlem [4].
Doba léčby je 8–16 týdnů a řídí se genotypem HCV,
pokročilostí jaterní choroby, předchozí protivirovou léčbou
a komorbiditami. Doba léčby doporučená pro příslušnou
skupinu pacientů je uvedena v tabulce 2. Pacient musí být upozorněn na nutnost užívat
léky pravidelně denně v určenou dobu a žádnou dávku
nevynechat. Dojde li k vynechání jedné dávky v určenou
hodinu, je nutno ji urychleně požít, pokud je zpoždění proti
určené hodině menší než 18 hodin, a další dávku pak
podat následující den v určenou hodinu. Je li zpoždění
větší než 18 hodin, je nutno příslušnou denní dávku vynechat
a pokračovat další dávkou v následující den
v určenou hodinu. Zvrací li pacient za méně než
tři hodiny po požití GLE/PIB, má užít novou dávku, aby
nedošlo ke snížení plazmatických koncentrací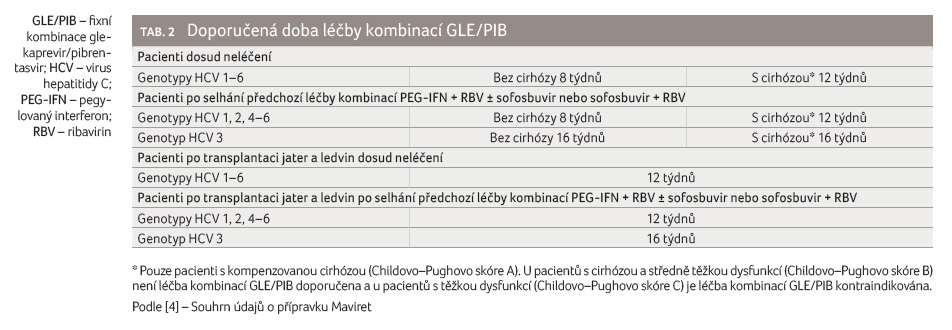 léčiv.
léčiv.
Stabilita
Léčivý přípravek obsahující GLE a PIB nevyžaduje žádné zvláštní podmínky uchovávání [4].
Závěr
Kombinace GLE/PIB nepochybně již v krátké době rozšíří v České republice pacientům s chronickou infekcí HCV paletu dostupných a hrazených léčiv. Kombinace GLE/PIB má jedinečné vlastnosti umožňující krátkou a vysoce efektivní léčbu pacientů infikovaných všemi genotypy HCV včetně pacientů s kompenzovanou cirhózou jater, pacientů s poruchou funkce nebo se selháním ledvin, pacientů po transplantaci jater nebo ledviny a pacientů s HCV/HIV koinfekcí. Jedinečný je bezpečnostní profil kombinace GLE/PIB s minimálním výskytem závažných nežádoucích účinků s následkem přerušení léčby (0,1 %).
Seznam použité literatury
- [1] European Association for the Study of the Liver. Electronic address eee, European Association for the Study of the L. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol 2018; 69: 461–511.
- [2] Manns MP, McHutchison JG, Gordon SC, et al. Peginterferon alfa‑2b plus ribavirin compared with interferon alfa‑2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358: 958–965.
- [3] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa‑2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–982.
- [4] Souhrn údajů o přípravku Maviret. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004430/WC500233677.pdf
- [5] Moradpour D, Penin F, Rice CM. Replication of hepatitis C virus. Nat Rev Microbiol 2007; 5: 453–463.
- [6] Ng TI, Krishnan P, Pilot‑Matias T, et al. In Vitro Antiviral Activity and Resistance Profile of the Next Generation Hepatitis C Virus NS5A Inhibitor Pibrentasvir. Antimicrob Agents Chemother 2017; doi: 10.1128/AAC.02558‑16.
- [7] Gao M. Antiviral activity and resistance of HCV NS5A replication complex inhibitors. Curr Opin Virol 2013; 3: 514–520.
- [8] Gane E, Poordad F, Wang S, et al. High Efficacy of ABT‑493 and ABT‑530 Treatment in Patients With HCV Genotype 1 or 3 Infection and Compensated Cirrhosis. Gastroenterology 2016; 151: 651–659.
- [9] Zeuzem S, Foster GR, Wang S, et al. Glecaprevir‑Pibrentasvir for 8 or 12 Weeks in HCV Genotype 1 or 3 Infection. N Engl J Med 2018; 378: 354–369.
- [10] Asselah T, Kowdley KV, Zadeikis N, et al. Efficacy of Glecaprevir/Pibrentasvir for 8 or 12 Weeks in Patients With Hepatitis C Virus Genotype 2, 4, 5, or 6 Infection Without Cirrhosis. Clin Gastroenterol Hepatol 2018; 16: 417–426.
- [11] Poordad F, Felizarta F, Asatryan A, et al. Glecaprevir and Pibrentasvir for 12 Weeks for HCV Genotype 1 Infection and Prior Direct‑acting Antiviral Treatment. Hepatology 2017; doi: 10.1002/hep.29081.
- [12] Rockstroh JK, Lacombe K, Viani RM, et al. Efficacy and Safety of Glecaprevir/Pibrentasvir in Patients Co‑infected with Hepatitis C Virus and Human Immunodeficiency Virus‑1: the EXPEDITION‑2 Study. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America 2018; doi: 10.1093/cid/ciy220.
- [13] Puoti M, Foster GR, Wang S, et al. High SVR12 with 8‑week and 12‑week glecaprevir/pibrentasvir therapy: An integrated analysis of HCV genotype 1‑6 patients without cirrhosis. J Hepatol 2018; 69: 293–300.