Galkanezumab pro profylaktickou léčbu pacientů s migrénou
Souhrn:
Řehulka P. Galkanezumab pro profylaktickou léčbu pacientů s migrénou. Remedia 2021; 31: 30–36.
Galkanezumab je rekombinantní humanizovaná monoklonální protilátka typu IgG4. Řadí se mezi antagonisty CGRP (calcitonin gene‑related peptide) a mechanismem jeho účinku je vazba CGRP, čímž je zabráněno jeho vazbě na CGRP receptory. Galkanezumab je indikován v profylaktické léčbě migrény u dospělých pacientů s minimálně čtyřmi migrenózními dny v měsíci. Galkanezumab je dodáván v lékové formě injekčního roztoku v předplněném jednorázovém peru, při první aplikaci se podává celková dávka 240 mg (ze dvou injekčních per), poté je aplikována každý měsíc dávka 120 mg z jednoho injekčního pera. Klinická účinnost a bezpečnost galkanezumabu byla prokázána ve třech randomizovaných, dvojitě zaslepených a placebem kontrolovaných studiích fáze III (studie EVOLVE‑1 a EVOLVE‑2 u pacientů s epizodickou migrénou, studie REGAIN u pacientů s chronickou migrénou). Nežádoucí účinky ve studiích celkově vedly k ukončení léčby u méně než 2,5 % pacientů. Z důvodu reakce v místě vpichu byla ukončena léčba u méně než 0,5 % pacientů. V teoretické části je zdůrazněn význam CGRP v patofyziologii migrény, místa exkrece CGRP v trigeminovaskulárním systému, struktura a rozmístění CGRP receptorů, důsledky aktivace CGRP receptorů v trigeminovaskulárním systému a cesty odvádění CGRP z intrakraniálních kompartmentů. V závěru je zmíněn mechanismus účinku anti‑CGRP protilátek, jejich místo v současné klinické praxi a jejich perspektivy v léčbě migrény.
Summary:
Rehulka P. Galcanezumab for prophylactic treatment in patients with migraine. Remedia 2021; 31: 30–36.
Galcanezumab is a recombinant humanised IgG4 monoclonal antibody, a calcitonin gene‑related peptide antagonist that binds to a calcitonin gene‑related peptide (CGRP), thus prevents its binding to CGRP receptors. Galcanezumab is indicated for the prophylactic treatment of migraine in adult patients with at least four migraine days per month. Galcanezumab is supplied as a solution for injection in a pre‑filled disposable pen. The first dose is 240 mg (from two syringes), followed by a monthly dose of 120 mg from one syringe. The clinical efficacy and safety of galcanezumab was demonstrated in three randomized, double‑blind, placebo‑controlled phase 3 studies (EVOLVE‑1 and EVOLVE‑2 studies in patients with episodic migraine, REGAIN study in patients with chronic migraine). Overall, adverse reactions in the studies led to treatment discontinuation in less than 2.5% of patients. Due to the injection site reaction, less than 0.5% of patients discontinued treatment. The theoretical part emphasizes the importance of CGRP in the pathophysiology of migraine, and describes the sites of CGRP excretion in the trigeminovascular system, the structure and distribution of CGRP receptors, the consequences of CGRP receptor activation in the trigeminovascular system and the pathways of CGRP removal from intracranial compartments. Finally, the mechanism of action of anti‑CGRP antibodies, their place in current clinical practice and their perspectives in the treatment of migraine are mentioned.
Key words: galcanezumab – CGRP – migraine – monoclonal antibodies – prophylactic treatment.
Farmakologická skupina, mechanismus účinku a indikace
Galkanezumab je antagonista CGRP (calcitonin gene related peptide) a formálně se řadí mezi analgetika, resp. antimigrenika (ATC kód N02CD02). Jedná se o rekombinantní humanizovanou monoklonální protilátku typu IgG4 produkovanou v buňkách ovarií křečíka čínského. Mechanismem účinku galkanezumabu je vazba CGRP, čímž je zabráněno jeho biologické aktivitě. Vůči CGRP vykazuje galkanezumab vysokou afinitu a jeho specificita je více než 10 000krát vyšší, než je specificita podobných peptidů (adrenomedulin, amylin, kalcitonin a intermedin). Galkanezumab je indikován v profylaktické léčbě migrény u dospělých pacientů s minimálně čtyřmi migrenózními dny v měsíci [1].
Dávkování
Galkanezumab je dodáván v lékové formě injekčního roztoku v předplněném jednorázovém peru. Roztok je třeba chránit před přímým slunečním zářením a uchovávat v chladničce (2–8 °C), mimo chladničku při teplotách do 30 °C až po dobu sedmi dní. Jedno předplněné pero obsahuje galcanezumabum 120 mg v 1 ml, roztok je určen k subkutánnímu podání. Pacient si může galkanezumab podávat injekčně sám do oblasti břicha, stehen, zadní strany paže nebo do gluteální oblasti; před aplikací je vhodné roztok ponechat 30 minut při pokojové teplotě. Při první aplikaci se podává celková dávka 240 mg (ze dvou injekčních per), poté je aplikována každý měsíc dávka 120 mg z jednoho injekčního pera [1].
Farmakokinetické vlastnosti
Místo vpichu injekce (břicho, stehno, paže, gluteální oblast) nemá vliv na absorpci galkanezumabu. Po podání úvodní dávky 240 mg je dosaženo maximální sérové koncentrace (cmax) přibližně 30 μg/ml v čase (tmax) za pět dní. Podáváním měsíčních dávek 120 mg je pak dosaženo ustálené (steady state) koncentrace přibližně 28 μg/ml. Zdánlivý distribuční objem galkanezumabu je 7,3 l, zdánlivá clearance přibližně 0,008 l/h a biologický poločas eliminace (t1/2) 27 dní. Obdobně jako endogenní IgG protilátky je galkanezumab degradován na malé peptidy a aminokyseliny a eliminován převážně v rámci intracelulárního katabolismu [1].
Klinické zkušenosti
Klinická účinnost a bezpečnost
galkanezumabu byly u dospělých pacientů (n = 2 886)
hodnoceny ve třech randomizovaných, dvojitě zaslepených
a placebem kontrolovaných studiích fáze III. Šlo o dvě
studie pacientů s epizodickou migrénou (EVOLVE 1
a EVOLVE 2) a jednu s chronickou migrénou
(REGAIN) [1]. Napříč studiemi došlo k předchozímu selhání
alespoň jedné profylaktické léčby migrény z důvodu
neúčinnosti u přibližně jedné třetiny pacientů
a u přibližně 16 % pacientů napříč studiemi došlo
k předchozímu selhání alespoň dvou profylaktických
terapií. Pacienti dostávali placebo, galkanezumab 120 mg/měsíc
(s úvodní dávkou 240 mg v prvním měsíci) nebo
galkanezumab 240 mg/měsíc a bylo jim povoleno užívat
akutní úlevovou medikaci k léčbě migrény. Ve všech
třech studiích byla primární mírou účinnosti celková průměrná
změna v počtu dní s migrenózní bolestí hlavy za měsíc
(monthly migraine days, MMD, v publikacích o galkanezumabu
označované jako MHD, migraine headache days) od výchozí
hodnoty. Pomocí dotazníku Migraine Specific Quality of Life
Questionnaire (MSQ) byl hodnocen dopad migrény na každodenní
aktivity (pracovní a každodenní činnosti, vztahy s rodinou
a přáteli, volný čas, produktivita, koncentrace, energie
a únava) a pomocí dotazníku Migraine Disability
Assessment (MIDAS) byla hodnocena míra funkčního postižení
migrénou. Oproti výchozím hodnotám bylo ve skupinách
pacientů užívajících galkanezumab 120 mg i 240 mg
ve srovnání s placebem prokázáno statisticky významné
snížení počtu MMD a zlepšení skóre dotazníku MSQ
a MIDAS. Ve sloučených datech ze studií EVOLVE 1
a EVOLVE 2 byl pozorován rozdíl ve snížení
průměrného počtu MMD mezi skupinami s galkanezumabem 120 mg
a s placebem ‒2,69 dne (p < 0,001)
a mezi skupinami s galkanezumabem 240 mg a s placebem
‒2,78 dne (p < 0,001). Při subanalýze
pacientů, u nichž selhaly dvě a více možností
profylaktické léčby, byl tento rozdíl ‒2,64 dne (p < 0,001)
mezi skupinami 120 mg a placebo a ‒3,04 dne (p < 0,001)
mezi skupinami 240 mg a placebo. Při vstupu do studie
REGAIN 64 % pacientů s chronickou migrénou nadužívalo
analgetika. V segmentu pacientů, u nichž selhaly dvě
a více profylaktické léčby, bylo dosaženo snížení počtu
MMD ‒4,48 dne (p < 0,001) mezi skupinami 120 mg
a placebo a ‒1,86 dne (p < 0,01)
mezi skupinami 240 mg a placebo. U pacientů
s nadužíváním analgetik byl rozdíl ve snížení
MMD mezi skupinami galkanezumab 120 mg a placebo a mezi
skupinami 240 mg a placebo ‒2,53 dne (p < 0,001),
respektive ‒2,26 dne (p < 0,001).
Ve studii EVOLVE 1, sledující pacienty s epizodickou
migrénou, činil podíl respondérů (pacientů s ≥ 50%
red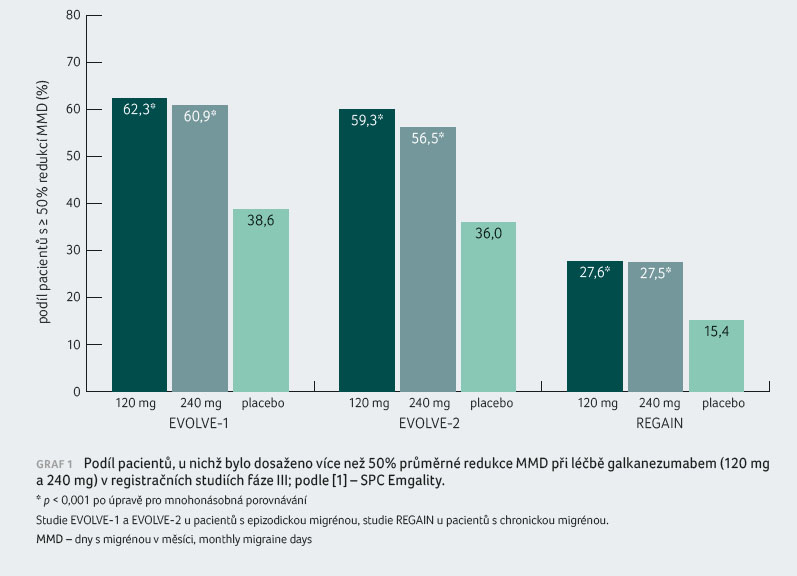 ukcí MMD) při léčbě galkanezumabem 120 mg a placebem
62,3 % a 38,6 % (p = 0,001). Ve studii
EVOLVE 2 byl replikován obdobný výsledek (59,3 %, resp.
36,0 %; p = 0,001). U pacientů s chronickou
migrénou ve studii REGAIN bylo dosaženo podílu
50 % respondérů v rameni s galkanezumabem 120 mg
27,6 % a 15,4 % v rameni s placebem (p = 0,001).
Dlouhodobá účinnost (po dobu až jednoho roku) galkanezumabu
byla ověřena v otevřené studii s pacienty s epizodickou
nebo chronickou migrénou (s průměrnou výchozí hodnotou
10,6 MMD), kteří dostávali galkanezumab 120 mg/měsíc
(s úvodní dávkou 240 mg v prvním měsíci) nebo
galkanezumab 240 mg/měsíc. Celkové průměrné snížení počtu
MMD za měsíc oproti výchozí hodnotě (zprůměrované
za léčebné období) činilo 5,6 dne pro dávku 120 mg
a 6,5 dne pro dávku 240 mg. Ve 12. měsíci
léčby bylo dosaženo 50% snížení počtu MMD u více než
72 % pacientů. Podíl počtu pacientů, u nichž bylo
dosaženo více než 50% redukce MMD při léčbě galkanezumabem
v registračních studiích fáze III, je znázorněn v grafu 1 [1]. Na základě výsledků těchto studií byla k léčbě
schválena dávka galkanezumabu 120 mg ‒ tj. 120 mg
galkanezumabu podáno subkutánně jednou za měsíc, s první
úvodní dávkou 240 mg.
ukcí MMD) při léčbě galkanezumabem 120 mg a placebem
62,3 % a 38,6 % (p = 0,001). Ve studii
EVOLVE 2 byl replikován obdobný výsledek (59,3 %, resp.
36,0 %; p = 0,001). U pacientů s chronickou
migrénou ve studii REGAIN bylo dosaženo podílu
50 % respondérů v rameni s galkanezumabem 120 mg
27,6 % a 15,4 % v rameni s placebem (p = 0,001).
Dlouhodobá účinnost (po dobu až jednoho roku) galkanezumabu
byla ověřena v otevřené studii s pacienty s epizodickou
nebo chronickou migrénou (s průměrnou výchozí hodnotou
10,6 MMD), kteří dostávali galkanezumab 120 mg/měsíc
(s úvodní dávkou 240 mg v prvním měsíci) nebo
galkanezumab 240 mg/měsíc. Celkové průměrné snížení počtu
MMD za měsíc oproti výchozí hodnotě (zprůměrované
za léčebné období) činilo 5,6 dne pro dávku 120 mg
a 6,5 dne pro dávku 240 mg. Ve 12. měsíci
léčby bylo dosaženo 50% snížení počtu MMD u více než
72 % pacientů. Podíl počtu pacientů, u nichž bylo
dosaženo více než 50% redukce MMD při léčbě galkanezumabem
v registračních studiích fáze III, je znázorněn v grafu 1 [1]. Na základě výsledků těchto studií byla k léčbě
schválena dávka galkanezumabu 120 mg ‒ tj. 120 mg
galkanezumabu podáno subkutánně jednou za měsíc, s první
úvodní dávkou 240 mg.
Bezpečnostní profil, kontraindikace a lékové interakce
Bezpečnost a účinnost galkanezumabu u dětí ve věku od šesti do 18 let nebyla stanovena. U pacientů ve věku ≥ 65 let není třeba upravovat dávku, avšak jsou k dispozici jen omezená data. Při mírné až středně závažné poruše funkce ledvin či jater není třeba úprava dávky. Do klinických studií nebyli zařazeni pacienti s nedávnými kardiovaskulárními příhodami (infarkt myokardu, nestabilní angina pectoris, bypass koronárních tepen, cévní mozková příhoda, hluboká žilní trombóza). Imunogenita ve smyslu tvorby neutralizačních protilátek proti galkanezumabu není z klinického hlediska pokládána za relevantní. V animálních studiích účinku toxicity na embryofetální vývoj nebyl zjištěn negativní vliv a dosud nebyl prokázán ani kancerogenní potenciál při dlouhodobé léčbě. U lidí byla maximální podávaná dávka 600 mg, aniž by byly pozorovány přímé toxické účinky. Lékové interakce galkanezumabu nejsou předpokládány a ve studiích nebyly hodnoceny [1]. Kontraindikací je hypersenzitivita na léčivou nebo některou z pomocných látek (histidin, monohydrát histidin hydrochloridu, polysorbát 80).
Nežádoucí účinky
V klinických studiích profylaxe migrény bylo galkanezumabu vystaveno více než 2 500 pacientů. Nejčastějšími hlášenými nežádoucími účinky pro dávku 120 mg byla bolest v místě vpichu injekce (10,1 %) a reakce v místě vpichu (erytém, pruritus, podlitina a/nebo otok; 9,9 %). Závrať (0,7 %), zácpa (1,0 %), pruritus (0,7 %) nebo kopřivka (0,3 %) postihly méně než jednu osobu ze sta. Nežádoucí účinky ve studiích celkově vedly k ukončení léčby u méně než 2,5 % pacientů. Z důvodu reakce v místě vpichu byla ukončena léčba u méně než 0,5 % pacientů. Objeví li se závažná hypersenzitivní reakce (anafylaxe, angioedém, kopřivka), podávání galkanezumabu musí být neprodleně ukončeno a je třeba zahájit odpovídající léčbu. Galkanezumab může mít v individuálních případech mírný vliv na schopnost řídit nebo obsluhovat stroje. Podezření na nežádoucí účinky po registraci léčivého přípravku by mělo být hlášeno [1].
Těhotenství a kojení
Podávání galkanezumabu v těhotenství je vhodné se vyhnout, protože imunoglobuliny třídy IgG4 mohou procházet placentární bariérou. V animálních studiích však nebyly zjištěny přímé či nepřímé škodlivé účinky vedoucí k reprodukční toxicitě. Zda je galkanezumab vylučován do mateřského mléka, není známo. Zvláště v průběhu prvních dní po porodu, kdy jsou lidské protilátky třídy IgG vylučovány do mateřského mléka, nelze vyloučit riziko pro kojené děti [1].
Role CGRP v patofyziologii migrény
CGRP a jeho exkrece v trigeminovaskulárním systému
CGRP (α
izoforma) je vazoaktivní neuropeptid složený z 37 aminokyselin.
Již od svého objevu v roce 1983 byl dáván
do souvislosti s trigeminovaskulárním systémem a možnou
rolí v patofyziologii migrény. CGRP je považován za působek
s nejsilnějším vazodilatačním účinkem na intrakraniální
arterie. Fyziologická funkce CGRP však zůstává neobjasněna,
předpokládá se jeho vliv na kompenzační vazodilataci
u mozkové hypoxie [2,3]. CGRP je syntetizován v tělech
pseudounipolárních neuronů lokalizovaných v trigeminálním
gangliu a uvolňuje se z ganglia i z terminál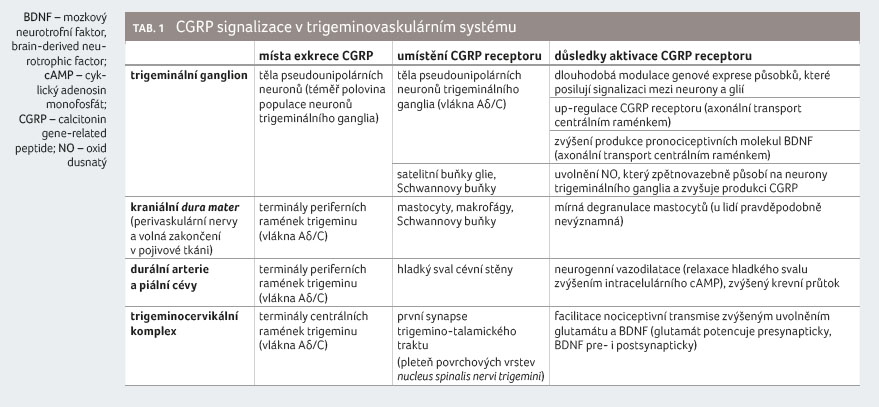 periferních a centrálních ramének trigeminu (vlákna Aδ/C).
Místa exkrece CGRP v trigeminovaskulárním systému jsou
uvedena v tabulce 1 a znázorněna na obrázku 1 [4]. Zdroje a místa exkrece CGRP v trigeminovaskulárním
systému byly identifikovány imunohistochemicky; uvolnění CGRP
bylo demonstrováno v ex vivo preparátech po stimulaci
kapsaicinem. Během záchvatu migrény byla u pacientů zjištěna
zvýšená koncentrace CGRP v plazmě z vena jugularis
interna, u migreniků však byla prokázána vyšší
koncentrace CGRP v periferní krvi, likvoru, slinách a slzách
i v období mezi záchvaty. Intravenózní infuze CGRP
indukovala u pacientů i zdravých kontrol bolest hlavy
podobnou migréně [3–5]. Zatímco uvolnění CGRP z trigeminálního
ganglia a meningeálních aferent není inhibováno triptany,
v experimentu byl takový centrální efekt triptanů průkazný
(ačkoliv není jisté, zda z klinického hlediska k jeho
průchodu přes hematoencefalickou bariéru dochází) [6].
periferních a centrálních ramének trigeminu (vlákna Aδ/C).
Místa exkrece CGRP v trigeminovaskulárním systému jsou
uvedena v tabulce 1 a znázorněna na obrázku 1 [4]. Zdroje a místa exkrece CGRP v trigeminovaskulárním
systému byly identifikovány imunohistochemicky; uvolnění CGRP
bylo demonstrováno v ex vivo preparátech po stimulaci
kapsaicinem. Během záchvatu migrény byla u pacientů zjištěna
zvýšená koncentrace CGRP v plazmě z vena jugularis
interna, u migreniků však byla prokázána vyšší
koncentrace CGRP v periferní krvi, likvoru, slinách a slzách
i v období mezi záchvaty. Intravenózní infuze CGRP
indukovala u pacientů i zdravých kontrol bolest hlavy
podobnou migréně [3–5]. Zatímco uvolnění CGRP z trigeminálního
ganglia a meningeálních aferent není inhibováno triptany,
v experimentu byl takový centrální efekt triptanů průkazný
(ačkoliv není jisté, zda z klinického hlediska k jeho
průchodu přes hematoencefalickou bariéru dochází) [6].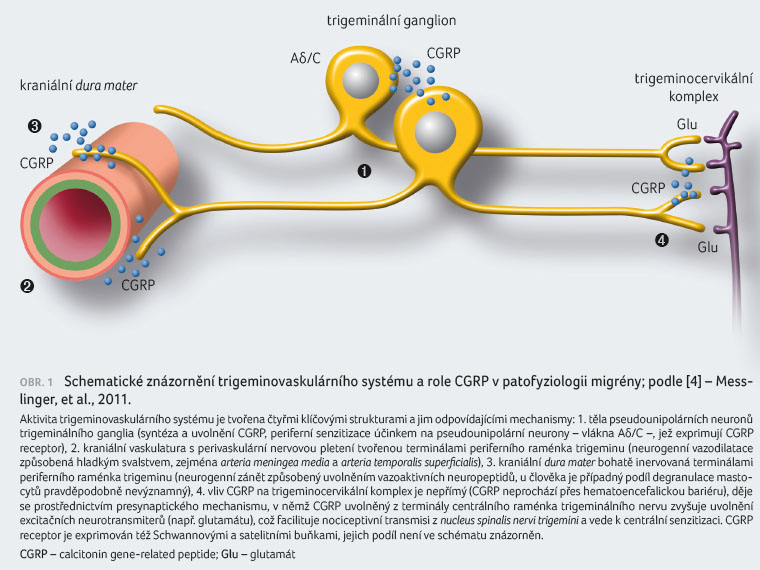
CGRP receptory v trigeminovaskulárním systému
CGRP receptory jsou heteromery složené z CLR (calcitonin receptor like receptor), RAMP1 (receptor activity modifying protein 1) a RCP (receptor component protein). CLR a RAMP1 jsou transmembránové proteiny, které společně tvoří vazebné místo pro CGRP, zatímco RCP tvoří intracelulární část celého receptoru [7]. Imunohistochemický průkaz kolokace CLR a RAMP1 indikuje místa exprese funkčního CGRP receptoru. Taková imunopozitivita byla nalezena v arteriích a mononukleárech (mastocytech, pravděpodobně i makrofázích) kraniální dura mater, v nervových vláknech a Schwannových buňkách. V trigeminálním gangliu byl prokázán výskyt obou transmembránových komponent CGRP receptoru téměř v polovině populace neuronů (vlákna Aδ/C), v cévách a gliových (Schwannových a satelitních) buňkách. Podobně byly potvrzeny v centrálních výběžcích trigeminu, resp. povrchových vrstvách nucleus spinalis nervi trigemini a v doprovodné glii. Zda těla neuronů v nucleus spinalis nervi trigemini také exprimují CGRP receptor, není jasné [6]. Tabulka 1 přináší detaily ohledně lokalizace CGRP receptoru v trigeminovaskulárním systému.
Důsledky aktivace CGRP receptoru
Vazodilatační účinek CGRP na intrakraniální arterie byl pozorován přímo (pomocí videomonitorace) nebo nepřímo (registrací krevního průtoku) [6]. Naopak nebyla prokázána přímá aktivace meningeálních aferent po experimentální aplikaci CGRP do oblasti dury nebo trigeminálního ganglia. Působení CGRP na degranulaci durálních mastocytů je u lidí pravděpodobně nevýznamné. Z hlediska nocicepce je za primární místo aktivace trigeminovaskulárního systému považována synapse na úrovni trigeminocervikálního komplexu [6]. CGRP ovlivňuje také signalizační mechanismy vlivem na axonální transport pronociceptivních působků (např. brain derived neurotrophic factor, glutamát) centrálním raménkem, pozitivním zpětnovazebným působením glie na neurony trigeminálního ganglia pomocí oxidu dusnatého, což vede ke zvýšení produkce CGRP, a dlouhodobým efektem na intracelulární signalizační mechanismy [6].
Drenáž CGRP z intrakraniálních kompartmentů
Uvolněné CGRP lze detekovat ve třech intrakraniálních kompartmentech: venózní krvi, mozkomíšním moku a tzv. glymfatickém systému. Koncentrace CGRP v mozkomíšním moku je pětkrát vyšší než v plazmě jugulární krve a může být dále zvýšena působením zánětlivých mediátorů (např. po intraventrikulární aplikaci v animálním modelu). Trigeminální ganglion a durální arterie se nacházejí mimo hematoencefalickou bariéru, zatímco piální cévy na povrchu mozkové kůry a prodloužené míchy jsou chráněny hematoencefalickou bariérou. Ačkoliv vlastní cévní zásobení prodloužené míchy je rovněž vybaveno hematoencefalickou bariérou, i z ní mohou molekuly velikosti peptidů difundovat na její povrch a do okolního mozkomíšního moku. CGRP uvolněný mimo hematoencefalickou bariéru (z aferentních zakončení inervujících durální arterie nebo z trigeminálního ganglia) je kapilárami a venulami odváděn do venózní krve sinus sagitalis superior a vena jugularis interna. CGRP uvolněný v blízkosti trigeminocervikálního komplexu (a podobně CGRP uvolněný do okolí piálních arterií a vén, které jsou rovněž chráněny hematoencefalickou bariérou) difunduje do perivaskulárních prostor a následně je v mozkomíšním moku sváděn subarachnoidálním prostorem do cisterna magna. Z mozkomíšního moku se část CGRP rychle dostává přes arachnoidální (Pacchionské) granulace do sinus sagitalis superior a je tak odváděna do jugulární krve. Takzvaný glymfatický systém, který odvádí odpadní látky z mezibuněčných prostor (mezi stěnou cév a obklopující astroglií) do perivaskulárního (Virchowova‒Robinova) prostoru a dále do lymfatických cév doprovázejících sinus sagitalis superior a ústících do cervikálního lymfatického systému, pravděpodobně také zajišťuje odstranění CGRP uvolněného z trigeminálních aferent inervujících kortikální arterioly [6]. Otázka distribuce CGRP mezi různé intrakraniální kompartmenty může v budoucnu nabýt na významu, např. v souvislosti s experimentálním průkazem kolabujících perivaskulárních prostor během vlny experimentálně indukované kortikální depolarizace (cortical spreading depression, CSD), která je považována za patofyziologický korelát migrenózní aury [8].
Mechanismus účinku anti CGRP protilátek
Ačkoliv k hlavnímu
nociceptivnímu účinku CGRP dochází na úrovni
trigeminocervikálního komplexu, inhibice účinku CGRP
i na ostatních úrovních ‒ ve strukturách
nechráněných hematoencefalickou bariérou ‒ vede ke snížení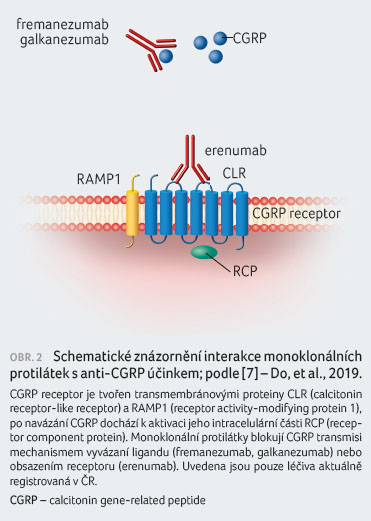 trigeminální nociceptivní transmise. Z hlediska možného
terapeutického využití anti CGRP působení u migrény
byly studovány dva rozdílné přístupy vyvolání anti CGRP
účinku: 1. tzv. malé molekuly, které působí jako
antagonisté CGRP receptoru (gepanty), a 2. monoklonální
protilátky namířené proti CGRP (galkanezumab, fremanezumab) nebo
proti CGRP receptoru (erenumab), obrázek 2. Na rozdíl
od gepantů se nepočítá s možným využitím
monoklonálních protilátek k akutní léčbě migrény.
Výhodou profylaktické léčby migrény přístupem založeným
na monoklonálních protilátkách je vysoká specificita vazby
na cílovou strukturu, extrahepatální metabolizace a nízký
výskyt nežádoucích účinků [3]. Prozatím jediná
experimentální studie však ukazuje, že účinek monoklonálních
protilátek blokujících transmisi CGRP může být rozdílný
v případě odlišných mechanismů uplatňujících se
v rozvoji záchvatu migrény: v experimentu fremanezumab
neinhiboval arteriální dilataci a extravazaci plazmatických
proteinů u myší, u nichž byly tyto fenomény navozeny
vyvoláním CSD, zatímco tuto odpověď blokoval, pokud byla
navozena prostřednictvím infuze CGRP [9].
trigeminální nociceptivní transmise. Z hlediska možného
terapeutického využití anti CGRP působení u migrény
byly studovány dva rozdílné přístupy vyvolání anti CGRP
účinku: 1. tzv. malé molekuly, které působí jako
antagonisté CGRP receptoru (gepanty), a 2. monoklonální
protilátky namířené proti CGRP (galkanezumab, fremanezumab) nebo
proti CGRP receptoru (erenumab), obrázek 2. Na rozdíl
od gepantů se nepočítá s možným využitím
monoklonálních protilátek k akutní léčbě migrény.
Výhodou profylaktické léčby migrény přístupem založeným
na monoklonálních protilátkách je vysoká specificita vazby
na cílovou strukturu, extrahepatální metabolizace a nízký
výskyt nežádoucích účinků [3]. Prozatím jediná
experimentální studie však ukazuje, že účinek monoklonálních
protilátek blokujících transmisi CGRP může být rozdílný
v případě odlišných mechanismů uplatňujících se
v rozvoji záchvatu migrény: v experimentu fremanezumab
neinhiboval arteriální dilataci a extravazaci plazmatických
proteinů u myší, u nichž byly tyto fenomény navozeny
vyvoláním CSD, zatímco tuto odpověď blokoval, pokud byla
navozena prostřednictvím infuze CGRP [9].
Zařazení anti CGRP protilátek do současné palety léčiv
Léčba migrény spočívá v akutní (symptomatické) léčbě jednotlivého záchvatu a v profylaktické (preventivní) léčbě, při níž dochází ke snížení frekvence záchvatů migrény. Za kandidáty profylaktické léčby je nutno považovat okolo 25 % pacientů s migrénou [10]. Jako léky první volby v profylaktické léčbě migrény se používají tzv. konvenční profylaktika. Jedná se o heterogenní skupinu léčiv s jistými důkazy účinku, používaných však na základě doporučení odborných společností (v ČR většina těchto léčiv nemá registrovanou indikaci pro migrénu). Jejich hlavními nevýhodami jsou nespecifický a často i neznámý mechanismus účinku, relativně nízká účinnost (obvykle < 50% redukce MMD), velmi častý výskyt nežádoucích účinků, určitá časová latence od zahájení léčby k dosažení pozitivního účinku a také nutnost denního užívání perorální formou a postupné titrace. Naopak anti CGRP protilátky přinášejí, kromě vyšší účinnosti a bezpečnosti, i možnost aplikace jednou měsíčně (případně jednou za tři měsíce) formou subkutánní injekce.
Zahájení léčby anti CGRP protilátkami je v ČR indikováno u pacientů starších 18 let trpících epizodickou migrénou (≥ 4 MMD) nebo chronickou migrénou, u kterých došlo k předchozímu selhání nebo intoleranci dvou nebo více konvenčních profylaktik, přičemž musí být zdokumentováno alespoň jedno selhání minimálně tříměsíční profylaktické léčby. Z konvenčních profylaktik je požadováno použití alespoň jednoho ze dvou antiepileptik (topiramát a/nebo valproát) a jednoho, pro pacienta vhodně zvoleného, léčiva ze skupiny betablokátorů (metoprolol, propranolol, bisoprolol), antidepresiv (amitriptylin, venlafaxin) nebo blokátorů kalciových kanálů (cinarizin, flunarizin). V ČR jsou registrovány jak monoklonální protilátky vázající CGRP (galkanezumab, fremanezumab), tak blokující CGRP receptor (erenumab). Jejich preskripce je vázána na centra pro diagnostiku a léčbu bolestí hlavy [11]. Léčba anti CGRP protilátkami je kontraindikována v těhotenství a v době kojení [1].
Efekt konvenční i anti CGRP profylaktické léčby musí být řádně zdokumentován, ideálně pomocí kalendáře bolestí hlavy. Za respondéra na anti CGRP léčbu je považován pacient, u kterého bylo po třetím měsíci léčby dosaženo ≥ 50% redukce počtu MMD (oproti průměrnému počtu MMD za poslední tři kalendářní měsíce před zahájením léčby) a u něhož tato redukce přetrvává alespoň v jednom ze tří po sobě následujících měsíců.
Perspektivy anti CGRP léčby migrény
V České republice je počet kandidátů léčby anti CGRP protilátkami odhadován na 23 000 dospělých pacientů s migrénou [12]. Obecně zatím přetrvává optimismus vyvolaný příchodem sofistikované a dostupné profylaktické léčby migrény pomocí monoklonálních protilátek. Na základě dostupných dat lze skutečně oprávněně tvrdit, že jde, oproti konvenčním profylaktikům, o léčbu superiorní z hlediska účinnosti a bezpečnosti. Podobně jako po příchodu nových technologií obecně je však možné i u anti CGRP protilátek v dohledné době očekávat podobný vývoj vnímání a používání této léčby odbornou veřejností jako tzv. hype: naděje a očekávání rostou k vrcholu, avšak v případě jistého nadsazení jsou vystřídány propadem do fáze určitého zklamání. Teprve poté se technologie pozvolna etabluje v každodenní praxi, až je nakonec používána zcela rutinně a v dlouhodobém horizontu pak její užití dosahuje maximálního potenciálu a prospěchu pro pacienty. V tomto ohledu je třeba počítat s dosud nevídaně vysokým, přitom však u některých pacientů velmi limitovaným přínosem anti CGRP léčby. Omezená účinnost spočívá zejména v rezistenci onemocnění u určité části pacientů (non respondéři), která zatím není zcela objasněna [9]. U většiny pacientů však skutečně dochází ke zvýšení kvality života následkem podstatné redukce MMD [13,14]. Přímé porovnání účinnosti monoklonálních protilátek namířených proti CGRP nebo proti CGRP receptoru není k dispozici. Nicméně analýza tzv. léčebného zisku u pacientů s epizodickou a chronickou migrénou naznačuje obdobnou účinnost monoklonálních protilátek nezávisle na cíli (receptor nebo ligand). Klinické studie s jednotlivými anti CGRP protilátkami jsou navíc poměrně heterogenní zejména ve smyslu podílu epizodických/chronických a naivních/předléčených pacientů, jejich srovnání je tedy metodologicky komplikované. Přestože v ČR je preskripce anti CGRP protilátek vázána na síť center pro diagnostiku a léčbu bolestí hlavy, úkolem každého neurologa by mělo být nejen standardní vedení konvenční profylaktické léčby, ale také včasná identifikace potenciálních kandidátů biologické léčby. Pacienti s migrénou, kteří splňují indikační kritéria, dostávají v galkanezumabu účinnou a bezpečnou profylaktickou léčbu.
Článek byl zkrácen a redakčně upraven.
Seznam použité literatury
- [1] SPC Emgality. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/emgality‑epar‑product‑information_cs.pdf
- [2] Russell FA, King R, Smillie SJ, et al. Calcitonin gene‑related peptide: physiology and pathophysiology. Physiol Rev 2014; 94: 1099‒1142.
- [3] Edvinsson L, Goadsby PJ. Discovery of CGRP in relation to migraine. Cephalalgia 2019; 39: 331‒332.
- [4] Messlinger K, Fischer MJ, Lennerz JK. Neuropeptide effects in the trigeminal system: pathophysiology and clinical relevance in migraine. Keio J Med 2011; 60: 82‒89.
- [5] Bigal ME, Walter S, Rapoport AM. Calcitonin Gene‑Related Peptide (CGRP) and Migraine Current Understanding and State of Development. Headache 2013; 53: 1230‒1244.
- [6] Messlinger K. The big CGRP flood ‒ sources, sinks and signalling sites in the trigeminovascular system. J Headache Pain 2018; 19: 22.
- [7] Do TP, Guo S, Ashina M. Therapeutic novelties in migraine: new drugs, new hope? J Headache Pain 2019; 20: 37.
- [8] Schain AJ, Melo‑Carrillo A, Strassman AM, Burstein R. Cortical spreading depression closes Paravascular space and impairs Glymphatic flow: implications for migraine headache. J Neurosci 2017; 37: 2904–2915.
- [9] Schain AJ, Melo‑Carrillo A, Stratton J, et al. CSD‑Induced Arterial Dilatation and Plasma Protein Extravasation Are Unaffected by Fremanezumab: Implications for CGRP′s Role in Migraine with Aura. J Neurosci 2019; 39: 6001‒6011.
- [10] Lipton RB, Bigal ME, Diamond M, et al. Migraine prevalence, disease burden, and the need for preventive therapy. Neurology 2007; 68: 343‒349.
- [11] Nežádal T, Marková J, Bártková A, Klečka L. CGRP monoklonální protilátky v léčbě migrény – indikační kritéria a terapeutická doporučení pro Českou republiku. Cesk Slov Neurol N 2020; 116: 445–451.
- [12] Dolezil D, Markova J, Klimes J, et al. An investigation into the prevalence of migraine and its prophylactic treatment patterns in the Czech republic: an observational study. J Pain Res 2020; 13: 2895–2906.
- [13] Buse DC, Gandhi SK, Cohen JM, et al. Improvements across a range of patient‑reported domains with fremanezumab treatment: results from a patient survey study. J Headache Pain 2020; 21: 109.
- [14] Ford JH, Kurth T, Starling AJ, et al. Migraine Headache Day Response Rates and the Implications to Patient Functioning: An Evaluation of 3 Randomized Phase 3 Clinical Trials of Galcanezumab in Patients With Migraine. Headache 2020; 60: 2304‒2319.