Gemtuzumab ozogamicin
Gemtuzumab ozogamicin (přípravek Mylotarg) představuje konjugát monoklonální protilátky a léčiva (antibody drug conjugate, ADC). Je složen z IgG4 monoklonální protilátky, která cílí na antigen CD33, a kovalentně vázané cytotoxické látky N‑acetyl‑gama-kalicheamicin (obr. 1) [1]. Strategie ADC představuje moderní přístup k léčbě, který kombinuje efekt cytostatika a specificitu monoklonální protilátky, jež transportuje účinnou látku na místo působení.
Indikace
Přípravek Mylotarg je indikován ke kombinované terapii s daunorubicinem a cytarabinem při léčbě pacientů ve věku od 15 let s dříve neléčenou CD33 pozitivní akutní myeloidní leukemií (AML) vzniklou de novo, s výjimkou akutní promyelocytární leukemie (APL) [2].
Mechanismus účinku
Monoklonální protilátka anti CD33 představuje transportní nosič vlastního účinného cytostatika ozogamicinu. Antigen CD33 je specifickým biomarkerem prekurzorových myeloidních buněk. Je přítomen na povrchu leukemických buněk, nikoliv už na povrchu zralých leukocytů. Jeho exprese byla doložena až u 90 % případů AML, což z něj činí ideální léčebný cíl [3,4].
Protilátka se na tento antigen specificky váže, komplex je internalizován do nitra buňky, kde se z něj působením buněčných enzymů uvolní cytotoxicky působící látka N acetyl gama kalicheamicin dimetylhydrazid. Uvolněné cytostatikum putuje do jádra, kde indukuje zlomy DNA, vyvolává zástavu buněčného cyklu a smrt buňky (obr. 2) [5].
Gemtuzumab ozogamicin patří mezi cílené léky – působí cíleně pouze na buňky s povrchovým antigenem CD33. Dokud je cytostatikum vázáno na protilátku, je neúčinné.
Dávkování
Injekční lahvička obsahuje 5 mg
gemtuzumab ozogamicinu, po rekonstituci obsahuje koncentrovaný
roztok 1 mg/ml gemtuzumab ozogamicinu. Přípravek
MYLOTARG je možné podat pouze pacientům, kteří jsou vhodní
k léčbě intenzivní indukční chemoterapií [2]. Během
infuzního podání by měl být monitorován tep, krevní tlak
a teplota. Přípravek se nesmí podávat intravenózní (i.v.)
rychlou nebo bolusovou injekcí. Schéma dávkování podrobně
ukazuje tabulka 1.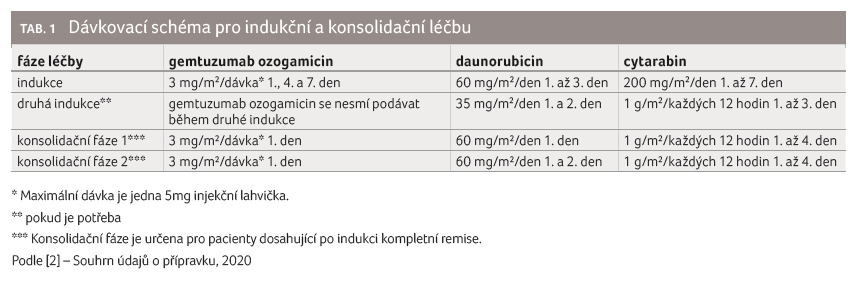
Indukce
Doporučená dávka gemtuzumab ozogamicinu je aplikována dvouhodinovou nitrožilní infuzí 1., 4. a 7. den v kombinaci s daunorubicinem podávaným ve 30minutové infuzi 1.−3. den a s cytarabinem podávaným kontinuální infuzí 1.−7. den (tab. 1).
Konsolidace
U pacientů, kteří po indukci dosáhnou kompletní remise, se doporučují až dvě fáze konsolidační terapie (tab. 1). Kompletní remise je definována jako < 5 % blastů v normocelulární kostní dřeni a absolutní počet neutrofilů > 1,0 × 109 buněk/l s počty trombocytů ≥ 100 × 109/l v periferní krvi (bez krevní transfuze).
Opatření při léčbě
Ke zmírnění příznaků reakce spojené s infuzí je doporučena premedikace kortikosteroidy, antihistaminiky a paracetamolem jednu hodinu před infuzí [2]. V prevenci rozvoje hyperurikemie spojené s nádorovým rozpadem je vhodné zajistit dostatečnou hydrataci a podání léčivých přípravků k ovlivnění hyperurikemie [2].
V případě hyperleukocytózy nebo výskytu nežádoucích účinků je možné harmonogram léčby upravit, podrobněji viz Souhrn údajů o přípravku [2].
Ženy ve fertilním věku a partnery žen ve fertilním věku je potřeba upozornit na nutnost používání dvou účinných metod antikoncepce během léčby a nejméně po dobu sedmi měsíců u žen a čtyř měsíců u mužů po poslední dávce [2].
Podání u zvláštních populací
U pacientů s lehkou a středně těžkou poruchou funkce ledvin není potřeba upravovat dávkování. U nemocných trpících těžkou poruchou funkce ledvin nebyl přípravek hodnocen. Přípravek nepodléhá renální clearance, ale jeho farmakokinetika nebyla u pacientů s těžkou poruchou funkce ledvin sledována [2].
U pacientů s poruchou funkce jater definovanou jako hodnota celkového bilirubinu ≤ dvojnásobek horní hranice normálu (ULN) a aktivita aspartátaminotransferázy/alaninaminotransferázy ≤ 2,5 × ULN není potřeba žádná úprava zahajovací dávky. Při vyšších hodnotách je nutno s podáním přípravku vyčkat do úpravy hodnot [2].
U pacientů ve věku 65 let a starších není potřeba upravovat dávkování. U nemocných mladších 15 let nebyla účinnost a bezpečnost přípravku stanovena, přípravek je indikován pro pacienty ve věku od 15 let [2].
Farmakokinetické vlastnosti
Gemtuzumab ozogamicin představuje konjugát monoklonální protilátky a N acetyl gama kalicheamicinu, který se hydrolyticky štěpí až po internalizaci do buňky. Systémové koncentrace nekonjugovaného kalicheamicinu jsou nízké, systémově jsou sledovány farmakokinetické charakteristiky monoklonální protilátky (hP67.6).
Při infuzním podání gemtuzumab ozogamicinu v dávce 3 mg/m2 v 1., 4. a 7. den je udávána maximální plazmatická koncentrace hP67.6 (na konci infuze) podle predikcí 0,38 mg/l po první dávce a 0,63 mg/l po třetí dávce. Celkový distribuční objem hP67.6 činí přibližně 25 l. Primární biotransformaci léčiva představuje hydrolytické uvolnění N acetyl gama kalicheamicin dimetylhydrazidu, který je pak neenzymaticky redukován. Plazmatické koncentrace nekonjugovaného kalicheamicinu jsou velmi nízké. Terminální eliminační poločas hP67.6 je u typického pacienta po podání doporučené dávky (3 mg/m2) odhadován na zhruba 160 hodin [2].
Lékové interakce
N acetyl gama kalicheamicin dimetylhydrazid je primárně metabolizován neenzymatickou redukcí. Z tohoto důvodu se interakce na podkladě cytochromu P450 nebo UGT (uridin difosfát glukuronosyltransferázy) nepředpokládají [2].
Léčivo vykazuje slabý potenciál indukovat nebo inhibovat aktivitu izoenzymů cytochromu P450, UGT‚ P glykoproteinu i dalších lékových transportérů.
Při kombinaci gemtuzumab ozogamicinu s daunorubicinem a cytarabinem neprokázaly farmakokinetické analýzy klinicky významné změny ve farmakokinetice těchto léčiv [2].
Účinnost léčby
Klinickou účinnost a bezpečnost léčby gemtuzumab ozogamicinem potvrdila randomizovaná klinická studie fáze III ALFA 0701 [6]. Toto otevřené multicentrické hodnocení porovnávalo účinnost standardního chemoterapeutického indukčního režimu daunorubicin + cytarabin a léčebného režimu, do kterého byl přidán gemtuzumab ozogamicin. Do sledování byli zařazeni dosud neléčení pacienti ve věku 50−70 let s diagnózou akutní myeloidní leukemie vzniklé de novo. Medián věku sledovaných pacientů byl 62 let, většina nemocných (87,8 %) měla na začátku léčby tělesnou výkonnost dle bodovací škály Eastern Cooperative Oncology Group (ECOG PS) 0−1.
Primárním cílovým ukazatelem bylo přežití bez příhody (event free survival, EFS) definované jako doba od randomizace do relapsu, úmrtí z jakékoliv příčiny nebo nedosažení kompletní remise (complete remission, CR) nebo CR bez kompletního obnovení počtu trombocytů (CRp). Dále byly hodnoceny celkové přežití (overall survival, OS), podíl pacientů s CR, přežití bez relapsu (relapse free survival, RFS) a bezpečnost léčby.
Randomizováno bylo celkem 280 pacientů
v poměru 1 : 1, kteří dostávali konvenční indukční
chemoterapii 3 + 7 (daunorubicin 60 mg/m2/den
1.−3. den + cytarabin 200 mg/m2/den
1.−7. den) – kontrolní rameno, nebo tuto léčbu
v kombinaci s gemtuzumab ozogamicinem (3 mg/m2/den
ve dnech 1, 4 a 7); celková dávka v infuzi nesměla
překročit jednu 5mg lahvičku). V případě, že byly
leukemické blasty ve vzorku kostní dřeně přítomny i v den
15, dostali pacienti druhou indukční léčbu. Pacienti s CR
nebo s CRp dostali dvě fáze konsolidační léčby zahrnující
opět daunorubicin + cytarabin ± gemtuzumab
ozogamicin (3 mg/m2/den 1. den) dle randomizace,
a to za předpokladu, že počet trombocytů byl v den
zahájení konsolidační léčby ≥ 50 × 109/l
[7].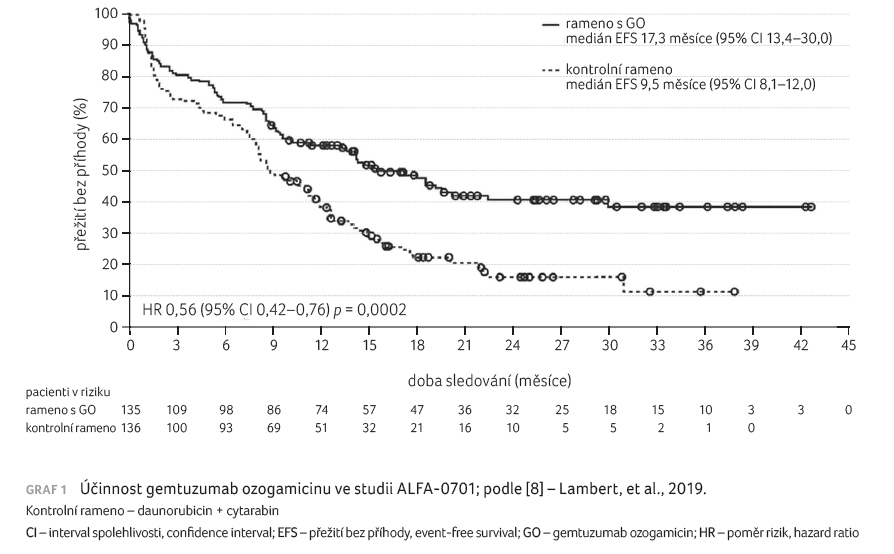
Klinická studie ALFA 0701
prokázala, že léčba redukovanou a frakcionovanou dávkou
gemtuzumab ozogamicinu, která byla přidána ke standardnímu
chemoterapeutickému režimu, signifikantně zlepšuje EFS
u dospělých pacientů s akutní myeloidní leukemií
vzniklou de novo (graf 1) [8]. Hlavní výsledky
účinnosti léčby v populaci mITT (modified
intention to treat, n = 271) ukazuje
u hodnocených parametrů tabulka 2.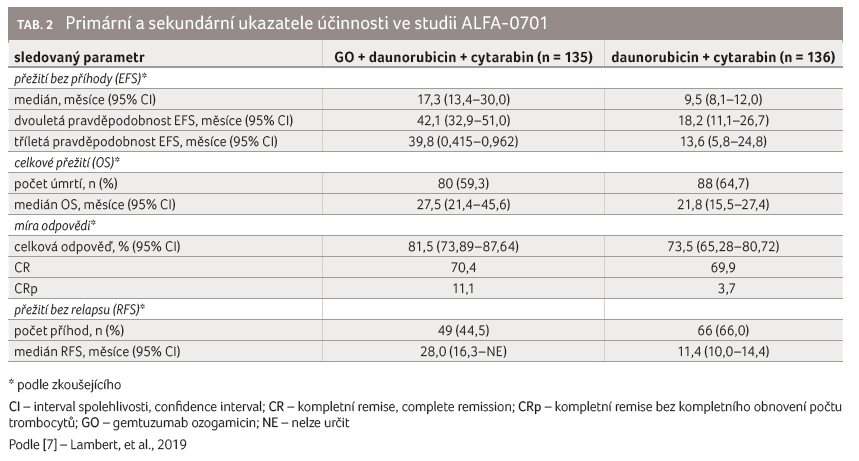
Analýza podskupin prokázala, že přidání gemtuzumab ozogamicinu ke standardní kombinované chemoterapii nezlepšilo EFS ve skupině pacientů s nepříznivým rizikovým profilem dle cytogenetiky (poměr rizik [HR, hazard ratio] 1,11; 95% interval spolehlivosti [CI, confidence interval] 0,63−1,95) [7]. Cytogenetické testování se užívá k hledání specifických genových mutací u určitých typů leukemie. Lidé, jejichž onemocnění má příznivou nebo středně příznivou cytogenetiku, mají lepší prognózu (odpověď na léčbu, riziko relapsu a přežití) než lidé, jejichž onemocnění má cytogenetiku nepříznivou [9].
Bezpečnost léčby a případná
opatření
Jedinou kontraindikací léčby gemtuzumab ozogamicinem uvedenou v Souhrnu údajů o přípravku je přecitlivělost na léčivou látku nebo na některou z pomocných látek přípravku [2].
Bezpečnostní profil přípravku je přijatelný, gemtuzumab ozogamicin, cílený lék k terapii akutní myeloidní leukemie, byl schválen pro léčbu na základě příznivého poměru přínosu a rizik. Na základě klinických zkušeností je třeba některým bezpečnostním rizikům věnovat zvýšenou pozornost.
Mezi klinicky relevantní závažné
nežádoucí účinky, které byly během léčby gemtuzumab
ozogamicinem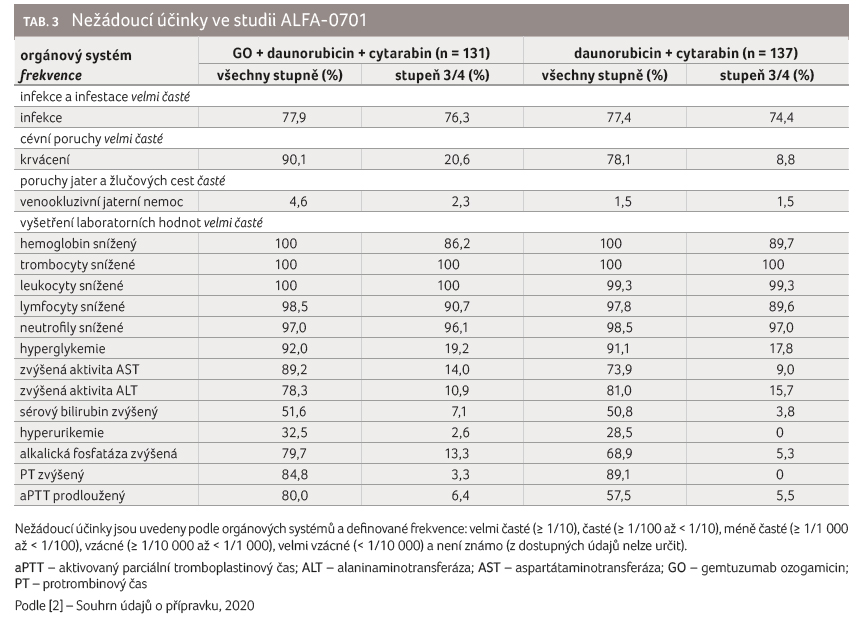 zaznamenány, patřily infekce, krvácení,
hepatotoxicita, reakce spojené s infuzí, syndrom nádorového
rozpadu, trombocytopenie a neutropenie. Výskyt sledovaných
nežádoucích účinků zaznamenaných v klinickém hodnocení
ALFA 0701 uvádí tabulka 3.
zaznamenány, patřily infekce, krvácení,
hepatotoxicita, reakce spojené s infuzí, syndrom nádorového
rozpadu, trombocytopenie a neutropenie. Výskyt sledovaných
nežádoucích účinků zaznamenaných v klinickém hodnocení
ALFA 0701 uvádí tabulka 3.
Reakce spojené s infuzí
Během léčby byly zaznamenány reakce spojené s infuzí včetně anafylaxe. Mohou se projevovat horečkou, třesavkou, hypotenzí, tachykardií nebo respiračními příznaky (dyspnoe, bronchospasmus). K reakci může dojít během 24 hodin od podání. Pacienti by měli být během infuzní aplikace pečlivě sledováni (monitorace krevního tlaku, tepu a tělesné teploty) a jednu hodinu před podáním přípravku je doporučena premedikace kortikoidy, antihistaminiky a paracetamolem (acetaminofenem, viz též Opatření při léčbě). V případě, že by se reakce vyskytla, je třeba infuzi ihned přerušit [2].
Hepatotoxicita
U pacientů léčených gemtuzumab ozogamicinem byly zaznamenány hepatotoxické nežádoucí účinky, včetně jaterního selhání a venookluzivní jaterní choroby/syndromu obstrukce jaterních sinusů (veno oclusive disease/sinusoidal obstruction syndrome, VOD/SOS). Pacienta je proto třeba pečlivě sledovat; před podáním každé dávky přípravku by měly být vyšetřeny hodnoty jaterních enzymů (alaninaminotransferáza, aspartátaminotransferáza), celkového bilirubinu a alkalické fosfatázy, měl by být monitorován případný přírůstek tělesné hmotnosti, ascites a hepatomegalie.
V případě výskytu VOD/SOS je nutné ukončit léčbu, při zvýšení uvedených laboratorních hodnot je doporučena případná úprava harmonogramu léčby (viz výše Dávkování) [2].
Syndrom nádorového rozpadu
Během klinického hodnocení byly zaznamenány případy TLS (tumor lysis syndrome). U pacientů s hyperleukocytárním onemocněním je třeba ke snížení rizika TLS zvážit před podáním přípravku leukoredukci (cílem je pokles počtu periferních leukocytů pod hodnotu 30 000/mm3) [2].
Myelosuprese
V průběhu léčby gemtuzumab ozogamicinem v kombinované terapii byly pozorovány zejména poklesy počtu leukocytů – neutropenie, a dále trombocytopenie. Mezi komplikace spojené s myelosupresí patří infekce (v případě neutropenie) a krvácivé případy (při trombocytopenii). Před aplikací každé dávky přípravku je doporučeno zkontrolovat kompletní krevní obraz.
Během léčby se mohou objevit únava, závratě a bolest hlavy, při činnostech vyžadujících soustředění (řízení auta, obsluha strojů) je třeba opatrnosti [2].
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Databáze Pharmacodia. Dostupné na: https://www.pharmacodia.com/yaodu/html/v1/biologics/e6be4c22a5963ab00dfe8f3b695b5332.html
- [2] Souhrn údajů o přípravku Mylotarg. Dostupné na: http://www.sukl.cz
- [3] Ricart AD. Antibody‑drug conjugates of calicheamicin derivative: gemtuzumab ozogamicin and inotuzumab ozogamicin. Clin Cancer 2011; 17: 6417–6427.
- [4] Ehninger A, Kramer M, Röllig C, et al. Distribution and levels of cell surface expression of CD33 and CD123 in acute myeloid leukemia. Blood Cancer J 2014; 4: e218.
- [5] Creative Biolabs. Dostupné na: https://www.creativebiolabs.net/gemtuzumab‑ozogamicin‑overview.htm
- [6] https://clinicaltrials.gov/ct2/show/NCT00927498
- [7] Lambert J, Pautas C, Terré C, et al. Gemtuzumab ozogamicin for de novo acute myeloid leukemia: final efficacy and safety updates from the open‑label, phase III ALFA‑0701 trial. Haematologica 2019; 104: 113–119.
- [8] Castaigne S, Pautas C, Terré C, et al. Effect of gemtuzumab ozogamicin on survival of adult patients with de‑novo acute myeloid leukaemia (ALFA‑0701): a randomised, open‑label, phase 3 study. Lancet 2012; 379: 1508–1516.
- [9] NICE guidance. Gemtuzumab ozogamicin for untreated acute myeloid leukaemia. Technology appraisal guidance [TA545] Published date: 14 November 2018. Dostupné na: https://www.nice.org.uk/guidance/ta545/chapter/1‑Recommendations