Inklisiran – velká naděje pro pacienty se závažnou poruchou metabolismu lipidů
Souhrn:
Táborský M. Inklisiran – velká naděje pro pacienty se závažnou poruchou metabolismu lipidů. Remedia 2022; 32: 106–115.
Kardiovaskulární onemocnění jsou nejčastější příčinou úmrtí v České republice, přičemž na prvním místě jsou klinické komplikace aterosklerózy – infarkt myokardu a cévní mozková příhoda. Zvýšená koncentrace LDL cholesterolu (LDL‑C) je jedním z nejlépe prozkoumaných a prokázaných příčinných rizikových faktorů rozvoje aterosklerózy – čím vyšší je koncentrace LDL‑C, tím větší je riziko vzniku kardiovaskulárních příhod, jako jsou infarkt myokardu nebo cévní mozková příhoda. Pro kardiovaskulární riziko je rozhodující jak koncentrace LDL‑C, tak kumulativní délka expozice jeho zvýšené hodnotě. Současné doporučené postupy proto za účelem redukce kardiovaskulárního rizika doporučují důsledné snižování koncentrace LDL‑C. I přes dostupné možnosti léčby v praxi však velké množství pacientů nedosahuje cílových hodnot uvedených v doporučených postupech. S malou interferující RNA (siRNA) inklisiranem je k dispozici možnost terapie pro dospělé s primární hypercholesterolemií (heterozygotní familiární a nefamiliární) nebo se smíšenou dyslipidemií vedle základní léčby statiny a/nebo jiné léčby snižující hodnotu lipidů – jako tzv. on top terapie, která rozšiřuje stávající spektrum léčby. Účinná látka dočasně inhibuje tvorbu enzymu proproteinová konvertáza subtilisin/kexin typu 9 (PCSK9), jemuž je připisována klíčová role v metabolismu cholesterolu. Pomocí přirozeného mechanismu RNA interference je cíleně potlačena syntéza PCSK9 v játrech, což díky zvýšené recyklaci LDL receptorů snižuje koncentraci LDL‑C v krevním oběhu. Klinické studie dokládají signifikantní (p < 0,001) a šest měsíců trvající snížení koncentrace LDL‑C při současné medikaci maximálně tolerované dávky statinu a ev. dalších hypolipidemik. Ve sdružené analýze studií fáze III bylo podáváním inklisiranu dosaženo poklesu hodnoty LDL‑C o 50–55 % již 90. den (3. měsíc) a tento pokles byl během dlouhodobé léčby udržován. Účinná látka je podávána zdravotnickým pracovníkem pomocí subkutánní injekce. Po iniciační dávce následuje další aplikace po třech měsících a v rámci dlouhodobé léčby se inklisiran podává každých šest měsíců.
Summary:
Taborsky M. Inclisiran – enormous hope for patients with severe lipid metabolism disease. Remedia 2022; 32: 106–115.
Cardiovascular diseases are the most frequent cause of death in the Czech Republic, where clinical complications of atherosclerosis, such as myocardial infarction and stroke, reach the top. High LDL cholesterol (LDL‑C) concentration is one of the best researched and demonstrated causal risk factors of developing atherosclerosis – the higher the concentration of LDL‑C is, the greater the risk of cardiovascular events, such as myocardial infarction and stroke. Aside from the LDL‑C concentration, the cardiovascular risk is determined by the cumulative exposition length to high LDL‑C levels. Thus, current recommendations advocate for strict lowering of LDL‑C concentration to reduce cardiovascular risk. Despite available treatment options, many patients in clinical practice do not reach the recommended target levels. With inclisiran, a small interfering RNA (siRNA), an option of so‑called on‑top therapy widening the current treatment spectrum becomes available for adults with primary hypercholesterolemia (heterozygous familial and non‑familial) or with mixed dyslipidemia accompanying the primary treatment with statins and/or other therapies lowering lipid levels. The active substance inhibits the production of proprotein convertase subtilisin kexin type 9 (PCSK9), which plays a key role in cholesterol metabolism. Using the native mechanism of RNA interference, it targets and suppresses the PCSK9 synthesis in the liver, increasing the recycling of LDL receptors and lowering the LDL‑C concentration in the blood. Clinical studies demonstrate a significant (p < 0.001) and six‑month‑long decrease in LDL‑C concentration with concurrent statin treatment at maximally tolerated doses or other hypolipidemic drugs. In a compound analysis of phase III studies, administering inclisiran led to a decrease in LDL‑C level of 50–55% at day 90 (third month), and long‑term treatment maintained the result. The active substance is subcutaneously administered by a health care professional 3 months after the initial dose and every 6 months during long‑term therapy.
Key words: inclisiran, LDL‑cholesterol, siRNA, treatment adherence
Úvod
V České republice zemře ročně přibližně 80 000 lidí na aterosklerotická kardiovaskulární onemocnění, jako jsou infarkt myokardu nebo cévní mozková příhoda a jiné. Nemoci cévního systému tak představují nejčastější příčinu úmrtí. V roce 2019 bylo 41,3 % všech úmrtí v ČR způsobeno kardiovaskulárními onemocněními [1,2].
LDL cholesterol – hlavní rizikový faktor pro vznik aterosklerózy
Při vzniku aterosklerózy se vzájemně ovlivňují různé kardiovaskulární rizikové faktory. Jedním z nejlépe prozkoumaných a zdokumentovaných rizikových faktorů pro vznik aterosklerózy je zvýšená koncentrace cholesterolu s nízkodenzitními lipoproteiny (LDL C). Podle konsenzuálního dokumentu Evropské společnosti pro aterosklerózu (European Atherosclerosis Society, EAS) prokazují genetické, epidemiologické, jakož i klinické studie, že mezi zvýšenou koncentrací LDL C a vznikem a progresí aterosklerózy existuje úzká příčinná souvislost [3].
Rozhodující je kumulativní expozice
Kardiovaskulární riziko určuje nejen výše koncentrace LDL C, ale také kumulativní trvání expozice jeho zvýšené koncentraci, protože aterosklerotické plaky se vyvíjejí progresivně, dokud tento rizikový faktor působí.
Nízká koncentrace LDL C podle definovaných cílových hodnot by proto měla být udržována pokud možno po celý život. Tímto způsobem lze konstantně minimalizovat množství cirkulujících aterogenních lipoproteinů, které se mohou ukládat ve stěně cév, a zpomalit tak progresi aterosklerotických plaků [3]. Z toho vyplývá potenciál dosáhnout desetinásobně významnějšího absolutního snížení míry celoživotního rizika rozvoje kardiovaskulárních příhod ve srovnání se zahájením hypolipidemické léčby v pozdější době, kdy kumulativní expozice rizikovému faktoru již vedla ke vzniku komplexních a nestabilních aterosklerotických plaků [3].
Dobrá tolerance také u velmi nízkých hodnot LDL C
Rovněž v sekundární prevenci lze riziko rozvoje závažných kardiovaskulárních příhod významně redukovat snížením koncentrace LDL C. To platí o to více, čím dále se koncentrace LDL C snižuje, jak ukazuje například metaanalýza 26 randomizovaných studií, které porovnávaly menší a větší redukci koncentrace LDL C [4]. Na 40 mg/dl (1 mmol/l) poklesu koncentrace LDL C se pětileté riziko takových příhod snížilo o 22 % (graf 1), aniž by v rámci z
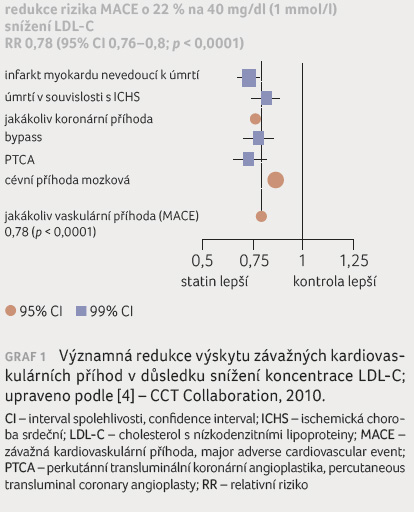
koumaného rozmezí koncentrací vzbuzovala pozornost prahová hodnota, pod níž se přínos oslabuje. Relativní účinky byly srovnatelné u všech pacientů, tedy u pacientů s manifestními kardiovaskulárními onemocněními i bez nich. I při velmi nízkých výchozích hodnotách LDL C nebyly prokázány nepříznivé účinky dalšího snižování koncentrace LDL C, například zvýšení nekardiovaskulární mortality nebo incidence malignity [4].
Metaanalýza dlouhodobých studií rovněž nemohla potvrdit příležitostně postulovanou souvislost mezi léčbou statiny a zvýšeným rizikem rozvoje demence. Naopak – pacienti léčení statiny vykazovali o 29 % nižší riziko incidentní demence[5].
Vezme li se v úvahu značný význam kumulativní expozice zvýšené koncentraci LDL C, zřetelně se ukazuje, že mutace, které vedou k omezenému snížení hodnoty LDL C, a tedy – pokud nejsou léčeny – k celoživotně výrazně zvýšené koncentraci LDL C, jsou spojeny s výrazně zvýšeným rizikem rozvoje kardiovaskulárních příhod [6]. Takové mutace, které většinou postihují gen LDL receptoru, se vyskytují u familiární hypercholesterolemie (FH) – autozomálně kodominantního dědičného onemocnění.
Velmi vzácně (1 : 1 000 000) se vyskytují homozygotní formy FH (HoFH). Téměř u všech postižených se již v dětství nebo v dospívání rozvine kardiovaskulární onemocnění. Pokud FH zůstane nerozpoznaná a neléčená, umírají tito lidé na kardiovaskulární příčiny v průměru před 20. rokem života [6–9].
S prevalencí 1 : 200–300 je heterozygotní forma FH (HeFH) jednou z nejčastějších vrozených metabolických poruch vůbec [10]. U postižených osob se již od středního věku rozvíjí kardiovaskulární onemocnění. Fenotypová prezentace FH je variabilní. Jak v případě HoFH, tak v případě HeFH je však rozvoj aterosklerózy a riziko kardiovaskulárních příhod úměrné absolutnímu zvýšení koncentrace LDL C a délce expozice [3,7,8,10].
Doporučený postup ESC/EAS 2019
Revize doporučeného postupu, která
proběhla naposledy v roce 2019 a je reflektována
v doporučeních Evropské kardiologické společnosti (European
Society of Cardiology, ESC) pro kardiovaskulární prevenci, je
zaměřena na co nejvýraznější a včasné absolutní
snížení koncentrace LDL C na nižší cílové hodnoty,
jichž bylo dosaženo díky farmakologickému vývoji v předchozích
letech [11]. Samotnými vysokými dávkami statinů lze koncentraci
LDL C snížit v průměru o 50 %, v kombinaci
s ezetimibem o 65 %, samotným inhibitorem proproteinové
konvertázy subtilisin/kexin typu 9 (PCSK9) o 60 %,
v kombinaci s vysokými dávkami statinů o 75 %
a v kombinaci se statinem a ezetimibem o 85 %
[11].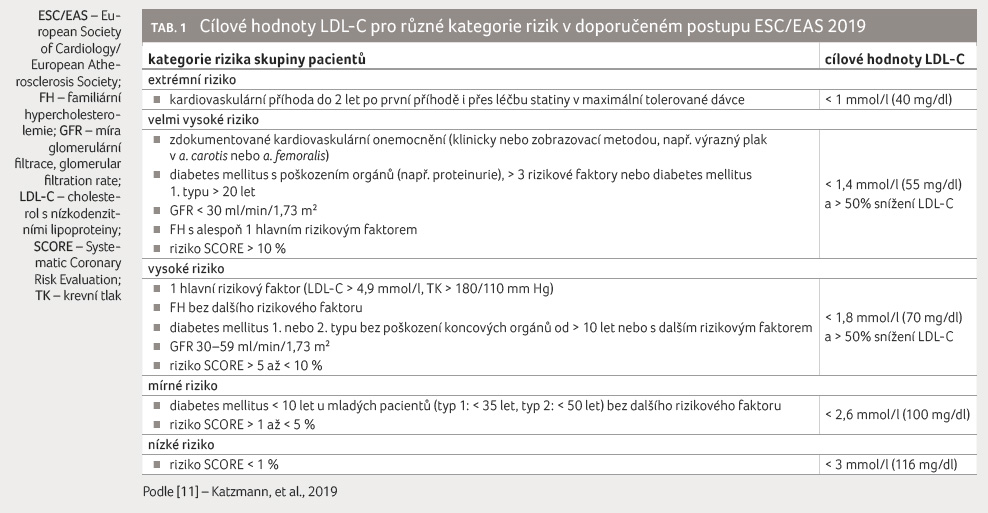
Doporučený postup ESC/EAS z roku 2019 rozlišuje pět kategorií počátečního rizika v závislosti na hodnotě SCORE (pravděpodobnost fatální kardiovaskulární příhody během příštích 10 let a/nebo dle klinických kritérií), tabulka 1 [11].
Cílových hodnot často není dosaženo
Navzdory dostupným možnostem léčby však mnoho pacientů podle řady studií nedosahuje v praxi svých cílových hodnot.
Ve studii DA VINCI, které se zúčastnila také Česká republika, dosáhlo v sekundární prevenci cílových hodnot LDL C pouze 23 % pacientů [12]. Hlavním důvodem, proč pacienti nedosahují cílových hodnot LDL C, je špatná adherence k léčbě. Například přibližně 30 % nemocných ukončilo léčbu statiny již po jednom roce. Nedostatek ověřených informací, vysoká zátěž v důsledku užívání léků a problémy se snášenlivostí, např. bolesti svalů, které jsou tak démonizovány na neautorizovaných webových stránkách či sociálních sítích, patří mezi ovlivňující faktory zhoršující adherenci. Z těchto důvodů přetrvává potřeba nových účinných možností medikamentózní léčby vedoucích ke snížení koncentrace LDL C.
Ultima ratio – lipidová aferéza
U pacientů s vysokým a velmi vysokým rizikem podle doporučeného postupu ESC/EAS se lipidová aferéza používá jako poslední možnost. Tento postup představuje nejen zátěž pro zdravotnictví z důvodu souvisejících nákladů, ale také pro pacienty, kteří musejí podstupovat zpravidla jednou týdně návštěvu ve speciálním centru. Lipidová aferéza připadá v úvahu jen u pacientů s HoFH, u pacientů s těžkou hypercholesterolemií (včetně HeFH), u nichž zdokumentovaná maximální dietní a medikamentózní léčba po dobu 12 měsíců nedokázala dostatečně snížit koncentraci LDL C, a u pacientů s Lp(a) hyperlipoproteinemií (lipoprotein (a) > 60 mg/dl [1,55 mmol/l]) a s progresivním kardiovaskulárním onemocněním [13]. V akutních případech může lipidová aferéza snížit koncentraci lipoproteinů v krvi přibližně o 75 %. Klinický přínos byl zatím zdokumentován pouze analýzami registrů.
siRNA – dočasné snížení genové exprese pomocí přirozeného mechanismu
Interference RNA (RNAi) představuje z hlediska mechanismu snížení koncentrace LDL C zcela novou metodu. Jde o fyziologický princip, který je v přírodě u rostlin a eukaryot všudypřítomný. Prostřednictvím malé interferující RNA (siRNA) reguluje rozsah, v kterém jsou geny translatovány za účelem tvorby proteinů, které kódují. Aktivací sekvenčně specifického procesu degradace RNA lze cíleně dočasně inaktivovat genovou expresi (tzv. genové umlčování) [14]. Syntetická výroba siRNA otevírá široké spektrum možných aplikací v medicíně. Vzhledem k základnímu principu účinku by molekuly siRNA mohly být v zásadě použity proti velkému počtu genů způsobujících onemocnění nebo k potlačení patogeneticky relevantních proteinů kódovaných těmito geny. Rozsáhlý výzkum vedl k novým poznatkům týkajícím se stabilizace a aplikace. To umožnilo snížit účinnou dávku a prodloužit poločas z několika minut na několik měsíců.
Konjugací s GalNAc (triantenárním N acetylgalaktosaminem) lze docílit, že je siRNA cíleně přijímána do jater přes asialoglykoproteinový receptor (ASGPR) [15].
Inhibice hepatické produkce PCSK9
Inklisiran (siRNA) lze použít specificky k inhibici tvorby enzymu PCSK9. K tomu účinná látka využívá mechanismus RNAi, aby zabránila syntéze PCSK9 v játrech, a tím snížila koncentraci LDL C v krevním oběhu [16]. PCSK9 hraje klíčovou roli v metabolismu cholesterolu, protože snižuje počet LDL receptorů membránově vázaných na játra. Vazbou na LDL receptor způsobuje PCSK9 endozomální a lysozomální degradaci receptoru po proběhlé endocytóze. V důsledku toho se na povrchu jater nachází méně LDL receptorů, méně LDL C je přijímáno hepatocyty a koncentrace LDL C v krvi se zvyšuje [17].
Inklisiran se skládá ze dvou
řetězců. Antisense řetězec obsahuje sekvenci pro rozpoznání
cílové mRNA (messenger RNA). Sense řetězec je spojen s GalNAc,
aby se umožnilo cílené přijímání do hepatocytů. Uvnitř
buňky je inklisiran přijímán do endozomů a pomalu
uvolňován do cytoplazmy. Zde se váže na komplex RNAi
(RNA induced silencing complex, RISC) a řetězce inklisiranu se
od sebe oddělí. Řízen antisense řetězcem se RISC dostane
k PCSK9 specifické mRNA, štěpí ji a přeruší tak
tok informací potřebný pro biosyntézu PCSK9. V důsledku
toho nedochází k tvorbě PCSK9 (obr. 1). Receptory pro
LDL tudíž nejsou intracelulárně degradovány, ale zvýšeně
recyklovány a opět prezentovány na povrchu buňky, aby
absorbovaly více LDL C z krve do hepatocytů [17].
Umlčení genu probíhá pouze do té doby, než je siRNA
intracelulárně odbourána, poté je gen opět funkčně exprimován.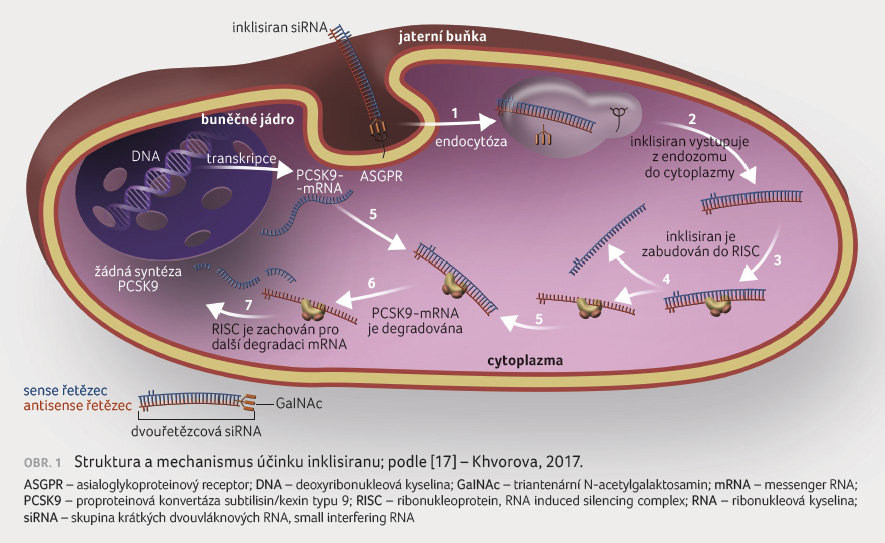
Studie fáze I a fáze II
Ve studiích fáze I a fáze II prokázal inklisiran trvání účinku po dobu více než 180 dnů. To je založeno na několika faktorech. Účinná látka byla stabilizována cílenými chemickými modifikacemi, aby byla chráněna před enzymatickou degradací, a je uvolňována z endozomů jen pomalu. Kromě toho vykazuje RISC obsahující siRNA poločas rozpadu v délce několika týdnů. Zhruba 100–200 RISC obsahujících siRNA na buňku postačuje k zabránění expresi cílového genu [18].
Dávkování, aplikace a indikace
Inklisiran je podáván zdravotnickým pracovníkem v iniciační injekci, další aplikace následuje po třech měsících a v rámci dlouhodobé léčby každých šest měsíců [19]. Ve dvojitě zaslepené, placebem kontrolované studii fáze II ORION 1 pro zjištění dávky u 501 pacientů s vysokým kardiovaskulárním rizikem a zvýšenou koncentrací LDL C se ukázalo, že subkutánní podávání 300 mg inklisiranu tři měsíce po iniciační dávce a dále po šesti měsících způsobilo největší snížení koncentrace LDL C. V klinických studiích a některých publikacích je dávka 284 mg inklisiranu ekvivalentní 300 mg sodné soli inklisiranu a je takto označována [19].
V registračních studiích ORION 9, 10 a 11 (viz dále) byl inklisiran podáván pacientům s HeFH, aterosklerotickým kardiovaskulárním onemocněním (atherosclerotic cardiovascular disease, ASCVD) a s ekvivalenty rizika ASCVD jako doplnění k maximální tolerované dávce léčby snižující koncentraci LDL C (např. statiny a/nebo ezetimibem). Koncentraci LDL C bylo možné významně snížit (p < 0,0001) během šesti měsíců [19–21].
Tato data tvořila základ pro schválení Evropskou komisí dne 9. prosince 2020. Inklisiran je schválen v Evropské unii k léčbě dospělých s primární hypercholesterolemií (heterozygotní familiární nebo nefamiliární) nebo se smíšenou dyslipidemií jako doplněk dietní terapie:
- v kombinaci se statinem nebo statinem a s jinými hypolipidemiky u pacientů, kteří nedosahují cílových hodnot LDL C při maximální tolerované dávce statinu nebo
- samostatně nebo v kombinaci s jinými hypolipidemiky u pacientů s intolerancí statinů nebo u nichž je statin kontraindikován [19].
Snížení koncentrace LDL C během šesti měsíců
Schválení vycházelo ze studií fáze III v rámci programu klinických studií ORION (ORION 9, 10 a 11), do nichž bylo zahrnuto 3 660 pacientů s ASCVD, ekvivalenty rizika ASCVD nebo HeFH (tab. 2A) [19–22] (společná kritéria pro zahrnutí do těchto tří studií a vyloučení z nich v tab. 2B).
Ve všech studiích pacienti
dostali iniciační subkutánní injekci inklisiranu v dávce
300 mg nebo placebo a po 90, 270 a 450 dnech navíc
k maximálně tolerované léčbě statiny a případně
k dalším lékům snižujícím koncentraci lipidů. Všechny
studie měly identické uspořádání (obr. 2).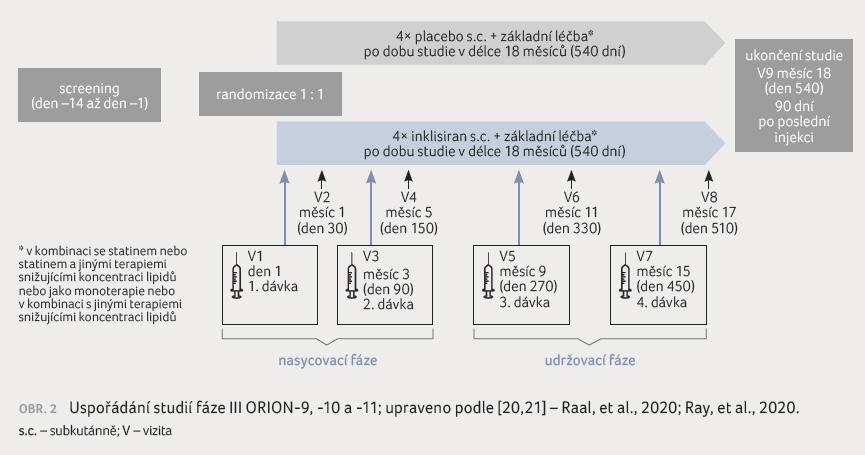
Ve všech třech skupinách bylo možné koncentraci LDL C významně snížit (p < 0,0001) během šesti měsíců až do 510. dne (17. měsíc). Data ze sdružené analýzy těchto tří studií ukázala průměrné placebem kontrolované snížení koncentrace LDL C až o 51 % v 510. dnu (17. měsíc) při současném podávání maximálně tolerované dávky statinu a případně dalších léků snižujících koncentraci lipidů. Po dobu sledování činilo snížení koncentrace LDL C mezi 90. dnem (třetí měsíc) a 540. dnem (18. měsíc) 51 % (p < 0,0001) [22].

ORION 9: pacienti s HeFH
Studie ORION 9 zahrnovala 482 pacientů s klinickým nebo genetickým průkazem HeFH a byla provedena ve 46 studijních centrech v osmi zemích [20]. Průměrný věk pacientů byl 56 let, přičemž 47 % z nich byli muži. Ve skupině s inklisiranem vykazovalo kardiovaskulární onemocnění 24 % a ve skupině s placebem již 30 % osob. Celkem 90 % pacientů bylo léčeno statiny, zhruba tři čtvrtiny s vysokou intenzitou. Více než polovina pacientů dostávala také ezetimib. Navzdory maximálně tolerované hypolipidemické terapii byla průměrná koncentrace LDL C u pacientů při zahrnutí do studie 153 mg/dl (4,0 mmol/l).
Inklisiran snížil koncentraci LDL C
v průměru o 39,7 % ve srovnání s výchozí
hodnotou do 510. dne (17. měsíc), v případě
placeba se koncentrace zvýšila o 8,2 %. Z toho vyplývá
pokles oproti placebu o 47,9 % (p < 0,001).
V době sledování činilo procentuální snížení
koncentrace LDL C mezi 90. dnem (třetí měsíc)
a 540. dnem (18. měsíc) s inklisiranem 38,1 %.
Bylo pozorováno průměrné zvýšení o 6,2 % v případě
placeba (graf 2A, B). Z toho vyplývá redukce při léčbě
inklisiranem oproti placebu o 44,3 % (p < 0,001).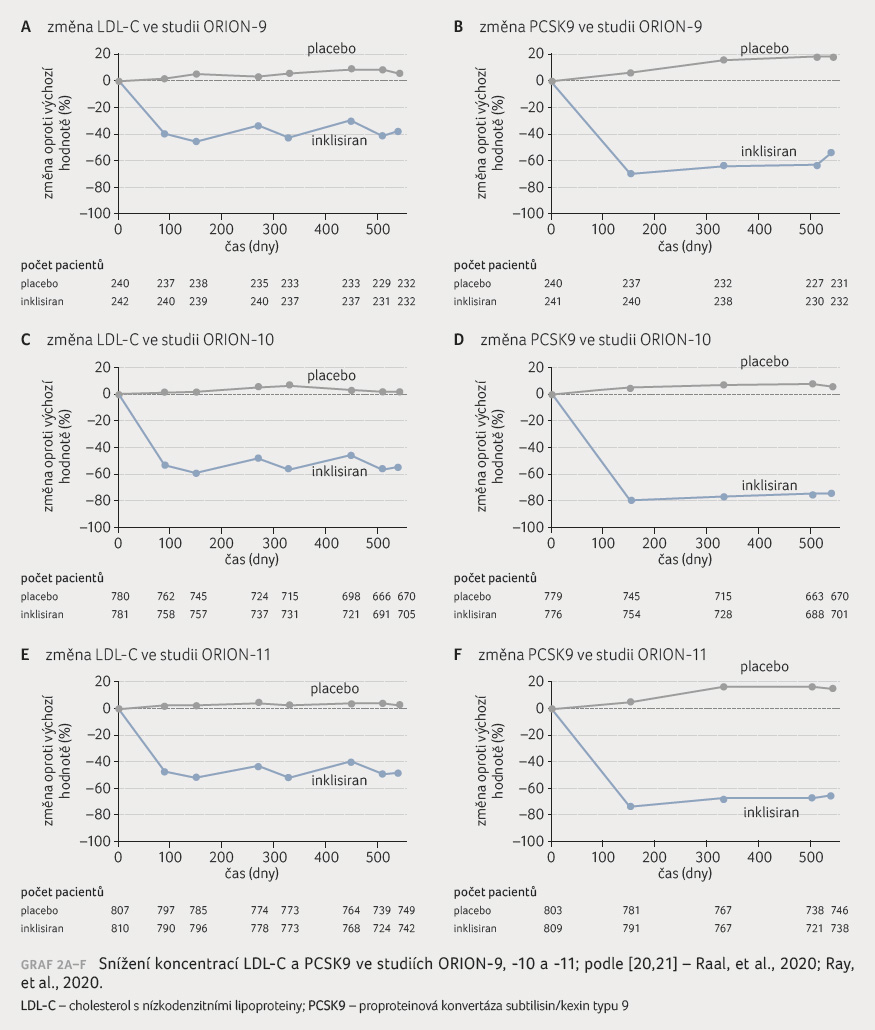
Mezi hlavní sekundární cílové ukazatele studií patřil účinek na koncentraci PCSK9. Ta se do 510. dne (17. měsíc) ve skupině s inklisiranem oproti placebu snížila o 78,4 % ve srovnání s výchozí hodnotou (p < 0,001). Procentuální snížení koncentrace PCSK9 mezi 90. dnem (třetí měsíc) a 540. dnem (18. měsíc) činilo 77 % ve skupině s inklisiranem ve srovnání s placebem (graf 2A, B).
ORION 10: pacienti s ASCVD
Studie ORION 10 byla provedena ve 145 studijních centrech ve Spojených státech amerických. Bylo randomizováno celkem 1 561 pacientů s ASCVD a vysokou koncentrací LDL C navzdory maximální tolerované dávce léčivých přípravků snižujících koncentraci LDL C (např. statin a/nebo ezetimib) [21,23]. Nemocným bylo v průměru 66 let a zhruba 70 % byli muži. Přibližně 89 % pacientů bylo léčeno statiny, více než dvě třetiny s vysokou intenzitou, zhruba 10 % pacientů dostávalo také ezetimib. Navzdory maximálně tolerované hypolipidemické terapii se průměrná koncentrace LDL C na začátku studie pohybovala okolo 104 mg/dl (2,7 mmol/l).
Průměrná koncentrace LDL C byla 510. den (17. měsíc) ve skupině s inklisiranem oproti placebu redukována o 52,3 % v porovnání s výchozí hodnotou (p < 0,001) a po dobu mezi 90. dnem (třetí měsíc) a 540. dnem (18. měsíc) byla koncentrace snížena v průměru o 53,8 % (p < 0,001). Koncentrace PCSK9 v 510. dnu (17. měsíc) byla o 83,3 % nižší ve srovnání s výchozí hodnotou ve skupině s inklisiranem oproti placebu (graf 2C, D).
ORION 11: ASCVD nebo ekvivalenty rizika ASCVD
Na studii ORION 11 se podílelo 70 studijních center v sedmi zemích [21,24]. Bylo randomizováno 1 617 pacientů s ASCVD nebo s ekvivalenty rizika ASCVD (diabetes mellitus 2. typu, FH, 10leté riziko kardiovaskulární příhody > 20 %) a se zvýšenými koncentracemi LDL C navzdory maximální tolerované dávce léků snižujících koncentraci LDL C (například statin a/nebo ezetimib).
Koncentrace LDL C u pacientů s ASCVD činila v rámci maximální tolerované hypolipidemické terapie 70 mg/dl (1,8 mmol/l), u pacientů s ekvivalenty rizika 100 mg/dl (2,6 mmol/l). V celkové studijní populaci byla naměřena průměrná koncentrace LDL C 105,5 mg/dl (1,8 mmol/l).
S inklisiranem pacienti dosáhli (oproti placebu) snížení koncentrace LDL C v 510. dnu (17. měsíc) ve srovnání s výchozí hodnotou o 49,9 % (p < 0,001). Mezi 90. dnem (třetí měsíc) a 540. dnem (18. měsíc) činilo průměrné snížení při léčbě inklisiranem 49,2 %, (p < 0,001). Koncentrace PCSK9 v 510. dnu (17. měsíc) byla v průměru o 79,3 % nižší ve skupině s inklisiranem než v placebové skupině ve srovnání s výchozí hodnotou (graf 2E, F).
Dosažení cílové hodnoty LDL C
Sdružená analýza ukázala, že
v 510. dnu (17. měsíc) dosáhlo 67,9 % pacientů
léčených inklisiranem hodnoty LDL C < 70 mg/dl
(1,8 mmol/l) a 51,8 % pacientů hodnoty LDL C < 50 mg/dl
(1,3 mmol/l) (graf 3). U 61,5 % pacientů užívajících
inklisiran bylo dosaženo snížení LDL C > 50 %
ve srovnání s výchozí hodnotou [22].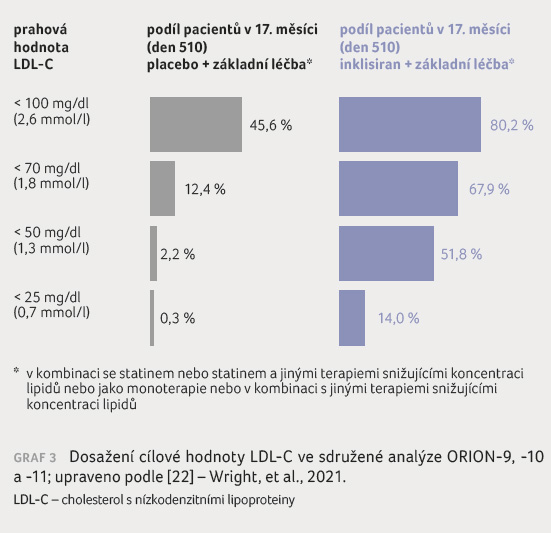
Účinky na další lipidové parametry
Koncentrace LDL C je stanovena
jako nejdůležitější cíl hypolipidemické terapie. Další
relevantní parametry aterogenního lipidového profilu, jako jsou
apolipoprotein B (ApoB), non HDL (high density lipoprotein) C
a Lp(a), byly ve studiích ORION hodnoceny jako sekundární
cílové ukazatele. Údaje ze sdružené analýzy studií
ORION 9, 10 a 11 ukázaly, že koncentrace
non HDL C, ApoB, celkového cholesterolu a Lp(a) se
významně snížily (p < 0,001), tabulka 3.
Výchozí hodnoty zmíněných lipoproteinů byly ve skupině
s inklisiranem a placebem srovnatelné [22].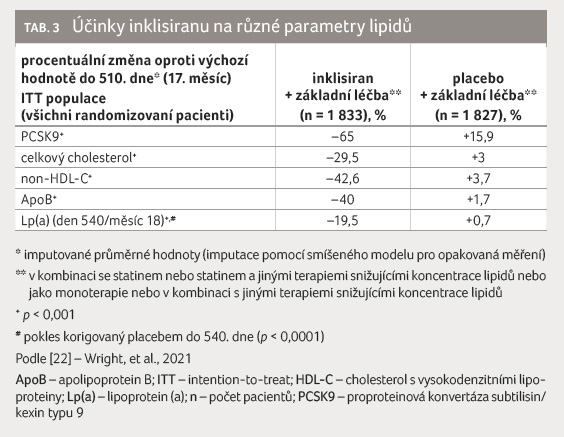
Aplikace každých šest měsíců může
zlepšit adherenci
Inklisiran je podáván pomocí předplněné injekční stříkačky zdravotnickým pracovníkem po iniciační dávce, následně po třech měsících a dále každých šest měsíců. Jeho aplikace může být zahrnuta do pravidelného rutinního vyšetření. Dávku není nutné titrovat a není potřeba zaškolení pacienta v aplikaci injekce. Lék lze skladovat při pokojové teplotě [19].
Intervaly léčby v délce šesti měsíců při dlouhodobé terapii umožňují kontinuitu v péči o pacienta. Podání dávky zdravotnickými pracovníky a interval aplikace mohou znamenat možnou podporu adherence [18].
Bezpečnostní profil
Jedinými nežádoucími účinky spojenými s podáním inklisiranu byly reakce v místě vpichu (8,2 %). Ty byly mírné až středně těžké, přechodné a odezněly bez jakýchkoliv následků [19].
Ve studii ORION 9 byly nežádoucí účinky dokumentovány u 76,8 % pacientů ve skupině s inklisiranem a u 71,7 % pacientů ve skupině s placebem bez ohledu na jejich kauzalitu [20]. Ve skupině s inklisiranem bylo 7,5 % těchto příhod závažných, ve skupině s placebem to bylo 13,8 %. Reakce v místě vpichu se objevily u 17 % pacientů léčených inklisiranem a u 1,7 % pacientů léčených placebem. Nízké titry protilátek proti lékům byly detekovány u 2,6 % pacientů ve skupině s inklisiranem, neovlivnily však hodnoty LDL C.
Ve studii ORION 10 se nežádoucí účinky vyskytly u 73,5 % pacientů ve skupině s inklisiranem a u 74,8 % pacientů ve skupině s placebem, ve studii ORION 11 u 82,7 % vs. 81,5 % pacientů [21]. Většina těchto účinků byla mírná nebo středně závažná a rovnoměrně rozložená v obou skupinách. Závažné příhody postihly 22,4 % pacientů léčených inklisiranem a 26,3 % pacientů léčených placebem ve studii ORION 10 a 22,3 % vs. 22,5 % pacientů ve studii ORION 11. Reakce v místě vpichu, většinou mírné povahy, se vyskytly ve studiích ORION 10 a 11 s frekvencí 2,6 %, resp. 4,7 % v případě inklisiranu a s frekvencí 0,9 %, resp. 0,5 % v případě placeba. Protilátky proti lékům byly naměřeny v klinické studii ORION 10 ve 2 % a ve studii ORION 11 ve 2,5 % zkoumaných vzorků pacientů léčených inklisiranem, neměly však žádný vliv na hodnoty LDL C [20,21].
Studie ORION 4 aktuálně probíhá
Kardiovaskulární studie ORION 4 aktuálně probíhá. Plánuje zahrnout zhruba 15 000 pacientů ve věku 55 let a starších s ASCVD a koncentrací LDL C ≥ 100 mg/dl (2,6 mmol/l) [25].
Kombinovaný primární cílový ukazatel je definován jako: doba do prvního výskytu úmrtí v důsledku ischemické choroby srdeční, infarktu myokardu, fatální nebo nefatální ischemické cévní mozkové příhody nebo závažné koronární revaskularizace. Studie začala v říjnu 2018. Průměrná doba následného pozorování je stanovena přibližně na pět let. Prezentaci výsledků lze očekávat v letech 2024–2025.
V době publikace tohoto přehledného článku není ještě definován úhradový mechanismus pro pacienty v České republice, který je předmětem diskuse Státního ústavu pro kontrolu léčiv, držitele molekuly a plátců zdravotní péče.
Seznam použité literatury
- [1] Táborský M, Vrablík M, Linhart A, et al. Doporučené postupy – Prevence kardiovaskulárních onemocnění, 2021. Dostupné na: https://kdp.uzis.cz/res/guideline/26‑aktivni‑prevence‑manifestace‑kardiovaskularnich‑chorob‑u‑asymptomatickych‑vysoce‑rizikovych‑osob‑final.pdf
- [2] Vrablik M, Seifert B, Parkhomenko A, et al. Lipid‑lowering therapy use in primary and secondary care in Central and Eastern Europe: DA VINCI observational study. Atherosclerosis 2021; 334: 66–75.
- [3] Ference BA, Ginsberg HN, Graham I, et al. Low‑density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017; 38: 2459–2472.
- [4] CCT Collaboration; Baigent T, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta‑analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670–1681.
- [5] Swiger KJ, Manalac RJ, Blumenthal RS, et al. Statins and cognition: a systematic review and meta‑analysis of short‑and long‑term cognitive effects. Mayo Clin Proc 2013; 88: 1213–1221.
- [6] Ference BA, Graham I, Tokgozoglu L, Catapano AL. Impact of Lipids on Cardiovascular Health: JACC Health Promotion Series. J Am Coll Cardiol 2018; 72: 1141–1156.
- [7] Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020; 41: 111–188.
- [8] Nordestgaard BG, Champan MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J 2013; 34: 3478–3490.
- [9] McGowan MP, Hosseini Dehkordi SH, Moriarty PM, Barton Duell P. Diagnosis and Treatment of Heterozygous Familial Hypercholesterolemia. J Am Heart Assoc 2019; 8: e013225.
- [10] Kastelein J, Reeskamp FL, Kees Hovingh G. Familial Hypercholesterolemia: The Most Common Monogenic Disorder in Humans. J Am Coll Cardiol 2020; 75: 2567–2569.
- [11] Katzmann JL, Tünnemann‑Tarr A, Laufs U. [European dyslipidemia guidelines 2019: What is new?]. Herz 2019; 44: 688–695.
- [12] Ray KK, Molemans B, Marieke Schoonen W, et al. EU‑Wide Cross‑Sectional Observational Study of Lipid‑Modifying Therapy Use in Secondary and Primary Care: the DA VINCI study. Eur J Prev Cardiol 2021; 11: 1279–1289.
- [13] Schettler JJ. Lipoproteinapherese. Wie ist der Stand im Jahr 2020? Dialyse aktuell 2020; 24: 163–168.
- [14] Agrawal N, Dasaradhi PVN, Mohmmed A, et al. RNA interference: biology, mechanism, and applications. Microbiol Mol Biol Rev 2003; 67: 657–685.
- [15] Khvorova A, Watts JK. The chemical evolution of oligonucleotide therapies of clinical utility. Nat Biotechnol 2017; 35: 238–248.
- [16] Murphy J. Study: Durable, Potent LDL‑C Reduction With Inclisiran for Cholesterol‑Lowering. Pharmacy Times. Dostupné na: https://www.pharmacytimes.com/ news/study‑durable‑potent‑LDL‑C‑reduction‑with‑inclisiran‑for‑cholesterol‑lowering; poslední přístup: duben 2021
- [17] Khvorova A. Oligonucleotide Therapeutics – A New Class of Cholesterol‑Lowering Drugs. N Engl J Med 2017; 376: 4–7.
- [18] Brandts J, Ray KK. Low Density Lipoprotein Cholesterol‑Lowering Strategies and Population Health. Circulation 2020; 141: 873–876.
- [19] SPC Leqvio. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/leqvio‑epar‑product‑information_cs.pdf
- [20] Raal F, Kallend D, Ray KK, et al. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. N Engl J Med 2020; 382: 1520–1530.
- [21] Ray KK, Wright RS, Kallend D, et al. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med 2020; 382: 1507–1519.
- [22] Wright RS, Ray KK, Raal FJ, et al. Pooled Patient‑Level Analysis of Inclisiran Trials in Patients With Familial Hypercholesterolemia or Atherosclerosis. J Am Coll Cardiol 2021; 77: 1182–1193.
- [23] https://clinicaltrials.gov/ct2/show/NCt03399370
- [24] https://clinicaltrials.gov/ct2/show/NCt03400800
- [25] https://clinicaltrials.gov/ct2/show/NCt03705234
- [26] Koenig W. Inclisiran (Leqvio®). Thieme Drug report; duben 2021: 1–16.