Ixazomib – první perorální inhibitor proteazomu
Souhrn:
Zavedení inhibitorů proteazomu do terapie mnohočetného myelomu zásadně změnilo léčebný přístup i prognózu pacientů. Prvním inhibitorem proteazomu, který se uplatnil v klinické praxi, byl bortezomib. Druhou generaci zastupuje především carfilzomib, selektivní ireverzibilní inhibitor proteazomu s vysokou účinností a absencí periferní neuropatie. Ixazomib je prvním perorálním inhibitorem proteazomu zavedeným do klinické praxe. V listopadu 2015 americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) schválil použití ixazomibu v kombinaci s lenalidomidem a dexametazonem u pacientů s mnohočetným myelomem, kteří byli léčeni alespoň jednou předchozí linií terapie. Předložené sdělení si klade za cíl bližší seznámení s přípravkem ixazomib, s jeho biologickými vlastnostmi, mechanismem účinku i s jeho postavením v léčbě mnohočetného myelomu.
Key words: proteasome inhibitor – oral administration – biological mechanism of action.
Summary:
The inclusion of proteasome inhibitors in the treatment of multiple myeloma has completely changed the treatment approach and the prognoses of patients. The first proteasome inhibitor that has been used in clinical practice was bortezomib. The second generation represents carfilzomib, a selective and irreversible proteasome inhibitor with high efficacy and absence of peripheral neuropathy. Ixazomib is the first oral proteasome inhibitor introduced into clinical practice. In November 2015, the Food and Drug Administration (FDA) approved ixazomib for use in combination with lenalidomide and dexamethasone for the treatment of patients with multiple myeloma who have received at least one prior line of therapy. The aim of the presented review is to introduce ixazomib, its biological properties, mechanism of action and its position in the treatment of multiple myeloma.
Úvod
Mnohočetný myelom (MM) je zhoubné onemocnění způsobené nekontrolovanou proliferací a akumulací patologicky změněných terminálně diferencovaných B lymfocytů (plazmatických buněk) s produkcí monoklonálního imunoglobulinu detekovatelného v séru a/nebo v moči, které je doprovázeno přítomností tzv. událostí definujících myelom (myeloma defining events, MDE) – tedy buď přítomnou orgánovou dysfunkci charakterizovanou zkratkou CRAB (C ‒ hyperkalcemie, R ‒ renální postižení, A ‒ anémie, B ‒ postižení skeletu), nebo zjištěním tzv. biomarkerů malignity (≥ 60% infiltrace kostní dřeně klonálními plazmocyty, poměr volných lehkých řetězců κ/λ ≥ 100 či více než jedna osteolytická léze větší než 5 mm při vyšetření magnetickou rezonancí) [1].
Léčba MM prošla v posledních letech výraznými změnami. Před zavedením účinné léčby byl v šedesátých letech medián přežití jeden rok. V éře alkylačních léků došlo k postupnému prodloužení přežití, v období terapie moderními léky s biologickým mechanismem účinku přežívá pět let více než 70 % pacientů [2‒4]. Přelomem v prognóze nemocných bylo zavedení inhibitorů proteazomu (proteasome inhibitor, PI) do klinické praxe. Ty v současnosti patří mezi klíčové přípravky v léčbě MM jak v případě relapsu, tak i u nově diagnostikovaného onemocnění [5]. Ixazomib (Ninlaro) je novou generací a současně jde o první perorální přípravek ze skupiny PI [6].
Charakteristika léčiva
Na základě chemické struktury dělíme v současnosti inhibitory proteazomu do tří skupin: boronáty, epoxyketony a salinosporamidy. Nejznámějším zástupcem první skupiny je bortezomib, nejužívanější PI dnešní doby. Hlavní představitel epoxyketonů ‒ carfilzomib ‒ je slibným PI druhé generace s ireverzibilní a selektivní vazbou na β1 podjednotku proteazomu. Do poslední skupiny patří marizomib, přírodní laktonová sloučenina získaná z mořské bakterie Salinospora tropica. Ten však dosud není registrován a v současnosti je používán v léčbě MM pouze v rámci klinických hodnocení [5].
Ixazomib je inhibitor proteazomu druhé
generace řadící se do stejné skupiny jako bortezomib.
Přípravek je k dispozici v perorální formě;
jeho chemický vzorec je: N2 (2,5 dichlorobenzoyl) N [(1R) 1 (dihydroxyboryl) 3 metylbutyl]glycinamid
(obr. 1) [7].![Chemická struktura ixazomibu; podle [7] – Li, et al., 2013.](https://www.remedia.cz/photo-a-31327---.jpg)
Mechanismus účinku a farmakokinetika
Ixazomib je podáván ve formě tzv. prodrug, ixazomib citrátu, který je rychle hydrolyzován na svou aktivní formu. Ta se přednostně reverzibilně váže na β5 podjednotku 20S proteazomu a inhibuje jeho chymotrypsinu podobnou aktivitu, ve vyšších koncentracích je též schopen vazby a inhibice β1 kaspáze podobné a β2 trypsinu podobné podjednotky proteazomu. Aktivní forma ixazomibu je chemicky velmi podobná bortezomibu, na rozdíl od něj ale indukuje rozpad proteazomu šestinásobně rychleji [8].
Po perorálním podání dosahuje ixazomib maximální plazmatické koncentrace (cmax) přibližně po jedné hodině, jeho průměrná biologická dostupnost je 58 %. Při požití společně s jídlem s vysokým obsahem tuku dochází k poklesu plochy pod křivkou plazmatické koncentrace o 28 % [9]. V séru je v 99 % vázán na plazmatické bílkoviny a jeho distribuční objem je 543 l.
Data ze studií na zvířatech naznačují, že ixazomib je schopen přecházet z krve do tkání mnohem jednodušeji než bortezomib [10]. Eliminace probíhá především metabolickou cestou, močí je v nezměněné podobě vyloučeno méně než 3,5 % tohoto léku. Je metabolizován pomocí některých cytochromů (CYP) a non CYP enzymů, nicméně nebyl rozpoznán žádný specifický cytochrom, který by přispíval k jeho biotransformaci. Pouze při koncentracích vyšších, než jsou klinicky sledované, dochází k biotransformaci i cestou CYP P450 (především jeho podskupinou 3A4, kde je pak metabolizován ze 42 %, z 26 % poté cestou 1A2). Následně je z 22 % vyloučen stolicí a z 62 % močí [10].
Lékové interakce
Byl zkoumán vliv silných induktorů a inhibitorů CYP P450 na hodnotu cmax ixazomibu. Bylo potvrzeno, že při souběžném podávání ixazomibu a rifampicinu dochází ke snížení cmax o 54 %. Současné podávání silných induktorů CYP3A4 a ixazomibu není vhodné, ovšem není li zbytí, je nutná pečlivá monitorace průběhu základního onemocnění. Kromě rifampicinu patří mezi silné induktory například karbamazepiny, fenytoin či dobře známá třezalka tečkovaná. Naopak nebyl prokázán vliv na hodnotu cmax při podání ixazomibu v kombinaci s klaritromycinem, silným inhibitorem CYP3A4 [11].
Indikace
Ixazomib je indikován k léčbě MM v kombinaci s lenalidomidem a dexametazonem u pacientů, kteří již prodělali nejméně jednu předchozí terapii. Je podáván do progrese onemocnění. Nicméně je nutno poznamenat, že v podmínkách České republiky nemá ixazomib zatím úhradu, přesto je využíván v klinických hodnoceních, případně v rámci Specifického léčebného programu.
Klinická hodnocení
Monoterapie
Ixazomib byl zkoumán celkem ve dvou studiích fáze I s dosažením léčebné odezvy v 15 %, resp. ve 24 % [12,13]. Ve studiích fáze II byla stanovena optimální iniciální dávka na 4 mg jednou týdně, přičemž v monoterapii či v kombinaci s dexametazonem bylo dosaženo celkové léčebné odpovědi u 34 %, resp. u 43 % pacientů. Při dávce 5,5 mg byla odezva ještě vyšší ‒ 54 % ‒, ovšem již i s vyšší toxicitou léčby [14,15].
Kombinovaná léčba
Aktuálně podle webového portálu ClinicalTrials.gov probíhá či již proběhlo 86 studií s ixazomibem. Jako registrační byla stanovena studie Tourmaline MM1, která hodnotila účinnost a bezpečnost ixazomibu v kombinaci s lenalidomidem a dexametazonem. Zařazeno bylo 722 nemocných s relabujícím anebo refrakterním MM, kteří již prodělali nejméně jednu předchozí léčbu. Randomizace rozdělila pacienty do dvou skupin ‒ do skupiny léčených ixazomibem (s lenalidomidem a dexametazonem ‒ IRD) a do kontrolní skupiny, v níž se podávala kombinace lenalidomidu s dexametazonem (RD) v následujícím schématu léčby: ixazomib (4 mg) byl podáván 1., 8. a 15. den, lenalidomid (25 mg) 1.‒21. den a dexametazon (40 mg) 1., 8., 15. a 22. den 28denního cyklu. Kombinovaný režim IRD dosáhl 78 % celkové léčebné odezvy, přičemž oproti režimu RD významně prodloužil dobu do progrese onemocnění (progression free survival, PFS) z 14,7 na 20,6 měsíce (p = 0,01). Překvapivým zjištěním byla významná účinnost i u jedinců s nepříznivým cytogenetickým profilem, tj. s přítomností del(17), t(4;14), t(14;16), kdy došlo k výraznému prodloužení PFS u nemocných léčených kombinací IRD oproti RD (21,4 měsíce vs. 9,7 měsíce) s prakticky identickými intervaly jako u nemocných bez přítomnosti těchto cytogenetických abnormalit. Na základě výše uvedených výsledků byl ixazomib v listopadu 2015 schválen FDA pro použití v kombinaci s lenalidomidem a dexametazonem [16].
Možností využití ixazomibu
v udržovací terapii se zabývala studie fáze II, kdy byl
přípravek podáván v indukční fázi léčby v kombinaci
s lenalidomidem a dexametazonem s navazující
autologní transplantací krvetvorných buněk (autologous stem cell
transplantation, ASCT) nebo bez ní, a následně se pokračovalo
v monoterapii ixazomibem. Léčebná odpověď byla výjimečná,
alespoň parciální remise (partial remission, PR) dosáhlo
90 % pacientů, z toho 45 % velmi dobré parciální remise
(very good partial remission, VGPR). V současnosti probíhá
několik studií fáze III hodnotících efekt ixazomibu
v udržovací terapii [17].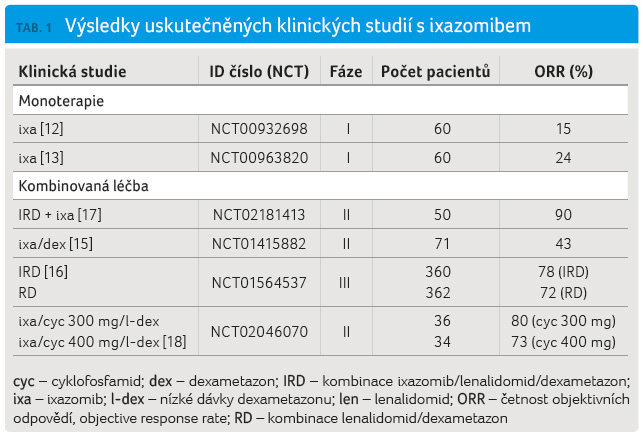
Byl taktéž zkoumán vliv ixazomibu na léčbu u starších dosud neléčených pacientů nevhodných k ASCT, kdy byla jako terapeutický režim zvolena kombinace ixazomibu s dexametazonem a cyklofosfamidem (v dávce 300 mg/m2, resp. 400 mg/m2 1., 8. a 15. den). Léčebné odezvy bylo dosaženo v 80 %, resp. 73 %, kdy kompletní remise (complete remission, CR) a VGPR dosáhlo 27 %, respektive 23 % nemocných (tab. 1). Optimální dávka cyklofosfamidu u starších komorbidních pacientů byla stanovena na 300 mg/m2 [18].
Nežádoucí účinky a tolerance
Mezi nejčastější nehematologické nežádoucí účinky řadíme postižení gastrointestinálního traktu, dále pak periferní neuropatii (peripheral neuropathy, PN) a vyrážku. Klinicky nejzávažnější nehematologickou komplikací je vznik PN, faktoru limitujícího kvalitu života u pacientů léčených inhibitory proteazomu. Charakteristický je vznik senzorické PN, motorická složka bývá postižena u méně než 1 % nemocných [12,13]. Ve srovnání s léčbou bortezomibem, kdy při subkutánním podání je indukována PN druhého a vyššího stupně u 24 % pacientů [19], dochází ke vzniku PN u 12‒20 % jedinců léčených samotným ixazomibem [12,13] a u 27 % nemocných dostávajících kombinaci IRD [16]. Incidence PN u ixazomibu je srovnatelná s jejím výskytem u bortezomibu, nicméně bývá méně závažná.
Častým nežádoucím účinkem postihujícím gastrointestinální trakt je zvracení. Bylo hlášeno jak u pacientů léčených monoterapií, tak u nemocných dostávajících kombinační léčbu (35 % vs. 23 %) [13,16]. Průjem se vyskytl u 38 % [13], resp. u 45 % [16] nemocných léčených ixazomibem.
Relativně často byl pozorován výskyt vyrážky typického vzhledu erytematózních makulo papulózních lézí s lokalizací především na trupu a na končetinách (22 % v monoterapii, resp. 36 % v kombinační léčbě). Nejčastěji se objevuje v prvních třech měsících od zahájení terapie a dobře reaguje na podání antihistaminik či topických kortikoidů [13,20]. Stejně jako u dalších PI je předpokládána reaktivace herpes zoster (u 5 % pacientů léčených kombinací IRD), proto je vhodná profylaktická terapie aciklovirem [20].
Hematologická toxicita se 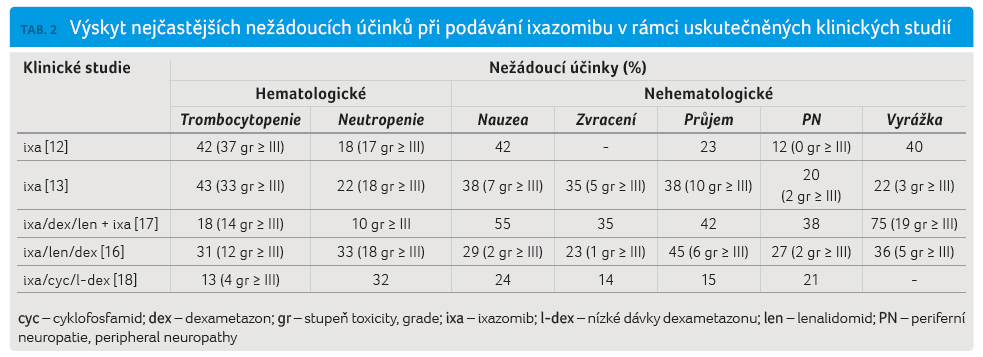 projevuje
zejména v podobě trombocytopenie objevující se především
v prvních třech měsících od počátku léčby,
nejčastěji pak mezi 14.‒21. dnem. Dalším udávaným
nežádoucím účinkem je neutropenie, v porovnání
s kontrolním ramenem RD nicméně nebylo v režimu IRD
zaznamenáno její signifikantně vyšší zastoupení (33 % vs.
31 %). Nejčastěji se objevuje mezi 8.‒12. dnem od zahájení
léčby [20].
projevuje
zejména v podobě trombocytopenie objevující se především
v prvních třech měsících od počátku léčby,
nejčastěji pak mezi 14.‒21. dnem. Dalším udávaným
nežádoucím účinkem je neutropenie, v porovnání
s kontrolním ramenem RD nicméně nebylo v režimu IRD
zaznamenáno její signifikantně vyšší zastoupení (33 % vs.
31 %). Nejčastěji se objevuje mezi 8.‒12. dnem od zahájení
léčby [20].
Souhrnně lze říci, že ixazomib je lék s běžným výskytem nežádoucích účinků, nicméně pomocí vhodných protiopatření je možno naprostou většinu z nich zvládnout, ať už přerušením terapie, či snížením dávky léčiva (tab. 2).
Závěr
Ixazomib je první perorální inhibitor proteazomu schválený k léčbě MM v kombinaci s lenalidomidem a dexametazonem. Dosavadní výsledky klinických studií naznačují dobrou léčebnou odpověď u relabovaných pacientů. Režim IRD je plně perorální s velmi dobrou tolerancí a běžným výskytem nežádoucích účinků. Jeho celková léčebná odezva je 78 %, navíc s výrazným prodloužením PFS a zejména s neočekávaně pozitivním vlivem na nemocné s nepříznivým cytogenetickým profilem. Je proto optimální volbou pro pacienty nevhodné k parenterálnímu podávání léků, např. z důvodu vysokého věku, absence žilního přístupu, případně i velké vzdálenosti od hematologického centra, a navíc rovněž pro pacienty s vysoce rizikovými cytogenetickými změnami. Toxický profil ixazomibu je příznivý, nežádoucí účinky jsou dobře zvládnutelné a nebývají závažné, jejich vznik lze snadno odhadnout. K přerušení léčby vedou pouze sporadicky, většinu z nich je možné regulovat upravením dávky přípravku. Byť i nadále probíhá celá řada klinických studií, již dnes se ixazomib jeví jako potenciálně slibný lék v terapii mnohočetného myelomu.
Seznam použité literatury
- [1] Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: 538–548.
- [2] Osgood EE. The survival time of patients with plasmacytic myeloma. Cancer Chemother Rep 1960; 9: 1–10.
- [3] Nair B, van Rhee F, Shaughnessy JD, et al. Superior results of Total Therapy 3 (2003‑33) in gene expression profiling‑defined low‑risk multiple myeloma confirmed in subsequent trial 2006‑66 with VRD maintenance. Blood 2010; 115: 4168–4173.
- [4] Cavo M, Tacchetti P, Patriarca F, et al. Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem‑cell transplantation in newly diagnosed multiple myeloma: a randomised phase 3 study. Lancet 2010; 376: 2075–2085.
- [5] Moreau P, Richardson PG, Cavo M, et al. Proteasome inhibitors in multiple myeloma: 10 years later. Blood 2012; 120: 947–959.
- [6] Ninlaro (ixazomib). SPC. SÚKL, listopad 2016. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003844/WC500217620.pdf
- [7] Li AC, Yu E, Ring SC, et al. Boronic acid‑containing proteasome inhibitors: alert to potential pharmaceutical bioactivation. Chem Res Toxicol 2013; 26: 608–615.
- [8] Allegra A, Alonci A, Gerace D, et al. New orally active proteasome inhibitors in multiple myeloma. Leukemia Research 2014; 38: 1–9.
- [9] Gupta N, Hanley MJ, Venkatakrishnan K, et al. A phase 1 study of the effect of a high‑fat meal on the pharmacokinetics of ixazomib citrate (MLN9708), an investigational oral proteasome inhibitor, in patients with advanced solid tumors or lymphoma. Haematologica 2014; 99: 376.
- [10] Kupperman E, Lee EC, Cao Y, et al. Evaluation of the proteasome inhibitor MLN9708 in preclinical models of human cancer. Cancer Research 2010; 70: 1970–1980.
- [11] Gupta N, Saleh M, Venkatakrishnan K. Flat‑dosing versus BSA‑based dosing for MLN9708, an investigational proteasome inhibitor: population pharmacokinetic (PK) analysis of pooled data from 4 phase‑1 studies. Blood 2011; 118: 1433.
- [12] Richardson PG, Baz R, Wang M, et al. Phase 1 study of twice‑weekly ixazomib, an oral proteasome inhibitor, in relapsed/refractory multiple myeloma patients. Blood 2014; 124: 1038–1046.
- [13] Kumar SK, Bensinger WI, Zimmermann TM, et al. Phase 1 study of weekly dosing with the investigational oral proteasome inhibitor ixazomib in relapsed/refractory multiple myeloma. Blood 2014; 124: 1047–1055.
- [14] Kumar SK, LaPlant BR, Reeder CB, et al. Phase 2 trial of ixazomib in patient with relapsed multiple myeloma not refractory to bortezomib. Blood Cancer J 2015; 5: 338.
- [15] Kumar SK, LaPlant BR, Reeder CB, et al. Randomized phase 2 trial of ixazomib and dexamethasone in relapsed multiple myeloma not refractory to bortezomib. Blood 2016; 128: 2415–2422.
- [16] Moreau P, Masszi T, Grzasko N, et al. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016; 374: 1621–1634.
- [17] Kumar SK, Berdeja JG, Niesvizky R, et al. Long‑term ixazomib maintenance is tolerable and improves depth of response following ixazomib‑lenalidomide‑dexamethasone induction in patients (Pts) with previously untreated multiple myeloma (MM): phase 2 study results. Blood 2014; 124: 82.
- [18] Dimopoulos MA, Grosicki S, Jedrzejczak W, et al. Randomized phase 2 study of the all‑oral combination of investigational proteasome inhibitor (PI) ixazomib plus cyclophosphamide and low‑dose dexamethasone (ICd) in patients (Pts) with newly diagnosed multiple myeloma (NDMM) who are transplant‑ineligible (NCT02046070). Blood 2015; 126: 26.
- [19] Moreau P, Pylypenko H, Grosicki S, et al. Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma: a randomised, phase 3, non‑inferiority study. Lancet Oncol 2011; 12: 431–440.
- [20] Kumar SK, Moreau P, Hari P, et al. Management of adverse events associated with ixazomib plus lenalidomide/dexamethasone in relapsed/refractory multiple myeloma. Br J Haematol 2017. doi:10.1111/bjh.14733