Kyselina zoledronová
Bisfosfonáty jako analoga pyrofosfátu představují skupinu léčiv široce používanou v léčbě chorob spojených se ztrátou kostní hmoty. Jedná se o silné inhibitory kostní resorpce. Kyselina zoledronová je nový, velmi potentní aminobisfosfonát, který lze podávat intravenózně. Nachází své místo v terapii nádorové kostní choroby. Svůj efekt prokázala kyselina zoledronová v dávce 4 mg podávané každé 3–4 týdny intravenózně v prevenci a léčbě kostní choroby u mnohočetného myelomu a u solidních tumorů (zejména plic, prostaty a prsu). Léčba nádory indukované hyperkalcémie je další indikací tohoto léčiva, která se opírá o výsledky klinických studií prokazujících lepší efekt podání kyseliny zoledronové v dávce 4 či 8 mg intravenózně oproti pamidronátu. Aktivní Pagetova choroba je třetí současnou indikací léčiva opírající se o výsledky kontrolovaných studií, které porovnávaly efekt jediné 15minutové infuze 5 mg zoledronátu s 60denním enterálním podáváním risedronátu v dávce 30 mg denně. Kyselina zoledronová prokázala výrazně rychlejší, kompletnější a setrvalejší efekt v léčbě Pagetovy choroby. Do budoucna lze očekávat rozšíření indikací kyseliny zoledronové o další nozologické jednotky (postmenopauzální osteoporóza).
Farmakologická skupina
Bisfosfonáty
Bisfosfonáty jsou analoga pyrofosfátu (P-C-P), která se používají v léčbě chorob spojených se zvýšenou kostní resorpcí a se ztrátou kostní hmoty. Je to skupina léčiv, která mají podobné vlastnosti zejména z hlediska farmakokinetiky.
Chemické a fyzikální vlastnosti
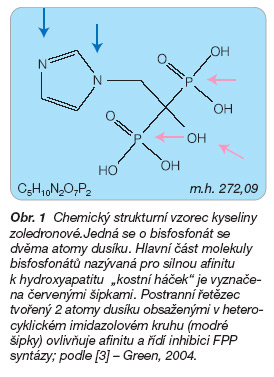
Kyselina zoledronová je chemicky [1-hydroxy-2-(imidazol-1-yl)ethan-1,
1-diyl]difosfonová kyselina (obr. 1).
Sumární vzorec: C5H10N2O7P2
Molekulová hmotnost: 272,09
Kyselina zoledronová je bílý krystalický prášek snadno rozpustný v 0,1N roztoku hydroxidu sodného, mírně rozpustný ve vodě a v 0,1N roztoku kyseliny chlorovodíkové a prakticky nerozpustný v organických rozpouštědlech.
Mechanismus účinku, farmakodynamika
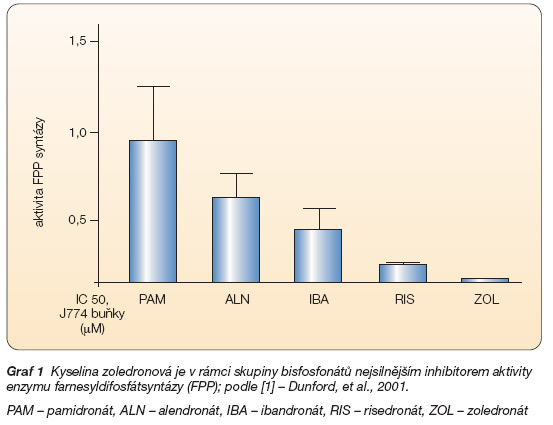
Zoledronát inhibuje kostní resorpci prostřednictvím svého účinku na osteoklasty a jejich prekurzory. Pevně se váže na kostní hydroxyapatit podobně jako ostatní aminobisfosfonáty prostřednictvím chemické struktury zvané pro její vysokou afinitu k hydroxyapatitu „kostní háček" a v kostech se rovněž dlouhodobě akumuluje. Preferenčně se váže k minerálu exponovanému osteoklastům a při osteoresorpci do nich proniká. Dusíkaté bisfosfonáty inhibují v osteoklastech syntézu cholesterolu prostřednictvím blokace enzymu farnesyldifosfátsyntázy (FPP) [1]. To v konečném důsledku vede k zániku aktivní zóny osteoklastu anglicky zvané „ruffled border", k inaktivaci a apoptóze této buňky. Kyselina zoledronová je v současné době nejsilnějším inhibitorem FPP (graf 1).
Na základě molekulárního mechanismu působení lze bisfosfonáty dělit do dvou skupin: aminobisfosfonáty (obsahují v molekule dusík) a bisfosfonáty neobsahující dusík. Každá skupina indukuje apoptózu jiným mechanismem. Aminobisfosfonáty tak činí prostřednictvím inhibice intracelulární mevalonátové cesty syntézy cholesterolu a izoprenylací proteinů, bisfosfonáty neobsahující v molekule dusík pak prostřednictvím cytotoxicky působících metabolitů ATP analog. Nicméně některé velmi potentní aminobisfosfonáty (kyselina zoledronová) stimulují tvorbu zcela recentně popsaného analoga ATP (ApppI) [2]. ApppI inhibuje mitochondriální ADP/ATP translokázu a způsobuje apoptózu osteoklastů. Tyto nálezy přinášejí nový pohled na mechanismus účinku aminobisfosfonátů třetí generace, jako je kyselina zoledronová, které tedy mohou zřejmě působit jak prostřednictvím inhibice mevalonátové cesty, tak blokádou mitochondriální ADP/ATP translokázy, čímž se rovněž podílejí na apoptóze [2]. Kromě inhibice kostní resorpce má zoledronát některé protinádorové vlastnosti, které by mohly přispívat k celkové účinnosti léčby kostních metastáz (ovlivnění mikroprostředí kostní dřeně a zhoršení podmínek pro růst nádorových buněk, antiangiogenetický efekt, analgetický účinek, inhibice osteoblastické proliferace, přímý cytostatický a proapoptotický efekt na nádorové buňky, antiadhezivní a antiinvazivní působení či synergický protinádorový efekt s cytostatiky) [3]. V souvislosti s karcinomem prsu je pozoruhodná teoretická studie prokazující synergickou interakci mezi kyselinou zoledronovou a chemoterapeutikem paklitaxelem v ovlivnění buněk karcinomu prsu in vitro, což poukazuje na možný přímý protinádorový efekt této kombinace [4].
Farmakokinetické vlastnosti
Absorbovaný či parenterálně podaný bisfosfonát má vysokou afinitu ke kosti, 50 % látky se váže ke kostnímu minerálu, zbytek je vyloučen močí.
Po zahájení infuze kyseliny zoledronové stoupá rychle její koncentrace v plazmě a dosahuje vrcholu před ukončením infuze. Tento vrchol je následován rychlým poklesem, za 4 hodiny je v plazmě méně než 10 % maximální koncentrace kyseliny zoledronové, za 24 hodin klesne koncentrace pod 1 % maximálních hodnot. Intravenózně podaná kyselina zoledronová je vylučována ve třech fázích: dvě rychlé fáze s poločasem t1/2 0,24 a 1,87 hod. a jedna fáze pomalá s t1/2 146 hodin. Kyselina zoledronová není metabolizována, je vylučována ledvinami v nezměněné podobě. Játra tedy nehrají v jejím metabolismu významnou roli. Po opakovaném podání nebyla pozorována kumulace zoledronátu v plazmě [5].
Klinické zkušenosti
Prevence kostních příhod
Kostní metastázy jsou častou komplikací nádorových onemocnění. Přítomnost a vznik kostních metastáz vede k tzv. kostním příhodám, které jsou definovány jako patologické zlomeniny, kompresní zlomeniny obratlových těl, potřeba radiační či chirurgické léčby kostí či hyperkalcemické stavy způsobené nádorovým postižením kostí. Tyto epizody mají hluboký negativní dopad na kvalitu života postižených lidí a významně zkracují jejich přežívání [6]. Nemocní s mnohočetným myelomem jsou postiženi kostními metastázami v 95–100 %, u karcinomů prsu či prostaty se vyskytují v 65–75 %, u nádorů štítné žlázy v 60 %, u nádorů močového měchýře ve 40 %, plic v 30–40 %, u nádorů ledvin ve 20–25 % a u melanomů v 14–45 % případů [6].
Účinnost a bezpečnost podávání zoledronátu při prevenci kostních příhod byla zjišťována v několika randomizovaných dvojitě slepých klinických studiích.
V první z nich byl zoledronát porovnáván s placebem při prevenci kostních příhod u pacientů s karcinomem prostaty po dobu 15měsíční studie s 9měsíční extenzí (214 mužů léčených 4 mg zoledronátu oproti 208 mužům užívajícím placebo) [7]. Zoledronát prokázal po dobu podávání lepší efekt proti placebu v prevenci kostní příhody (kostní příhodu utrpělo 33 % pacientů léčených zoledronátem v dávce 4 mg každé 3 týdny oproti 44 % pacientů, kterým bylo podáváno placebo) a prodloužení mediánu času do výskytu první kostní příhody [7]. Extenze prokázala další signifikantní redukci procenta nemocných s kostní příhodou (p = 0,017), prodloužila medián do první kostní příhody (p = 0,036), redukovala roční incidenci kostních příhod o 52 % a jejich riziko o 53 % ve srovnání s placebem [8].
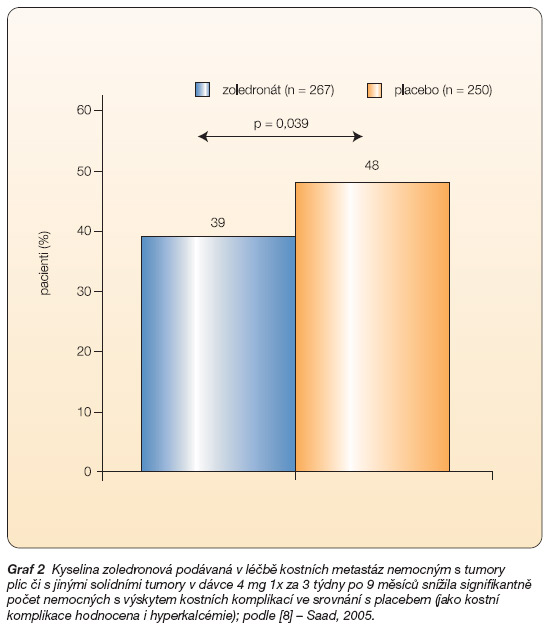
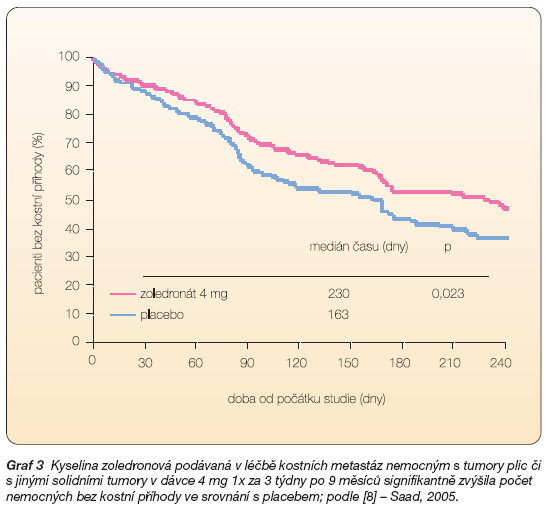
Ve druhé klinické studii, do níž bylo zahrnuto 773 pacientů s nemalobuněčnými karcinomy plic (49 % zařazených) a jinými solidními nádory (s výjimkou karcinomu prostaty a prsu) metastazujícími do kostí, snížil zoledronát podávaný po 9 měsíců každé 3 týdny ve dvou dávkových schématech (4 mg a 8 mg s redukcí dávky na 4 mg) počet pacientů s kostními příhodami (38 % a 35 % v aktivních skupinách v. 44 % v placebové skupině, p = 0,127 a p = 0,023) a prodloužil medián času do výskytu první kostní příhody (230 v. 163 dnů, p = 0,023) [9] (graf 2 a 3).
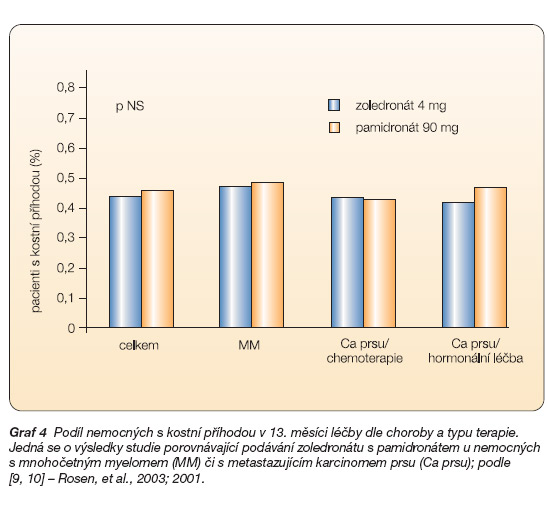
Třetí randomizovaná dvojitě slepá studie III. fáze porovnávala léčbu zoledronátem v dávce 4 mg s léčbou pamidronátem v dávce 90 mg každé 3 až 4 týdny u 1122 pacientů (564 zoledronát, 558 pamidronát) s mnohočetným myelomem nebo karcinomem prsu s přítomností nejméně jedné kostní léze. Zoledronát prokázal po 25 měsících sledování nemocných srovnatelnou účinnost s pamidronátem při prevenci kostních příhod [10, 11]. Ve srovnání s pamidronátem snížil zoledronát celkové riziko rozvoje kostních komplikací o 16 % (p = 0,030). Ve skupině nemocných s karcinomem prsu byl zoledronát signifikantně účinnější než pamidronát s redukcí rizika o 20 % (p = 0,025) a s redukcí o 30 % u nemocných užívajících současně i hormonální terapii (p = 0,009) (graf 4).
Další randomizovaná dvojitě slepá jednoroční studie porovnávala infuze zoledronátu podávané v 3–4týdenních intervalech v dávce 4 mg či 8 mg s infuzemi pamidronátu 90 mg v léčbě 1130 nemocných s karcinomem prsu s nejméně 1 osteolytickou lézí. Počty nemocných s kostními příhodami byly srovnatelné v jednotlivých ramenech (43 % nemocných užívajících zoledronát v. 45 % užívajících pamidronát). Doba do první kostní příhody byla významně delší pro zoledronát ve srovnání s pamidronátem (medián 310 v. 174 dní, p = 0,013). Navíc analýza mnohočetných příhod demonstrovala další redukci rizika ve prospěch zoledronátu (30 % u pacientů s osteolytickou lézí, p = 0,010, a 20 % pro všechny nemocné s karcinomem prsu, p = 0,037) [12].
Kyselina zoledronová (4 mg v 15minutové infuzi podávané každé 4 týdny po dobu 1 roku) byla srovnávána s placebem rovněž v léčbě 227 japonských žen s kostní metastázou u karcinomu prsu. Pacientky léčené kyselinou zoledronovou vykazovaly 39% redukci počtu kostních příhod (p = 0,027). Kyselina zoledronová rovněž signifikantně redukovala procento nemocných s více než jednou kostní příhodou (31 % v. 52 % u placeba, p = 0,001) a prodlužovala dobu do první příhody (nedosaženo mediánu v. medián 360 dní u placeba, p = 0,004). Bylo dosaženo 44% redukce rizika rozvoje mnohočetných kostních příhod ve srovnání s placebem (p = 0,009) [13].
Hyperkalcémie vyvolaná nádorovým onemocněním
Hyperkalcémie doprovázející nádorová onemocnění metastazující do skeletu je akutní příhoda bezprostředně ohrožující život nemocného. Její léčba spočívá tradičně v dostatečné hydrataci postiženého, navození adekvátní diuretické odpovědi prostřednictvím kličkových diuretik, podání hydrokortizonu, kalcitoninu a intravenózních bisfosfonátů.
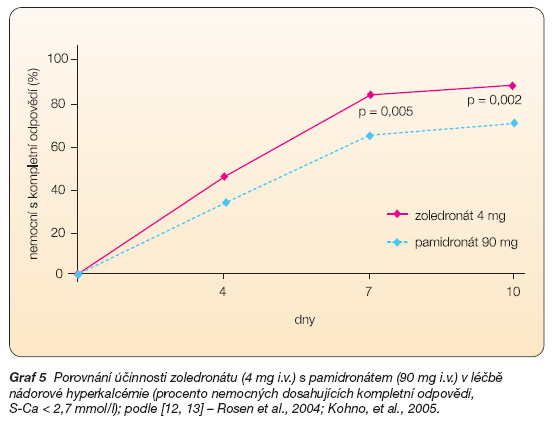
Schválení léčby zoledronátem v této indikaci vycházelo z výsledků dvou identických dvojitě zaslepených paralelních randomizovaných studií, do nichž bylo zahrnuto 287 pacientů se středně významnou až těžkou hyperkalcémií (sérové kalcium ≥ 3,00 mmol/l) vyvolanou nádorovým onemocněním [14, 15]. Nemocní byli léčeni buď jednou infuzí zoledronátu (4 či 8 mg) po dobu 5 minut, nebo infuzí pamidronátu 90 mg po dobu 2 hodin. Tyto studie potvrdily velmi dobrou účinnost zoledronátu při léčbě hyperkalcémie. Studie hodnotily kompletní klinickou odpověď 10. den od podání léčiva, trvání klinické odpovědi a čas do relapsu hyperkalcémie. Obě dávky zoledronátu byly účinnější než pamidronát. Kompletní odpovědi bylo dosaženo desátý den u 88,4 % (p = 0,002), 86,7 % (p = 0,015) a u 69,7 % nemocných léčených 8 mg a 4 mg kyseliny zoledronové a 90 mg pamidronátu (graf 5). Normalizace hladin vápníku bylo dosaženo u 50 % nemocných léčených zoledronátem již 4. den podávání proti 33,3 % ve skupině léčených pamidronátem. Medián trvání kompletní odpovědi rovněž favorizoval kyselinu zoledronovou v obou použitých dávkách oproti pamidronátu (32 a 43 dní proti 18 dnům) [14].
Léčba Pagetovy choroby
Pagetova kostní choroba je charakterizována dramatickým zvýšením kostního obratu (kostní novotvorby i resorpce) v jedné i ve více lokalizacích, doprovázeným chaotickou kostní novotvorbou. Choroba je doprovázena bolestmi kostí, deformitami, patologickými frakturami, sekundární artrózou, neurologickými komplikacemi a rovněž hluchotou. Pro hodnocení aktivity choroby i léčebné odpovědi se využívá sledování hladin ukazatelů kostního obratu, zejména hladin kostního izoenzymu alkalické fosfatázy (ALP). Incidence Pagetovy kostní choroby jeví výrazné etnické rozdíly s nejvyšším výskytem v anglosaském prostředí, kde se objevuje velmi často. V léčbě této nemoci mají své pevné místo bisfosfonáty. Jejich podávání často vede k normalizaci biochemických parametrů kostního obratu a k náhradě chaoticky tvořené „plstnaté" kosti normální kostní lamelární strukturou [16]. Bisfosfonáty rovněž pozitivně ovlivňují kostní bolesti [17]. V současnosti používané vysoké dávky enterálně podávaných bisfosfonátů vyžadují každodenní dávkování po dva až šest měsíců s požadavkem na lačnění nemocného před podáním i po podání léčiva a zachovávání vzpřímené pozice alespoň 30 minut po jeho požití k minimalizaci rizika gastrointestinálních komplikací [17]. Intravenózně podávaný pamidronát je rovněž používán v léčbě Pagetovy choroby, ale pro pacienty představuje jeho podávání sérii pomalých intravenózních infuzí, z nichž každá trvá několik hodin. Proto je nasnadě, že vývoj nových látek pro tuto indikaci může pomoci vyřešit nastíněné problémy. Zdá se, že kyselina zoledronová splňuje nové požadavky na účinnou terapii této nemoci [18, 19].
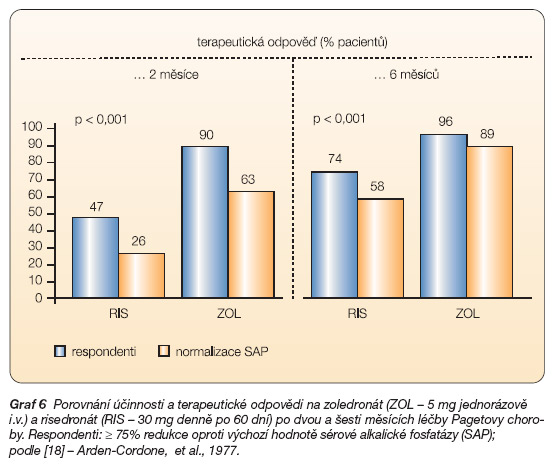
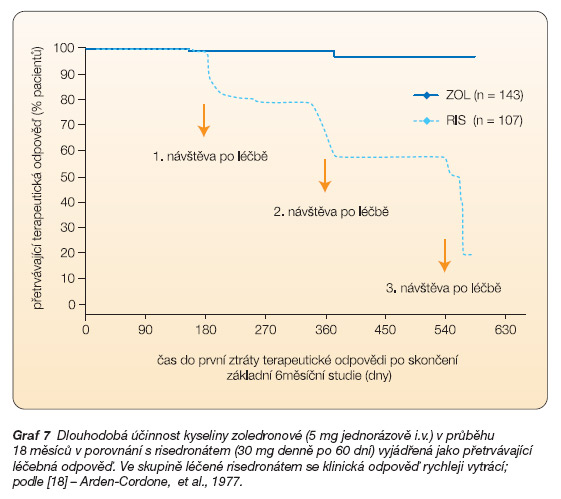
Tato indikace kyseliny zoledronové se opírá o výsledky dvou šestiměsíčních randomizovaných dvojitě slepých, aktivním léčebným ramenem kontrolovaných studií, které porovnávaly efekt jediné 15minutové infuze 5 mg zoledronátu s 60denním enterálním podáváním risedronátu v dávce 30 mg denně [20]. Do těchto studií bylo zařazeno 357 nemocných, z nich 182 spadalo do ramene léčeného zoledronátem. Primárním cílem studie bylo porovnání počtu nemocných dosahujících v obou ramenech remise, která byla definována jako dosažení normálních hodnot kostního izoenzymu alkalické fosfatázy nebo snížení její hladiny o 75 %. Po 6 měsících vykázalo 96,0 % nemocných léčených jedinou infuzí zoledronátu léčebnou odpověď ve srovnání se 74,3 % odpovědí ve skupině léčené risedronátem. Jednalo se o statisticky signifikantní rozdíl (p < 0,001). Po infuzi zoledronátu došlo také k rychlejšímu nástupu klinického efektu (64 v. 89 dní). Vyšší klinická odpověď ve skupině léčené infuzí zoledronátu byla konzistentně potvrzena ve všech podskupinách (demografie, závažnost choroby, anamnéza předcházející léčby), jakož i prostřednictvím dalších ukazatelů kostního obratu. Rovněž kvalita života hodnocená pomocí dotazníku SF36 se významně lišila ve prospěch léčby zoledronátem. Z hlediska snížení bolestivosti byly oba léčebné režimy ekvipotentní. Během následného sledování (190 dní) došlo ve skupině původně léčené risedronátem ke ztrátě efektu u 21 z 82 nemocných zahrnutých do hodnocení ve srovnání pouze s 1 případem relapsu ze 113 sledovaných nemocných léčených zoledronátem (p < 0,001). Na základě těchto výsledků lze uzavřít, že jedna infuze zoledronátu vede k rychlejšímu, kompletnějšímu a setrvalejšímu efektu v terapii Pagetovy kostní choroby (graf 6 a 7).
Jedna z recentních studií prokazuje rovněž určitý ekonomický přínos této formy léčby ve srovnání s tradičním enterálním podáváním bisfosfonátu [21].
Osteoporóza – potenciální budoucí indikace
Postmenopauzální osteoporóza
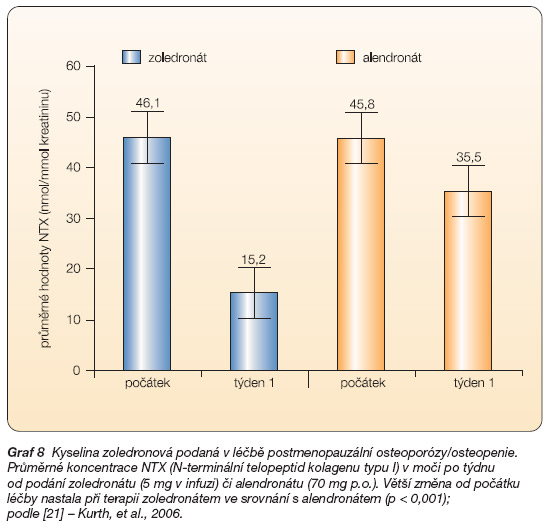
V současné době probíhají klinické studie s podáváním zoledronátu v dávce 5 mg jednou ročně u nemocných s postmenopauzální osteoporózou i osteopenií. Jedna infuze zoledronátu byla srovnávána s efektem 1x týdně podávaného alendronátu 70 mg v randomizované dvojitě slepé 24týdenní studii [22, 23]. Zoledronát rychleji a výrazněji snížil ukazatele kostní resorpce, zejména NTX (N-terminální telopeptid kolagenu typu I) v moči proti alendronátu. Vliv na ukazatele kostní formace se statisticky významně nelišil. Subjekty studie vykazovaly výrazně silnou preferenci pro jedenkrát ročně podávaný medikament proti týdennímu enterálnímu podávání [22]. Zoledronát byl v této studii dobře tolerován, nejčastějším vedlejším účinkem byly příznaky podobné chřipkovému onemocnění. Přítomnost těchto příznaků neovlivnila negativně preferenci této léčby mezi pacientkami [22–24], (graf 8).
Vliv na kostní hmotu po transplantaci jater
Po transplantaci jater se objevuje rychlá ztráta kostní hmoty zejména v období 3–6 měsíců po výkonu a může být spojena s osteoporotickými frakturami. Dvanáctiměsíční randomizovaná dvojitě slepá placebem kontrolovaná studie hodnotila ve dvou transplantačních centrech 62 dospělých jedinců po transplantaci jater, kterým byla podána infuze 4 mg kyseliny zoledronové (n = 32), či fyziologického roztoku během sedmi dnů po operaci, a následně v intervalech 1, 3, 6, a 9 měsíců po transplantaci. Byl prokázán signifikantní účinek aktivní léčby na zachování BMD po třech měsících v oblasti lumbální páteře s rozdílem 4 % (p = 0,002), krčku stehenní kosti (4,7 %, p = 0,001) i celkové hodnoty BMD v oblasti proximálního femuru (3,8 %, p = 0,001) proti placebu. Po 12 měsících byl rozdíl menší: 1,1 % v oblasti lumbální páteře, 2,7 % u krčku stehenní kosti a 2,4 % u celkové hodnoty BMD u proximálního femuru. Léčba kyselinou zoledronovou indukovala přechodnou sekundární hyperparatyreózu při statisticky významné poinfuzní hypokalcémii [25].
Zařazení do současné palety léčiv
V léčbě kostních chorob přichází doba velmi potentních bisfosfonátů, které mohou být podávány v intermitentních či v cyklických režimech (zoledronát, neridronát, tiludronát). Některé z nich již mají své místo v léčbě metastatického postižení kostí u solidních nádorů a mnohočetného myelomu, v léčbě osteoporózy či Pagetovy choroby. Pokračují klinické zkoušky v řadě dalších stavů (ankylozující spondylitida, hypertrofická plicní osteoartropatie, myelofibróza, mužská osteoporóza).
Bisfosfonáty všeobecně jsou bezesporu nejefektivnějšími inhibitory kostní resorpce a v současnosti jedněmi ze základních léčiv v terapii i prevenci postmenopauzální, mužské i kortikoidy indukované osteoporózy, používají se při terapii Pagetovy kostní choroby a osteogenesis imperfecta a mnohé z nich jsou nezastupitelné v prevenci komplikací kostního šíření zhoubných nádorů [3].
Indikace a dávkování
Zoledronát je určen k prevenci kostních příhod (patologických zlomenin, kompresivních zlomenin obratlů, k radiační nebo chirurgické léčbě kostí nebo hyperkalcémie vyvolané nádorovým onemocněním) u pacientů s pokročilou formou nádorového onemocnění postihujícího kosti a k léčbě hyperkalcémie vyvolané nádorovým onemocněním (TIH – Tumor Induced Hypercalcemia) [5]. V této indikaci se zoledronát podává v dávce 4 mg intravenózně každé tři týdny. Další indikací zoledronátu je léčba rozvinuté Pagetovy choroby, kde stačí k potlačení aktivity nemoci dávka 5 mg intravenózně podaná jedenkrát ročně. Potenciální indikací, která se pro zoledronát otevírá v současnosti, je rovněž léčba postmenopauzální osteoporózy či prevence kostních ztrát po transplantaci jater. Do budoucna lze očekávat rozšíření indikací kyseliny zoledronové o další nozologické jednotky.
Kontraindikace
Podávání kyseliny zoledronové je kontraindikováno u těhotných a kojících žen a u pacientů s přecitlivělostí na kyselinu zoledronovou či jiné bisfosfonáty.
Nežádoucí účinky
Při léčbě nádorových onemocnění
Nejčastější nežádoucí účinky pozorované v průběhu léčby u pacientů s metastázami do kostí byly kostní bolesti (17 % pacientů), artralgie (10 %), zvýšená teplota (6 %), nauzea (6 %), myalgie (5 %), projevy chřipkového onemocnění (5 %), ztuhlost a bolesti zad.
Nejčastějšími nežádoucími účinky pozorovanými během léčby hyperkalcémie byly vedle zvýšení tělesné teploty (11 % pacientů) projevy chřipkového onemocnění se zvýšenou teplotou (7 %) a bolesti kostí (1 %), artralgie, únava, zmatenost, žízeň, pancytopenie a bradykardie (1,2 %). Pokles vylučování kalcia ledvinami je často doprovázen snížením sérové hladiny fosforu (3,5 % pacientů), což však obvykle nevyžaduje specifickou léčbu.
Koncentrace vápníku v séru mohou poklesnout k asymptomatické hypokalcemické hladině (6 % pacientů). Bylo zaznamenáno zhoršení funkce ledvin (2,5 % pacientů). U této skupiny vážně nemocných pacientů však k tomuto jevu mohou přispět i jiné rizikové faktory [8–13].
Při léčbě Pagetovy choroby
Během prvních tří dnů po aplikaci se u 53 % nemocných léčených zoledronátem objevují příznaky podobné chřipkovému onemocnění. Tyto příznaky se statisticky významně méně často vyskytovaly ve skupině léčené risedronátem (25 %). Dále se mohou objevit svalové bolesti, horečka, svalová ztuhlost, nauzea, bolesti hlavy, bolesti kostí. Frekvence těchto příznaků je ale podobná rovněž ve skupině s risedronátem. Jsou vesměs přechodné a reagují dobře na symptomatickou léčbu.
V pozdějším období po aplikaci léku (mezi 3. a 13. dnem) se může u nemocných vyskytnout symptomatická hypokalcémie, což je ovšem jev objevující se při léčbě všemi parenterálně podanými bisfosfonáty. Dále byla popsána přítomnost bolestí v končetinách, artralgie, závratě, nazofaryngitida, průjem, bolesti hlavy a bolesti zad. Tyto příznaky se vyskytovaly v obou léčebných ramenech bez významnějšího rozdílu [20].
Osteonekróza čelisti
U pacientů léčených bisfosfonáty s obsahem dusíku byly hlášeny případy osteonekrózy čelisti. Neexistují však data, která by jednoznačně dokládala přímou souvislost osteonekrózy čelisti a podávání bisfosfonátů. Mnoho těchto nemocných bylo rovněž současně léčeno imunosupresivy, cytostatiky či kortikoidy, byl u nich proveden stomatologický výkon a mnoho těchto pacientů mělo známky lokální infekce chrupu. U pacientů s rizikovými faktory (nádorové onemocnění, terapie kortikoidy, špatná ústní hygiena) je třeba provést před zahájením terapie stomatologické ošetření [26, 27].
Interakce
Výskyt významných nežádoucích lékových interakcí nebyl pozorován, klinické studie cíleně zaměřené na interakce kyseliny zoledronové však chybí. Opatrnosti je třeba při současném podávání zoledronátu s nefrotoxickými léčivy či léčivy způsobujícími hypokalcémii.
In vitro bylo popsáno synergické cytotoxické působení zoledronátu s některými antineoplastiky na nádorové buňky (indukce jejich apoptózy) [4].
Balení
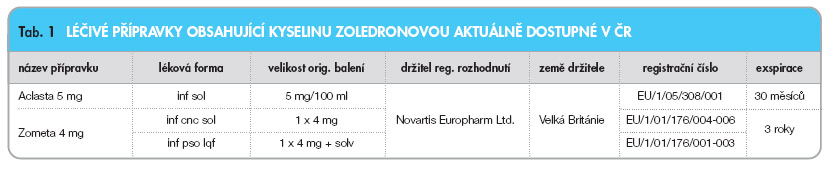
Viz tab. 1.
Přípravek Zometa 4 mg podávaný v 21denních intervalech je indikován k prevenci kostních komplikací nádorových onemocnění metastazujících do skeletu a k léčbě nádory vyvolané hyperkalcémie. Přípravek Aclasta 5 mg
podávaný jednou ročně je novým preparátem pro léčbu Pagetovy kostní choroby.
Obr. 1 Chemický strukturní vzorec kyseliny zoledronové.Jedná se o bisfosfonát se dvěma atomy dusíku. Hlavní část molekuly bisfosfonátů nazývaná pro silnou afinitu k hydroxyapatitu „kostní háček" je vyznačena červenými šipkami. Postranní řetězec tvořený 2 atomy dusíku obsaženými v heterocyklickém imidazolovém kruhu (modré šipky) ovlivňuje afinitu a řídí inhibici FPP syntázy; podle [3] – Green, 2004.
Léčivé přípravky obsahující kyselinu zoledronovou aktuálně dostupné v ČR
Graf 1 Kyselina zoledronová je v rámci skupiny bisfosfonátů nejsilnějším inhibitorem aktivity enzymu farnesyldifosfátsyntázy (FPP); podle [1] – Dunford, et al., 2001.
PAM – pamidronát, ALN – alendronát, IBA – ibandronát, RIS – risedronát, ZOL – zoledronát
Graf 2 Kyselina zoledronová podávaná v léčbě kostních metastáz nemocným s tumory plic či s jinými solidními tumory v dávce 4 mg 1x za 3 týdny po 9 měsíců snížila signifikantně počet nemocných s výskytem kostních komplikací ve srovnání s placebem (jako kostní komplikace hodnocena i hyperkalcémie); podle [8] – Saad, 2005.
Graf 3 Kyselina zoledronová podávaná v léčbě kostních metastáz nemocným s tumory plic či
s jinými solidními tumory v dávce 4 mg 1x za 3 týdny po 9 měsíců signifikantně zvýšila počet nemocných bez kostní příhody ve srovnání s placebem; podle [8] – Saad, 2005.
Graf 4 Podíl nemocných s kostní příhodou v 13. měsíci léčby dle choroby a typu terapie. Jedná se o výsledky studie porovnávající podávání zoledronátu s pamidronátem u nemocných s mnohočetným myelomem (MM) či s metastazujícím karcinomem prsu (Ca prsu); podle [9, 10] – Rosen, et al., 2003; 2001.
Graf 5 Porovnání účinnosti zoledronátu (4 mg i.v.) s pamidronátem (90 mg i.v.) v léčbě nádorové hyperkalcémie (procento nemocných dosahujících kompletní odpovědi, S-Ca < 2,7 mmol/l); podle [12, 13] – Rosen et al., 2004; Kohno, et al., 2005.
Graf 6 Porovnání účinnosti a terapeutické odpovědi na zoledronát (ZOL – 5 mg jednorázově i.v.) a risedronát (RIS – 30 mg denně po 60 dní) po dvou a šesti měsících léčby Pagetovy choroby. Respondenti: ≥ 75% redukce oproti výchozí hodnotě sérové alkalické fosfatázy (SAP); podle [18] – Arden-Cordone, et al., 1977.
Graf 7 Dlouhodobá účinnost kyseliny zoledronové (5 mg jednorázově i.v.) v průběhu 18 měsíců v porovnání s risedronátem (30 mg denně po 60 dní) vyjádřená jako přetrvávající léčebná odpověď. Ve skupině léčené risedronátem se klinická odpověď rychleji vytrácí; podle [18] – Arden-Cordone, et al., 1977.
Graf 8 Kyselina zoledronová podaná v léčbě postmenopauzální osteoporózy/osteopenie. Průměrné koncentrace NTX (N-terminální telopeptid kolagenu typu I) v moči po týdnu od podání zoledronátu (5 mg v infuzi) či alendronátu (70 mg p.o.). Větší změna od počátku léčby nastala při terapii zoledronátem ve srovnání s alendronátem (p < 0,001); podle [21] – Kurth, et al., 2006.
Seznam použité literatury
- [1] Dunford JE, Thompson K, Coxon FP, et al. Structure-activity relationships for inhibition of farnesyl diphosphate synthase in vitro and inhibition of bone resorption in vivo by nitrogen-containing bisphosphonates. J Pharmacol Exp Ther 2001; 296: 235–242.
- [2] Monkkonen H, Auriola S, Lehenkari P, et al. A new endogenous ATP analog (ApppI) inhibits the mitochondrial adenine nucleotide translocase (ANT) and is responsible for the apoptosis induced by nitrogen-containing bisphosphonates. Brit J Pharmacol 2006; 147: 437–445.
- [3] Green JR. Bisphosphonates: clinical review. Oncologist 2004; 9 (Suppl 4): 3–13.
- [4] Neville Webbe HL, Evans CA, Coleman RE, Holen I. Mechanisms of the synergistic interaction between the bisphosphonate zoledronic acid and the chemotherapy agent paclitaxel in breast cancer cells in vitro. Tumour Biol 2006; 27: 92–103.
- [5] Wellington K, Goa KL. Zoledronic acid: a review of its use in the management of bone metastases and hypercalcemia of malignancy. Drugs 2003; 63: 417–437.
- [6] Coleman RE. Skeletal complications of malignancy. Cancer 1997; 80 (Suppl): 1588–1594.
- [7] Saad F, Gleason DM, Murray R, et al. A randomized, placebo controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma. J Natl Cancer Inst 2002; 94: 1458–1468.
- [8] Saad F. Clinical benefit of zoledronic acid for the prevention of skeletal complications in advanced prostate cancer. Clinic Prostate Cancer 2005; 4: 31–37.
- [9] Rosen LS, Gordon D, Tchekmedyian S, et al. Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: A phase III, double blind, randomized trial – the zoledronic acid lung cancer and other solid tumor study group. J Clin Oncology 2003; 21: 3150–3157.
- [10] Rosen LS, Gordon D, Kaminski M, et al. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma: a phase III, double blind,comparative trial. Cancer J 2001; 7: 377–387.
- [11] Lipton A, Small E, Saad F, et al. The new bisphosphonate, ZOMETA (zoledronic acid) decreases skeletal complications in both lytic and blastic lesions: A comparison to pamidronate. Cancer Invest 2001; 20: 45–47.
- [12] Rosen LS, Gordon D, Dugan W, et al. Zoledronic acid is superior to pamidronate for the treatment of bone metastases in breast carcinoma patients with at least one osteolytic lesion. Cancer 2004; 100: 36–43.
- [13] Kohno N, Aogi K, Minami H, et al. Zoledronic acid significantly reduces skeletal complications compared with placebo in Japanese women with bone metastases from breast cancer: A randomized, placebo-controlled trial. J Clin Oncol 2005; 23: 3314–3321.
- [14] Major P, Lortholary A, Hon J, et al. Zoledronic acid is superior to pamidronate in the treatment of hypercalcemia of malignancy: A pooled analysis of two randomized, controlled clinical trials. J Clin Oncology 2001; 19: 558–567.
- [15] Berenson JR, Rosen LS, Howell A, et al. Zoledronic acid reduces skeletal-related events in patients with osteolytic metastases: A double blind, randomized dose response study. Cancer 2001; 91: 1191–1200.
- [16] Siris E, Weinstein RS, Altman R, et al. Comparative study of alendronate versus etidronate for the treatment of Paget´s disease of bone. J Clin Endrocrinol Metab 1996; 81: 961–967.
- [17] Singer FR, Clemens TI, Eusebio RA, et al. Risedronate, a highly effective oral agent in the treatment of patients with severe Paget ´s disease. J Clin Endocrinol Metab 1998; 83: 1906–1910.
- [18] Arden-Cordone M, Siris ES, Lyles KW, et al. Antiresorptive affect of a single infusion of microgram quantities of zoledronate in Paget ´s disease of bone. Calcif Tissue Int 1997; 60: 415–418.
- [19] Buckler H, Fraser W, Hosking D, et al. Single infusion of zoledronate in Paget ´s disease of bone: a placebo controlled, dose ranging study. Bone 1999; 24, Suppl. 5: S81–85.
- [20] Reid IR, Miller P, Lyles K, et al. Comparison of a single infusion of zoledronic acid with risedronate for Paget ´s disease. NEJM 2005; 353: 898–908.
- [21] Kurth AA, Kotowa W, Goel D, et al. Long term cost-effectiveness of zoledronic acid versus risedronate in patients with Paget ´s disease of the bone in Germany. Osteoporosis Int 2006; 17 (Suppl. 1): S64.
- [22] Lindsay R, Saag K, Kriegman A, et al. A single zoledronic acid 5 mg infusion is preferred over weekle 70 mg oral alendronate in a clinical trial of post-menopausal women with osteoporosis/osteopenia. Osteoporosis Int 2006; 17 (Suppl. 1): S43–44.
- [23] Saag K, Lindsay R, Kriegman A, et al. A zoledronic acid 5 mg produces more rapid reduction in bone resoption markers compared to weekly 70 mg oral alendronate in post-menopausal women with osteoporosis/osteopenia. Osteoporosis Int 2006; 17 (Suppl. 1): S44.
- [24] Reid IR, Brown JP, Burckhardt P, et al. Intravenous zoledronic acid in post-menopausal women with low bone mineral density. NEJM 2002; 346: 653–661.
- [25] Crawford BA, Kam C, Pavlovic J, et al. Zoledronic acid prevents bone loss after liver transplantation: a randomized, double-blind, placebo-controlled trial. Ann Intern Medicine 2006; 144: 239–248.
- [26] Gibbs SD, O´Grady J, Seymour JF, et al. Bisphosphonate-induced osteonecrosis of the jaw requires early detection and intervention. Med J Austral 2005; 183: 549–550.
- [27] Markiewicz MR, Margarone JE 3rd, Campbell JH, et al. Bisphosphonate-associated osteonecrosis of the jaws: a review of current knowledge. J Am Dental Assoc 2005; 136: 1669–1674.