Lanadelumab
Souhrn:
Sobotková M. Lanadelumab. Remedia 2020; 30: 526–531.
Lanadelumab je plně humánní monoklonální protilátka (IgG1κ) namířená proti plazmatickému kallikreinu. Jedná se o novou, efektivní a velmi dobře tolerovanou terapeutickou alternativu určenou k dlouhodobé preventivní léčbě pacientů s hereditárním angioedémem. Lanadelumab se podává subkutánně a je registrován pro použití od 12 let věku.
Summary:
Sobotkova M. Lanadelumab. Remedia 2020; 30: 526–531.
Lanadelumab is a fully human monoclonal antibody (IgG1κ) against plasma kallikrein. Itʼs a novel, effective and well tolerated therapeutic option for prevention of hereditary angioedema attacks. Lanadelumab is administered subcutaneously and has been approved for use in patiens 12 years of age and older.
Key words: angioedema, bradykinin, C1 inhibitor, hereditary, monoclonal antibody
Farmakologická skupina
Lanadelumab (Takhzyro) má dle ATC klasifikace označení B06AC05, a patří tedy do anatomické skupiny Krev a krvetvorné orgány a do hlavní terapeutické skupiny Jiné hematologické látky [1].
Indikace
Lanadelumab představuje první registrovanou monoklonální protilátku určenou k prevenci rekurentních atak hereditárního angioedému (HAE) [1]. Hereditárním angioedémem rozumíme skupinu onemocnění vznikajících na dědičném podkladě, která se manifestuje otoky v různých lokalitách. Jeho nejčastější příčinou je deficit C1 inhibitoru (C1 INH) podmíněný mutací v genu SERPING1 [2]. Lanadelumab v terapii HAE významně rozšiřuje terapeutické možnosti v rámci tzv. dlouhodobé profylaktické léčby (long term prophylaxis, LTP), která je určena zejména pro pacienty s těžkými nebo závažnými otoky a má za cíl těmto atakám předcházet [3]. Lze ho podávat u dospělých pacientů a u dětí ve věku od 12 let [1]. V roce 2018 získal registraci amerického Úřadu pro kontrolu potravin a léčiv (FDA) i Evropské lékové agentury (EMA) a v roce 2019 byla tato léčba poprvé zahájena u pacienta v České republice [4,5].
Mechanismus účinku
Za hlavní mediátor angioedému
považujeme u pacientů s HAE bradykinin. Ten vzniká
z vysokomolekulárního kininogenu (high molecular weight
kininogen, HMWK) působením kallikreinu (obr. 1) [2].
Lanadelumab je plně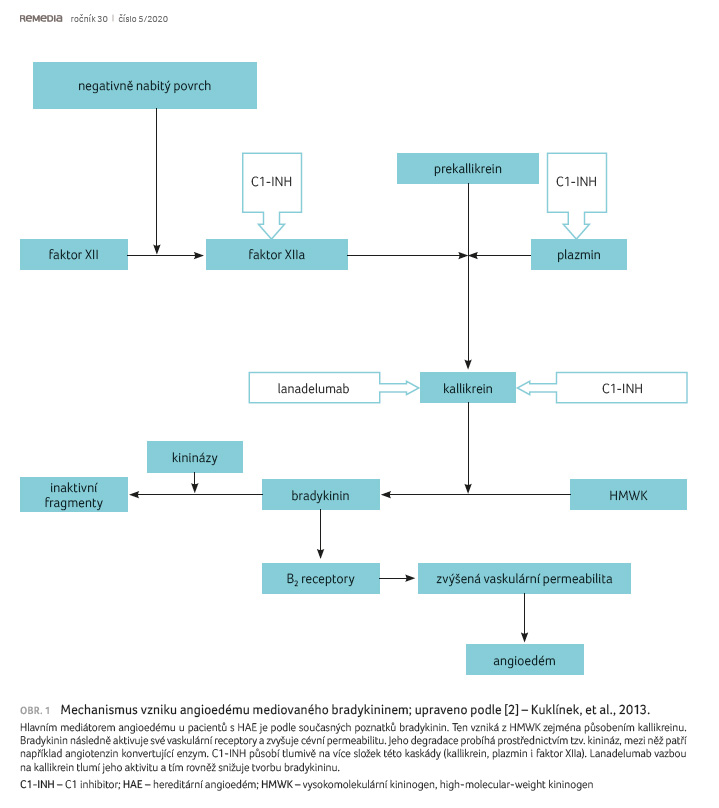 humánní monoklonální protilátka IgG1κ,
která inhibuje aktivitu plazmatického kallikreinu, a tím
rovněž tlumí tvorbu bradykininu [1]. Přitom tkáňový systém
kallikrein kininy není ovlivněn, a tak zůstává
zachována tvorba bradykininu nutná pro fyziologické
a kardiovaskulární funkce [6]. V preklinických studiích
lanadelumab in vitro prokázal schopnost vázat se na aktivní
místo kallikreinu a inhibovat kallikrein volný i vázaný
na HMWK. In vivo na zvířecím modelu (makak
jávský) tlumil proteolýzu HMWK mediovanou kallikreinem
a u potkanů (plemeno Sprague Dawley)
redukoval tvorbu otoků navozenou karagenanem [6]. Schopnost
inhibovat kallikrein lanadelumab následně potvrdil v klinické
studii u zdravých dobrovolníků (fáze Ia) a také
u pacientů s HAE s deficitem C1 inhibitoru
(HAE C1 INH, fáze Ib) [7].
humánní monoklonální protilátka IgG1κ,
která inhibuje aktivitu plazmatického kallikreinu, a tím
rovněž tlumí tvorbu bradykininu [1]. Přitom tkáňový systém
kallikrein kininy není ovlivněn, a tak zůstává
zachována tvorba bradykininu nutná pro fyziologické
a kardiovaskulární funkce [6]. V preklinických studiích
lanadelumab in vitro prokázal schopnost vázat se na aktivní
místo kallikreinu a inhibovat kallikrein volný i vázaný
na HMWK. In vivo na zvířecím modelu (makak
jávský) tlumil proteolýzu HMWK mediovanou kallikreinem
a u potkanů (plemeno Sprague Dawley)
redukoval tvorbu otoků navozenou karagenanem [6]. Schopnost
inhibovat kallikrein lanadelumab následně potvrdil v klinické
studii u zdravých dobrovolníků (fáze Ia) a také
u pacientů s HAE s deficitem C1 inhibitoru
(HAE C1 INH, fáze Ib) [7].
Dávkování, léková forma a způsob
podání
Lanadelumab v roztoku se podává formou podkožní injekce v dávce 300 mg (2 ml). Vhodným místem pro aplikaci je oblast abdominální, horní část paže nebo stehno. Místa je třeba střídat. Proškolený pacient si může lék podávat sám v domácím prostředí. Terapii se doporučuje zahájit aplikací každé dva týdny. U pacientů, kteří jsou při této léčbě stabilně bez atak (a zejména tehdy, pokud mají nižší tělesnou hmotnost), lze aplikační interval prodloužit až na čtyři týdny [1]. V souhrnu údajů o přípravku (SPC) určeném pro Evropu (a tedy i Českou republiku) není uvedeno, po jak dlouhé době léčby lze k prodloužení aplikačního intervalu přistoupit. Podle příbalové informace pro USA a dle mezinárodního doporučení pro léčbu HAE z roku 2019 by pacient měl být zcela asymptomatický více než šest měsíců [7,8]. Stejně jako u jiných biologických přípravků i u lanadelumabu je doporučeno evidovat podanou šarži [1].
Farmakokinetické vlastnosti
Po podkožním podání dosahuje lanadelumab maximální koncentrace v séru přibližně za pět dní. Předpokládá se, že k dosažení stabilní koncentrace je při aplikačním intervalu dva týdny potřeba asi 70 dní. Volba aplikačního místa nemá vliv na absorpci lanadelumabu. Průměrný distribuční objem představuje u pacientů s HAE 14,5 litru. Lanadelumab má průměrnou celkovou clearance 0,0297 l/h a poločas konečné eliminace se pohybuje kolem 14 dní. Jelikož se jedná o monoklonální protilátku, eliminace probíhá zejména intracelulárním katabolismem. Studie farmakokinetiky u speciálních populací (u těhotných, pacientů s poruchou jater nebo ledvin či dělených podle věku a pohlaví) nebyly provedeny. Při farmakologické analýze nebyl patrný vliv věku či pohlaví na clearance nebo distribuční objem lanadelumabu. Naopak tělesná hmotnost byla identifikována jako důležitý faktor, který clearance ovlivňuje. Dávka 300 mg každé dva týdny nicméně poskytuje dostatečný terapeutický efekt pro všechny pacienty. Vzhledem ke způsobu eliminace je nepravděpodobné, že by choroby jater či ledvin měly na clearance vliv [1,7].
Klinické zkušenosti
Účinnost lanadelumabu byla ověřena
mezinárodní multicentrickou, randomizovanou, dvojitě zaslepenou,
placebem kontrolovanou klinickou studií (fáze III), která nesla
označení HELP (Hereditary Angioedema Long term Prophylaxis).
Probíhala na 41 místech v Evropě, Spojených státech
amerických, Kanadě a Jordánsku od března 2016 do dubna
2017 a v roce 2018 byly publikovány její výsledky
[9,10]. Do studie bylo zařazeno celkem 125 pacientů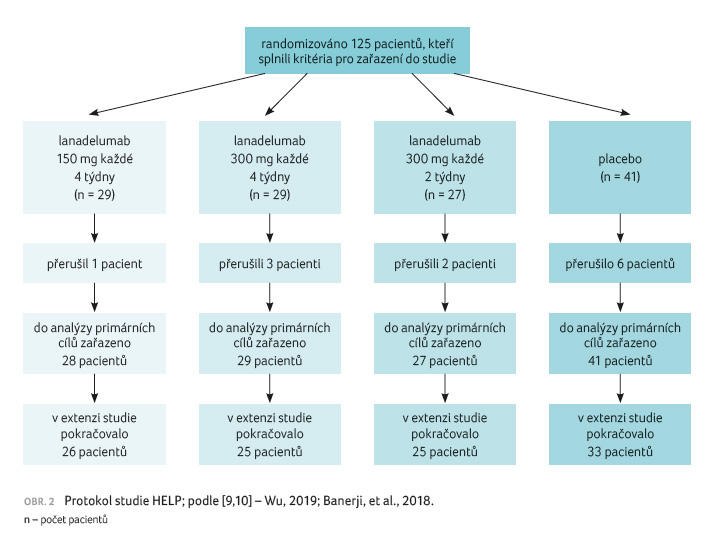 s HAE C1 INH, kteří byli ve věku od 12 let,
a 113 z nich studii dokončilo [9,10]. Primárním cílem
bylo porovnání účinnosti lanadelumabu v LTP k prevenci
atak angioedému oproti placebu na základě počtu atak
verifikovaných investigátorem po dobu 26 týdnů
(den 0–182). Sekundárním cílem byla monitorace počtu
středně těžkých a těžkých atak, počtu atak vyžadujících
podání akutní terapie a také počtu atak od dne 14
do dne 182 [9,10]. Dále byl sledován počet pacientů bez
atak, počet pacientů, u kterých došlo k redukci atak
(respondérů), počet dní bez atak a počet atak s vysokou
morbiditou [10]. Zařazení pacienti byli rozděleni do skupiny
léčené lanadelumabem a placebem v poměru 2 : 1.
Pacienti zařazení do větve s lanadelumabem byli dále
v poměru 1 : 1 : 1 rozděleni do skupin léčených
150 mg lanadelumabu každé čtyři týdny, 300 mg každé čtyři
týdny a 300 mg každé dva týdny (obr. 2). Léčba
lanadelumabem se ukázala být efektivnější než placebo ve všech
třech větvích [10]. Medián věku populace ve studii činil
42 let (12–73 let), přičemž převažovaly ženy (70 %)
[1]. Průměrný počet atak za měsíc byl ve větvi
s placebem 1,97 oproti 0,48 ve větvi s lanadelumabem
v dávce 150 mg každé čtyři týdny, 0,53
ve větvi s 300 mg lanadelumabu
s HAE C1 INH, kteří byli ve věku od 12 let,
a 113 z nich studii dokončilo [9,10]. Primárním cílem
bylo porovnání účinnosti lanadelumabu v LTP k prevenci
atak angioedému oproti placebu na základě počtu atak
verifikovaných investigátorem po dobu 26 týdnů
(den 0–182). Sekundárním cílem byla monitorace počtu
středně těžkých a těžkých atak, počtu atak vyžadujících
podání akutní terapie a také počtu atak od dne 14
do dne 182 [9,10]. Dále byl sledován počet pacientů bez
atak, počet pacientů, u kterých došlo k redukci atak
(respondérů), počet dní bez atak a počet atak s vysokou
morbiditou [10]. Zařazení pacienti byli rozděleni do skupiny
léčené lanadelumabem a placebem v poměru 2 : 1.
Pacienti zařazení do větve s lanadelumabem byli dále
v poměru 1 : 1 : 1 rozděleni do skupin léčených
150 mg lanadelumabu každé čtyři týdny, 300 mg každé čtyři
týdny a 300 mg každé dva týdny (obr. 2). Léčba
lanadelumabem se ukázala být efektivnější než placebo ve všech
třech větvích [10]. Medián věku populace ve studii činil
42 let (12–73 let), přičemž převažovaly ženy (70 %)
[1]. Průměrný počet atak za měsíc byl ve větvi
s placebem 1,97 oproti 0,48 ve větvi s lanadelumabem
v dávce 150 mg každé čtyři týdny, 0,53
ve větvi s 300 mg lanadelumabu 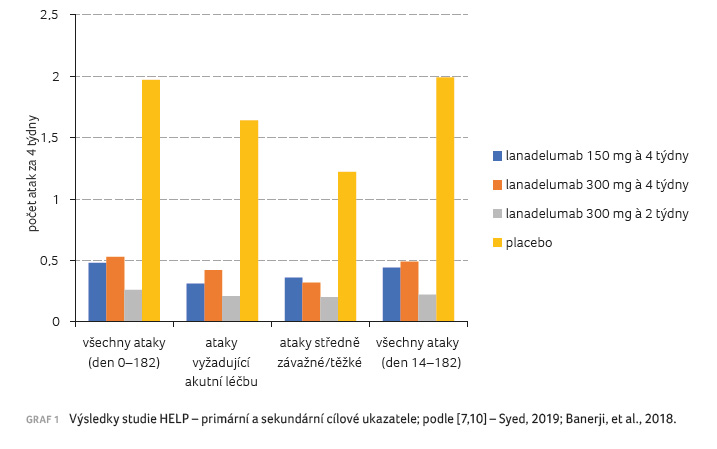 každé čtyři týdny
a 0,26 ve větvi s 300 mg lanadelumabu každé dva
týdny [10]. Také ve všech vedlejších kritériích byl
efekt lanadelumabu oproti placebu patrný (graf 1) [9,10].
Ve skupinách s lanadelumabem byl rovněž podstatně vyšší
podíl pacientů bez atak (39,3 % ve větvi se 150 mg à 4
týdny, 31 % ve větvi s 300 mg à 4 týdny a 44,4 %
ve větvi s 300 mg à 2 týdny) oproti větvi s placebem
(2,4 %) a pacienti léčení lanadelumabem měli více dní
v měsíci bez ataky a méně atak s vysokou
morbiditou. K redukci počtu atak alespoň o 50 % došlo
u 89,3 % pacientů léčených 150 mg à čtyři týdny
a u všech pacientů s dávkou lanadelumabu 300 mg,
zatímco ve skupině s placebem jen u 31,7 % pacientů.
Rozdíl mezi léčbou lanadelumabem a placebem byl ještě
patrnější při porovnání redukce počtu atak o 70 %,
resp. 90 % [10]. Na základě provedeného dotazníkového
průzkumu se zlepšila také kvalita života pacientů léčených
lanadelumabem [7,9,10].
každé čtyři týdny
a 0,26 ve větvi s 300 mg lanadelumabu každé dva
týdny [10]. Také ve všech vedlejších kritériích byl
efekt lanadelumabu oproti placebu patrný (graf 1) [9,10].
Ve skupinách s lanadelumabem byl rovněž podstatně vyšší
podíl pacientů bez atak (39,3 % ve větvi se 150 mg à 4
týdny, 31 % ve větvi s 300 mg à 4 týdny a 44,4 %
ve větvi s 300 mg à 2 týdny) oproti větvi s placebem
(2,4 %) a pacienti léčení lanadelumabem měli více dní
v měsíci bez ataky a méně atak s vysokou
morbiditou. K redukci počtu atak alespoň o 50 % došlo
u 89,3 % pacientů léčených 150 mg à čtyři týdny
a u všech pacientů s dávkou lanadelumabu 300 mg,
zatímco ve skupině s placebem jen u 31,7 % pacientů.
Rozdíl mezi léčbou lanadelumabem a placebem byl ještě
patrnější při porovnání redukce počtu atak o 70 %,
resp. 90 % [10]. Na základě provedeného dotazníkového
průzkumu se zlepšila také kvalita života pacientů léčených
lanadelumabem [7,9,10].
Ze 113 pacientů, kteří dokončili studii HELP, 109 pokračovalo v nezaslepené extenzi této studie (HELP OLE study) [7,10]. Navíc bylo do této extenze zařazeno dalších 103 pacientů [1,11]. Pacienti z původní studie HELP nejprve dostali dávku 300 mg lanadelumabu a další poté po první atace. Pak pokračovali aplikací každé dva týdny. Pacienti nově zařazení dostávali 300 mg každé dva týdny bez ohledu na výskyt ataky. Po prvních dvou dávkách a zaškolení si pacienti mohli lék sami aplikovat v domácím prostředí. Primárním cílem studie bylo ověření bezpečnosti subkutánně podávaného lanadelumabu. Mezi sekundární cíle patřilo zhodnocení efektivity, bezpečnosti domácí aplikace, určení doby do první ataky angioedému (za účelem stanovení nejdelšího možného aplikačního intervalu), zhodnocení bezpečnosti a účinnosti u pacientů, kteří přecházeli na lanadelumab z jiné dlouhodobé profylaktické léčby, a zhodnocení kvality života, farmakokinetiky/farmakodynamiky a imunogenicity [9,12]. Studie probíhala do listopadu 2019 a publikované výsledky jsou zatím pouze předběžné [11]. U pacientů byla pozorována redukce počtu atak ve srovnání s historickou hodnotou za tři měsíce před zařazením bez ohledu na to, zda byli před zařazením do studie léčeni jinou profylaktickou léčbou, či nikoliv [9]. Také pacienti ze studie HELP, kteří neodpověděli na dávku lanadelumabu 150 mg podávanou každé čtyři týdny, pozorovali zlepšení stavu při dávce 300 mg podávané každé dva týdny [7,9].
Kontraindikace a nežádoucí
účinky
Jedinou kontraindikací lanadelumabu je známá hypersenzitivita na účinnou látku nebo na látky pomocné [1]. Nejčastěji hlášenými nežádoucími účinky jsou bolest, zarudnutí či hematom v místě podání léčiva. Tyto reakce jsou v naprosté většině mírné a v 90 % případů vymizejí během jednoho dne po aplikaci. Medián jejich trvání je šest minut [1,10]. Mezi další nežádoucí účinky patří bolest hlavy a závratě, hypersenzitivní reakce, myalgie a elevace hodnot alaninaminotransferázy (ALT) a aspartátaminotransferázy (AST) [1,10]. Nežádoucí reakce pozorované ve studii HELP byly mírné či středně závažné, nedošlo k žádným těžkým reakcím spojeným s léčbou nebo k úmrtí [7,10]. U pacientů léčených lanadelumabem můžeme pozorovat prodloužení koagulačních testů (konkrétně aktivovaného parciálního tromboplastinového času, aPTT) z důvodu laboratorní interakce. Tento nález není spojen s poruchou koagulace a s abnormálně zvýšenou krvácivostí [1,7]. Někteří pacienti mohou tvořit protilátky proti lanadelumabu. Jejich výskyt byl pozorován u 11,9 % pacientů, avšak jejich titry byly nízké. Výskyt protilátek v séru pacientů může být jen přechodný. Produkce neutralizačních protilátek byla pozorována u 2,4 % pacientů. Nebyl však zaznamenán vliv těchto protilátek na farmakokinetiku, farmakodynamiku či klinický efekt [1].
Lékové interakce
Žádné studie, které by zkoumaly lékové interakce, nebyly provedeny. Vzhledem k vlastnostem lanadelumabu se žádné farmakokinetické interakce se současně podávanými léčivy nepředpokládají.
Těhotenství a kojení
O použití lanadelumabu v graviditě máme jen omezené údaje. Studie provedené na zvířatech neukazují žádné přímé či nepřímé nežádoucí účinky, nicméně podávání lanadelumabu v graviditě je vhodné se vyhnout [1]. Také nemáme žádné informace o tom, zda lanadelumab přestupuje do mateřského mléka. Jelikož se jedná o velkou molekulu, je množství přestupující do mateřského mléka nejspíš velmi malé, a navíc bude lanadelumab pravděpodobně natráven v gastrointestinálním traktu dítěte [9]. Vzhledem k tomu, že během několika prvních dnů po porodu se lidské IgG protilátky do mateřského mléka vylučují a brzy poté klesá jejich koncentrace na nízké hodnoty, je vhodné se během těchto několika dní kojení vyhnout. Poté lze lanadelumab používat i při laktaci, pokud je jeho podávání indikováno [1].
Zařazení do současné palety
léčiv
V rámci terapie HAE řešíme tři základní situace: léčbu již vzniklého otoku (léčba akutní ataky), preventivní léčbu v situaci, kdy pacientovi otok hrozí (krátkodobá profylaktická léčba; short term prophylaxis, STP), a preventivní léčbu u pacientů s častými či závažnými atakami (LTP) [3]. Pro léčbu akutní ataky pacientů s HAE C1 INH máme k dispozici tři plně hrazené, velmi dobře účinné léky, které si proškolení pacienti mohou v případě potřeby aplikovat i sami. Jedná se o ikatibant (Firazyr), který se podává subkutánně, a dva intravenózní koncentráty humánního C1 inhibitoru – plazmatický (Berinert) a rekombinantní (Ruconest).
V České republice je registrován i plazmatický koncentrát C1 INH Cinryze, ale u něj zatím nebyla stanovena úhrada ze zdravotního pojištění [3]. Za účelem STP je aktuálně nejvhodnější použít plazmatický koncentrát C1 INH Berinert, ale ani u něj v této indikaci nebyla stanovena úhrada a je třeba o ni žádat revizního lékaře. V úvahu také připadá použití čerstvě mražené plazmy či přípravku Cinryze. V případě, že žádná z výše jmenovaných alternativ není k dispozici, je možné využít méně účinné profylaxe atenuovanými androgeny (danazol) nebo ve výjimečných případech i kyseliny tranexamové [3]. V LTP v našich podmínkách dosud převažuje použití atenuovaných androgenů, konkrétně danatrolu. U pacientů, kde je jeho použití kontraindikováno (např. děti a fertilní ženy), využíváme kyselinu tranexamovou. Zejména použití atenuovaných androgenů však s sebou přináší četné nežádoucí účinky a kyselina tranexamová je dle mezinárodních doporučení považována za nedostatečně účinnou [13].
V zahraničí je k LTP využíván i intravenózní koncentrát humánního plazmatického C1 INH (Cinryze). V našich podmínkách se jeho použití nerozšířilo, zejména z důvodu špatné dostupnosti. Nově se na našem trhu pro účely LTP objevil koncentrát humánního plazmatického C1 inhibitoru k subkutánní aplikaci (Berinert 2 000/3 000 IU) a lanadelumab (Takhzyro). Oba přípravky představují velmi žádoucí a dlouho očekávané rozšíření našich terapeutických možností v rámci LTP. Oproti intravenóznímu a subkutánnímu přípravku, které se zpravidla musejí aplikovat dvakrát týdně, nabízí lanadelumab možnost podání formou subkutánní injekce jednou za 2–4 týdny [7]. Vzhledem k vysoké ceně se však zatím jedná o terapeutickou alternativu určenou jen pro ty nejzávažnější pacienty. Jeho úhrada ze zdravotního pojištění nebyla stanovena, a tak je třeba o ni pro konkrétního pacienta žádat revizního lékaře příslušné zdravotní pojišťovny [3].
Závěr
V posledních letech se spektrum léků určených k terapii pacientů s HAE významně rozšířilo. Toto rozšíření se týká hlavně oblasti léčby akutních atak. V dlouhodobé preventivní léčbě byly dosud naše možnosti omezené. Lanadelumab, který funguje jako inhibitor plazmatického kallikreinu, představuje první registrovanou monoklonální protilátku určenou k preventivní terapii HAE. Na základě provedené klinické studie se jedná o velmi účinnou léčebnou alternativu s minimem nežádoucích účinků, která může významně zlepšit kvalitu života pacientů se závažnou formou tohoto onemocnění.
Seznam použité literatury
- [1] Souhrn údajů o přípravku Takhzyro®. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/takhzyro‑epar‑product‑information_cs.pdf [navštíveno 21. 8. 2020].
- [2] Kuklínek P, Hanzlíková J. Hereditární angioedém. Praha: Medical Tribune CZ, 2013; 74.
- [3] Sobotková M. Hereditární angioedém a aktuální možnosti jeho léčby v České republice. Farmakoter Revue 2020; 3: 302‒308.
- [4] Takhzyro. FDA approval [online]. Dostupné na: https://www.fda.gov/
- [5] Takhzyro. European Medicines Agency [online]. Dostupné na: https://www.ema.europa.eu/en/medicines/human/EPAR/takhzyro [navštíveno 21. 8. 2020].
- [6] Kenniston JA, Faucette RR, Martik D, et al. Inhibition of plasma kallikrein by a highly specific active site blocking antibody. J Biol Chem 2014; 289: 23596‒23608.
- [7] Syed YY. Lanadelumab: A Review in Hereditary Angioedema. Drugs 2019; 79: 1777‒1784.
- [8] Betschel S, Badiou J, Binkley K, et al. The International/Canadian Hereditary Angioedema Guideline [published correction appears in Allergy Asthma Clin Immunol 2020 May 6; 16: 33]. Allergy Asthma Clin Immunol 2019; 15: 72.
- [9] Wu MA. Lanadelumab for the treatment of hereditary angioedema. Expert Opin Biol Ther 2019; 19: 1233‒1245.
- [10] Banerji A, Riedl MA, Bernstein JA, et al. Effect of Lanadelumab Compared With Placebo on Prevention of Hereditary Angioedema Attacks: A Randomized Clinical Trial [published correction appears in JAMA 2019 Apr 23; 321: 1636]. JAMA 2018; 320: 2108‒2121.
- [11] Tisková zpráva společnosti Takeda. New Data from the Phase 3 HELP Study Open‑Label Extension Evaluate the Long‑Term Safety and Efficacy of TAKHZYRO® (lanadelumab) in Reducing Hereditary Angioedema Attacks [online]. Dostupné na: https://www.takeda.com/newsroom/newsreleases/2020/new‑data‑from‑the‑phase‑3‑help‑study‑open‑label‑extension‑evaluate‑the‑long‑term‑safety‑and‑efficacy‑of‑takhzyro‑lanadelumab‑in‑reducing‑hereditary‑angioedema‑attacks/ [navštíveno 23. 6. 2020].
- [12] Riedl MA, Bernstein JA, Craig T, et al. An open‑label study to evaluate the long‑term safety and efficacy of lanadelumab for prevention of attacks in hereditary angioedema: design of the HELP study extension. Clin Transl Allergy 2017; 7: 36.
- [13] Maurer M, Magerl M, Ansotegui I, et al. The international WAO/EAACI guideline for the management of hereditary angioedema ‒ The 2017 revision and update. Allergy 2018; 73: 1575‒1596.