Liraglutid
Liraglutid je dlouhodobě působící analog lidského glukagon-like peptidu-1 (GLP-1), vyznačuje se rezistencí vůči účinkům DPP-4, má dlouhý biologický poločas eliminace a působí 24 hodin. Jeho účinnost a bezpečnost byla ověřena v sérii klinických studií, v nichž byl liraglutid podáván v monoterapii, ve dvojkombinaci i v trojkombinaci a srovnáván s placebem či s dalšími antidiabetiky – glimepiridem, glitazonem, inzulinem glarginem, exenatidem či sitagliptinem. Liraglutid se ukazuje jako léčivá látka, která ve všech uvedených režimech účinně zlepšuje kompenzaci diabetu, snižuje HbA1c, lačnou i postprandiální glykemii. Podávání liraglutidu v monoterapii nebo v kombinaci s metforminem či pioglitazonem není provázeno rizikem vzniku hypoglykemie. Podání této látky navíc vede ke snížení hmotnosti, k poklesu systolického krevního tlaku a k úpravě řady biomarkerů kardiovaskulárního rizika. Nejčastějším nežádoucím účinkem jsou gastrointestinální obtíže, které však u většiny nemocných odeznívají do 4 týdnů od zahájení léčby. V ČR je liraglutid běžně dostupný už jeden rok, zatím potvrzuje klinická očekávání a ukazuje se jako účinná molekula s výborným bezpečnostním profilem. Vzhledem k dosud chybějícím definitivním výsledkům klinických studií testujících dlouhodobý bezpečnostní profil liraglutidu z hlediska rizika KV mortality a nádorových onemocnění, včetně karcinomů štítné žlázy, zůstává liraglutid antidiabetikem druhé volby. Je vhodný do kombinační léčby nemocných s diabetem 2. typu. Hlavním podpůrným kritériem pro jeho podání je BMI vyšší než 35 kg/m2. Podává se v podkožní injekci 1krát denně.
Farmakologická skupina
Liraglutid řadíme do skupiny: ostatní léčiva k terapii diabetu, s výjimkou inzulinů. ATC kód: A10BX07.
![Obr. 1 Struktura liraglutidu a lidského GLP-1; podle [10, 11] – Degn, et al., 2004; Knudsen, et al., 2000.](https://www.remedia.cz/photo-a-28532---.jpg) Liraglutid je dlouhodobě účinkující analog lidského glukagon-like peptidu-1 (GLP-1). Prodloužení účinku je dosaženo záměnou lysinu v pozici 34 za arginin poblíž terminální NH2 skupiny a navázáním kyseliny palmitové (C16:0) na lysin v pozici 26 prostřednictvím kyseliny gamma-glutamové. Strukturu liraglutidu znázorňuje obr. 1. Molekula vykazuje 97% homologii s lidským GLP-1 (7–37). Vysoký stupeň homologie se pravděpodobně projevuje nízkou imunogenicitou preparátu a nižší tvorbou protilátek proti přípravku ve srovnání s dalším zástupcem této skupiny léčiv – exenatidem, jehož struktura je s lidským GLP-1 srovnatelná pouze v 53 %. Liraglutid je rezistentní k dipeptidyl peptidáze 4 (DPP-4), která za fyziologických podmínek inaktivuje GLP-1 [1, 2].
Liraglutid je dlouhodobě účinkující analog lidského glukagon-like peptidu-1 (GLP-1). Prodloužení účinku je dosaženo záměnou lysinu v pozici 34 za arginin poblíž terminální NH2 skupiny a navázáním kyseliny palmitové (C16:0) na lysin v pozici 26 prostřednictvím kyseliny gamma-glutamové. Strukturu liraglutidu znázorňuje obr. 1. Molekula vykazuje 97% homologii s lidským GLP-1 (7–37). Vysoký stupeň homologie se pravděpodobně projevuje nízkou imunogenicitou preparátu a nižší tvorbou protilátek proti přípravku ve srovnání s dalším zástupcem této skupiny léčiv – exenatidem, jehož struktura je s lidským GLP-1 srovnatelná pouze v 53 %. Liraglutid je rezistentní k dipeptidyl peptidáze 4 (DPP-4), která za fyziologických podmínek inaktivuje GLP-1 [1, 2].
Mechanismus účinku, farmakodynamika
Liraglutid se váže na receptory pro GLP-1 a jeho biologické účinky jsou shodné s působením GLP-1. Liraglutid upravuje hladinu krevního cukru, na snížení glykemie se podílí řada příznivých pankreatických a extrapankreatických účinků této látky. V závislosti na výši hyperglykemie zvyšuje liraglutid sekreci inzulinu a potlačuje vylučování glukagonu in vitro i in vivo [3]. Při hypoglykemii potlačuje liraglutid sekreci inzulinu a neovlivňuje vylučování glukagonu. Klinickým korelátem je, že jeho podávání nevyvolává hypoglykemii, a pokud k ní dojde například v souvislosti se současnou aplikací derivátů sulfonylurey (SU), nepotlačuje kontraregulační mechanismy. Liraglutid také zpomaluje vyprazdňování žaludku, snižuje chuť k jídlu v CNS, redukuje příjem potravy a snižuje hmotnost v experimentu i u člověka [4–7]. Kromě toho se diskutují další mechanismy, jimiž by se tato látka mohla příznivě uplatnit při léčbě diabetu 2. typu (DM2). V průběhu onemocnění dochází k progresivnímu úbytku masy β-buněk a zhoršování jejich funkce. In vitro bylo doloženo, že liraglutid snižuje apoptózu β-buněk [8] a vede ke zvětšení masy β-buněk u laboratorních zvířat [9]. Zlepšení první fáze sekrece inzulinu, zvýšení citlivosti β-buněk na glukózu, pokles poměru proinzulin/inzulin a zlepšení funkce β-buněk hodnocené pomocí matematického modelování byly nalezeny i v řadě studií se zdravými dobrovolníky i v klinickém programu LEAD (Liraglutide Effect and Action in Diabetes) [2]. Receptory GLP-1 se vyskytují v řadě dalších orgánů a tkání, například v kardiomyocytech, v cévním endotelu či v ledvinách, a mohou být zodpovědné za případné další přímé účinky liraglutidu. Některé z nich, např. příznivý vliv na funkci myokardu a velikost ischemického ložiska, byly demonstrovány v experimentu i v pilotních experimentech u člověka. Ovlivnění exkrece sodíku v ledvinách a ovlivnění funkce endotelových buněk může být v pozadí konzistentního poklesu systolického krevního tlaku, který byl opakovaně doložen v klinických studiích při podávání liraglutidu.
Farmakokinetické vlastnosti
Absorpce
Liraglutid se pomalu vstřebává z podkoží. V léčivém přípravku tvoří molekula liraglutidu heptamery (partikule podobné micelám), které zpomalují jeho absorpci [10, 11]. Po subkutánní aplikaci je čas dosažení maximálních koncentrací v plazmě 9–13 hodin. Absolutní biologická dostupnost liraglutidu po subkutánním podání je asi 55 %. Maximální koncentrace liraglutidu po subkutánní jednorázové dávce 0,6 mg je 9,4 nmol/l a zvyšuje se v závislosti na podané dávce. Intraindividuální variační koeficient pro AUC liraglutidu je po podání jednorázové dávky 11 %.
Distribuce
Zdánlivý distribuční objem po subkutánním podání je 11–17 l. Střední distribuční objem po intravenózním podání liraglutidu je 0,07 l/kg. Liraglutid se váže na plazmatické proteiny (> 98 %). Farmakologicky účinný in vitro i in vivo je pouze volný liraglutid a vysoká vazba na plazmatický albumin je dalším mechanismem, který se uplatňuje při prodloužení účinku liraglutidu.
Metabolismus a eliminace
 Liraglutid je rezistentní k dipeptidyl peptidáze 4 (DPP-4), která za fyziologických podmínek inaktivuje GLP-1. Léčivá látka se metabolizuje pouze minimálně, nebyl zjištěn určitý orgán jako hlavní cesta eliminace. V intaktní formě se v plazmě vyskytuje 89–100 % liraglutidu. Stanoveny byly dva méně významné plazmatické metabolity (≤ 9 % a ≤ 5 % celkové expozice). Intaktní liraglutid není přítomen v moči ani ve stolici, pouze menší část je vyloučena ve formě metabolitů močí nebo stolicí (6 % a 5 %). Průměrná clearance po subkutánním podání jednorázové dávky liraglutidu je přibližně 1,2 l/h. Poločas eliminace je relativně dlouhý, přibližně 13 hodin.
Liraglutid je rezistentní k dipeptidyl peptidáze 4 (DPP-4), která za fyziologických podmínek inaktivuje GLP-1. Léčivá látka se metabolizuje pouze minimálně, nebyl zjištěn určitý orgán jako hlavní cesta eliminace. V intaktní formě se v plazmě vyskytuje 89–100 % liraglutidu. Stanoveny byly dva méně významné plazmatické metabolity (≤ 9 % a ≤ 5 % celkové expozice). Intaktní liraglutid není přítomen v moči ani ve stolici, pouze menší část je vyloučena ve formě metabolitů močí nebo stolicí (6 % a 5 %). Průměrná clearance po subkutánním podání jednorázové dávky liraglutidu je přibližně 1,2 l/h. Poločas eliminace je relativně dlouhý, přibližně 13 hodin.
Farmakokinetika liraglutidu není klinicky významně ovlivněna věkem, pohlavím či místem vpichu, tj. nejsou významné rozdíly při podání do podkoží břicha, stehna či paže [6]. Klinicky významným faktem je, že těžká a středně těžká renální insuficience farmakokinetiku liraglutidu také neovlivňuje [5, 12].
Shrnutí farmakokinetických vlastností uvádí tab. 1.
Klinické zkušenosti
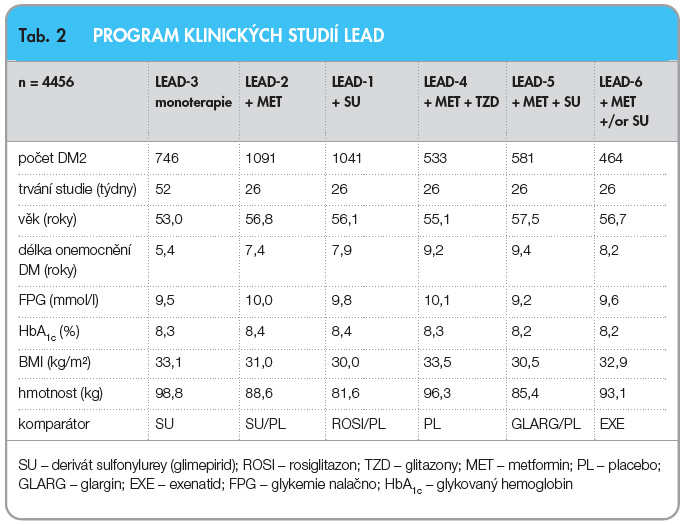 Účinnost a bezpečnost liraglutidu u DM2 byla testována v klinickém programu (LEAD), který zahrnoval randomizované kontrolované studie 3. fáze (tab. 2). Liraglutid byl zkoušen ve všech klinicky relevantních způsobech podání: v monoterapii byl srovnáván s derivátem SU [13], po přidání do dvojkombinace s metforminem byl srovnáván s derivátem SU [14], dále se přídával do dvojkombinace s derivátem SU pro srovnání s pioglitazonem [15], do trojkombinace s metforminem a glitazonem ve srovnání s placebem [16] a po přidání do trojkombinace s metforminem a derivátem SU byl srovnáván s dlouhodobě působícím inzulinem glarginem v jedné dávce [17]. V uvedených režimech liraglutid účinně zlepšuje kompenzaci diabetu a snižuje hodnoty HbA1c o 1–1,5 % (graf 1),
Účinnost a bezpečnost liraglutidu u DM2 byla testována v klinickém programu (LEAD), který zahrnoval randomizované kontrolované studie 3. fáze (tab. 2). Liraglutid byl zkoušen ve všech klinicky relevantních způsobech podání: v monoterapii byl srovnáván s derivátem SU [13], po přidání do dvojkombinace s metforminem byl srovnáván s derivátem SU [14], dále se přídával do dvojkombinace s derivátem SU pro srovnání s pioglitazonem [15], do trojkombinace s metforminem a glitazonem ve srovnání s placebem [16] a po přidání do trojkombinace s metforminem a derivátem SU byl srovnáván s dlouhodobě působícím inzulinem glarginem v jedné dávce [17]. V uvedených režimech liraglutid účinně zlepšuje kompenzaci diabetu a snižuje hodnoty HbA1c o 1–1,5 % (graf 1), 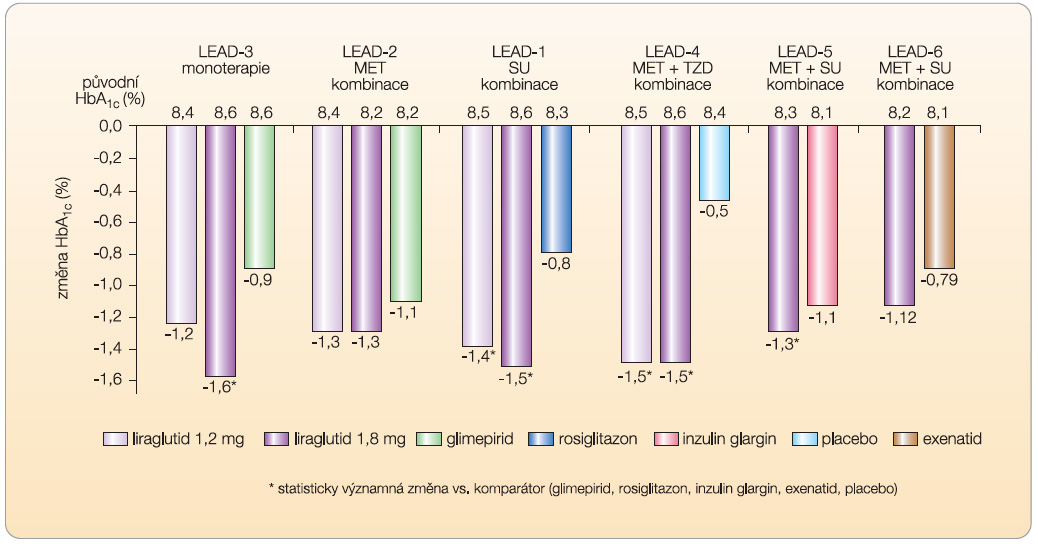 snižuje hodnoty lačné i postprandiální glykemie. V otevřených extenzích studií LEAD-3 a LEAD-2 bylo potvrzeno, že příznivý účinek liraglutidu na kompenzaci diabetu a pokles hmotnosti přetrvává po dobu dvou let sledování [18]. Příznivé je, že tento efekt je přítomen při minimálním výskytu hypoglykemií a poklesu hmotnosti. Pokles hodnot HbA1c je nezávislý na poklesu hmotnosti. Riziko hypoglykemií je srovnatelné s rizikem při podávání placeba. Hypoglykemie se mohou vyskytnout pouze v případě, pokud je liraglutid podáván v kombinaci s deriváty SU (nebo s inzulinem). Zajímavé je, že nejvyšší účinnost liraglutidu se ukázala u osob s relativně nejvyšší hladinou C-peptidu, což podporuje časné zahájení léčby v klinické praxi.
snižuje hodnoty lačné i postprandiální glykemie. V otevřených extenzích studií LEAD-3 a LEAD-2 bylo potvrzeno, že příznivý účinek liraglutidu na kompenzaci diabetu a pokles hmotnosti přetrvává po dobu dvou let sledování [18]. Příznivé je, že tento efekt je přítomen při minimálním výskytu hypoglykemií a poklesu hmotnosti. Pokles hodnot HbA1c je nezávislý na poklesu hmotnosti. Riziko hypoglykemií je srovnatelné s rizikem při podávání placeba. Hypoglykemie se mohou vyskytnout pouze v případě, pokud je liraglutid podáván v kombinaci s deriváty SU (nebo s inzulinem). Zajímavé je, že nejvyšší účinnost liraglutidu se ukázala u osob s relativně nejvyšší hladinou C-peptidu, což podporuje časné zahájení léčby v klinické praxi.
Liraglutid byl porovnán s dalším dostupným inkretinovým mimetikem exenatidem podávaným 2krát denně v přímé (tzv. head to head) studii [19]. Liraglutid v dávce 1,8 mg/den se ukázal jako účinnější než exenatid ve smyslu snížení HbA1c. Pokles byl o 0,3 % vyšší než u exenatidu.
Ve srovnání s exenatidem účinkuje liraglutid déle, vykazuje nižší kolísání koncentrací v plazmě a méně ovlivňuje vyprazdňování žaludku. Klinickým korelátem je pak lepší ovlivnění lačné glykemie u liraglutidu, a naproti tomu menší vliv na postprandiální glykemie ve srovnání s exenatidem podávaným 2krát denně a pravděpodobně i nižší výskyt nauzey. Pokles hmotnosti a nízké riziko hypoglykemií jsou při léčbě oběma inkretinovými mimetiky srovnatelné.
Další přímé srovnání je k dispozici mezi liraglutidem a sitagliptinem [20]. Liraglutid v dávce 1,2 mg/den i v dávce 1,8 mg/den ve srovnání se sitagliptinem účinněji snižuje hodnoty HbA1c a léčba je provázena hmotnostním úbytkem při srovnatelně zanedbatelném výskytu hypoglykemií.
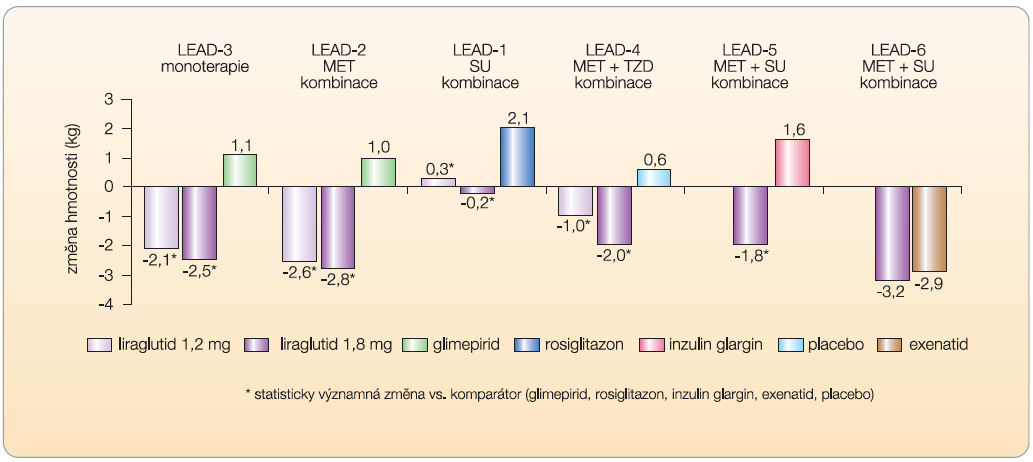 Dalším pravidelně se vyskytujícím účinkem liraglutidu je pokles hmotnosti (graf 2). Hmotnostní pokles je závislý na dávce [21, 22] a není podmíněn přítomností vedlejších GIT příznaků [21]. U obézních osob bez cukrovky je hmotnostní pokles také přítomen, a je dokonce vyšší než u nemocných s diabetem [22, 23]. Konzistentním nálezem ve všech klinických hodnoceních je pokles systolického krevního tlaku o 2,1 až 6,7 mm Hg [13–17, 19]. Bez zajímavosti není ani příznivý vliv na hladiny dalších rizikových faktorů kardiovaskulárních onemocnění, jako je pokles hladiny C-reaktivního proteinu, BNP (brain natriuretic peptide – mozkový natriuretický peptid), PAI-1 (inhibitor plazminogenu) či sérových triglyceridů, byť může jít o sekundární efekt navozený poklesem hyperglykemie a snížením hmotnosti [5, 24]. Zda se tyto příznivé změny biomarkerů odrazí i v redukci rizika KV onemocnění, není potvrzeno.
Dalším pravidelně se vyskytujícím účinkem liraglutidu je pokles hmotnosti (graf 2). Hmotnostní pokles je závislý na dávce [21, 22] a není podmíněn přítomností vedlejších GIT příznaků [21]. U obézních osob bez cukrovky je hmotnostní pokles také přítomen, a je dokonce vyšší než u nemocných s diabetem [22, 23]. Konzistentním nálezem ve všech klinických hodnoceních je pokles systolického krevního tlaku o 2,1 až 6,7 mm Hg [13–17, 19]. Bez zajímavosti není ani příznivý vliv na hladiny dalších rizikových faktorů kardiovaskulárních onemocnění, jako je pokles hladiny C-reaktivního proteinu, BNP (brain natriuretic peptide – mozkový natriuretický peptid), PAI-1 (inhibitor plazminogenu) či sérových triglyceridů, byť může jít o sekundární efekt navozený poklesem hyperglykemie a snížením hmotnosti [5, 24]. Zda se tyto příznivé změny biomarkerů odrazí i v redukci rizika KV onemocnění, není potvrzeno.
Zařazení do současné palety léčiv
Liraglutid je druhým zástupcem skupiny inkretinových mimetik a zároveň prvním dlouhodobě účinným mimetikem na našem trhu. Ve 3. fázích klinického hodnocení se nacházejí další přípravky z této terapeutické skupiny, tj. s účinkem delším než 24 hodin, které bude možné aplikovat 1krát týdně (exenatid LAR, taspoglutid, albiglutid a lixisenatid). Zatím však liraglutid kompetuje pouze s jediným dostupným inkretinovým mimetikem a tím je exenatid [3]. Klinická účinnost je u obou preparátů velmi podobná. Výhodou liraglutidu proti exenatidu je možnost aplikace 1krát denně a dále nižší výskyt a časnější odeznění nežádoucích gastrointestinálních účinků, další potenciální výhodou by mohla být nižší antigenicita a tvorba protilátek.
Lékem volby u nemocných s DM2 je v současné době metformin [25–27]. Jeho podávání je doporučeno u všech nemocných bez ohledu na hmotnost ihned po manifestaci cukrovky, pokud není kontraindikace k jeho podání. Inkretinová mimetika včetně liraglutidu jsou tudíž léky druhé volby, jejichž podávání zvažujeme do kombinace s metforminem či s dalšími léčivy. O své místo v kombinační léčbě se liraglutid dělí s deriváty SU, pioglitazonem, akarbózou, gliptiny (inhibitory DPP-4) a inzulinem. Inkretinová mimetika se zdají být výhodná vzhledem k jejich dobré účinnosti a lepšímu bezpečnostnímu profilu ve srovnání s ostatními PAD. Nemocný není při jejich podávání ohrožen hypoglykemií (pokud neužívá zároveň deriváty SU), navíc jsou jedinými antidiabetiky, která vedou k úbytku hmotnosti. Jejich nevýhodou je však nutnost injekčního podání. Závazné údaje z intervenčních studií, které by přesně doložily prospěšnost určitého výběru z hlediska dlouhodobé prognózy nemocného, zejména s ohledem na riziko kardiovaskulárních komplikací a nádorových onemocnění, zatím chybějí.
Poslední revidovaná doporučení NICE (2010) [28] jsou poměrně rezervovaná a staví liraglutid, stejně jako exenatid, do pozice léčiv, jimiž se snažíme oddálit léčbu inzulinem nebo která podáváme tam, kde nemůžeme použít jiná PAD. Podle NICE by léčba liraglutidem měla být zvážena v následujících případech: a) do trojkombinace s dalšími léčivy, a to především u osob s BMI > 35; u osob s BMI < 35 podporuje indikaci liraglutidu potenciální příznivý vliv na snížení hmotnosti a okolnosti, které brání zahájení léčby inzulinem; b) do dvojkombinace by měl být liraglutid přidán pouze tehdy, pokud není možné použít z důvodů nesnášenlivosti nebo kontraindikace metformin nebo deriváty SU a není-li možné ze stejných důvodů použít pioglitazon či gliptin. Účinnost léčby by měla být zhodnocena za 6 měsíců podle poklesu hodnot HbA1c a vlivu na hmotnost. Liraglutid by měl být podáván v maximální dávce 1,2 mg/den.
Doporučení ČDS (Česká diabetologická společnost) z roku 2011 jsou v indikacích inkretinových mimetik pro kombinační léčbu poměrně liberální [25]. Hlavním podpůrným kritériem pro podání přípravku je BMI > 35 kg/m2. Doporučení umožňují použít liraglutid v trojkombinaci i v dvojkombinaci, pokud stávající léčba není uspokojivá, tj. hodnota HbA1c je vyšší než 6 % (dle IFCC).
Indikace
Liraglutid je určen pro léčbu hyperglykemie u dospělých s DM2 jako lék druhé volby:
a) v dvojkombinaci s metforminem nebo s deriváty SU u pacientů s nedostatečnou kontrolou glykemie, přestože již bylo dosaženo maximální tolerované dávky při monoterapii uvedenými léčivy;
b) v trojkombinaci s metforminem a deriváty SU nebo s metforminem a pioglitazonem u pacientů s nedostatečnou kontrolou glykemie navzdory kombinované léčbě.
Zatím neschválené, nicméně nadějné je použití liraglutidu v monoterapii, zejména u obézních nemocných s DM2, a v kombinační léčbě s jednou dávkou dlouze působícího inzulinu. Stejně tak je potenciálně zajímavé jeho použití u diabetiků se středně závažnou a těžkou renální insuficiencí. Tato indikace není zatím schválena, nicméně jsou k dispozici doklady o tom, že farmakokinetika liraglutidu není ovlivněna přítomností těžké poruchy funkce ledvin [12]. Další perspektivní oblastí je užití liraglutidu v léčbě obezity u nediabetických osob [22, 23].
Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku.
Zvláštní upozornění
Liraglutid nesmí být používán u pacientů s diabetem mellitem 1. typu. Pro nedostatek zkušeností by neměl být podáván nemocným s městnavým srdečním selháním. Pro častý výskyt GIT obtíží a nedostatek zkušeností není doporučeno podávání pacientům se zánětlivým onemocněním střev a diabetickou gastroparézou. Pro nedostatek zkušeností není zatím dle SPC podávání liraglutidu doporučeno u osob se středním stupněm renální insuficience, byť je známo, že těžká a středně těžká renální insuficience farmakokinetiku liraglutidu neovlivňuje [5, 12], a dále u osob s poškozením jater. Pro nedostatek dat o účinnosti a bezpečnosti se liraglutid nepodává u dětí mladších 18 let. Pokud nemocný současně užívá derivát SU, měl by být upozorněn na možnost hypoglykemie a případně by měla být snížena dávka derivátů SU.
Zváženo a monitorováno by během léčby liraglutidem mělo být riziko nádoru štítné žlázy [28].
Nežádoucí účinky a bezpečnost
Relativně nejčastějším nežádoucím účinkem jsou přechodné gastrointestinální obtíže, včetně nevolnosti, zvracení a průjmu. Lehké obtíže jako nauzea se vyskytují asi u 5–40 % nemocných časně po zahájení léčby. U většiny nemocných příznaky vymizí do 2–4 týdnů [13–17]. Ve studii LEAD-6, která srovnávala exenatid a liraglutid [19], byl výskyt nauzey při zahájení léčby srovnatelný, ale u skupiny léčené liraglutidem obtíže dříve odeznívaly a po 6 týdnech léčby přetrvávaly u méně než 10 % nemocných.
Platí, že liraglutid je velmi bezpečnou látkou z hlediska rizika výskytu hypoglykemie [13–17, 19]. Hypoglykemie se však může vyskytnout u nemocných, kterým je liraglutid podáván v kombinaci s deriváty SU [13, 18], toto riziko však můžeme omezit snížením dávky derivátů SU.
Při podávání liraglutidu bylo stejně jako u ostatních GLP-1 analog a gliptinů hlášeno několik případů akutní pankreatitidy, stejně jako v déle trvajících klinických studiích (< 0,2 %) [29]. Nemocní s DM2 mají vyšší výskyt obezity, cholecystolitiázy a hypertriglyceridemie, což jsou faktory, které obecně zvyšují riziko vzniku pankreatitidy. Příčinná souvislost mezi podáváním liraglutidu a výskytem akutních pankreatitid nebyla potvrzena, ale zatím není možné ji ani vyloučit. V souladu se stávajícím SPC je znění i posledního revidovaného upozornění FDA [29] z června tohoto roku, které doporučuje informovat všechny nemocné, u nichž zahajujeme léčbu liraglutidem nebo zvyšujeme jeho dávku, o charakteristických příznacích akutní pankreatitidy (trvalá a intenzivní bolest břicha, někdy vyzařující do zad, která může nebo nemusí být provázena zvracením). Vyskytne-li se podezření na pankreatitidu, musí být podávání liraglutidu a dalších potenciálně podezřelých léčivých přípravků ukončeno. Další závěry týkající se bezpečnosti podávání liraglutidu z hlediska výskytu akutní pankreatitidy by měla přinést také studie LEADER [30]. Její výsledky můžeme očekávat v roce 2016.
Experimentální data u hlodavců ukazují na zvýšené riziko vzniku hyperplazií a tumorů C-buněk štítné žlázy, které mohou být v souvislosti s expresí receptorů pro GLP-1, jejichž stimulace vede k proliferaci C-buněk a vyšší tvorbě kalcitoninu [31]. Tyto nálezy nebyly potvrzeny u primátů, ani klinické studie u člověka zatím nepotvrzují tyto obavy. Nicméně dostupné údaje toto riziko nemohou zcela vyloučit a riziko tumorů štítné žlázy je stále předmětem pečlivého postmarketingového monitorování jak FDA, tak EMEA. Poslední upozornění FDA z 13. 6. 2011 [29] doporučuje pomýšlet na uvedené riziko, neupravuje však časy a způsob screeningu, omezuje se pouze na další podrobné vyšetření endokrinologem u osob s uzlem ve štítné žláze, který byl zachycen při objektivním vyšetření či při použití zobrazovacích technik. Rutinní monitorování hladin kalcitoninu taktéž není standardně doporučeno, nicméně pokud jsou zachyceny vyšší hladiny kalcitoninu, měl by pacient být vyšetřen s ohledem na výskyt tumoru štítné žlázy. Bezpečnost liraglutidu z hlediska výskytu tumorů štítné žlázy a jejich biomarkerů je předmětem probíhající studie LEADER [30].
Tvorba protilátek proti liraglutidu během jeho podávání je nízká. V hodnocení programu LEAD 1–6 byl nízký titr protilátek proti liraglutidu nalezen u přibližně 8,5 % léčených. Jejich přítomnost přitom nesnižuje účinnost léčiva. Tvorba protilátek je u liraglutidu významně nižší než při podávání exenatidu BID [32].
Relativně krátká doba, po kterou je liraglutid v klinické praxi používán, nedovoluje učinit definitivní závěry týkající se jeho dlouhodobé bezpečnosti z hlediska kardiovaskulární (KV) mortality a rizika nádorových onemocnění. Nicméně příznivé vlivy liraglutidu na funkci myokardu v experimentálních studiích byly již zmíněny. Také předběžné metaanalýzy klinických studií poukazují na relativní bezpečnost liraglutidu v tomto směru a nezavdávají důvod k obavám. Například metaanalýza publikovaná v tomto roce a zahrnující 6638 osob, z nichž 4257 bylo léčeno liraglutidem, ukazuje, že relativní KV riziko při léčbě liraglutidem je ve srovnání s komparátory 0,73 (95% CI: 0,38–1,41) a že se toto riziko pohybuje v bezpečných mezích [33]. Definitivní závěry by měla přinést intervenční studie LEADER (Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results Trial) [30], do níž bude plánovaně zařazeno 9000 nemocných s DM2 s vysokým KV rizikem a která bude srovnávat efekt liraglutidu oproti placebu na KV mortalitu a morbiditu.
Lékové interakce
Liraglutid má in vitro velmi nízký potenciál pro farmakokinetické interakce s jinými léčivými látkami s vlivem na cytochrom P-450. Při současném podávání liraglutidu není nutná žádná úprava dávkování paracetamolu, atorvastatinu, griseofulvinu, lisinoprilu, digoxinu či perorálních antikoncepčních přípravků. U warfarinu je vzhledem k absenci dat vhodné častější měření IRN při zahájení léčby liraglutidem.
Těhotenství a kojení
Užívání liraglutidu v těhotenství není doporučeno z důvodu prokázané reprodukční toxicity u zvířat. Není známo, zda se liraglutid vylučuje do mateřského mléka.
Dávkování
Léčivý přípravek s obsahem liraglutidu je distribuován jako injekční roztok v předplněném peru (6 mg/ml). Podává se v subkutánní injekci do podkoží břicha, stehna nebo paže 1krát denně (kdykoli v průběhu dne, nezávisle na jídle). Počáteční dávka je 0,6 mg liraglutidu denně, po jednom týdnu by měla být zvýšena na standardní dávku 1,2 mg/den. Dle SPC je možné u vybraných pacientů na základě klinické odpovědi zvýšit dávku liraglutidu až na 1,8 mg/den. Tato dávka však na základě kritického zhodnocení NICE [28] není doporučena a v rámci ČR není hrazena zdravotními pojišťovnami.
Selfmonitoring glukózy při léčbě liraglutidem není nutný, může však být přínosný při kombinaci s deriváty SU k případné úpravě dávek derivátů SU. Dávku není potřeba upravovat u starších nemocných a u nemocných s mírným stupněm renální insuficience.
Podpořeno výzkumným záměrem MZO 00023001.
Seznam použité literatury
- [1] Davies MJ, Kela R, Khunti K. Liraglutide – over-view of the preclinical and clinical data and its role in the treatment of type 2 diabetes. Diabetes Obes Metab 2011; 13: 207–220.
- [2] Garber AJ. Incretin effects on beta-cell function, replication, and mass: the human perspective. Diabetes Care 2011; 34 (Suppl. 2): S258–263.
- [3] Garber AJ. Long-acting glucagon-like peptide 1 receptor agonists: a review of their efficacy and tolerability. Diabetes Care 2011; 34 (Suppl. 2): S279–284.
- [4] Raun K, von Voss P, Gotfredsen CF, et al. Liraglutide, a long-acting glucagon-like peptide-1 analog, reduces body weight and food intake in obese candy-fed rats, whereas a dipeptidyl peptidase-IV inhibitor, vildagliptin, does not. Diabetes 2007; 56: 8–15.
- [5] Pinkney J, Fox T, Ranganath L. Selecting GLP-1 agonists in the management of type 2 diabetes: differential pharmacology and therapeutic benefits of liraglutide and exenatide. Ther Clin Risk Manag 2010; 6: 401–411.
- [6] Wajcberg E, Amarah A. Liraglutide in the management of type 2 diabetes. Drug Des Devel Ther 2010; 4: 279–290.
- [7] Nauck MA. Incretin-based therapies for type 2 diabetes mellitus: properties, functions, and clinical implications. Am J Med 2011; 124: S3–18.
- [8] Bregenholt S, Moldrup A, Blume N, et al. The long-acting glucagon-like peptide-1 analogue, liraglutide, inhibits beta-cell apoptosis in vitro. Biochem Biophys Res Commun 2005; 330: 577–584.
- [9] Rolin B, Larsen MO, Gotfredsen CF, et al. The long-acting GLP-1 derivative NN2211 ameliorates glycemia and increases beta-cell mass in diabetic mice. Am J Physiol Endocrinol Metab 2002; 283: E745–752.
- [10] Degn KB, Juhl CB, Sturis J, et al. One week's treatment with the long-acting glucagon-like peptide 1 derivative liraglutide (NN2211) markedly improves 24-h glycemia and alpha- and beta-cell function and reduces endogenous glucose release in patients with type 2 diabetes. Diabetes 2004; 53: 1187–1194.
- [11] Knudsen LB, Nielsen PF, Huusfeldt PO, et al. Potent derivatives of glucagon-like peptide-1 with pharmacokinetic properties suitable for once daily administration. J Med Chem 2000; 43: 1664–1669.
- [12] Jacobsen LV, Hindsberger C, Robson R, et al. Effect of renal impairment on the pharmacokinetics of the GLP-1 analogue liraglutide. Br J Clin Pharmacol 2009; 68: 898–905.
- [13] Garber A, Henry R, Ratner R, et al. Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): a randomised, 52-week, phase III, double-blind, parallel-treatment trial. Lancet 2009; 373: 473–481.
- [14] Nauck M, Frid A, Hermansen K, et al. Efficacy and safety comparison of liraglutide, glimepiride, and placebo, all in combination with metformin, in type 2 diabetes: the LEAD (liraglutide effect and action in diabetes)-2 study. Diabetes Care 2009; 32: 84–90.
- [15] Marre M, Shaw J, Brandle M, et al. Liraglutide, a once-daily human GLP-1 analogue, added to a sulphonylurea over 26 weeks produces greater improvements in glycaemic and weight control compared with adding rosiglitazone or placebo in subjects with Type 2 diabetes (LEAD-1 SU). Diabet Med 2009; 26: 268–278.
- [16] Zinman B, Gerich J, Buse JB, et al. Efficacy and safety of the human glucagon-like peptide-1 analog liraglutide in combination with metformin and thiazolidinedione in patients with type 2 diabetes (LEAD-4 Met+TZD). Diabetes Care 2009; 32: 1224–1230.
- [17] Russell-Jones D, Vaag A, Schmitz O, et al. Liraglutide vs insulin glargine and placebo in combination with metformin and sulfonylurea therapy in type 2 diabetes mellitus (LEAD-5 met+SU): a randomised controlled trial. Diabetologia 2009; 52: 2046–2055.
- [18] Garber A, Henry RR, Ratner R, et al. Liraglutide, a once-daily human glucagon-like peptide 1 analogue, provides sustained improvements in glycaemic control and weight for 2 years as monotherapy compared with glimepiride in patients with type 2 diabetes. Diabetes Obes Metab 2011; 13: 348–356.
- [19] Buse JB, Rosenstock J, Sesti G, et al. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6). Lancet 2009; 374: 39–47.
- [20] Pratley RE, Nauck M, Bailey T, et al. Liraglutide versus sitagliptin for patients with type 2 diabetes who did not have adequate glycaemic control with metformin: a 26-week, randomised, parallel-group, open-label trial. Lancet 2010; 375: 1447–1456.
- [21] Vilsboll T, Zdravkovic M, Le-Thi T, et al. Liraglutide, a long-acting human glucagon-like peptide-1 analog, given as monotherapy significantly improves glycemic control and lowers body weight without risk of hypoglycemia in patients with type 2 diabetes. Diabetes Care 2007; 30: 1608–1610.
- [22] Vilsboll T, Knop FK, Christensen M, et al. Weight-Lowering Efficacy of Glucagon-Like Peptide-1 Receptor Agonists: A Meta-Analysis. Diabetes 2011; 60: 1146–P.
- [23] Astrup A, Rossner S, Van Gaal L, et al. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet 2009; 374: 1606–1616.
- [24] Courreges JP, Vilsboll T, Zdravkovic M, et al. Beneficial effects of once-daily liraglutide, a human glucagon-like peptide-1 analogue, on cardiovascular risk biomarkers in patients with Type 2 diabetes. Diabet Med 2008; 25: 1129–1131.
- [25] ČDS. Česká diabetologická společnost. Doporučený postup péče o diabetes mellitus 2. typu – 2011.
- [26] Standards of medical care in diabetes. Diabetes Care 2011; 34 (Suppl. 1): S11–61.
- [27] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009; 32: 193–203.
- [28] NICE technology appraisal guidance 203. Liraglutide for the treatment of type 2 diabetes mellitus. 2010: (www.nice.org.uk/guidance/TA203).
- [29] U.S. Food and Drug Administration. Victoza (liraglutide [rDNA origin]) Injection: REMS – Risk of Thyroid C-cell Tumors, Acute Pancreatitis. 06/13/2011 (http: //www.fda.gov/Safety/MedWatch/SafetyInformation].
- [30] Bergenstal R, Daniels G, Mann J, et al. Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results (LEADER™) Trial: Rationale and Study Design Diabetes 2011; 60: 2303–PO.
- [31] Knudsen BL, Madsen LW, Andersen S, et al. Glucagon-like Peptide-1 receptor agonists activate rodent thyroid C-cells causing calcitonin release and C-cell proliferation. Endocrinology 2010; 151: 1473–1486.
- [32] Buse JB, Garber A, Rosenstock J, et al. Liraglutide treatment is associated with a low frequency and magnitude of antibody formation with no apparent impact on glycemic response or increased frequency of adverse events: results from the Liraglutide Effect and Action in Diabetes (LEAD) trials. J Clin Endocrinol Metab 2011; 96: 1695–1702.
- [33] Marso SP, Lindsey JB, Stolker JM, et al. Cardiovascular safety of liraglutide assessed in a patient-level pooled analysis of phase 2-3 liraglutide clinical development studies. Diab Vasc Dis Res 2011; 8: 237–240.