Mifamurtid
Nově registrovaný lék mifamurtid nabízí po velmi dlouhé době rozšíření léčebných možností osteogenního sarkomu vysokého stupně malignity. Je v současné době indikován k léčbě resekovatelného nemetastatického osteosarkomu dětí, adolescentů a mladých dospělých ve věku od dvou do 30 let po makroskopicky radikálním chirurgickém výkonu. Je podáván jako součást pooperační léčby v kombinaci s adjuvantní/konsolidační polychemoterapií. Sdělení předkládá aktuální přehled dostupných informací o farmakodynamice, farmakokinetice a možnostech využití mifamurtidu v klinické praxi.
Úvod
Mifamurtid neboli muramyl tripeptid fosfatidyl ethanolamin (MTP-PE) je syntetický derivát muramyldipeptidu (MDP), který je v přírodě součástí buněčných stěn bakterií. MDP je nejmenší strukturální jednotka s imunogenním potenciálem, jež se vyskytuje ve stěně bakterií Bacillus Calmette-Guérin [1]. Látka byla objevena a zkoumána jako im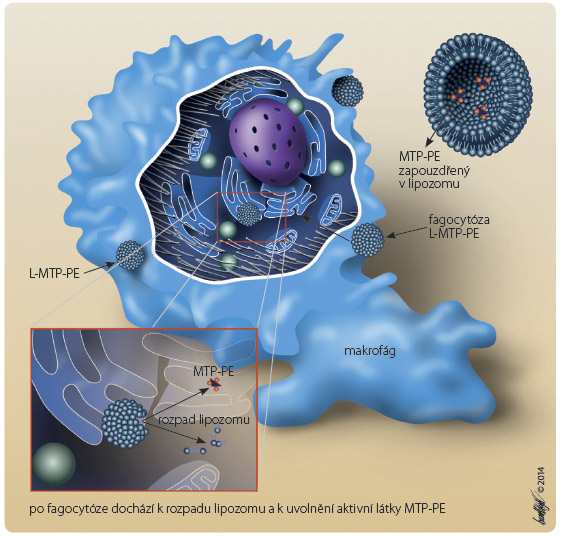 unostimulans. MTP-PE má identické imunostimulační účinky jako přirozeně se vyskytující MDP. Jeho výhodou je nižší toxicita a delší biologický poločas [2]. Lipofilní forma navíc vykazuje vyšší aktivitu makrofágů a lidských monocytů než volný MDP [3]. MTP-PE se chová jako aktivátor povrchů. Mifamurtid je amfipatická molekula složená z hydrofilního muramyltripeptidu a z lipofilní části dipalmitoylfosfatidylethanolaminu zapouzdřená v lipozomu. Lipozomální část je složena z fosfatidylcholinu a syntetického fosfatidylserinu a je uspořádána podobně jako cibule, v několika vrstvách, na něž je navázána aktivní komponenta MTP-PE. Po proběhlé fagocytóze (monocyty, makrofágy) dochází k degradaci jednotlivých vrstev lipozomální složky, a tím k uvolnění aktivní látky (obr. 2).
unostimulans. MTP-PE má identické imunostimulační účinky jako přirozeně se vyskytující MDP. Jeho výhodou je nižší toxicita a delší biologický poločas [2]. Lipofilní forma navíc vykazuje vyšší aktivitu makrofágů a lidských monocytů než volný MDP [3]. MTP-PE se chová jako aktivátor povrchů. Mifamurtid je amfipatická molekula složená z hydrofilního muramyltripeptidu a z lipofilní části dipalmitoylfosfatidylethanolaminu zapouzdřená v lipozomu. Lipozomální část je složena z fosfatidylcholinu a syntetického fosfatidylserinu a je uspořádána podobně jako cibule, v několika vrstvách, na něž je navázána aktivní komponenta MTP-PE. Po proběhlé fagocytóze (monocyty, makrofágy) dochází k degradaci jednotlivých vrstev lipozomální složky, a tím k uvolnění aktivní látky (obr. 2).
Farmakologická skupina
Mifamurtid patří do farmakologické skupiny jiné cytokininy a imunomodulátory, ATC kód L03AX15.
Chemické a fyzikální vlastnosti 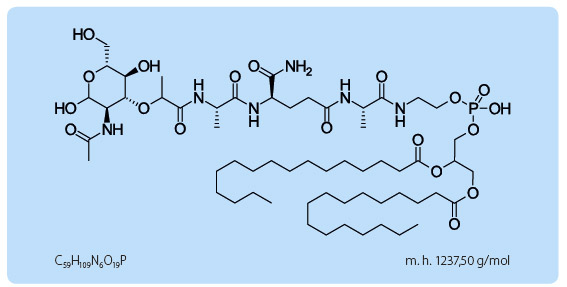
Mifamurtid je chemicky N-acetyl-muramyl--L-alanyl-D-isoglutaminyl-L-alanin-(1, 2-dipalmitoyl-sn-glycero-3-fosforyl)-ethylamid (obr. 1). Je to bílý až téměř bílý homogenní lyofilizovaný prášek pro přípravu infuzní suspenze.
Mechanismus účinku, farmakodynamika
Farmakodynamický účinek spočívá v aktivaci makrofágů, indukci tumoricidních monocytů, zvýšení hladin cytokinů a dalších pr![Obr. 3 Schematické znázornění mechanismu účinku mifamurtidu; volně podle [38] – Ando, et al., 2011.MTP-PE se po uvolnění do cytosolu specificky váže na intracelulární receptor NOD-2, čímž se spustí kaskáda aktivací signálních drah cestou nukleárního faktoru (NF-κB) a dochází k produkci tumoricidních látek. Tato reakce vede k likvidaci reziduálních nádorových buněk.L-MTP-PE – lipozomální léková forma mifamurtidu; MTP-PE – muramyl tripeptid fosfatidyl ethanolamin, mifamurtid; NF-κB- nukleární faktor kappa-B; NOD-2 – intracelulární receptor rozpoznávající specifické bakteriální peptidoglykany](https://www.remedia.cz/photo-a-29577---.jpg) ozánětlivých molekul (obr. 3). Receptory rodiny NOD (NOD-1, NOD-2) jsou proteiny exprimované především na buňkách prezentujících antigen, jako jsou makrofágy, epitelové a dendritické buňky; jako rozpoznávací molekuly jsou součástí přirozené imunity proti bakteriálním infekcím [4]. MTP-PE se po intravenózní aplikaci specificky váže na NOD-2 [5, 6]. Primární exprese NOD-2 na myeloidních buňkách je pak zodpovědná za selektivní účinek mifamurtidu na monocyty a makrofágy, jejichž účinným aktivátorem je MTP-PE. Po aktivaci signálních drah cestou nukleárního faktoru (NF-κB) dochází k uvolnění látek způsobujících „chřipkový“, „flu-like“ syndrom, posléze pak k produkci řady cytokinů (IL-1, IL-6, IL-8, IL-12) včetně tumor nekrotizujícího faktoru (TNFα) [4, 7–12]. Dochází k vzestupu hodnot dalších sérových markerů imunitní stimulace (C-reaktivní protein, neopterin). Vlastní protinádorový účinek je založen na přímé i nepřímé aktivaci makrofágů a uvolňování tumoricidních faktorů [13]. Aktivace lidských monocytů mifamurtidem vede ke specifickému rozpoznání nádorových buněk současně s tím, že makrofágy nemají cytotoxické účinky vůči buňkám vlastním, což potvrdily studie in vitro [14, 15]. Vedle syntézy cytokinů a zánětlivých faktorů stimuluje mifamurtid expresi adhezních molekul včetně antigenu 1 asociovaného s funkcí lymfocytů (lymphocyte-function associated antigen 1, LFA-1) a intercelulární adhezní molekuly 1 (intercellular adhesion molecule 1, ICAM-1) na monocytech. Tyto molekuly hrají svoji roli v přímé interakci s nádorovými buňkami [16].
ozánětlivých molekul (obr. 3). Receptory rodiny NOD (NOD-1, NOD-2) jsou proteiny exprimované především na buňkách prezentujících antigen, jako jsou makrofágy, epitelové a dendritické buňky; jako rozpoznávací molekuly jsou součástí přirozené imunity proti bakteriálním infekcím [4]. MTP-PE se po intravenózní aplikaci specificky váže na NOD-2 [5, 6]. Primární exprese NOD-2 na myeloidních buňkách je pak zodpovědná za selektivní účinek mifamurtidu na monocyty a makrofágy, jejichž účinným aktivátorem je MTP-PE. Po aktivaci signálních drah cestou nukleárního faktoru (NF-κB) dochází k uvolnění látek způsobujících „chřipkový“, „flu-like“ syndrom, posléze pak k produkci řady cytokinů (IL-1, IL-6, IL-8, IL-12) včetně tumor nekrotizujícího faktoru (TNFα) [4, 7–12]. Dochází k vzestupu hodnot dalších sérových markerů imunitní stimulace (C-reaktivní protein, neopterin). Vlastní protinádorový účinek je založen na přímé i nepřímé aktivaci makrofágů a uvolňování tumoricidních faktorů [13]. Aktivace lidských monocytů mifamurtidem vede ke specifickému rozpoznání nádorových buněk současně s tím, že makrofágy nemají cytotoxické účinky vůči buňkám vlastním, což potvrdily studie in vitro [14, 15]. Vedle syntézy cytokinů a zánětlivých faktorů stimuluje mifamurtid expresi adhezních molekul včetně antigenu 1 asociovaného s funkcí lymfocytů (lymphocyte-function associated antigen 1, LFA-1) a intercelulární adhezní molekuly 1 (intercellular adhesion molecule 1, ICAM-1) na monocytech. Tyto molekuly hrají svoji roli v přímé interakci s nádorovými buňkami [16].
Zcela detailní mechanismus účinku mifamurtidu však není dosud znám. Studie in vitro prokázaly inhibici nádorového růstu na myších a krysích modelech u plicních metastáz osteosarkomu, také u nádorů kůže, jater a fibrosarkomů [17–21]. Zásadní protinádorový efekt prokázal mifamurtid u spontánních osteosarkomů psů. Ve skupině s podáním mifamurtidu byla místem relapsu nejčastěji lokální recidiva na rozdíl od výskytu plicních metastáz ve skupině kontrolní [22, 23]. Existuje tedy předpoklad vyšší citlivosti plicních metastáz k makrofágům, jejichž aktivace a protinádorový účinek vykazují závislost na lokalizaci a především na velikosti nádorové masy. Tento předpoklad podporuje i fakt, že v případě rozsáhlé metastatické nádorové masy nádorů prsu psů i koček mifamurtid účinek neprokázal [24].
Farmakokinetické vlastnosti
Distribuční studie na zvířatech prokázaly po intravenózním podání rychlou distribuci do specifických orgánů, především do plic, jater a sleziny [25]. Během sedmi dnů došlo k eliminaci látky, a to především močí. Obdobná data byla zjištěna v rámci humánních biodistribučních studií. Po intravenózním podání u 21 zdravých dospělých subjektů byl mifamurtid z plazmy rychle eliminován. Průměrná plocha pod křivkou (AUC) byla 17,0 ± 4,71 h x nM a hodnota vrcholové koncentrace (cmax) představovala 15,7 ± 3,72 nM. Za 6 hodin po injekčním podání radioaktivně značených lipozomů, které obsahovaly 6 mg mifamurtidu, byla radioaktivita detekována v játrech, slezině, nosohltanu, štítné žláze a v menší míře v plicích. Lipozomy jsou eliminovány z krevního oběhu především fagocytózou buněk retikuloendotelového systému. Střední poločas radioaktivně značeného materiálu byl bifázický s dobou trvání α-fáze okolo 15 minut a s terminálním poločasem přibližně 18 hodin [26].
U 14 hodnocených pacientů se časové křivky průměrných koncentrací celkového a volného mifamurtidu, které byly hodnoceny po první infuzi přípravku a po poslední infuzi o 11 nebo 12 týdnů později, téměř překrývaly a průměrné hodnoty AUC volného mifamurtidu po první a poslední infuzi byly obdobné. Tyto údaje potvrzují, že ani celkový, ani volný mifamurtid se během období léčby neakumuluje [8].Farmakokinetická data tedy prokazují po intravenózním podání mifamurtidu jeho rychlou distribuci do specifických orgánů i rychlou eliminaci z cirkulace bez známek akumulace v čase. Farmakokinetika mifamurtidu u pacientů s poškozením ledvin či jater nebyla vyhodnocena. U těchto pacientů je třeba zvýšené opatrnosti, protože informace o přizpůsobení dávky nejsou k dispozici. Je-li mifamurtid používán déle než chemoterapie, doporučuje se kontinuální sledování funkce ledvin a jater, a to až do ukončení veškeré léčby.
Klinické zkušenosti
Klinická bezpečnost a účinnost mifamurtidu byla zkoumána u 21 zdravých dospělých. Bylo provedeno několik studií fáze I a II s různými typy pokročilých neoplazií [8–12, 15, 26–27].Podkladem pro registraci léku pro léčbu vysoce maligního osteogenního sarkomu byla prospektivní randomizovaná studie fáze III provedená u nově zjištěného lokalizovaného onemocnění ve věkové skupině dětí až mladých dospělých [28]. Primárním cílem studie bylo porovnání účinnosti trojkombinačního režimu chemoterapie (cisplatina, doxorubin, vysokodávkovaný methotrexát) proti čtyřkombinačnímu režimu (s přidáním ifosfamidu). Dalším cílem bylo porovnání účinnosti léčby cytostatiky s přidáním a bez přidání mifamurtidu. Design studie byl v souladu s běžně užívanou klinickou praxí, kdy je aplikována indukční/předoperační/neoadjuvantní chemoterapie před samotným resekčním výkonem. Cílem je zmenšení nádorové masy, ovlivnění možných mikrometastáz a snaha o umožnění chirurgického výkonu s minimální invalidizací. Po chirurgickém výkonu pak následuje pooperační/konsolidační/adjuvantní chemoterapie. Mifamurtid byl zařazen jako součást pooperační léčby spolu s chemoterapií, a to dvakrát týdně po dobu 12 týdnů a jedenkrát týdně po dobu dalších 24 týdnů. Přežití (OS, overall survival), doba bez známek nemoci (EFS, event free survival) a vedlejší účinky léčby (NÚL, nežádoucí účinky léků) patřily mezi základní sledované parametry.
V časovém rozmezí listopad 1993 až listopad 1997 bylo do studie INT0133 zařazeno 793 pacientů, z celkově 777 hodnotitelných pacientů byly u 91 pacientů detekovány vzdálené metastázy a u 24 pacientů byl nález označen za jasně chirurgicky neřešitelný. Sledovaný soubor 662 pacientů s lokalizovaným potenciálně operabilním vysoce maligním osteosarkomem tvořilo 301 žen a 361 mužů ve věku 2–30,6 roku v době stanovení diagnózy. Medián věku činil 13 let. Studie měla čtyři ramena, pacienti dostávali trojkombinaci či čtyřkombinaci cytostatik s mifamurtidem či bez něj. První výsledky byly publikovány v roce 2005, konečné pak v roce 2008 s mediánem sledování 7,9 roku. Ve sledovaném souboru neovlivnilo přidání ifosfamidu celkové přežití (p = 0,91). Statisticky signifikantní vliv na celkové přežití (p = 0,03, HR 0,71) vykazovalo přidání mifamurtidu k chemoterapii. Byla zaznamenána téměř 30% redukce rizika úmrtí. Ve skupině s lokalizovaným osteosarkomem přežívalo po šesti letech 78 % nemocných léčených mifamurtidem proti 70 % pacientů, kteří mifamurtid k chemoterapii nedostávali. Projevil se trend k prodloužení doby bez známek nemoci/události (EFS) v šestém roce od zahájení léčby (67 % vs. 61 %, p = 0,08).
Samostatně byla vyhodnocena i malá podskupina 91 pacientů s primárně metastatickou nemocí. Při přidání mifamurtidu k chemoterapii přežívalo pět let 53 % pacientů proti 39 % léčených samostatnou chemoterapií (p = 0,19, HR 0,69), tyto nadějné výsledky však vyžadují další verifikaci.
Zařazení do současné palety léčiv
Kostní sarkomy obecně patří svým výskytem mezi ultravzácné typy nádorů. Incidence osteosarkomu na území Evropy představuje přibližně tři nové pacienty na jeden milion obyvatel ročně. Křivka výskytu má bimodální charakter. Maxima dosahuje v období růstové akcelerace, tedy u velmi mladých nemocných, druhý (nižší) vrchol křivky je pak po 65. roce věku. Méně než 30 % pacientů je starších 30 let. Prognóza nízce maligních osteosarkomů je příznivá, radikální chirurgický výkon je metodou volby. Naopak vysoce maligní/konvenční osteogenní sarkom je nádorem s vysokou biologickou aktivitou, s agresivním lokoregio-nálním růstem a především s rizikem časné hematogenní diseminace. Až 20 % pacientů má metastázy v době stanovení diagnózy, u vysokého procenta pacientů je třeba jejich výskyt předpokládat. Před zavedením systémové chemoterapie, v éře obvykle jen amputačních výkonů, umíralo až 95 % pacientů do dvou let na vzdálené metastázy. Zásadní zlepšení přineslo zavedení systémové chemoterapie v posledních dvaceti letech minulého století, s nímž šlo ruku v ruce zdokonalení chirurgických metod. Celosvětově nejsou kontroverzní data: cisplatina, doxorubicin, vysokodávkovaný methotrexát a ifosfamid patří mezi cytostatika s prokázanou účinností v léčbě konvenčního osteosarkomu. Současná klinická praxe zahrnuje podání indukční chemoterapie, po které následuje chirurgický výkon se zhodnocením efektu chemoterapie (% nekróz) a následná chemoterapie. Ozařování má postavení metody doplňkové a je indikováno pouze v některých specifických situacích. Komplexní léčba všech kostních sarkomů by měla být vedena na specializovaných pracovištích, v rámci mezioborových týmů, tam, kde jsou s léčbou těchto velmi vzácných nádorů zkušenosti [29–32]. V současné době tato pracoviště udávají 5leté přežití u 65–75 % pacientů s lokalizovanou formou osteosarkomu. Výsledky léčby primárně metastatické nemoci (vyjma resekabilního plicního postižení) jsou nadále tristní, pět let přežívá 10–30 % nemocných. Podobně nepříznivé jsou vyhlídky pacientů s časnou progresí. Od konce osmdesátých let minulého století, tedy od zavedení polychemoterapie, se navíc prognóza této podskupiny pacientů zásadně nezměnila a zůstává nadále enormně nepříznivá. Mifamurtid je po velmi dlouhé době novým lékem, který by mohl znamenat další zlepšení léčebných výsledků pacientů s osteosarkomem. V současné době je schválen pro podání v rámci kombinované pooperační léčby u lokalizovaného vysoce maligního osteosarkomu po chirurgické resekci u mladých nemocných; pro podání u pacientů s primárně metastatickou formou nemoci nebo u pacientů relabujících/vyššího věku nejsou v současně době dostatečná data [28, 33, 34].
Indikace
Mifamurtid je indikován u dětí, mladistvých a mladých dospělých pro léčbu lokalizovaného resekovatelného osteosarkomu vysokého stupně malignity po makroskopicky kompletní chirurgické resekci. Používá se v kombinaci s pooperační chemoterapií sestávající z více léčiv. Bezpečnost a účinnost byla hodnocena ve studiích u pacientů, jimž byla počáteční diagnóza stanovena v období mezi 2. a 30. rokem věku [35].
Kontraindikace
Kontraindikací pro podání přípravku je hypersenzitivita na mifamurtid nebo na kteroukoli pomocnou látku tohoto přípravku, současné užívání cyklosporinu nebo jiných inhibitorů kalcineurinu a/nebo současné užívání velmi vysokých dávek nesteroidních protizánětlivých léků (NSAID, inhibitory cyklooyxygenázy) pro možnost ovlivnění imunitního systému.
Nežádoucí účinky
Tolerance podání mifamurtidu je velmi dobrá. Především jeho první aplikace je obvykle provázena vzestupem tělesné teploty, třesavkou či zimnicí. Paracetamol pak tvoří dostatečnou prevenci, navíc většina nemocných získává časno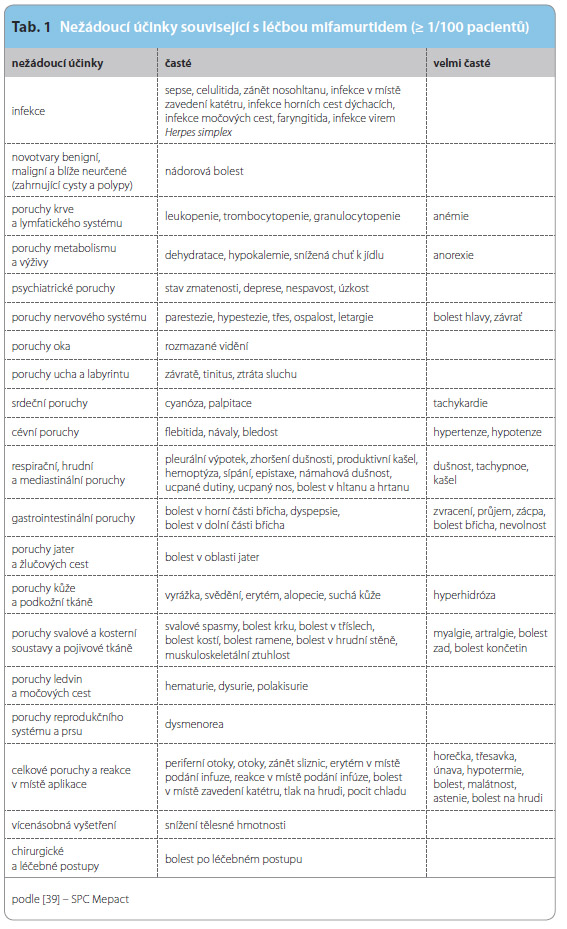 u toleranci k léčbě a tyto počáteční příznaky se obvykle již nevyskytují. U zdravých jedinců byly pozorovány dále bolesti hlavy, svalů, nevolnost, zvracení, tachykardie, změny tlaku či dyspnoe.Z dalších nežádoucích účinků byl zaznamenán vyšší výskyt poruch sluchu ve skupině pacientů léčených kombinací chemoterapie s mifamurtidem proti chemoterapii samotné (11,5 % vs. 7,1 %). Mifamurtid v kombinaci s jinými cytostatiky nezvyšoval jejich toxicitu, dávkování nemuselo být upraveno a podání je možné i v případě neutropenie.Zvláštní opatrnosti je třeba u nemocných s anamnézou astmatu či chronické plicní obstrukční choroby, kde lze zvážit profylaktické podávání bronchodilatancií. Přípravek by měl být používán s opatrností u pacientů s anamnézou autoimunitního, zánětlivého nebo jiného onemocnění vaziva. Při očekávaném působení cytokinů je třeba cíleně sledovat možný vývoj artritidy, synovitidy či možného vzniku výpotků v jiných lokalizacích. Zvláštní opatrnost během podání je doporučována rovněž u jedinců s anamnézou nestabilního kardiovaskulárního onemocnění, vaskulitidy či žilního tromboembolismu v anamnéze. U těchto nemocných je doporučován také monitoring koagulace po prvním a několika dalších podáních léku.
u toleranci k léčbě a tyto počáteční příznaky se obvykle již nevyskytují. U zdravých jedinců byly pozorovány dále bolesti hlavy, svalů, nevolnost, zvracení, tachykardie, změny tlaku či dyspnoe.Z dalších nežádoucích účinků byl zaznamenán vyšší výskyt poruch sluchu ve skupině pacientů léčených kombinací chemoterapie s mifamurtidem proti chemoterapii samotné (11,5 % vs. 7,1 %). Mifamurtid v kombinaci s jinými cytostatiky nezvyšoval jejich toxicitu, dávkování nemuselo být upraveno a podání je možné i v případě neutropenie.Zvláštní opatrnosti je třeba u nemocných s anamnézou astmatu či chronické plicní obstrukční choroby, kde lze zvážit profylaktické podávání bronchodilatancií. Přípravek by měl být používán s opatrností u pacientů s anamnézou autoimunitního, zánětlivého nebo jiného onemocnění vaziva. Při očekávaném působení cytokinů je třeba cíleně sledovat možný vývoj artritidy, synovitidy či možného vzniku výpotků v jiných lokalizacích. Zvláštní opatrnost během podání je doporučována rovněž u jedinců s anamnézou nestabilního kardiovaskulárního onemocnění, vaskulitidy či žilního tromboembolismu v anamnéze. U těchto nemocných je doporučován také monitoring koagulace po prvním a několika dalších podáních léku.
Alergické reakce 4. stupně včetně vyrážky, dušnosti a hypertenze se vyskytly v rámci klinických studií velmi vzácně, odlišení skutečné etiologie těchto obtíží při předpokládaném vývoji protizánětlivé reakce je velmi obtížné. Podobně obtížná je detekce etiologie nevolnosti, zvracení a ztráty chuti k jídlu, pokud je mifamurtid podáván současně s chemoterapií.Celkový výskyt zaznamenaných nežádoucích účinků je uveden v tab. 1.
Lékové interakce
Přípravek mifamurtid nezvyšoval toxicitu dalších současně užívaných léčivých přípravků se známým vlivem na ledviny či játra. Neexistuje důkaz, že by ovlivňoval protinádorové účinky chemoterapie. Dle dostupných dat neovlivňuje metabolickou aktivitu ani transkripci cytochromu P450. Je doporučováno časově oddálit podávání mifamurtidu a doxorubicinu či jiných lipofilních léčivých přípravků, jsou-li použity ve stejném režimu chemoterapie. Je obecně kontraindikováno užití léku spolu s cyklosporinem či s dalšími inhibitory kalcineurinu pro předpokládaný účinek na fagocytární funkci makrofágů a mononukleárů ve slezině. Podobně by mifamurtid neměl být podáván při chronickém či pravidelném užívání kortikosteroidů. Je kontraindikováno užívání vysokých dávek nesteroidních antiflogistik (inhibitorů cyklooxygenázy), neboť mohou blokovat aktivující účinek mifamurtidu na makrofágy [35].
Těhotenství
O použití mifamurtidu u těhotných žen nejsou k dispozici žádné údaje. Přípravek by neměl být podáván během těhotenství nebo ženám, které neužívají účinnou hormonální antikoncepci. Rovněž o možném vylučování mifamurtidu do mateřského mléka nejsou dostupné žádné informace.
Dávkování
Léčba by měla být zahájena a sledována lékařem se zkušenostmi v diagnostice a léčbě osteosarkomu. Doporučená dávka pro všechny pacienty je 2 mg/m2 tělesného povrchu. První aplikace by měla být podána co nejdříve po chirurgickém výkonu a po zhojení rány, ideálně do dvou týdnů. Prvních 12 týdnů je mifamurtid podáván spolu s chemoterapií 2krát týdně s minimálně 3denní pauzou mezi aplikacemi a dále 1krát týdně po dobu dalších 24 týdnů. Jde tedy o podání 48 aplikací v průběhu 36 týdnů [35–37].Není k dispozici dostatek údajů o bezpečnosti a účinnosti podání přípravku u dětí mladších dvou let stejně jako u pacientů starších 30 let.Před podáním musí být přípravek rekonstituován, přefiltrován pomocí přiloženého filtru a dále naředěn. Takto naředěná suspenze je homogenní, bílá až téměř neprůhledná lipozomální suspenze bez viditelných částic, bez pěny a tukových hrudek. Poté je přípravek podáván pomocí intravenózní infuze v průběhu 60 minut, bolusové podání není možné.
Další informace
Mifamurtid byl schválen Evropskou lékovou agenturou (EMA) 6. března 2009 jako přípravek pro léčbu lokalizovaného vysoce maligního osteogenního sarkomu po makroskopicky radikální resekci; v den schválení EMA mu byl přiznán status orphan drug. Do konce roku 2013 byl již podán v Evropě dalším více než 350 pacientům včetně pacientů v České republice, kde má od 1. 2. 2013 lék stanovenou úhradu. Od 1. 5. 2013 byl zařazen mezi vysoce inovativní léčebné přípravky (VILP) a od 9. 7. 2013 je jeho podání možné v onkologických centrech, která se na léčbu konvenčního osteosarkomu specializují (Praha, Brno). Jeho podání podléhá hlášení do celorepublikového registru, jež je mimo jiné i podmínkou úhrady plátcem léčebné péče.
Závěr
V zemích Evropské unie je mifamurtid indikován k léčbě resekovatelného lokalizovaného vysoce maligního osteosarkomu dětí, adolescentů a mladých dospělých po makroskopicky radikálním chirurgickém výkonu. Je součástí pooperační systémové léčby. V kombinaci s pooperační chemoterapií se podává dvakrát týdně v dávce 2 mg/m2 tělesného povrchu v 60minutové infuzi s odstupem nejméně tří dnů mezi aplikacemi, a to prvních 12 týdnů, následně pak jedenkrát týdně dalších 24 týdnů do maximálního počtu 48 infuzí v průběhu 36 týdnů. Mifamurtid má příznivý profil nežádoucích účinků, podání je možné ambulantní cestou.
Tato práce byla vytvořena za institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR Masarykovu onkologickému ústavu v roce 2013.
Seznam použité literatury
- [1] Fidler IJ. Therapy of cancer metastasis by systemic activation of macrophages. Adv Pharmacol 1994; 30: 271–326.
- [2] Fidler IJ, Brown NO, Hart IR. Species variability for toxicity of free and liposome-encapsulated muramyl peptides administered intravenously. J. Biol Response Mod 1985; 4: 298–309.
- [3] Sone S, Matsuura S, Ogawara M, et. al. Potentiating effect of muramyl dipeptide and its lipophilic analog encapsulated in liposomes on tumor cell killing by human monocytes. J Immunol 1984; 132: 2105–2110.
- [4] Strober W, Murray PJ, Kitani A, et al. Signalling pathways and molecular interactions of NOD1 and NOD2. Nat Rev Immunol 2006; 6: 9–20.
- [5] Girardin SE, Boneca G, Viola J, et. al. Nod2 is general sensor of peptidoglycan through muramyl dipeptid (MDP) detection. J Biol Chem 2003; 278: 8869–8872.
- [6] Inohara N, Ogura Y, Fontalba A, et al. Host recognition of bacterial muramyl dipeptide mediated through Nod2 implication for Crohn´s disease. J Biol Chem 2003; 278: 5509–5512.
- [7] Lebourhis L, Benko S, Girardin SE. Nod1 and Nod2 in innate immunity and human inflammatory disorders. Biochem Soc Trans 2007; 35: 1479–1484.
- [8] Landmann R, Obrist R, Denz H, et al. Pharmacokinetics and immunomodulatory effects on monocytes during prolonged therapy with liposomal muramyltripeptide. Biotherapy 1994; 7: 1–12.
- [9] Liebes L, Walsch CM, Chachoua A, et al. Modulation of monocyte functions by muramyl tripeptide phosphatidylethanolamine in a Phase II Study with patients with metastatic melanoma. J Natl Cancer Inst 1992; 84: 694–699.
- [10] Frost H, Murray JL, Chaudri HA, et al. Interleukin-6 induction by a muramyltripeptide in cancer patients. J Biol Resp Mod 1990; 9: 160–166.
- [11] Kleinerman ES, Jia SF, Griffin J, et al. Phase II study of liposomal muramyl tripeptide in osteosarcoma: the cytokine cascade and monocyte activation following administration. J Clin Oncol 1992; 10: 1310–1316.
- [12] Asano T, Kleinerman ES. Liposome-encapsulated MTP-PE: a novel biologic agent for cancer therapy. J Immunother 1993; 14: 286–292.
- [13] Nardin A, Lefebvre ML, Labroquère K. Liposomal muramyl tripeptide phosphatidylethanolamine: Targeting and activating macrophages for adjuvant treatment of osteosarcoma. Curr Cancer Drug Targets 2006; 6: 123–133.
- [14] Kleinerman ES, Erickson KL, Chroit AJ, et al. Activation of tumoricidal properties in human blood monocytes by liposomes containing lipophilic muramyl tripeptide. Cancer Res 1983; 43: 2010–2014.
- [15] Kleinerman ES, Murray JL, Snyder JS, et al. Activation of tumoricidal properties in monocytes from cancer patients following intravenous administration of liposomes containing muramyl tripeptide phosphatidylethanolamine. Cancer Res 1989; 49: 4665–4670.
- [16] Asano T, Mcintyre BW, Bednarczyk JL, et al. Liposomal muramyl tripeptide upregulates adhesion molecules on the surface of human monocytes. Oncol Res 1995; 7: 253–257.
- [17] Key ME, Talmagde JE, Fogler WE, et al. Isolation of tumoricidal macrophages from lung melanoma metastases of mice treated systemically with liposomes containing a lipophilic derivative of muramyl dipeptide. J Natl Cancer Inst 1982; 69: 1189–1198.
- [18] Talmagde JE, Lenz BF, Collins MS, et al. Tumor models to investigate the therapeutic efficiency of immunomodulators. Behring Inst Mit 1984; 74: 219–229.
- [19] Talmagde JE, Lenz BF, Klabansky R, et al. Therapy of autochthonous skin cancer in mice with intravenously injected liposomes containing muramyltripeptide. Cancer Res 1986; 46: 1160–1163.
- [20] Karpoff HM, Jarnagin W, Delman K, et al. Regional muramyl tripeptide phosphatidylethanolamine administration enhanced hepatic immune function and tumor surveillance. Surgery 2000; 128: 213–218.
- [21] Thomas K, Nijenhuis AM, Dontje BH, et al. Antitumor reactivity induced by liposomal MTP-PE in liver metastasis model of colon cancer in the rat. Clin Exp Metastasis 1995; 13: 328–336.
- [22] MacEwen EG, Kurzman ID, Rosenthal RC, et al. Therapy for osteosarcoma in dogs with intravenous injection liposome-encapsulated muramyl tripeptide. J. Natl Cancer Inst 1989; 81: 935–938.
- [23] Kurzman ID, Shi F, Vail DM, et al. In vitro and in vivo enhancement of canine pulmonary alveolar macrophage cytotoxic activity against canine osteosarcoma cells. Cancer Biother Radiopharm 1999; 14: 121–128.
- [24] Fox LE, MacEwen EG, Kurzman ID, et al. Liposome-encapsulated muramyl tripeptide phosphatidyl-ethanolamine for the treatment of feline mammary adenocarcinoma – a multicenter randomized double-blind study. Cancer Biother 1995; 10: 125–130.
- [25] Fogler WE, Wade R, Brundisch DE, et al. Distribution and fate of free and liposome-encapsulated [3H] muramyl dipeptide and [3H] muramyl tripeptide phosphatidylethanolamine in mice. J Immunol 1985; 135: 1372–1377.
- [26] Murray JL, Kleinerman ES, Cunningham JE, et al. Pha-se I trial of liposomal muramyl tripeptide phosphatidyl-ethanolamine in cancer patients. J Clin Oncol 1989; 7: 1915–1925.
- [27] Verweij J, Judson I, Steward W, et el. Phase II study of liposomal muramyl tripeptide phosphatidylethanol-amine (MTP/PE) in advanced soft tissue sarcoma of the adult. An EORTC Soft Tissue and Bone Sarcoma Group study. Eur J Cancer 1994; 30A/6: 842–843.
- [28] Meyers PA, Schwartz CL, Krailo MD, et al. Osteosarcoma: the addition of muramyl tripeptide to chemotherapy improves overall survival – a report from the Children‘s Oncology Group. J Clin Oncol 2008; 26: 633–638.
- [29] Cancer management: A multidisciplinary Approach, 12 th edition, edited by Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ, 2009, Chapter 21, 569–583.
- [30] NCCN Clinical Practise Guidlines in Oncology, Bone Cancer, V. 1/2014, www.nccn.org
- [31] Bone sarcomas: ESMO Clinical Practise Guidelines for diagnosis, treatment and follow up. Ann Oncol 2012; 23 (Suppl. 7): vii 100–109.
- [32] www.euramos.org
- [33] Chou AJ, Kleinerman ES, Krailo MD, et al. Addition of muramyl tripeptide to chemotherapy for patients with newly diagnosed metastatic osteosarcoma: a report from the Children‘s Oncology Group. Cancer 2009; 115: 5339–5348.
- [34] Anderson PM, Meyers P, Kleinerman K, et al. Mifamurtid in Metastatic and Recurrent Osteosarcoma: A patient Access Study With Pharmacokinetics, Pharmacodynamic, ad Safety Assessments. Pediatr Blood Cancer 2014; 61: 238–244.
- [35] MEPACT, informace o přípravku dostupné na www. sukl.cz a www.ema.europa.eu
- [36] Meyers PA. Muramyl tripeptide (mifamurtide) for the treatment of osteosarcoma. Expert Rev Anticancer Ther 2009; 9: 1035–1049.
- [37] Mifamurtide for the treatment of osteosarcoma, www.nice.org.uk/ta235
- [38] Ando K, Mori K, Corradini N, et al. Mifamurtide for the treatment of nonmetastatic osteosarcoma. Expert Opin Pharmacother 2011; 12: 285--292.
- [39] SPC Mepact; http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000802/WC500026565.pdf. Navštíveno 20. února 2014.