Mometason furoát
Asthma bronchiale je chronické zánětlivé onemocnění dýchacích cest, na jehož rozvoji se účastní mnoho buněk a buněčných působků. Chronický zánět je spojen s průduškovou hyperreaktivitou a vede k opakovaným epizodám pískotů, dušnosti, tíže na hrudi a kašle, které se vyskytují převážně v noci a časně nad ránem. Tyto stavy jsou obvykle provázeny rozsáhlou, ale proměnlivou bronchiální obstrukcí, která je často reverzibilní, ať již spontánně, či po léčbě. Cílem léčby astmatu je dosažení dlouhodobě stabilizovaného stavu, který označujeme jako astma pod kontrolou. Kontrolující, preventivní antiastmatika jsou zaměřena proti zánětu dýchacích cest. Nejvýraznější protizánětlivý účinek mají kortikosteroidy podávané v inhalační formě, které jsou lékem první volby. Mometason furoát (MF) je účinným inhalačním protizánětlivým kortikosteroidem, a tím i efektivní udržovací léčbou lehkého, středně těžkého až těžkého perzistujícího bronchiálního astmatu. Díky nízké biologické dostupnosti vykazuje MF vynikající bezpečnostní profil. Je určen k pravidelné léčbě astmatiků ve věku 12 let a starších v dávkování 200 až 400 mg 1krát či 2krát denně dle tíže astmatu a kontroly nad chorobou. Vlastnosti MF (vysoká receptorová afinita, nízká biologická dostupnost) ho v blízké budoucnosti předurčují taktéž pro léčbu dětských astmatiků.
Farmakologická skupina
Dle ATC klasifikace patří mometason furoát do farmakoterapeutické skupiny R03B: jiná inhalační léčiva onemocnění spojených s obstrukcí dýchacích cest – glukokortikoidy (R03BA). ATC kód mometason furoátu je R03BA07.
Chemické a fyzikální vlastnosti
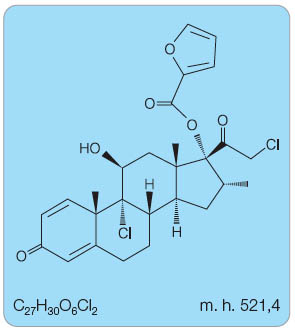 Mometason furoát je chemicky (11β, 16α)-9,21-dichlor-11-hydroxy-16-methyl-3,20-dioxopregna-1,4-dien-17-yl 2-furoát (obr. 1).
Mometason furoát je chemicky (11β, 16α)-9,21-dichlor-11-hydroxy-16-methyl-3,20-dioxopregna-1,4-dien-17-yl 2-furoát (obr. 1).
Sumární vzorec:
C22H28Cl2O4 (mometason)
C27H30O6Cl2 (mometason furoát)
Molekulová hmotnost:
427,4 g/mol (mometason)
521,4 g/mol (mometason furoát)
Mechanismus účinku, farmakodynamika
Bronchiální astma představuje bez ohledu na svoji etiologii a různé klinické formy (resp. vyjádřený fenotyp) chronické zánětlivé onemocnění dýchacích cest spojené s jejich strukturálními změnami. Perzistující zánět je spojen s bronchiální hyperreaktivitou, obstrukcí a klinickými příznaky astmatu. Protizánětlivá léčba inhalačními kortikosteroidy (KS) je proto základem léčby perzistujícího astmatu [1, 2].
Mechanismus účinku inhalačních KS je objasněn jen do určité míry. Vdechované KS jsou látky lipofilní povahy, které prostupují cytoplazmatickou membránu a v cytoplazmě se váží na glukokortikoidní receptor (GR). Cytoplazmatický GR je identický ve všech buňkách lidského organismu, ale může se lišit jeho tkáňová exprese. Imunohistochemické studie prokázaly vysokou expresi GR v epiteliálních buňkách respiračního systému. Receptor je tvořen třemi doménami. Molekula KS se váže na C-koncovou část, střední část je určena k interakci s DNA a N-terminální část se účastní transaktivačních procesů v jádře. Polymorfní charakter receptoru může být podkladem pro individuální senzitivitu nemocných vůči KS.
V cytoplazmě se GR nachází v inaktivní podobě, po vazbě KS dochází ke konformační změně receptoru. Tato vazba je zásadní v účinku KS, neboť vede ke zvýšení či snížení transkripce [3].
Snížení transkripce se děje cestou negenomové-transrepresivní blokády transkripčních faktorů AP-1 (aktivační protein 1) a NF-kB (nukleární faktor kB). Při probíhajícím zánětu jsou tyto transkripční faktory aktivovány některými cytokiny, např. TNF-α (tumor nekrotizující faktor α). Transkripční faktory v aktivované formě pronikají do jádra buňky a cestou mRNA indukují tvorbu celé řady prozánětlivých mediátorů. Nově vytvořený komplex KS-GR je schopen navázat se na transkripční faktory a tímto způsobem blokovat jejich průnik do jádra buňky.
Kortikosteroidy jsou schopny takto inhibovat produkci celé škály cytokinů – interleukiny (IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-11, IL-12, IL-18), IFN-gamma (interferon gamma), TNF-α, včetně dalších proteinů zapojených do procesu zánětu (GM-CSF, RANTES, receptor NK-1, endotelin 11, adhezní molekuly ICAM-1 a selektin).
Cestou genomovou-transaktivační jsou pozitivně regulovány geny kódující protizánětlivě působící látky. Po vazbě KS na GR a vzniku komplexu KS-GR v cytoplazmě dochází ke konformační změně a rozpadu receptoru. Do jádra buňky prostupuje jen jeho nukleární část a váže se na DNA, konkrétně na tzv. GER sekvenci (glucocorticoid response elements). Cestou mRNA dochází buď k potlačení, nebo k indukci produkce mediátorů. V první řadě je třeba jmenovat nově tvořený protein lipokortinu, který inhibuje fosfolipázu A2 a takto zasahuje do metabolismu kyseliny arachidonové se snížením tvorby prozánětlivých leukotrienů, prostaglandinů a PAF (destičky aktivující faktor) [4].
Transaktivační mechanismy jsou též odpovědny za nežádoucí systémové metabolické a endokrinní účinky KS, což v terapeutických dávkách inhalačních KS nepředstavuje významné (ač diskutované) riziko.
Zásahem KS do produkce regulačních a prozánětlivých cytokinů dochází k dalším dějům, které vyplývají z účinků těchto cytokinů. Je snižována exprese adhezních molekul na endoteliích (např. ICAM-1, E-selektin), a tím snížena migrace buněk submukózně a jejich přežívání v místech zánětu. Při pravidelné aplikaci inhalačních KS dochází ke snižování slizniční buněčné infiltrace – je redukován počet aktivovaných T lymfocytů, antigen prezentujících buněk, eozinofilů a též neutrofilů v zánětlivé nosní sliznici.
Epiteliální buňky, které jsou místem prvního kontaktu inhalačních KS se sliznicí, redukují tvorbu chemokinů, jako jsou MIP-1 a RANTES, a snižují produkci GM-CSF [5].
 Účinkem KS na hlenové slizniční žlázky je snížena sekrece hlenu a jejich schopnost odpovídat na cholinergní podněty. Při dlouhodobé aplikaci inhalačních KS je dokladován jejich restaurační vliv s obnovením a řádnou funkcí řasinkového epitelu respirační sliznice. Aplikace inhalačních KS snižuje bronchiální reaktivitu jak na specifické, tak na nespecifické podněty [6].
Účinkem KS na hlenové slizniční žlázky je snížena sekrece hlenu a jejich schopnost odpovídat na cholinergní podněty. Při dlouhodobé aplikaci inhalačních KS je dokladován jejich restaurační vliv s obnovením a řádnou funkcí řasinkového epitelu respirační sliznice. Aplikace inhalačních KS snižuje bronchiální reaktivitu jak na specifické, tak na nespecifické podněty [6].
Z hlediska systémových účinků je důležitým faktem, že biologická dostupnost inhalačních KS je uváděna méně než 1 % aplikované dávky (při terapeutickém dávkování v µg).
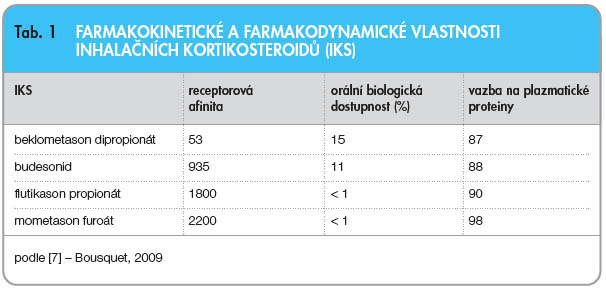
Protizánětlivá účinnost a bezpečnost léčby MF je pozitivně ovlivněna jeho vysokou receptorovou afinitou, vysokou vazbou na plazmatické proteiny a nízkou biologickou dostupností, viz tab. 1 [7].
Tyto vlastnosti MF dokládají studie in vitro. MF prokázal účinek na snížení exprese adhezních molekul, vliv na snížení sekrece IL-4 a IL-5 z alergen-specifických buněk. Byl potvrzen vliv MF na zvýšenou apoptózu eozinofilů s vyšším efektem, než má flutikason propionát nebo budesonid [6, 8].
Studie s MF podávaným v dávce 100 µg/ den dokládají dlouhodobé sledování dětských pacientů s ohledem na jejich růst a neprokázaly retardaci růstu po dobu jednoho roku. Díky krátkému plazmatickému poločasu a rychlému metabolismu MF játry (samozřejmě při zachování minimální udržovací terapeutické dávky, která postačí ke kontrole symptomů) byly zaznamenány jen minimální či téměř žádné systémové účinky [9].
V obecné rovině lze konstatovat, že při dodržení doporučených dávek nedochází k útlumu hypothalamo-hypofyzární osy, a tím ke snížení funkce nadledvin [3].
Farmakokinetické vlastnosti
Absorpce
Systémová biologická dostupnost po inhalaci MF je nízká. Je to díky nízké absorpci z plic a střev a rozsáhlému presystémovému metabolismu porce inhalačního léku zachycené v dutině ústní a polknuté. Při ustálené expozici MF po inhalačním podání nebo po jednotlivé i.v. dávce se dle různých studií odhaduje absolutní biologická dostupnost přibližně 16 % u zdravých dobrovolníků a přibližně 10 % u astmatických pacientů.
Distribuce
Po intravenózním podání bolusové dávky je průměrná hodnota distribučního objemu (Vd) v ustáleném stavu 152 l. Vazba MF na plazmatické bílkoviny in vitro je vysoká, 98–99 %, v rozmezí plazmatických koncentrací 5–500 ng/ml.
Metabolismus
Část vdechované dávky MF zůstává v dutině ústní a je spolknuta. Absorpce z gastrointestinálního traktu podléhá extenzivnímu metabolismu. U lidí je MF v jaterních mikrozomech metabolizován na mnoho metabolitů, včetně 6-betahydroxyl MF, který vzniká na cytochromu P-450 (izoenzym 3A4).
Vylučování
Inhalovaná dávka, radioaktivně označená, je vylučována především stolicí (75 %) a v menší míře močí (8 %) [10].
Klinické zkušenosti
Dle publikovaných studií bylo zařazeno do klinického sledování s aplikací MF více než 4000 pacientů starších 12 let (dávky v rozmezí 200 µg až 800 µg denně).
Mometason furoát ve srovnání s placebem
Plán studií zahrnoval skupiny pacientů léčených před vstupem do studie pouze úlevovou léčbou [11–13] či pacienty s terapií inhalačními KS [14–16] nebo KS systémovými [17]. Celkově zhodnoceno, léčba MF signifikantně zvyšovala plicní funkce ve srovnání s placebem ve všech sledovaných skupinách (p ≤ 0,05). Výsledná data dokládala, že podávání jedné inhalační dávky večer představuje účinné a jednoduché schéma pro pacienty s lehkým či středně těžkým perzistujícím astmatem. U pacientů, kteří před vstupem do studie dostávali pouze úlevovou medikaci, nastalo signifikantní zlepšení při terapii MF v hlavním cíli sledování, jímž byla ventilační hodnota FEV1 (forced expiratory volume), a to o 10,5–16,8 %. Rovněž v dalších sledovaných ventilačních parametrech bylo zaznamenáno statisticky významné zlepšení (FVC, MEF 25–75 %, PEF) [11–13].
U pacientů s astmatem tíže lehké až středně těžké, kteří byli před vstupem do studie již léčeni inhalačními KS, byly průměrné změny hodnot FEV1 při různých dávkovacích režimech MF (100 µg 2krát denně, 200 µg 1krát denně večer či 2krát denně, 400 µg 1krát denně či 2krát denně, 800 µg 1krát denně večer) v rozmezí od -1,1 % do +24,0 % ve srovnání s placebem, kde byly zaznamenány změny v rozmezí -11,2 % až +7,8 %. Ve studii Noonana a kol., která srovnávala 12 týdnů aktivní léčby (200 µg ráno) oproti podávání placeba, bylo zjištěno zlepšení v hodnotě FEV1, jež však nebylo statisticky významné [14].
Zvláštní skupinu tvoří pacienti s těžkým perzistujícím astmatem léčení perorálními KS. Ve studii Fishe a kol. bylo v aktivní skupině léčené MF v dávce 400 µg nebo 800 µg 2krát denně dosaženo signifikantního zlepšení v parametru FEV1, ale taktéž snížení dávky systémových KS a zlepšení kvality života [17].
Pokud byl MF sledován z hlediska příznaků astmatu a srovnáván s placebem, byly zjištěny tyto signifikantní změny v aktivně léčené skupině: snížení výskytu astmatických příznaků, skóre astmatu, snížení počtu nočních buzení, sporadičtější užívání úlevové medikace a nižší spotřeba perorálních KS. Stejně tak odpověď na léčbu hodnocená lékaři prokázala statisticky významný rozdíl ve prospěch MF [12–14, 18].
Mometason furoát ve srovnání s jinými inhalačními kortikosteroidy
V klinických studiích byl taktéž sledován vliv MF ve srovnání s jinými inhalačními KS, jako je beklometason dipropionát, budesonid a flutikason propionát.
Byla srovnávána účinnost MF (práškový inhalátor) podávaného v dávce 200 µg 2krát denně s beklometason dipropionátem (tlakový sprej) v dávce 168 µg 2krát denně. Změny ve ventilačních funkcích svědčily ve prospěch MF (hodnoty FEV1 7,1– 9,6 %) oproti beklometasonu (FEV1 3,0–4,4 %). Rozdíly však nebyly signifikantní. Obdobné závěry studií byly učiněny při sledování různého dávkování MF (100 µg, 200 µg, 400 µg 2krát denně) vůči beklometasonu 168 µg 2krát denně [18]. Při srovnání flutikason propionátu v dávce 250 µg 2krát denně vůči MF (100–400 µg 2krát denně či 400 µg jednou denně) nebyly zjištěny statisticky významné rozdíly [19].
Signifikantní změny (p ≤ 0,01) však byly doloženy při srovnání MF (400 µg) a budesonidu (400 µg jednou denně ráno) ve ventilačních hodnotách FEV1, FEF 25–75 % a PEF. Stejně tak v dalších studiích s dávkováním MF 200 µg a 400 µg 2krát denně oproti budesonidu 400 µg 2krát denně bylo prokázáno signifikantní zlepšení hodnoty FEV1 u pacientů léčených MF v průběhu celého 12týdenního sledování. V ostatních ventilačních ukazatelích svědčily změny ve prospěch MF, ale nebyly statisticky významné [20].
Tak jako tomu bylo při sledování jiných inhalačních KS, potvrdily i studie s MF klinický efekt léku závislý na dávce. Zdvojnásobení dávky léku vedlo k výraznějšímu zlepšení ventilačních funkcí. Žádný přídatný efekt však již nebyl pozorován u dávek vyšších než 400 µg 2krát denně [21, 22].
Kromě ventilačních parametrů byly v rámci studií sledovány taktéž příznaky astmatu ve srovnání s jinými inhalačními KS (beklometason dipropionát, budesonid a flutikason propionát). U naprosté převahy ukazatelů nebyl prokázán signifikantní rozdíl, ač některé rozdíly svědčily ve prospěch MF. V některých studiích byly zjištěny statisticky významné rozdíly v dílčích parametrech – např. srovnání MF 400 µg s budesonidem 400 µg podávaným jednou denně ráno při hodnocení odpovědi na léčbu lékařem. Obdobné výsledky prokazovala taktéž srovnání vůči fllutikason propionátu při různém dávkování [18–21].
Zařazení do současné palety léčiv
Dle současných populačních dat trpí bronchiálním astmatem až 300 milionů lidí a vývojové trendy nasvědčují tomu, že do roku 2025 se tento počet zvýší na 400 milionů [1]. Bronchiální astma je celoživotní onemocnění s velmi variabilním průběhem. Cílem léčby astmatu je dosažení dlouhodobě stabilizovaného stavu, který označujeme jako astma pod kontrolou. Kontrolující, preventivní antiastmatika jsou zaměřena proti zánětu dýchacích cest. Je nutné aplikovat je každodenně a dlouhodobě i po vymizení potíží. Nejvýraznější protizánětlivý účinek mají KS podávané v inhalační formě, jež jsou lékem první volby. MF je účinný protizánětlivý KS určený k pravidelné léčbě astmatiků s perzistující formou astmatu ve věku od 12 let.
Podle subjektivních obtíží (denních a nočních), míry zjištěné obstrukce, její variability a četnosti užití úlevové medikace je astma děleno na jednotlivé stupně od astmatu intermitentního až po astma těžké perzistující. Tato klasifikace je v praxi stále s výhodou užívána a je kombinována s klasifikací, která uvádí úroveň kontroly nad astmatem. Dle tíže a frekvence příznaků může být astma pod kontrolou, pod částečnou kontrolou nebo pod nedostatečnou kontrolou [2]. Snahou je vytvořit další klasifikace astmatu, které by péči o astmatiky zjednodušovaly a současně byly výstižné z hlediska typu astmatického zánětu.
Základním cílem léčby je dosažení a udržení kontroly nad astmatem. Léčba zahrnuje kromě medikamentózní složky celou řadu dalších aspektů. Zásadní význam pro nemocného má omezení expozice rizikovým faktorům – známým spouštěčům exacerbací.
V medikamentózní léčbě astmatu se uplatňují dvě skupiny léků. Úlevová antiastmatika jsou zastoupena bronchodilatačními léky s rychlým nástupem účinku pro akutní potíže, kam patří inhalační b2-agonisté s rychlým nástupem účinku (RABA – Rapid-acting β-agonists) – formoterol, salbutamol a terbutalin. Formoterol je zároveň RABA i inhalačním b2-agonistou s dlouhodobým účinkem (LABA – Long-acting β-agonists). Léky salbutamol a terbutalin jsou taktéž označovány jako inhalační b2-agonisté s krátkodobým účinkem (SABA – Short-acting β-agonists).
Kontrolující, preventivní antiastmatika jsou zaměřena proti zánětu dýchacích cest. Je nutné aplikovat je každodenně a dlouhodobě i po vymizení potíží. Nejvýraznější protizánětlivý účinek mají kortikosteroidy podávané v inhalační formě (IKS), které představují léky první volby. Podpůrný protizánětlivý účinek mají antileukotrieny, methylxantiny (theofyliny) a částečně i LABA, kam se řadí již uvedený formoterol a dále salmeterol. LABA je nutno podávat současně s IKS, což ideálně splňuje fixní kombinace obsahující IKS a LABA v jednom inhalačním systému. U některých nemocných, zejména s obtížně léčitelným astmatem, se nevyhneme perorálnímu podávání KS. Pětistupňové dávkování a kombinace kontrolujících antiastmatik se řídí závažností stavu nemocného a odpovědí na dosavadní léčbu. Mezi léčebné možnosti v 5. stupni farmakoterapie alergického, respektive IgE mediovaného astmatu přibyla biologická léčba anti-IgE protilátkami (omalizumabem) [2].
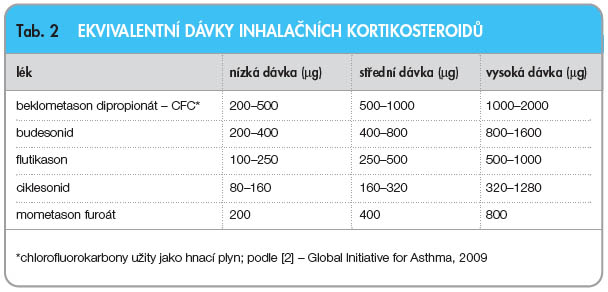
MF jako účinný zástupce KS je v základní léčebné paletě řazen mezi kontrolující protizánětlivá antiastmatika v inhalační formě. Porovnání dávek současných inhalačních KS uvádí tab. 2 [2].
 MF představuje účinnou protizánětlivou léčbu lehkého, středně těžkého až těžkého perzistujícího astmatu. Díky nízké biologické dostupnosti vykazuje MF vynikající bezpečnostní profil. Ač je tento lék v současné době určen v České republice pro léčbu astmatiků ve věku 12 let a výše, jeho vlastnosti ho předurčují pro kvalitní léčbu narůstající populace dětských astmatiků. V dalším vývoji očekáváme v blízké budoucnosti nástup léčby fixní kombinací MF s formoterolem či indakaterolem, což bude slibná terapie pro pacienty se středně těžkým až těžkým perzistujícím astmatem.
MF představuje účinnou protizánětlivou léčbu lehkého, středně těžkého až těžkého perzistujícího astmatu. Díky nízké biologické dostupnosti vykazuje MF vynikající bezpečnostní profil. Ač je tento lék v současné době určen v České republice pro léčbu astmatiků ve věku 12 let a výše, jeho vlastnosti ho předurčují pro kvalitní léčbu narůstající populace dětských astmatiků. V dalším vývoji očekáváme v blízké budoucnosti nástup léčby fixní kombinací MF s formoterolem či indakaterolem, což bude slibná terapie pro pacienty se středně těžkým až těžkým perzistujícím astmatem.
Indikace
MF je indikován k pravidelné protizánětlivé léčbě pro kontrolu perzistujícího astmatu tíže lehké, středně těžké až těžké. Tento inhalační KS je určen k podávání u dospělých a mladistvých ve věku od 12 let.
Řada studií provedených v populaci dětí ve věku 4–11 let prokázala účinnost a bezpečnost této léčby. Tyto závěry vedly k tomu, že dle doporučení FDA byl MF povolen i pro léčbu dětského astmatu [7].
Kontraindikace
Jedinými v současné době známými kontraindikacemi jsou hypersenzitivní reakce vůči MF či laktóze a mléčným bílkovinám, které jsou v laktóze obsaženy ve stopovém množství. Lze však konstatovat, že maximální doporučená denní dávka (800 µg MF) obsahuje 4,64 µg laktózy a toto množství by nemělo vyvolat u astmatiků s intolerancí laktózy žádné příznaky [10].
Nežádoucí účinky
Incidence nežádoucích reakcí při léčbě MF byla stejná jako u jiných srovnávaných inhalačních KS. Srovnání skupin pacientů léčených MF v různých léčebných schématech s pacienty, jimž bylo podáváno placebo, ukazuje v aktivní skupině výskyt nežádoucích účinků v rozmezí 19–25 % a v placebové skupině v rozmezí 19–22 %. Taktéž studie prodloužená na celkovou dobu 12 měsíců (MF podáván v dávce 200 µg či 400 µg) neprokázala zvýšení výskytu nežádoucích účinků [11–13].
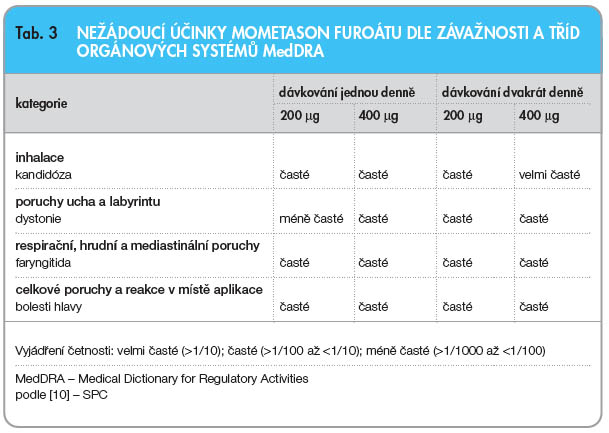 Významné je, že ve všech studiích, které zahrnovaly více než 2800 astmatiků ve věku 12 let a více, byly všechny nežádoucí reakce označeny jako mírné až střední závažnosti. Dle klinických studií kontrolovaných placebem byla jako velmi častý nežádoucí účinek uváděna orální kandidóza při dávce 400 µg 2krát denně (více než 10 % pacientů). Ostatní nežádoucí účinky ve vztahu k účinné léčbě se u nemocných vyskytovaly s četností 1–10 %, byla uváděna zejména dysfonie, faryngitida a bolesti hlavy, viz tab. 3) [10]. Orální kandidóza byla četnější zejména u pacientů léčených současně perorálními KS a souběžně MF v dávce 400 µg 2krát denně po dobu 12 týdnů. U této podskupiny pacientů se orální kandidóza objevila ve 20 % a dysfonie v 7 % případů [7].
Významné je, že ve všech studiích, které zahrnovaly více než 2800 astmatiků ve věku 12 let a více, byly všechny nežádoucí reakce označeny jako mírné až střední závažnosti. Dle klinických studií kontrolovaných placebem byla jako velmi častý nežádoucí účinek uváděna orální kandidóza při dávce 400 µg 2krát denně (více než 10 % pacientů). Ostatní nežádoucí účinky ve vztahu k účinné léčbě se u nemocných vyskytovaly s četností 1–10 %, byla uváděna zejména dysfonie, faryngitida a bolesti hlavy, viz tab. 3) [10]. Orální kandidóza byla četnější zejména u pacientů léčených současně perorálními KS a souběžně MF v dávce 400 µg 2krát denně po dobu 12 týdnů. U této podskupiny pacientů se orální kandidóza objevila ve 20 % a dysfonie v 7 % případů [7].
Ve skupině mladistvých či pacientů starších 65 let nebylo dokumentováno vyšší riziko nežádoucích účinků.
Stejně jako léčba jinými KS, může i podávání MF vyvolat hypersenzitivní reakce. V průběhu postmarketingového sledování byly hlášeny hypersenzitivní reakce typu svědění, urtikarie, angioedému a anafylaktické reakce. Taktéž bylo uvedeno zhoršení astmatu s projevy kašle, sípání a dyspnoe [10].
Zvýšenou opatrnost při užití MF (tak jako u jiných IKS) je třeba věnovat nemocným s tuberkulózou respiračního traktu v aktivním i klidovém stadiu, s neléčenou mykotickou či systémovou virovou infekcí [7, 10].
Lékové interakce
Při inhalačním podávání MF je dosaženo jen nízkých plazmatických hladin, a proto klinicky významné lékové interakce nejsou pravděpodobné. Potenciálně může dojít ke zvýšení systémové expozice MF při současné léčbě silnými inhibitory CYP3A4, jako jsou zejména ketokonazol, itrakonazol, ritonavir a nelfinavir [10].
Těhotenství a laktace
U těhotných žen neexistují adekvátní studie s užitím inhalačního MF. Obecně je léčba inhalačními KS v průběhu gravidity astmatiček doporučována, pokud očekávaný léčebný efekt převýší potenciální riziko pro matku, plod nebo novorozence. Novorozenci matek, které jsou v průběhu gravidity léčeny KS jak perorálními, tak inhalačními, by měli být sledování (vyloučení hypoadrenalismu).
V retrospektivních sledováních nebyl u gravidních pacientek prokázán teratogenní či jiný závažný nežádoucí účinek inhalačních KS. V USA je dle úřadu FDA (Food and Drug Administration) budesonid zařazen do skupiny B, MF a flutikason propionát do skupiny C [2]. Toto zařazení podléhá určitému historickému vývoji.
KS jsou vylučovány do mléka kojících žen. Bylo prokázáno, že MF se vylučuje do mléka potkanů v nízkých dávkách [10]. V současné době není známo, zda se MF vylučuje do mléka žen, ale lze to přepokládat.
Ovlivnění pozornosti
Při léčbě inhalačním MF nebylo prokázáno snížení schopnosti řídit nebo obsluhovat stroje.
Dávkování
Doporučené dávkování závisí na tíži astmatu.
U pacientů s perzistujícím lehkým až středně těžkým astmatem je doporučená denní dávka 400 µg jednou denně. Některá klinická data naznačují, že lepší kontroly nad astmatem je dosaženo, pokud je dávka aplikována ve večerní době či rozděleně ve dvou denních dávkách, tj. 200 µg 2krát denně. Po dosažení kontroly nad chorobou by ošetřující lékař měl snížit podávání IKS na nejnižší dávku, která bezpečně udrží chorobu pod kontrolou. U pacientů s lehkou tíží astmatu může být dávka jednou denně večer postačující k udržení kontroly nad chorobou [23].
Pacienti s těžkým perzistujícím astmatem zahajují léčbu dávkou 400 µg dvakrát denně, což je současně maximální doporučovaná dávka. Když jsou symptomy pod kontrolou, titruje se podané množství MF směrem k nejnižší účinné dávce. Pacienti s těžkým perzistujícím astmatem, u nichž již byla zahájena léčba perorálními KS, začínají MF užívat současně s obvyklými udržovacími dávkami systémového KS. V průběhu ukončování léčby perorálními KS je třeba pacienty pečlivě monitorovat z hlediska nestabilního astmatu a sledovat známky nedostatečnosti funkce nadledvin [7, 10].
U pacientů s těžkým perzistujícím astmatem, kteří jsou léčeni udržovací dávkou perorálních KS, je nezbytné začít inhalovat MF 200 (až 400) µg souběžně s touto léčbou. Dávku systémových KS lze snižovat nejdříve až po týdnu souběžné léčby za pečlivého monitorování příznaků astmatu a možných známek nedostatečnosti funkce nadledvin. Obecně platí, že snížení dávky perorálních KS by nemělo být rychlejší než snížení o 2,5 mg prednisonu (nebo jeho ekvivalentu) denně [16].
Tak jako je tomu při léčbě jinými inhalačními KS, musí být i v případě MF astmatický pacient poučen, že lék není určen k užívání dle potřeby, tedy k úlevě od příznaků dušnosti. Jedná se o udržovací protizánětlivou léčbu s pravidelnou dlouhodobou inhalací i v bezpříznakovém období.
Jednorázové či krátké předávkování lékem vzhledem k jeho nízké biologické dostupnosti nevyžaduje zvláštní terapeutický přístup. Při pravidelné inhalaci MF ve vyšších než doporučených dávkách je nezbytné sledovat funkci nadledvin k vyloučení suprese osy hypothalamus-hypofýza-nadledviny. Prolongované klinické studie však nepřinesly žádné důkazy o supresi této osy při terapii MF v denních dávkách vyšších než 800 µg.
Technika inhalace
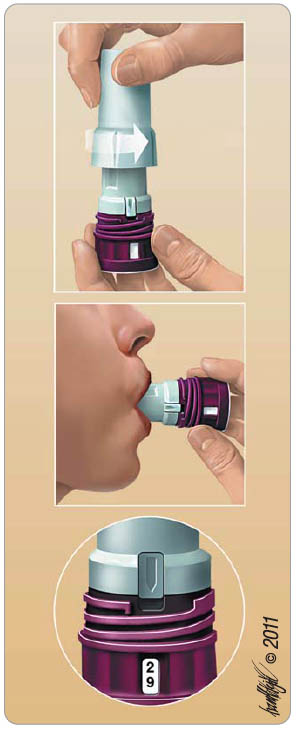 Pro dostatečnou účinnost léčby je nezbytné, aby byl každý astmatik poučen o správné inhalační technice (obr. 2).
Pro dostatečnou účinnost léčby je nezbytné, aby byl každý astmatik poučen o správné inhalační technice (obr. 2).
Při inhalaci přípravku musí být pacient ve vzpřímené poloze. Výhodou inhalačního systému je jednoduchá obsluha s počítáním dávek léku v inhalátoru. Ve svislé poloze je inhalátor otevřen sejmutím bílého krytu. Otočením krytu proti směru hodinových ručiček počitadlo inhalátoru zaregistruje otáčku a posune se o jedno číslo dolů. Pacient vloží inhalátor do úst, sevře rty kolem náustku a provede rychlý a hluboký nádech. Poté inhalátor z úst vyjme a zadrží na 10 sekund (nebo na dobu pro něj únosnou) dech. V žádném případě by nemělo dojít k vydechování vzduchu přes inhalátor. Inhalátor se bezprostředně po každé inhalaci opět uzavře nasazením krytu při držení ve svislé poloze. Při uzávěru krytu jeho pootočením ve směru hodinových ručiček je třeba kryt současně lehce stlačovat a otáčet jím tak dlouho, než se ozve klapnutí. Teprve pak je inhalátor zcela uzavřen. V této poloze se šipka na krytu zcela kryje s okénkem počitadla. Po ukončené inhalaci se doporučuje vypláchnout ústa a vyplivnout vodu pro snížení rizika orální kandidózy.
Inhalátor s dávkou 200 µg nebo 400 µg MF obsahuje 30 nebo 60 dávek. Výhodou léku je, že po podání poslední dávky z inhalátoru se na počitadle ukáže znak v podobě dvou nul (00) a kryt se uzamkne, takže jím nelze otáčet. Po celou dobu užívání je nutné udržovat inhalátor trvale v čistotě a suchu. Okolí náustku lze čistit měkkým materiálem; inhalátor není vhodné mýt [10].
Stabilita
Vícedávkový inhalátor by měl být uchováván při teplotě do 30 °C, chráněn před mrazem. Doba jeho použitelnosti by měla být do 3 měsíců po jeho otevření, jinak je doba použitelnosti uváděna 2 roky [10].
Seznam použité literatury
- [1] Masoli M, Fabian D, Holt S, Beasley R. The global burden of asthma: executive summary of the GINA Dissemination Committee report. Allergy 2004; 59: 469–478.
- [2] Global Initiative for Asthma (GINA) Workshop Report – Revised 2009; www.ginasthma.org (10. 6. 2011)
- [3] Urbach V, Verriere V, Grumbach Y, et al. Rapid anti-secretory effects of glucocorticosteroids in human airway epithelium. Steroids 2006; 71: 323–328.
- [4] Salter M, Biggadike K, Matthews JL, et al. Pharmacological properties of the enhanced-affinity glucocorticoid fluticasone furoate in vitro and in an in vivo model of respiratory inflammatory disease. Am J Physiol Lung Cell Mol Physiol 2007; 293: L660–667.
- [5] Högger P. Current concepts for optimizing the therapeutic index of glucocorticoid receptor ligands for oral and inhalative use: basic consideration and clinical reality. Curr Med Chem Anti-Inflamm Anti-Allergy Agents 2003; 2: 395–408.
- [6] Atsuta J, Plitt J, Bochner BS, Schleimer RP. Inhibition of VCAM-1 expression in human bronchial epithelial cells by glucocorticoids. Am J Respir Cell Mol Biol 1999; 20: 643–650.
- [7] Bousquet J. Mometason furoate: an effective anti-inflammatory with well-defined safety and tolerability profile in the treatment of asthma. Int J Clin Pract 2009; 63: 806–819.
- [8] Crocker IC, Church MK, Newton S, Townley RG. Glucocorticoids inhibit proliferation and interleukin-4 and interleukin-5 secretion by aeroallergen-specific T-helper type 2 cells lines. Ann Allergy Asthma Immunol 1998; 80: 509–516.
- [9] Inman MD,Watson RM, Rerecich T, et al. Dose-dependent effects of inhaled mometason furoate on airway function and inflammation after allergen inhalation challenge. Am J Respir Crit Care Med 2001; 164: 569–574.
- [10] Asmanex Twisthaler 200 and 400 mg (mometasone furoate inhalation powder); UK prescribing information, Summary of Product Characteristics (SPC). http://www.medicines.org.uk/emc/ (10. 6. 2011).
- [11] Bensch GW, Prenner B, Berkowitz R, Galant S, et al. Once-daily evening administration of mometasone furoate in asthma treatment initiation. Ann Allergy Asthma Immunol 2006; 96: 533–540.
- [12] Kemp JP, Berkowitz RB, Miller SD, et al. Mometasone furoate administered once daily is as effective as twice-daily administration for treatment of mild-to-moderate persistent asthma. J Allergy Clin Immunol 2000; 106: 485–492.
- [13] Nayak AS, Banov C, Corren J, et al. Once-daily mometasone furoate dry powder inhaler in the treatment of patients with persistent asthma. Ann Allergy Asthma Immunol 2000; 84: 417–424.
- [14] Noonan M, Karpel JP, Bensch GW, et al. Comparison of once-daily to twice-daily treatment with mometasone furoate dry powder inhaler. Ann Allergy Asthma Immunol 2001; 86: 36–43.
- [15] Karpel JP, Busse WW, Noonan MJ, et al. Effects of mometasone furoate given once daily in the evening on lung function and symptom control in persistent asthma. Ann Pharmacother 2005; 39: 1977–1983.
- [16] D’Urzo A, Karpel JP, Busse WW, et al. Efficacy and safety of mometasone furoate administered once-daily in the evening in patients with persistent asthma dependent on inhaled corticosteroids. Curr Med Res Opin 2005; 21: 1281–1289.
- [17] Fish JE, Karpel JP, Craig TJ, et al. Inhaled mometasone furoate reduces oral prednisone requirements while improving respiratory function and health-related quality of life in patients with severe persistent asthma. J Allergy Clin Immunol 2000; 106: 852–860.
- [18] Nathan RA, Nayak AS, Graft DF, et al. Mometasone furoate-efficacy and safety in moderate asthma compared with beclomethasone dipropionate. Ann Allergy Asthma Immunol 2001; 86: 203–210.
- [19] Wardlaw A, Larivee P, Eller J, et al. Efficacy and safety of mometasone furoate dry powder inhaler vs fluticasone propionate metered-dose inhaler in asthma subjects previously using fluticasone propionate. Ann Allergy Asthma Immunol 2004; 93: 49–55.
- [20] Corren J, Berkowitz R, Murray JJ, Prener B, Comparison of once-daily mometasone furoate versus once-daily budesonide in patients with moderate persistent asthma. Int J Clin Pract 2003; 57: 567–572.
- [21] Bernstein DI, Berkowitz RB, Chervinsky P, et al. Dose-ranging study of a new steroid for asthma: mometasone furoate dry power inhaler. Respir Med 1999; 603–612.
- [22] Bousquet J, D’Urzo A, Hebert J, et al. Comparison of the efficacy and safety of mometasone furoate dry powder inhaler to budesonide Turbuhaler. Eur Respir J 2000; 16: 808–816.
- [23] Karpel JP, Busse WW, Noonan MJ, et al. Effects of mometasone furoate given once daily in the evening on lung function and symptom control in persistent asthma. Ann Pharmacother 2005; 39: 1977–1983.