Obinutuzumab
Souhrn:
Obinutuzumab je nejnovější schválenou monoklonální protilátkou pro léčbu pacientů s chronickou lymfocytární leukemií, která je nejčastěji se vyskytujícím typem leukemie v západní populaci. Jedná se o humanizovanou monoklonální protilátku anti CD20 II. typu, podtřídy IgG1 cíleně změněnou glykosylací v oblasti Fc fragmentu, což výrazně zvyšuje její buněčně zprostředkovanou cytotoxicitu závislou na protilátce. Tato protilátka zároveň působí jako potentnější induktor přímé buněčné smrti (ve srovnání s protilátkami I. typu, jako je rituximab), a to i v přítomnosti antiapoptických signálů, např. Bcl 2. Zavedení obinutuzumabu do klinické praxe znamená výrazné zlepšení celkového přežívání zejména starších, komorbidních pacientů, pro něž by byla nevhodná léčba na bázi fludarabinu. Účinnost obinutuzumabu v kombinaci s chlorambucilem byla demonstrována klíčovou mezinárodní multicentrickou, otevřenou, randomizovanou studií fáze III BO2104/CLL11, jež potvrdila výrazné prodloužení jak doby přežití bez progrese onemocnění, tak celkového přežití. Toto zlepšení bylo signifikantní v porovnání se standardní léčbou starších komorbidních pacientů chlorambucilem v monoterapii či v kombinaci s rituximabem, a to za cenu přijatelné toxicity. Kombinace obinutuzumabu s chlorambucilem dnes představuje léčbu volby pro starší komorbidní pacienty, kteří dosud nebyli léčeni. Zároveň probíhají další klinické studie, jež by měly ujasnit možnou roli obinutuzumabu v léčbě B non-hodgkinských lymfomů.
Key words:
obinutuzumab – monoclonal antibody antiCD20 – glycoengineered – treatment – chronic lymphocytic leukemia-B non-Hodgkin lymphomas.
Summary:
Obinutuzumab represents the newest monoclonal antibody approved for the treatment of patients suffering from chronic lymphocytic leukemia, which is the most common leukemia in the Western population. Obinutuzumab is a humanized monoclonal antibody anti-CD20 type II, IgG1 subgroup, which has been glycoengineered in the Fc fragment area, leading to great enhancement of the antibody dependent cytotoxicity. It is also a more potent inductor of the direct cell death (compared to type I monoclonal antibodies, e.g. rituximab), even in the presence of anti apoptotic signals, such as Bcl 2. The implementation of obinutuzumab into clinical practice leads to significant improvement of patients’ survival, especially of the elderly ones with multiple comorbidities, who are unsuitable for a fludarabine based regimens. The efficacy of obinutuzumab in the combination with chlorambucil was demonstrated in the key international multicentric open randomized phase 3 trial BO2104/CLL11, which confirmed a significant prolongation of progression free survival as well as of overall survival. Therefore, this treatment combination now represents the treatment of choice for the first line therapy of elderly patients with comorbidities. Moreover, many clinical trials are now trying to help define the role of obinutuzumab in the treatment of B non Hodgkin lymphoproliferative diseases.
Úvod
Chronická lymfocytární leukemie představuje nejčastější leukemii v dospělosti [1], incidence v České republice se pohybuje okolo 6/100 000/rok. Jedná se o onemocnění starších pacientů, s mediánem věku 70 let při stanovení diagnózy [2]. V poslední dekádě došlo díky zavedení kombinované imunochemoterapie k výraznému prodloužení přežívání pacientů s tímto onemocněním, zejména v populaci mladších nemocných, tzv. go‑go pacientů, kteří ještě mají lepší zdravotní kondici a jsou schopni léčby fludarabinovým režimem. U těchto pacientů se dnes medián celkového přežití (overall survival, OS) pohybuje kolem deseti let [3].
Problematickou však zůstávala zejména léčba starších, komorbidních pacientů [4,5]. K léčbě těchto tzv. slow‑go pacientů byla recentně schválena nová monoklonální protilátka anti‑CD20 – obinutuzumab. Tato monoklonální protilátka představuje díky své struktuře pozměněné glykosylací potentnější induktor přímé buněčné smrti a cytotoxicity závislé na protilátce ve srovnání s rituximabem, a to bez zásadního zvýšení toxicity [6,7].
Obinutuzumab je nyní schválen jako lék první linie v kombinaci s chlorambucilem u komorbidních pacientů s chronickou lymfocytární leukemií a probíhají klinické studie, jež by měly ujasnit jeho postavení v léčbě non‑hodgkinských lymfomů.
Obinutuzumab je řazen do farmakoterapeutické skupiny Cytostatika, monoklonální protilátky, ATC kód L01XC15. Léčivý přípravek slouží k intravenóznímu podání. Koncentrát pro infuzní roztok je čirá bezbarvá či lehce nahnědlá tekutina s obsahem 1 000 mg obinutuzumabu ve 40 ml roztoku.
Farmakodynamika – mechanismus účinku
Obinutuzumab je humanizovaná protilátka anti‑CD20 podtřídy IgG1 o molekulové hmotnosti 146 kDa. Byla získána humanizací a cílenou glykosylací (glycoengineered) Fc fragmentu původní myší protilátky typu IgG1‑κBly1, jež je produkována technologií rekombinace DNA na buněčných liniích ovaria čínského křečka [6]. Tyto linie se vyznačují zvýšenou expresí glykosylačních enzymů, což způsobuje snížení fukosylace uhlovodíkových zbytků připojených k Asn‑297 Fc fragmentu protilátky. Nefukosylovaný Fc fragment poté vede k vytvoření silně![Obr. 1 Mechanismus účinku obinutuzumabu a porovnání působení protilátky typu I a typu II; podle [8] – Mössner, et al., 2010. Protilátka typu II (obinutuzumab) má oproti protilátce typu I (rituximab, ofatumumab) glykosylovaný Fc fragment a odlišnou 3D vazbu k CD20. V důsledku těchto rozdílů se liší i v cytotoxickém působení.](https://www.remedia.cz/photo-a-30504---.jpg) jší vazby FcγRIII na efektorových buňkách, např. na NK‑buňkách (natural killer cells, tzv. přirození zabíječi) či na makrofázích, a to způsobuje až stonásobný vzestup účinnosti prostřednictvím tzv. buněčně zprostředkované cytotoxicity závislé na protilátce (antibody dependent cell‑mediated cytotoxicity, ADCC) v porovnání s rituximabem [7] Obinutuzumab je zároveň také účinnější v indukci přímé buněčné smrti, a to jak cestou apoptózy nezávislé na kaspáze, tak na aktinu závislé buněčné smrti zprostředkované lysozomy [8].
jší vazby FcγRIII na efektorových buňkách, např. na NK‑buňkách (natural killer cells, tzv. přirození zabíječi) či na makrofázích, a to způsobuje až stonásobný vzestup účinnosti prostřednictvím tzv. buněčně zprostředkované cytotoxicity závislé na protilátce (antibody dependent cell‑mediated cytotoxicity, ADCC) v porovnání s rituximabem [7] Obinutuzumab je zároveň také účinnější v indukci přímé buněčné smrti, a to jak cestou apoptózy nezávislé na kaspáze, tak na aktinu závislé buněčné smrti zprostředkované lysozomy [8].
Na rozdíl od protilátek I. typu (rituximab, ofatumumab) není obinutuzumab tak silným induktorem cytotoxicity závislé na komplementu, což je dáno jeho slabší vazbou na C1q. Buněčně zprostředkovaná cytotoxicita závislá na protilátce, která je vyvolána glykosylovanými protilátkami, je navíc oproti non‑glykosylovaným protilátkám méně inhibována aktivací komplementu (obr. 1). To za fyziologických podmínek dále akcentuje její účinnost a společně s přímou buněčnou smrtí vysvětluje vyšší účinnost ve srovnání s protilátkami I. typu [9]. V rámci klinického hodnocení vyvolal obinutuzumab ve srovnání s rituximabem výraznější depleci lymfocytů CD20+ v periferní krvi jak u zdravých dobrovolníků, tak u pacientů s chronickou lymfocytární leukemií či s indolentními lymfomy [10,11].
Farmakokinetika
K hodnocení farmakokinetiky přípravku byly použity údaje více než 650 pacientů s chronickou lymfocytární leukemií či s B‑non‑hodgkinským lymfomem z klinických studií fáze I, II a III [10–13].
Absorpce
Obinutuzumab je podáván intravenózně, hodnocení absorpce tedy není relevantní a jiné způsoby podávání nebyly dosud posuzovány. Dle studie GAUGUIN fáze I/II u pacientů s folikulárním lymfomem refrakterních na léčbu nebo u pacientů s relapsem onemocnění stoupá průměrná maximální plazmatická koncentrace (cmax) se zvyšující se dávkou lineárně, ustáleného stavu (steady state) bylo dosaženo v průměru ve druhém cyklu léčby obinutuzumabem dávkou 1 000 mg/den podávanou v den 1, 8 a 15, tj. v průměru při čtvrté dávce [12]. Na základě výsledků populačních studií se odhaduje hodnota mediánu cmax, jíž je dosaženo po podání první dávky v šestém cyklu, na 473,2 µg/ml a hodnota plochy pod křivkou plazmatické koncentrace AUC(τ) na 9 516 µg.d/ml.
Distribuce
Geometrický průměr distribučního objemu po intravenózním podání činí zhruba 3,9 l, což odpovídá převážně intravaskulární distribuci.
Během podávání čtvrté dávky obinutuzumabu byl pozorován statisticky významný rozdíl mezi muži a ženami, a to jak v čase nutném k dosažení cmax, tak i v její hodnotě. Příčina není zjevná, nicméně nemá praktický dopad – není nutné upravovat dávku na základě pohlaví pacienta. V některých studiích bylo také vypozorováno, že hodnoty cmax byly vyšší u pacientů, kteří dosáhli léčebné odpovědi. U non‑respondérů byly také pozorovány vyšší rozdíly mezi cmax a údolními koncentracemi (tzv. trough), což je vysvětlováno pravděpodobně rychlejším odbouráváním obinutuzumabu v této skupině pacientů [9].
Biotransformace
Nebyly provedeny žádné studie se zaměřením na metabolismus obinutuzumabu.
Eliminace
Clearance obinutuzumabu v šestém cyklu léčby se pohybuje kolem 0,083 l/den s mediánem biologického poločasu eliminace (t1/2) v rozmezí 303–567 hodin. Existují dvě paralelní metabolické cesty – lineární a non‑lineární metabolická cesta clearance měnící se v čase. Při zahájení léčby převažuje non‑lineární cesta, jež se mění s časem, při pokračování terapie začíná dominovat lineární cesta, což je dáno tzv. dispozicí léku dle cíle (target‑mediated drug disposition, TMDD), kdy zpočátku při vysoké nabídce buněk CD20+ dochází k rychlému navázání obinutuzumabu a později s měnícím se počtem cílových buněk se kinetika upravuje.
Vyšší věk a mírná až střední renální insuficience významně neovlivňují farmakokinetické parametry obinutuzumabu. Nejsou však k dispozici údaje týkající se pacientů se závažným poškozením funkce ledvin (clearance kreatininu < 30 ml/min) či pacientů s významnou hepatální insuficiencí. Rovněž nejsou k dispozici data pediatrických pacientů.
Klinické zkušenosti
Klinické studie fáze I/II
Účinnost obinutuzumabu byla poprvé zásadněji demonstrována výsledky studie GAUGUIN fáze I/II u pacientů s relabující/refrakterní chronickou lymfocytární leukemií. Jednalo se o 20 výrazně předléčených pacientů (medián absolvovaných linií léčby byl 3, z toho 91 % pacientů již absolvovalo fludarabinový režim) bez významnějších komorbidit, s mediánem věku 63 let. Léčbou obinutuzumabem bylo dosaženo celkové odpovědi (overall response rate, ORR) u více než 60 % pacientů, kompletních remisí dosaženo nebylo, PFS byla 10,7 měsíce [14].
Studie fáze III
Pro zavedení obinutuzumabu do klinické praxe hrála klíčovou roli studie CLL11 [15] – otevřená multicentrická, randomizovaná studie fáze III, která byla primárně organizována německou výzkumnou skupinou GCLLSG (German Chronic Lymphocytic Leukemia Study Group) a probíhala od dubna 2010 do července 2013 ve 189 centrech 26 zemí světa. Do této studie bylo zahrnuto celkem 781 dosud neléčených pacientů s chronickou lymfocytární leukemií se zásadními komorbiditami (cumullative illness rating score, CIRS ≥ 7, a/nebo s clearance kreatininu < 70 ml/min), tedy pacienti vyžadující léčbu, avšak nevhodní pro fludarabinový režim.
Tito pacienti byli randomizováni v poměru 1 : 2 : 2 k monoterapii chlorambucilem (0,5 mg/kg 1. a 15. den po dobu nejvýše šesti cyklů), k léčbě kombinací chlorambucil + rituximab (R‑CLB, 375 mg/m2 i.v. 1. den 1. cyklu, 500 mg/m2 1. den 2.–6. cyklu) a nebo k léčbě kombinací chlorambucil + obinutuzumab (G‑CLB, 100 mg i.v. 1. den, 900 mg i.v. 2. den, 1 000 mg i.v. 8. a 15. den 1. cyklu, 1 000 mg i.v. 1. den 2.–6. cyklu).![Graf 1a, b Výsledky studie CLL11; podle [15] – Goede, et al., 2014. CI – interval spolehlivosti, confi dence interval; CLB – chlorambucil; HR – poměr rizik, hazard ratio; G-CLB – obinutuzumab + chlorambucil; PFS – doba bez progrese onemocnění, progression free survival; R-CLB – rituximab + chlorambucil](https://www.remedia.cz/photo-a-30505---.jpg)
Pacientům, u nichž došlo během monoterapie chlorambucilem či do šesti měsíců od jejího ukončení k progresi, bylo umožněno zařazení do skupiny G‑CLB.
Oba kombinované režimy byly významně účinnější než monoterapie chlorambucilem, což však bylo již známo z předchozích studií porovnávajících účinnost a toxicitu režimů s chlorambucilem a bez něj a režimů s rituximabem či bez něj. Nicméně ukázala se superiorita kombinace G‑CLB oproti R‑CLB, kdy kombinace s obinutuzumabem přinesla zásadně delší PFS (G‑CLB: 23 měsíců; R‑CLB: 15,7 měsíce; chlorambucil v monoterapii: 10,9 měsíce; p < 0,0001, graf 1a, b) i prodloužení OS (mediánu OS nebylo dosud v žádné skupině dosaženo, nicméně úmrtnost představovala 9 % oproti 20 %; hodno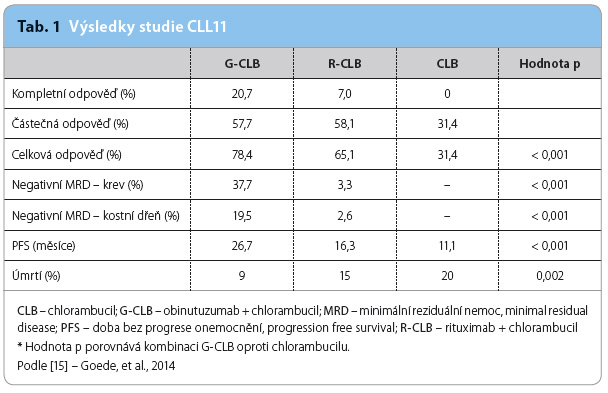 ta p = 0,002 hovoří jasně ve prospěch obinutuzumabu).
ta p = 0,002 hovoří jasně ve prospěch obinutuzumabu).
Oproti rituximabu bylo kombinací s obinutuzumabem častěji dosahováno také kompletních remisí včetně negativity tzv. minimální reziduální choroby (měřeno pomocí polymerázové řetězové reakce), a to za cenu srovnatelné toxicity. Kompletní remise dosáhlo 20,7 % pacientů ve skupině G‑CLB oproti 7,0 % pacientů léčených R‑CLB (p < 0,001); respektive negativita minimální reziduální choroby byla zaznamenána u 37,7 % oproti 3,3 % pacientů (p < 0,001), tab. 1.
Zařazení do současné palety léčiv
Obinutuzumab představuje léčbu první linie pro dosud neléčené pacienty s chronickou lymfocytární leukemií, kteří jsou starší a/nebo jejichž komorbidity znamenají kontraindikaci fludarabinového režimu [17].
Indikace
Na základě těchto výsledků byl obinutuzumab v kombinaci s chlorambucilem schválen jako lék volby první linie u starších pacientů s komorbiditami.
Kontraindikace
Kontraindikací léčby obinutuzumabem je hypersenzitivita na účinnou či pomocnou látku léčivého přípravku či život ohrožující reakce na podání infuze (viz následující odstavec).
Nežádoucí účinky
V klinické praxi, stejně jako bylo popisováno ve studiích GAUGUIN a CLL11, se nejčastěji setkáváme s nežádoucími účinky charakteru reakce související s infuzí (infusion related reaction, IRR).
Reakce související s infuzí
Reakce související s infuzí provází většinu podání první dávky obinutuzumabu. Ve studii GAUGUIN [16], kdy v rámci premedikace bylo podáváno pouze antipyretikum a antihistaminikum, byla tato reakce popsána až u 96 % nemocných, z toho zhruba u 30 % nemocných se jednalo o závažné reakce. Nejčastěji je pozorována hypotenze, tachykardie, zimnice, třesavka, horečka, nauzea či zvracení. Těmto reakcím je však možno s úspěchem předejít, a to dodržením doporučení ohledně dávkování a premedikace při zahajování léčby. Tato doporučení zahrnují: vynechání antihypertenzní medikace či její redukci v den podání první dávky, dostatečnou premedikaci v den 1 zahrnující i kortikosteroidy a rozdělené podání první dávky do dvou dnů s postupným navyšováním rychlosti infuze dle doporučeného dávkovacího schématu. Závažnější reakce je třeba očekávat u pacientů s větší tumorózní masou (např. vysoký počet lymfocytů CD20+, bulky onemocnění) a u polymorbidních nemocných (vyjádřeno např. vyšším skóre CIRS).
Život ohrožující IRR či rekurentní, akcentací podpůrných opatření špatně zvladatelné reakce jsou důvodem k ukončení další léčby obinutuzumabem.
Syndrom nádorového rozpadu
Syndrom nádorového rozpadu (tumor lysis syndrome, TLS) se častěji vyskytuje u pacientů s větší nádorovou masou, zde je nutná adekvátní profylaxe (prehydratace, posthydratace, monitoring iontogramu, renálních funkcí, podávání allopurinolu, případně rasburikázy).
Hypersenzitivní reakce, anafylaxe
Hypersenzitivní reakce jsou poměrně obtížně odlišitelné od IRR, nicméně objevují se jen vzácně při prvním podání přípravku. Hypersenzitivita na obinutuzumab zprostředkovaná IgE představuje absolutní kontraindikaci jeho dalšího podávání.
Myelotoxicita, infekce
V kombinaci s chlorambucilem je zásadním nežádoucím účinkem myelotoxicita; neutropenie i trombocytopenie stupně III–IV byly ve skupině pacientů klinické studie CLL11 léčených kombinací G‑CLB popisovány častěji než u pacientů s chlorambucilem podávaným v monoterapii nebo v kombinaci s rituximabem. Během léčby je nutné sledovat krevní obraz, při nízkých hodnotách je doporučena případná podpora růstovými faktory stimulujícími kolonie granulocytů (G‑CSF) a substituce trombonáplavy. Anemie je většinou stupně I–II, avšak může vést ke zhoršení preexistujících kardiálních onemocnění.
Hlavně u pacientů s delším obdobím neutropenie byly popsány život ohrožující bakteriální, mykotické či virové infekce. Na zvážení je tedy profylaxe pneumocystové pneumonie kombinací sulfomethoxazolu a trimethoprimu, v indikovaných případech i profylaxe antimykotikem.
Reaktivace virů
Vzhledem k hlášeným případům reaktivace viru hepatitidy B vedoucí až k fulminantnímu jaternímu selhání je před zahájením léčby nutný sérologický screening. V případě pozitivity HBsAg či protilátek proti antigenu HBc je vhodná profylaxe dle doporučení hepatologa po celou dobu léčby a po jejím ukončení, než dojde k restituci B‑lymfocytů [18].
Elevace hodnot jaterních testů
Laboratorně dochází poměrně často k elevaci hodnot jaterních transamináz, zejména v návaznosti na první infuzi, jedná se však o laboratorní údaj, bez klinického korelátu.
Zhoršení preexistujícího kardiálního onemocnění
Jednalo se zejména o výskyt arytmií typu fibrilace síní, dekompenzace chronického srdečního selhávání apod. U pacientů se známým kardiálním onemocněním je proto vhodná monitorace zejména při zahajování léčby a prevence tekutinového overloadu.
Progresivní multifokální leukoencefalopatie
Progresivní multifokální leukoencefalopatie (PML) je velmi vzácným, avšak neopomenutelným nežádoucím účinkem, jenž byl popsán u několika pacientů léčených obinutuzumabem. Na možnou PML je nutno myslet v případě rozvoje nových neurologických symptomů – nejčastěji se jedná o postupně se zhoršující nespecifické příznaky postižení pyramidové dráhy, tractus corticospinalis či jiné lokality. V případě suspekce na PML je nutné okamžité přerušení léčby a komplexní neurologické vyšetření včetně magnetické rezonance mozku a lumbální punkce zahrnující specifické vyšetření na přítomnost DNA lidského JC viru.
Reprodukční toxicita
Možný kancerogenní potenciál nebyl v klinických studiích hodnocen. Při opakovaném podávání obinutuzumabu makakům nebyl prokázán toxický účinek na samčí či samičí pohlavní orgány, rovněž nebyla prokázána teratogenita. Obinutuzumab prochází placentární bariérou i do mateřského mléka a následně způsobuje depleci buněk CD20+ u mláďat.
Imunizace
Očkování živými či atenuovanými vakcínami v průběhu léčby se nedoporučuje vzhledem k depleci B‑lymfocytů.
Vzhledem k vysoce pravděpodobnému přestupu obinutuzumabu přes placentární bariéru a do mateřského mléka během laktace se gravidita nedoporučuje do 18 měsíců po ukončení léčby. V opačném případě se předpokládá významná deplece funkčních B‑lymfocytů u těchto dětí, a proto by případná vakcinace měla být provedena až po dokumentované restituci funkčních B‑lymfocytů, což při pokusech s makaky trvalo zhruba šest měsíců od porodu.
Ovlivnění pozornosti
Při podávání obinutuzumabu nebyl pozorován vliv na koncentraci či na schopnost obsluhovat stroje, tedy nejsou doporučena žádná speciální opatření.
Lékové interakce
Obinutuzumab není substrátem, inhibitorem ani induktorem enzymů cytochromu P450 (CYP450), uridin‑difosfát‑glukuronyltransferázy (UGT) ani transportérů, jako je glykoprotein P. Proto se při podání s léčivy, o kterých je známo, že jsou metabolizována těmito enzymatickými systémy, žádné farmakokinetické interakce neočekávají.
Dávkování
S přihlédnutím k výše zmíněným nežádoucím účinkům spojeným zejména s první infuzí obinutuzumabu a s ohledem na možné zhoršení preexistujícího kardiálního onemocnění je nutné podávat tento přípravek pod stálým dohledem zkušeného personálu, s vybavením, jež umožňuje promptní zahájení případné kardiopulmonální resuscitace. Během zahajování léčby je výhodou možnost podání na monitorovaném lůžku.
U pacientů s hrozící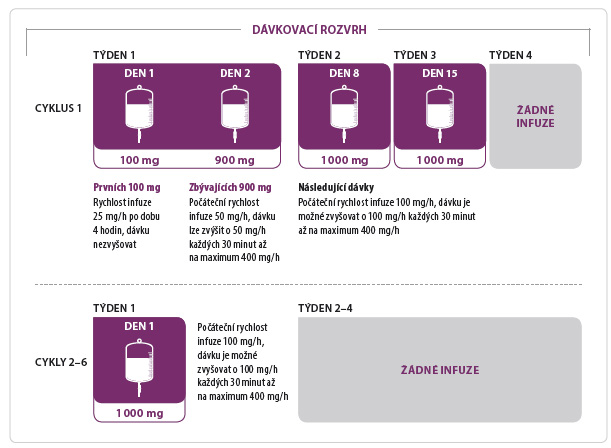 m syndromem nádorového rozpadu je vhodná prehydratace, posthydratace a podávání allopurinolu. Vzhledem ke sklonům k hypotenzi je často nutné redukovat antihypertenzní léčbu. Na základě studií GAUGUIN a CLL11 byla optimální jednotlivá dávka stanovena na 1 000 mg obinutuzumabu, kdy standardní doba podávání představuje šest cyklů v intervalu 28 dní; v prvním cyklu se k dosažení optimální plazmatické koncentrace léčiva podává obinutuzumab v den 1, 8 a 15; v následujících cyklech navazuje podávání pouze v den 1 (obr. 2).
m syndromem nádorového rozpadu je vhodná prehydratace, posthydratace a podávání allopurinolu. Vzhledem ke sklonům k hypotenzi je často nutné redukovat antihypertenzní léčbu. Na základě studií GAUGUIN a CLL11 byla optimální jednotlivá dávka stanovena na 1 000 mg obinutuzumabu, kdy standardní doba podávání představuje šest cyklů v intervalu 28 dní; v prvním cyklu se k dosažení optimální plazmatické koncentrace léčiva podává obinutuzumab v den 1, 8 a 15; v následujících cyklech navazuje podávání pouze v den 1 (obr. 2).
Zahájení léčby
Dávka obinutuzumabu se na začátku prvního cyklu podává rozděleně, první den se aplikuje po adekvátní premedikaci intravenózně podaným kortikosteroidem (minimálně 100 mg prednisonu, 80 mg methylprednisolonu či 20 mg dexamethasonu) minimálně jednu hodinu před podáním a následuje perorální podání acetaminofenu (např. paracetamolu 1 g) a antihistaminika. Poté je zahájeno podávání obinutuzumabu, a to v dávce 100 mg rychlostí 25 mg/h.
Následující den se opět po premedikaci podá zbývajících 900 mg obinutuzumabu úvodní rychlostí 50 mg/h s možností postupného zrychlení infuze – každých 30 minut o 50 mg/h na maximální rychlost 400 mg/h.
Podávání od druhého cyklu
V případě dobré tolerance léčby se po premedikaci podává vždy plná dávka, tj. 1 000 mg obinutuzumabu, a to rychlostí infuze při zahájení 100 mg/h, kterou lze postupně zvýšit na maximální rychlost 400 mg/h [17–21].
Závěr
Kombinace obinutuzumabu s chlorambucilem představuje účinnou možnost léčby starších pacientů s chronickou lymfocytární leukemií a s komorbitami. Toxicita této kombinace je přijatelná. Díky profylaktickým opatřením se setkáváme se závažnými reakcemi spojenými s prvním podáním pouze ojediněle [22].
Možné využití obinutuzumabu v kombinaci s dalšími zavedenými či s novými léky (např. s ibrutinibem, idelalisibem či s venetoclaxem) u pacientů s chronickou lymfocytární leukemií je předmětem řady klinických studií, na jejichž výsledky si zatím musíme počkat.
Postavení obinutuzumabu v léčbě non‑hodgkinských B‑lymfomů zatím není jasně definováno. Prvotní výsledky studie GADOLIN (otevřená multicentrická, randomizovaná studie fáze III pro pacienty s progresí/relapsem indolentního B‑lymfomu refrakterními na léčbu rituximabem), která srovnává účinnost bendamustinu v monoterapii a v kombinaci s obinutuzumabem s následnou udržovací léčbou obinutuzumabem, dokumentují několikanásobně vyšší účinnost kombinace s obinutuzumabem [23]. Z dalších klinických hodnocení nyní probíhajících na našem pracovišti je vhodné zmínit např. studii GALLIUM, jež porovnává účinnost rituximabu v kombinaci se standardní chemoterapií oproti obinutuzumabu v kombinaci s chemoterapií u pacientů s indolentními lymfomy CD20+ [24]. Na základě preliminárních výsledků těchto studií se dá v budoucnu očekávat, že bude schváleno rozšíření indikací podávání obinutuzumabu u lymfoproliferativních onemocnění.
Seznam použité literatury
- [1] Dores GM, Anderson WF, Curtis RE, et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology. Br J Haematol 2007; 139: 809–819.
- [2] Panovska A, Doubek M, Brychtova Y, Mayer J. Chronic lymphocytic leukemia and focusing on epidemiology and management in everyday hematologic practice: recent data from the Czech Leukemia Study Group for Life (CELL). Clin Lymphoma Myeloma Leuk 2010; 10: 297–300
- [3] Bauman T, Delgado J, Santacruz R, et al. Chronic lymphocytic leukemia in elderly: clinico biological features, outcomes, and proposal of a prognostic model. Haematologica 2014: 99: 1599–1604.
- [4] Hallek M, Fischer K, Fingerle Rowson G, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open label phase 3 trial. Lancet 2010; 376: 1164–1174.
- [5] Zenz T, Gribben JG, Hallek M, et al. Risk categories and refractory CLL in the era of chemoimmunotherapy. Blood 2012; 119: 4101–4107.
- [6] Beers SA, Chan Ch, French RR, et al. CD20 as a target for therapeutic type I and II monoclonal antibodies. Semin Hematol 2010; 47: 107–114.
- [7] Golay J, Bologna L, Ferrara C, et al. Glycoengineered CD20 antibody obinutuzumab activates neutrophils and mediates phagocytosis through CD16B more efficiently than rituximab. Blood 2013; 122: 3482–3491.
- [8] Mössner E, Brunker P, Moser S, et al. Increasing the efficacy of CD20 antibody therapy through the engineering of a new type II anti CD20 antibody with enhanced direct and immune effector cell mediated B cell cytotoxicity. Blood 2010; 115: 4393–4402.
- [9] Smolej L. Targeted treatment for chronic lymphocytic leukemia: clinical potential of obinutuzumab. Pharmgenomic Pers Med 2015: 8: 1–7.
- [10] Salles G, Morschhauser F, Lamy T, et al. Phase 1 study results of the type II glycoengineered humanized anti CD20 monoclonal antibody obinutuzumab (GA101) in B cell lymphoma patients. Blood 2012; 119: 5126–5132.
- [11] Shah A. Obinutuzumab: a novel anti CD 20 monoclonal antibody for previously untreated chronic lymphocytic leukemia. Ann Pharmacother 2014; 48: 1356–1361.
- [12] Morschhauser FA, Cartron G, Thieblemont C, et al. Obinutuzumab (GA101) monotherapy in relapsed/refractory diffuse large b cell lymphoma or mantle cell lymphoma: results from the phase II GAUGUIN study. J Clin Oncol 2013; 31: 2912–2919.
- [13] Radford J, Davies A, Cartron G, et al. Obinutuzumab (GA101) plus CHOP or FC in relapsed/refractory follicular lymphoma: results of the GAUDI study (BO21000). Blood 2013; 122: 1137–1143.
- [14] Cartron G, Guibert S, Dilhuydy MS et al. Obinutuzumab (GA101) in relapsed/refracterory chronic lymphocytic leukemiac final data from the phase 1/2 GAUGUIN study. Blood 2014; 124: 2196–2202.
- [15] Goede V, Fischer K, Busch R, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370: 1101–1110.
- [16] Salles GA, Morschhauser F, Solal-Céligny P, et al. Obinutuzumab (GA101) in patients with relapsed/refractory indolent non Hodgkin lymphoma: results from the phase II GAUGUIN study. J Clin Oncol 2013; 31: 2920–2926.
- [17] Hoy SM. Obinutuzumab: a review of its use in patients with chronic lymphocytic leukaemia. Drugs 2015; 75: 285–296.
- [18] Highlights in prescribing information http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/125486s000lbl.pdf
- [19] http://www.gazyva.com/hcp/clinical information/
- [20] Freeman CL, Morschhauser F, Sehn L. Cytokine release in patients with CLL treated with obinutuzumab and possible relationship with infusion related reactions. Blood 2015; 126: 2646–2649.
- [21] Snowden A, Hayden I. Prevention and management of obinutuzumab associated toxicities: Australian experience. Int J Nurs Pract 2015; 21 (Suppl. 3): 15–27.
- [22] Hill BT, Kalaycio M. Profile of obinutuzumab for the treatment of patients with previously untreated chronic lymphocytic leukemia. Onco Targets Ther 2015; 8: 2391–2397.
- [23] https://clinicaltrials.gov/ct2/show/NCT01059630
- [24] https://clinicaltrials.gov/ct2/show/NCT01332968