Oxid dusný
Oxid dusný je bezbarvý, nedráždivý, nasládle chutnající plyn, který je spolu s xenonem jediným anorganickým plynem používaným v anesteziologii. V roce 1772 jej objevil Joseph Priestley. Farmakologické účinky oxidu dusného poprvé popsal Davy okolo roku 1800. V roce 1844 první demonstroval oxid dusný jako anestetikum Wells. Teprve od poloviny 20. století se však zlepšuje technické vybavení jeho podávání v různých oborech medicíny, především ve stomatologii a k tlumení bolesti za porodu. Interakcí s benzodiazepinovými receptory působí oxid dusný anxiolýzu, uvolněním endogenních opioidů vzniká euforie a analgetický účinek. Na tom se podílí i interakce s noradrenergním systémem. Amnestický účinek vzniká teprve v koncentracích vyšších než 50 %. Hypnotický a anestetický účinek oxidu dusného je zprostředkován interakcí s NMDA (N-methyl-D-aspartátové) receptory. Jeho MAC (minimální alveolární koncentrace) je však 104 %. Při několikahodinové aplikaci se vyvíjí akutní tolerance k jednotlivým účinkům oxidu dusného. Kardiorespirační systém podstatně neovlivňuje. Má velmi rychlý nástup i odeznění účinku, protože je velmi málo rozpustný v krvi. V organismu při inhalaci však vytlačuje dusík, který je v krvi ještě 35krát méně rozpustný než oxid dusný, a může proto dojít k expanzi uzavřených tělních dutin. Inhalace oxidu dusného je používána především v ambulantní chirurgii při drobných chirurgických výkonech, jako jsou např. incize abscesu, odstranění stehů, prvotní ošetření ran a pohmožděnin, reparace fraktur, a v přednemocniční fázi k tlumení bolesti. Dlouholetou tradici má používání oxidu dusného ve stomatologii i v porodnictví. Velkou výhodou je, že oxid dusný ve formě premixu 50 % N2O/50 % O2 může podávat i proškolený střední zdravotnický personál. Nežádoucí účinky při koncentracích do 50 % jsou mírné a nezávažné. Oxid dusný patří mezi tzv. skleníkové plyny a jeho subanestetické koncentrace vdechované po delší dobu mohou způsobit zdravotní komplikace, a proto je třeba dodržet všechny hygienické předpisy související s jeho aplikací.
Farmakologická skupina
Oxid dusný je anorganický plyn používaný k navození sedace a analgezie ve směsi s O2 (50 % N2O/50 % O2) a jako analgetická hypnotická komponenta v celkové anestezii. ATC kód je N01AX63.
Chemické a fyzikální vlastnosti
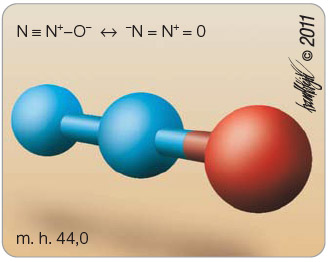 Oxid dusný (obr. 1) je nedráždivý plyn, který chutná nasládle, a je to spolu s xenonem jediný anorganický plyn používaný v anesteziologii. Molekulární hmotnost je 44, poměrná hustota je 1,53 (vzduch = 1). Bod varu je -89 °C, koeficient rozpustnosti krev-plyn je 0,47. Je připravován tepelným rozkladem dusičnanu amonného.
Oxid dusný (obr. 1) je nedráždivý plyn, který chutná nasládle, a je to spolu s xenonem jediný anorganický plyn používaný v anesteziologii. Molekulární hmotnost je 44, poměrná hustota je 1,53 (vzduch = 1). Bod varu je -89 °C, koeficient rozpustnosti krev-plyn je 0,47. Je připravován tepelným rozkladem dusičnanu amonného.
Mechanismus účinku, farmakodynamika
CNS
Na rozdíl od jiných inhalačních anestetik má oxid dusný minimální účinek na EEG a bispektrální index. Někteří autoři však uvádějí slabou aktivaci EEG a následné zvýšení bispektrálního indexu.
Oxid dusný i ve vysokých koncentracích může být použit k výzkumu evokovaných potenciálů nebo k elektromyografickému monitorování kraniálních nervů. Oxid dusný působí zvýšení průtoku krve mozkem a neovlivňuje nebo jen mírně zvyšuje objem krve v mozku [1]. Neurologické projevy po chronické expozici oxidu dusnému byly popsány poprvé v roce 1978 u zubních lékařů a následně pak při jeho rekreačním používání. Známky chronického účinku se projevují otupením, poklesem aktivity hlubokých šlachových reflexů, pocity elektrických výbojů v těle, kognitivní dysfunkcí s histologickými změnami, které se projevují zduřením mitochondrií a apoptózou. Literatura obsahuje protichůdné zprávy o vlivu oxidu dusného na zdravé neurony a glie. Oxid dusný zvyšuje metabolismus mozkové tkáně a může tak působit negativně při exacerbaci ischemického poranění. Na druhé straně je však oxid dusný antagonistou NMDA (N-methyl-D-aspartátových) receptorů. Při mozkové ischemii se zvyšuje uvolňování excitačního neurotransmiteru glutamátu. Oxid dusný může antagonizováním NMDA receptorů snížit uvolňování glutamátu a tím působit příznivě při ischemické příhodě mozkové.
Moore (1983) [2] zjistil, že oxid dusný již v koncentracích 10 % a 20 % výrazně ovlivňuje psychomotorické funkce. Inhalace 50% koncentrace oxidu dusného může tedy významně snížit schopnost řízení auta. Ale již po 30 minutách po ukončení inhalační aplikace je psychomotorický výkon plně obnoven [3].
Anxiolytický účinek
O![Obr. 2 Anxiolytický účinek oxidu dusného pravděpodobně vzniká jeho interakcí s benzodiazepinovými vazebnými místy v GABAergním komplexu; podle [17] – Emmanouil, Quock, 2007.](https://www.remedia.cz/photo-a-28597---.jpg) xid dusný působí změny v chování, které upomínají na účinky benzodiazepinů v různých zvířecích modelech experimentální anxiety. Kromě toho benzodiazepiny navozené anxiolytické účinky a anxiolytické účinky navozené oxidem dusným jsou antagonizovatelné specifickým antagonistou benzodiazepinů flumazenilem [4]. Anxiolytický účinek oxidu dusného je tedy spojen v CNS s benzodiazepinovými mechanismy (obr. 2). Je možné, že oxid dusný může indukovat uvolnění endogenních benzodiazepinů, které pak stimulují benzodiazepinová vazebná místa v GABAergním komplexu.
xid dusný působí změny v chování, které upomínají na účinky benzodiazepinů v různých zvířecích modelech experimentální anxiety. Kromě toho benzodiazepiny navozené anxiolytické účinky a anxiolytické účinky navozené oxidem dusným jsou antagonizovatelné specifickým antagonistou benzodiazepinů flumazenilem [4]. Anxiolytický účinek oxidu dusného je tedy spojen v CNS s benzodiazepinovými mechanismy (obr. 2). Je možné, že oxid dusný může indukovat uvolnění endogenních benzodiazepinů, které pak stimulují benzodiazepinová vazebná místa v GABAergním komplexu.
Euforizujících a psychicky relaxujících účinků oxidu dusného se využívalo na „party s rajským plynem“ již od začátku 19. století ještě před poznáním jeho analgetických účinků. Oxid dusný také aktivuje mezokortikální dopaminergní systém a tím vzniká jeho euforizující účinek.
Amnestický účinek
Údaje o amnestickém účinku při inhalační sedaci oxidem dusným se různí. Někteří udávají pravidelný výskyt anterográdní amnézie, jiní ji naopak popírají [5, 6], Mathers v roce 2011 [7] však udává, že inhalace zpravidla není doprovázena výskytem amnézie. Domníváme se, že teprve koncentrace oxidu dusného vyšší než 50 % vedou k parciálnímu amnestickému účinku. Ten je zprostředkován interakcí oxidu dusného s NMDA receptory.
Analgetický účinek
Uprostřed 70. let 20. století bylo poprvé publikováno, že oxidem dusným indukovaný antinociceptivní účinek u myší a potkanů je možno antagonizovat specifickým antagonistou naloxonem [8]. Také u lidí byl posléze prokázán stejný účinek naloxonu na analgezii po podání oxidu dusného [9]. V dalších studiích bylo prokázáno, že důležitou úlohu mají opioidní receptory v periakveduktální šedi. Jestliže byla tato oblast odstraněna nebo byla injikována mikroinjekcí opioidního antagonisty, vymizel i oxidem dusným indukovaný analgetický účinek. V pokusech na myších bylo prokázáno, že důležitý vliv mají nejen µ-opioidní receptory, ale i kappa-opioidní receptory, a to jak na supraspinální, tak na spinální úrovni [10].
![Obr. 3 Molekulární mechanismy, kterými oxid dusný navozuje analgezii. Oxid dusný stimuluje uvolnění endogenních opioidních peptidů, na tomto ději se podílí patrně i oxid dusnatý; podle [17] – Emmanouil, Quock, 2007.](https://www.remedia.cz/photo-a-28598---.jpg) Spojení s opioidy bylo dále posíleno zjištěním, že zvířata tolerantní na morfin mají zkříženou toleranci na oxid dusný. Stimulací opioidních receptorů oxidem dusným dochází k uvolnění endogenních opioidních peptidů – endorfinů i enkefalinů. Vdechování oxidu dusného v 75% koncentraci po dobu 60 minut zvýšilo u potkana dvojnásobně hladinu methionin-enkefalinu v perfuzátu z mozkových komor [11]. Na uvolnění endogenních opioidů účinkem oxidu dusného se podílí i důležitý endogenní biologický regulátor – oxid dusnatý (NO), viz obr. 3. Uvolnění endogenních opioidních peptidů aktivuje descendentní dráhy, které modulují nociceptivní podněty v míše. Nejdůležitější součástí těchto drah jsou noradrenergní dráhy, které jsou pod vlivem tonické inhibice GABAergních drah v pontu. Stimulace opioidních receptorů opioidními
Spojení s opioidy bylo dále posíleno zjištěním, že zvířata tolerantní na morfin mají zkříženou toleranci na oxid dusný. Stimulací opioidních receptorů oxidem dusným dochází k uvolnění endogenních opioidních peptidů – endorfinů i enkefalinů. Vdechování oxidu dusného v 75% koncentraci po dobu 60 minut zvýšilo u potkana dvojnásobně hladinu methionin-enkefalinu v perfuzátu z mozkových komor [11]. Na uvolnění endogenních opioidů účinkem oxidu dusného se podílí i důležitý endogenní biologický regulátor – oxid dusnatý (NO), viz obr. 3. Uvolnění endogenních opioidních peptidů aktivuje descendentní dráhy, které modulují nociceptivní podněty v míše. Nejdůležitější součástí těchto drah jsou noradrenergní dráhy, které jsou pod vlivem tonické inhibice GABAergních drah v pontu. Stimulace opioidních receptorů opioidními ![Obr. 4 Vliv oxidu dusného na descendentní inhibiční noradrenergní nervové dráhy; podle [17] – Emmanouil, Quock, 2007.Oxid dusný indukuje uvolnění endogenních opioidních peptidů aktivací opioidních receptorů v GABAergních jádrech pontu. Tím dochází k aktivaci descendentního noradrenergního systému v zadních rozích míšních, který přímo nebo nepřímo inhibuje nociceptivní procesy v míše.EOP – endogenní opioidy; PAG – periakveduktální šeď; NE – noradrenalin; GABA – kyselina gamma-aminomáselná](https://www.remedia.cz/photo-a-28599---.jpg) peptidy uvolněnými oxidem dusným pak inhibuje tyto inhibiční GABAergní dráhy, viz obr. 4. Tím dojde k desinhibici descendentních noradrenergních drah. Dokázal to sérií elegantních pokusů na potkanech Guo a kol. [12, 13]. Přerušení míchy je prevencí antinociceptivních účinků oxidu dusného. Studie na transgenních myších ukázaly, že za antinociceptivní účinek oxidu dusného jsou zodpovědné adrenergní receptory α2B a α2C, nikoliv α2A. Descendentní noradrenergní inhibiční neurony však nejsou u mladých potkanů dosud zralé, a proto zde také chybí analgetický účinek navozený oxidem dusným.
peptidy uvolněnými oxidem dusným pak inhibuje tyto inhibiční GABAergní dráhy, viz obr. 4. Tím dojde k desinhibici descendentních noradrenergních drah. Dokázal to sérií elegantních pokusů na potkanech Guo a kol. [12, 13]. Přerušení míchy je prevencí antinociceptivních účinků oxidu dusného. Studie na transgenních myších ukázaly, že za antinociceptivní účinek oxidu dusného jsou zodpovědné adrenergní receptory α2B a α2C, nikoliv α2A. Descendentní noradrenergní inhibiční neurony však nejsou u mladých potkanů dosud zralé, a proto zde také chybí analgetický účinek navozený oxidem dusným.
Starší vyšetření ukázala, že nízké koncentrace oxidu dusného mají analgetický účinek, který odpovídá analgetickému účinku 15 mg morfinu s.c. [14]. Whitwam a kol. [15] měřili práh bolesti u dobrovolníků při kontinuálním podávání oxidu dusného. Bolest působili tlakem na holenní kost a horkým drátem, který přikládali k tenaru. Maximálního prahu bylo dosaženo v 10. minutě. Oxid dusný v koncentraci 50 % způsobil zvýšení prahu pouze o 33 %. U některých pokusných osob se i během aplikace rajského plynu vrátil práh bolesti k výchozím hodnotám. Jestliže však byl oxid dusný podáván s postupujícím zvyšováním koncentrace o 10 % v časovém úseku 45 minut, vedla cílová koncentrace 50 % k více než dvojnásobně zvýšenému prahu bolesti. Autoři konstatují rychlý vývoj tolerance k analgetickému účinku oxidu dusného u některých pokusných osob. Podle Matherse [7] je však analgezie zřetelně slabší. Také z našich dosavadních zkušeností vyplývá, že stupeň dosažené analgezie je individuálně různý. Při stomatologických výkonech jsme však opakovaně pozorovali výraznou redukci citlivosti dásní při aplikaci lokálního anestetika. James a kol. testovali [16] analgetické účinky 50% oxidu dusného na práh bolesti u dobrovolníků ve výšce při hladině moře a dále v nadmořské výšce 3300 m. V prvém případě se zvedl práh bolesti o 71,5 %, v 1460 m o 40 % a v nadmořské výšce 3300 m pouze o 19 %. Rozdíly mezi analgetickými účinky oxidu dusného v různých nadmořských výškách jsou statisticky signifikantní. Z práce je patrno, že analgetické účinky oxidu dusného jsou v přímém vztahu k jeho parciálnímu tlaku v různých nadmořských výškách.
Anestetický účinek
Anestetický účinek oxidu dusného je limitován, protože MAC (minimální alveolární přípustná koncentrace) dosahuje hodnoty 104 %. K navození celkové anestezie musí být tedy hyperbarické podmínky. Oxid dusný je však používán k redukci MAC jiných inhalačních anestetik, např. izofluranu nebo sevofluranu, a k urychlení indukce (účinek druhého plynu). Oxid dusný také zvyšuje účinek analgetické komponenty celkové anestezie [17]. Celková anestezie je výsledkem změny rovnováhy mezi inhibicí a excitací v komplexních neuronálních sítích. Přitom existují dvě možnosti, jak farmaka rozvíjejí svůj hypnotický účinek; děje se tak inhibicí excitačních drah v CNS nebo odtlumením inhibičních drah. Oxid dusný uplatňuje oba mechanismy. Váže se na excitační NMDA receptory jako nekompetitivní antagonista. Dále se váže na další subpopulaci glutamátových receptorů – na AMPA receptory. Kromě toho zesiluje inhibiční účinek GABAergních synapsí. Nejnověji bylo zjištěno, že oxid dusný ovlivňuje některé typy draslíkových kanálů, např. TREK-1. Ty hrají důležitou úlohu při modulaci nervové dráždivosti [18].
Vznik tolerance na oxid dusný
![Graf 1 Vývoj tolerance při inhalaci oxidu dusného po dobu 3 hodin. Je patrné rychlé zvýšení analgetického účinku oxidu dusného s maximem ve 20.–30. minutě inhalace a vývoj úplné tolerance k tomuto účinku během 2,5 hodiny. Analgetický účinek oxidu dusného byl měřen u skupiny 8 dobrovolníků ponořením končetiny do vody 0 °C teplé; podle [19, 20] – Rupreht, et al., 1983, 1985.](https://www.remedia.cz/photo-a-28600---.jpg) V pokusech na zvířatech v různých experimentálních modelech i v klinických studiích na dobrovolnících byl zjištěn vývoj tolerance na různé účinky oxidu dusného. Přitom čas potřebný k vývoji tolerance na jednotlivé účinky oxidu dusného se pohybuje mezi 10 minutami až 2 hodinami. Tolerance na analgetický účinek je zřejmá během jedné hodiny, tolerance k ostatním psychickým účinkům se vyvíjí během několika hodin až dní. Rupreht a kol. testovali [19, 20] na skupině 8 dobrovolníků vývoj tolerance na antinociceptivní a anestetické účinky oxidu dusného (graf 1). Nejprve stanovili jeho nejnižší koncentraci, při které nastoupila ztráta vědomí během 10 minut. Tato koncentrace se pohybovala mezi 60–80 %. Nejčastější byla ztráta vědomí při koncentraci 70 % oxidu dusného. Dobrovolníci pak vdechovali tuto individuálně zjištěnou koncentraci oxidu dusného pro ztrátu vědomí po dobu 3 hodin. Již během 20–30 minut se projevil vývoj tolerance k antinociceptivním účinkům, úplná tolerance nastoupila během 2,5 hodiny. Nociceptivním podnětem bylo ponoření ruky do vody 0 °C teplé. U dvou dobrovolníků z osmi se vrátilo vědomí za 77 a 91 minut inhalace oxidu dusného. To znamená, že došlo i k vývoji tolerance na anestetický účinek. Polykací a kašlací reflexy byly zachovány v průběhu celého období vdechování. Příležitostně se vyskytlo pocení. Po skončení 3hodinové inhalace oxidu dusného byla patrna u šesti dobrovolníků nauzea. Všichni dobrovolníci měli pocit chladu, jejich rektální teplota však zůstala nezměněna. Po ukončení pokusu měly dvě osoby pocit euforie, u dvou osob byly zaznamenány pocity dejavu po dobu 3 dnů, zvláště při únavě. Zacny a kol. [21] testovali vývoj akutní tolerance u jednotlivých komponent účinku oxidu dusného. Skupina deseti dobrovolníků vdechovala oxid dusný spolu s kyslíkem v koncentraci 10 %, 20 %, 30 % a 40 % a byly hodnoceny psychomotorické a analgetické účinky oxidu dusného. V průběhu 2hodinové inhalace došlo k vývoji akutní tolerance na analgetický účinek. Také některé subjektivně pociťované účinky oxidu dusného, jako je euforie, elace nálady, vykazovaly známky akutní tolerance. Na rozdíl od toho psychomotorické účinky nebyly v průběhu inhalace podstatně ovlivněny. Rozdíly v akutní toleranci na jednotlivé účinky oxidu dusného ukazují na to, že mohou být zprostředkovány různými neurotransmitery. Na vzniku tolerančních účinků na opioidy se snad podílí pokles hustoty opioidních receptorů v jednotlivých mozkových oblastech.
V pokusech na zvířatech v různých experimentálních modelech i v klinických studiích na dobrovolnících byl zjištěn vývoj tolerance na různé účinky oxidu dusného. Přitom čas potřebný k vývoji tolerance na jednotlivé účinky oxidu dusného se pohybuje mezi 10 minutami až 2 hodinami. Tolerance na analgetický účinek je zřejmá během jedné hodiny, tolerance k ostatním psychickým účinkům se vyvíjí během několika hodin až dní. Rupreht a kol. testovali [19, 20] na skupině 8 dobrovolníků vývoj tolerance na antinociceptivní a anestetické účinky oxidu dusného (graf 1). Nejprve stanovili jeho nejnižší koncentraci, při které nastoupila ztráta vědomí během 10 minut. Tato koncentrace se pohybovala mezi 60–80 %. Nejčastější byla ztráta vědomí při koncentraci 70 % oxidu dusného. Dobrovolníci pak vdechovali tuto individuálně zjištěnou koncentraci oxidu dusného pro ztrátu vědomí po dobu 3 hodin. Již během 20–30 minut se projevil vývoj tolerance k antinociceptivním účinkům, úplná tolerance nastoupila během 2,5 hodiny. Nociceptivním podnětem bylo ponoření ruky do vody 0 °C teplé. U dvou dobrovolníků z osmi se vrátilo vědomí za 77 a 91 minut inhalace oxidu dusného. To znamená, že došlo i k vývoji tolerance na anestetický účinek. Polykací a kašlací reflexy byly zachovány v průběhu celého období vdechování. Příležitostně se vyskytlo pocení. Po skončení 3hodinové inhalace oxidu dusného byla patrna u šesti dobrovolníků nauzea. Všichni dobrovolníci měli pocit chladu, jejich rektální teplota však zůstala nezměněna. Po ukončení pokusu měly dvě osoby pocit euforie, u dvou osob byly zaznamenány pocity dejavu po dobu 3 dnů, zvláště při únavě. Zacny a kol. [21] testovali vývoj akutní tolerance u jednotlivých komponent účinku oxidu dusného. Skupina deseti dobrovolníků vdechovala oxid dusný spolu s kyslíkem v koncentraci 10 %, 20 %, 30 % a 40 % a byly hodnoceny psychomotorické a analgetické účinky oxidu dusného. V průběhu 2hodinové inhalace došlo k vývoji akutní tolerance na analgetický účinek. Také některé subjektivně pociťované účinky oxidu dusného, jako je euforie, elace nálady, vykazovaly známky akutní tolerance. Na rozdíl od toho psychomotorické účinky nebyly v průběhu inhalace podstatně ovlivněny. Rozdíly v akutní toleranci na jednotlivé účinky oxidu dusného ukazují na to, že mohou být zprostředkovány různými neurotransmitery. Na vzniku tolerančních účinků na opioidy se snad podílí pokles hustoty opioidních receptorů v jednotlivých mozkových oblastech.
Dýchací systém
Patrně centrálně nervovou stimulací a aktivací plicních receptorů reagujících na roztažení vede inhalace oxidu dusného ke zvýšení dechové frekvence a tím paralelně k mírné redukci dechového objemu. Celkově však zůstává parciální tlak oxidu uhličitého nezměněn. Důležité je, že oxid dusný již v nízkých koncentracích ovlivňuje „hypoxic drive“, tzn. že se snižuje respirační odpověď na hypoxii zprostředkovanou periferními receptory. Na základě toho, že je oxid dusný bez zápachu a nezpůsobuje podráždění sliznice bronchů, je jeho podání příjemné [22].
Kardiovaskulární systém
Účinek oxidu dusného na oběhový systém je klinicky nevýznamný. Klinické studie ukázaly, že dochází k lehkému zvýšení srdeční frekvence a tepového objemu a periferní rezistence, tzn. že oxid dusný má lehký sympatomimetický účinek. Po nástupu sedace a anxiolýzy srdeční frekvence a krevní tlak mírně klesají. Účinek oxidu dusného na kardiovaskulární systém je také modifikován současným podáním kyslíku v koncentraci vyšší, než je ve vzduchu. Při stomatologických výkonech dochází účinkem psychiky k uvolnění katecholaminů. Výsledkem je zvýšení krevního tlaku, srdeční frekvence i zvýšený výskyt srdečních arytmií. K tomu přistupuje i iatrogenní podání adrenalinu jako vazokonstriktoru v lokálním anestetiku. Redukce strachu a úzkosti účinkem oxidu dusného je proto velmi výhodná u pacientů s ischemickou chorobou srdeční [7].
Gastrointestinální systém
Za klinických podmínek neovlivňuje oxid dusný činnost trávicího ústrojí. Při koncentraci vyšší než 50 % se může vyskytnout nauzea nebo zvracení. Před sedací se proto doporučuje 4hodinová karence příjmu potravy. Někteří však udávají, že není třeba před inhalací žádné hladovění. Reflexy dýchacích cest jsou zachovány, a nebezpečí aspirace proto nehrozí.
Ledviny a játra
Oxid dusný neovlivňuje průtok krve orgány včetně jater a ledvin. Není téměř metabolizován a je opět vyloučen z velké části plícemi. Proto nezatěžuje metabolickou činnost jater nebo ledvin. Může být použit u pacientů se závažným omezením funkce těchto parenchymatózních orgánů.
Farmakokinetické vlastnosti
Farmakokinetika oxidu dusného se blíží ideálu. Podobně jako ostatní inhalační anestetika se dostává plícemi do krevního oběhu a dále do CNS, kde rozvíjí svůj účinek. Oxid dusný je v krvi velmi málo rozpustný (koeficient krev-plyn je 0,47), takže dochází k rychlému vyrovnání alveolární koncentrace v plicích s koncentrací v krvi. Tento fenomén vede během několika minut k nástupu účinku. Síla účinku nebo přesněji řečeno hloubka sedace může být velmi rychle změnou vdechované koncentrace oxidu dusného přizpůsobena operačnímu výkonu. V krevním oběhu oxid dusný vytlačuje dusík, ten je 35krát méně rozpustný v krvi než oxid dusný [23]. Rychlost nástupu účinku a dosažení steady-state závisí na rozpustnosti plynů zvané koeficient krev-plyn. Nízký koeficient krev-plyn znamená malou rozpustnost a tím i rychlý nástup účinku. Rychle stoupající koncentrace plynu v krvi znamená rychlý prostup na místo účinku v mozku. Oxid dusný má vedle desfluranu nejnižší rozpustnost a tím také nejrychlejší nástup účinku. Oxid dusný je transportován v krvi ve volném stavu, aniž by se vázal na hemoglobin. Není téměř metabolizován a je opět vylučován plicními alveoly. Nízká rozpustnost v krvi je také příčinou velmi rychlého odeznění účinku. Protože oxid dusný má vyšší rozpustnost v krvi než dusík, je méně dusíku do krve dopravováno, než je oxidu dusného přijato. Vzniká relativní vakuum, tzv. koncentrační účinek s vyšší než očekávanou koncentrací oxidu dusného v alveolu. Tento fenomén podmiňuje také dvě důležité vlastnosti rajského plynu. Difunduje rychle do ![Graf 2 Po inhalaci oxidu dusného může dojít k difuzní hypoxii, při které klesá parciální tlak kyslíku v alveolech (PaO2) a zároveň stoupá koncentrace oxidu dusného; podle [23] – Craig, Skelly, 2004.](https://www.remedia.cz/photo-a-28601---.jpg) uzavřených tělních dutin a může rychle vést k jejich expanzi. Dusík vyskytující se v tělní dutině nemůže difundovat ven tak rychle, jako oxid dusný difunduje dovnitř. To je případ střevních kliček nebo dutin v processus mastoideus. Životu nebezpečné by bylo použití oxidu dusného u pacienta s pneumotoraxem, protože zde dochází k rychlému zvýšení intratorakálního tlaku s posunem mediastina. Když je ukončen přívod oxidu dusného, dojde k protikladu koncentračního efektu. Oxid dusný je rychle eliminován ve směru plic a zřeďuje tím zde přítomný kyslík. K tomu dochází v prvních minutách po ukončení inhalace oxidu dusného a tento jev podmiňuje tzv. difuzní hypoxii (graf 2). Jednoduchým manévrem je podání 100% kyslíku po dobu 3 minut na konci inhalace oxidu dusného. Tento postup platí jako dobrý standard, ale u stomatologických pacientů bylo prokázáno, že se nevyskytly žádné problémy také bez podání 100% kyslíku [7].
uzavřených tělních dutin a může rychle vést k jejich expanzi. Dusík vyskytující se v tělní dutině nemůže difundovat ven tak rychle, jako oxid dusný difunduje dovnitř. To je případ střevních kliček nebo dutin v processus mastoideus. Životu nebezpečné by bylo použití oxidu dusného u pacienta s pneumotoraxem, protože zde dochází k rychlému zvýšení intratorakálního tlaku s posunem mediastina. Když je ukončen přívod oxidu dusného, dojde k protikladu koncentračního efektu. Oxid dusný je rychle eliminován ve směru plic a zřeďuje tím zde přítomný kyslík. K tomu dochází v prvních minutách po ukončení inhalace oxidu dusného a tento jev podmiňuje tzv. difuzní hypoxii (graf 2). Jednoduchým manévrem je podání 100% kyslíku po dobu 3 minut na konci inhalace oxidu dusného. Tento postup platí jako dobrý standard, ale u stomatologických pacientů bylo prokázáno, že se nevyskytly žádné problémy také bez podání 100% kyslíku [7].
Klinické zkušenosti
Klinické projevy inhalace oxidu dusného
 Prvním klinickým příznakem účinku oxidu dusného je pocit omámení a u někoho točení hlavy. Zároveň dochází k paresteziím v horních a dolních končetinách, případně i v dutině ústní. Dostavuje se pocit tepla v těle, který probíhá ve vlnách. Nastupuje analgezie. Dochází k pocitu euforie (obr. 5). Krevní tlak a srdeční frekvence nejprve mírně stoupají, stejně tak respirační frekvence. Dochází k periferní vazodilataci. Může se objevit flush (zčervenání v obličeji). Svalový tonus také u některých jedinců mírně klesá, takže se objevuje výrazný pocit lehkosti dolních končetin, dochází ke změnám ve vnímání, může se vyskytnout hyperakuzie – zvýšené sluchové vnímání během
Prvním klinickým příznakem účinku oxidu dusného je pocit omámení a u někoho točení hlavy. Zároveň dochází k paresteziím v horních a dolních končetinách, případně i v dutině ústní. Dostavuje se pocit tepla v těle, který probíhá ve vlnách. Nastupuje analgezie. Dochází k pocitu euforie (obr. 5). Krevní tlak a srdeční frekvence nejprve mírně stoupají, stejně tak respirační frekvence. Dochází k periferní vazodilataci. Může se objevit flush (zčervenání v obličeji). Svalový tonus také u některých jedinců mírně klesá, takže se objevuje výrazný pocit lehkosti dolních končetin, dochází ke změnám ve vnímání, může se vyskytnout hyperakuzie – zvýšené sluchové vnímání během  výkonu. Strop se může přibližovat a pohybovat. Může se objevit smích (obr. 6, 7) nebo pláč. Již Humphry Davy (1778–1829) pozoroval výskyt příjemných sexuálních voluptózních pocitů a velmi vzácně i orgasmus. Z těchto důvodů je oxid dusný zneužíván.
výkonu. Strop se může přibližovat a pohybovat. Může se objevit smích (obr. 6, 7) nebo pláč. Již Humphry Davy (1778–1829) pozoroval výskyt příjemných sexuálních voluptózních pocitů a velmi vzácně i orgasmus. Z těchto důvodů je oxid dusný zneužíván.
Klinické použití
Oxid dusný je používán v medicíně více než 150 let. Teprve od poloviny 50. let 20. století však byla zlepšena technika jeho podávání. Zjistilo se, že k sedaci  plně dostačují koncentrace do 50 % a že vyšší koncentrace jsou spojeny s výraznějšími nežádoucími účinky, aniž by se podstatně zvýšila účinnost. Oxid dusný je samozřejmě s přihlédnutím ke kontraindikacím dosud běžně používán jako komponenta kombinované celkové anestezie, kde přispívá k zesílení analgetických účinků. Sedace oxidem dusným je v současné době používána téměř ve všech odvětvích medicíny s možností podání zaškoleným středním zdravotnickým personálem. To je nesporná výhoda. Na druhé straně si musíme uvědomit, že v jednotlivých případech může být inhalace oxidu dusného ve svých účincích nedostatečná, a musí být proto doplněna dalšími anesteziologickými technikami.
plně dostačují koncentrace do 50 % a že vyšší koncentrace jsou spojeny s výraznějšími nežádoucími účinky, aniž by se podstatně zvýšila účinnost. Oxid dusný je samozřejmě s přihlédnutím ke kontraindikacím dosud běžně používán jako komponenta kombinované celkové anestezie, kde přispívá k zesílení analgetických účinků. Sedace oxidem dusným je v současné době používána téměř ve všech odvětvích medicíny s možností podání zaškoleným středním zdravotnickým personálem. To je nesporná výhoda. Na druhé straně si musíme uvědomit, že v jednotlivých případech může být inhalace oxidu dusného ve svých účincích nedostatečná, a musí být proto doplněna dalšími anesteziologickými technikami.
Zařazení do současné palety léčiv
Oxid dusný je používán jako složka celkové anestezie i samostatně k navození sedace a analgezie v různých odvětvích medicíny. Jeho aplikace v koncentraci do 50 % je bezpečná a je provázena minimálním výskytem nežádoucích účinků. Rozšiřuje významně paletu farmakologických možností navození sedace a analgezie s rychlým nástupem a odezněním účinku. Velmi důležitá je skutečnost, že oxid dusný ve formě registrovaného premixu (50 % N2O/50 % O2) může podávat i proškolený střední zdravotnický personál.
Výhodou použití oxidu dusného je cenově srovnatelná alternativa k analgosedaci. Ve formě premixu 50 % N2O/50 % O2 je rychle dostupný (vždy po ruce). Jeho výhodou je rychlý nástup účinku a rychlé probuzení, které nastává mnohem rychleji než při použití klasických analgosedačních technik. Po inhalaci oxidu dusného se lze hned napít a najíst. Velmi rychlé psychomotorické zotavení dovoluje řízení automobilu do 30 minut. Chybí těžké nežádoucí účinky, mírnější nežádoucí účinky jsou častější, ale jsou rychle reverzibilní.
Indikace
Ambulantní chirurgické výkony
Oxid dusný je vhodný zejména při krátkých bolestivých výkonech, jako je například transrektální biopsie prostaty, repozice ramene, lokte a dalších kloubů, zavedení a odstranění hrudních drénů, incize abscesu, repozice fraktury, transkutánní punkce portu, akutní ošetření ran a pohmožděnin, odstranění stehů, lumbální punkce. Je vhodným analgetikem v záchranné službě v rámci předhospitalizačního ošetření [24, 25].
Gynekologie
Inhalace oxidu dusného je vhodná pro drobné gynekologické výkony, jako je vyjmutí a zavedení antikoncepčního tělíska, hysteroskopie, biopsie děložního čípku, rozšíření nepoddajného hymenu, chemická ablace Bartholiniho žlázy.
Porodnictví
V porodnictví je oxid dusný používán již od 60. let 20. století k tlumení porodních bolestí, zejména v první době porodní, především u rodiček, které odmítají epidurální analgezii. Pařízek (osobní sdělení 2011) se domnívá, že ve druhé době porodní není analgezie oxidem dusným u více rodiček dostatečná, a proto musí být kombinována s dalšími analgetickými technikami. V poporodní době se může uplatnit při šití hráze, vybavení placenty a revizi dělohy. Pocitem omámení se výrazně snižuje úzkost některých pacientek před porodem, velmi důležitá je změna emočního vnímání bolesti účinkem oxidu dusného. Neoddiskutovatelnou součástí sedativního analgetického účinku u rodiček je důvěra v porodníka nebo sestru, kteří aplikují oxid dusný.
Stomatologie
Použití oxidu dusného je v některých zemích oblíbeno při stomatologických výkonech. Uplatňuje se zde zejména anxiolytický a omamující (euforický) účinek a také redukce bolesti při aplikaci lokálního anestetika. Podobně jako při aplikaci v jiných oblastech medicíny je důležité, aby stomatolog doprovázel inhalaci oxidu dusného uklidňující řečí a navozením pocitu důvěry. Oxid dusný činí pacienta velmi přístupným sugesci. Zvláště účinná je inhalace oxidu dusného nádechovým ventilem, kdy během několika minut dochází k významnému omámení s výrazným pocitem euforie a analgetickým účinkem. V tomto období je proto vhodné aplikovat injekce lokálního anestetika.
U dětí je samotné podání oxidu dusného často nedostatečné, zvláště u dětí předškolního věku. Zde je vhodná kombinace s midazolamem per os nebo per rectum.
Lahoud a Averley [26] kombinují 40 % oxidu dusného s 0,3 % sevofluranu k tzv. sedaci při vědomí u dětí při stomatologickém ošetření.
Ve Velké Británii je často používána při extrakci zubů u dětí celková anestezie. V Anglii a ve Skotsku se v letech 1998–1999 uskutečnilo v této indikaci téměř 106 tisíc celkových anestezií. Je otázkou, zda by alespoň část z těchto anestezií nemohla být nahrazena inhalační sedací oxidem dusným bez ztráty vědomí. Dosavadní studie svědčí o tom, že lze skutečně nahradit v jednotlivých případech celkovou anestezii inhalační sedací. Účinek oxidu dusného je však značně individuální. U velmi malých dětí je často účinek oxidu dusného nedostatečný, a měla by být proto použita celková anestezie.
Endoskopické výkony
Oxid dusný je možno použít individuálně také při různých endoskopických výkonech. Úspěch se však pohybuje okolo 50 % například při použití u kolonoskopií.
Katetrizace močového měchýře
Zier a kol. [27] popisují přes tisíc katetrizací močového měchýře u dětí ve věku mezi 11 měsíci a 17 lety (průměr 5,4 roku) z diagnostických důvodů. Pacient inhaloval směs 70% oxidu dusného s kyslíkem. Po skončení katetrizace inhaloval po dobu 2–5 minut čistý kyslík. Většina výkonů byla ukončena během 15 minut. Saturace hemoglobinu kyslíkem neklesla u žádného pacienta pod 92 %. U 4 % pacientů se vyskytly lehké nežádoucí účinky – nevolnost nebo zvracení a také pocení. Pouze v 1 % případů nedošlo k sedaci a 1 % dětí bylo nadměrně sedováno. Tuto techniku byl schopen podávat i střední zdravotnický personál.
Punkce kostní dřeně
Gudgin a kol. [28] hodnotili oxid dusný k sedaci při aspiraci kostní dřeně a biopsii. U celkem 22 pacientů s hematologicko-onkologickým onemocněním, při kterém bylo nezbytné provést punkci kostní dřeně, srovnávali intravenózní sedaci midazolamem s inhalací oxidu dusného. Přes 90 % pacientů udalo, že oxid dusný je lepší nebo stejně dobrý jako midazolam, jen jeden pacient udal horší výsledky. Proto je inhalace oxidu dusného účinnou alternativou k redukci strachu a bolesti při této proceduře.
Ošetřování dekubitálních vředů
Paris a kol. [29] použili inhalační sedaci oxidem dusným při ošetřování 34 geriatrických pacientů trpících dekubity; průměrný věk pacientů byl 84 let. Směs 50 % oxidu dusného s kyslíkem srovnávali s účinky morfinu nebo použili kombinaci obou. Oxid dusný měl při terapii lepší výsledky než morfin. Kombinace oxidu dusného s morfinem nepřinesla žádné výhody ve srovnání se samotnou aplikací oxidu dusného.
Kontraindikace
Kontraindikace podání oxidu dusného vyplývají především z jeho fyzikálních vlastností a jeho schopnosti difundovat do plynem naplněných uzavřených dutin a expandovat. Dochází tak ke zvýšení tlaku v nich a k jejich roztahování. Při delší expozici ovlivňuje N2O metabolické dráhy vitaminu B12 a kyseliny listové, respektive folátů.
Absolutní kontraindikace jsou tyto:
- pneumotorax, pneumoperikard, těžký plicní emfyzém, vzduchová embolie;
- stav po kardiochirurgických operacích s mimotělním oběhem nebo koronárním bypassu bez mimotělního oběhu;
- po podání intrakutánních plynových injekcí;
- těžká dilatace zažívacího traktu – ileus;
- srdeční insuficience nebo kardiální dysfunkce;
- zvýšený intrakraniální tlak;
- snížené vědomí a chybějící kooperace;
- neléčený nedostatek vitaminu B12 nebo kyseliny listové;
- poranění obličeje, která znemožňují správné použití nádechového ventilu, obličejové či nazální masky;
- ušní operace (tympanoplastika);
- intraokulární plynové injekce nebo perforující oční zranění;
- poškození hematoencefalické bariéry;
- první trimestr těhotenství.
Nežádoucí účinky
Při použití oxidu dusného v 50% koncentraci společně s 50 % kyslíku jsou nežádoucí účinky minimální. Asi v 5 % může dojít ke krátkodobým bolestem hlavy po skončení inhalace a k pocitům závratě, které však rychle odeznívají. U senzitivních jedinců může dojít k nevolnosti a ve velmi vzácných případech i ke zvracení. Rovněž tyto příznaky odeznívají bez léčení brzy po skončení inhalace.
Oxid dusný a nedostatek vitaminu B12
Oxid dusný zasahuje negativně do metabolismu kyseliny listové a methioninu. Methionin hraje důležitou úlohu při syntéze DNA, myelinu a také při syntéze katecholaminů. Při jeho syntéze hraje důležitou úlohu enzym methionin syntetáza, který je závislý na vitaminu B12. Oxid dusný právě inhibicí methionin syntetázy zasahuje do metabolismu kyseliny listové a methioninu. Kofaktorem methionin syntetázy je methylkobalamin. Při delším podání může vést nedostatek vitaminu B12 a kyseliny listové k poruchám erytropoézy s vývojem makrocytární anémie, leukopenie a trombocytopenie až k agranulocytóze [30, 31]. Může dojít až k manifestaci neurotoxických komplikací ve smyslu akutní funikulární myelózy. První zprávy o neurologických komplikacích pocházejí z období, kdy byl oxid dusný používán k dlouhodobé sedaci u pacientů s tetanem [32].
Lékové interakce
Oxid dusný snižuje MAC inhalačních anestetik a zesiluje analgetickou komponentu v celkové anestezii. Při delším podání má interakce s vitaminem B12 nežádoucí účinky (viz výše). Zesiluje účinky některých benzodiazepinů, v minulosti to byl často používaný flunitrazepam. Jinak se v organismu téměř nemetabolizuje.
Dávkování
Oxid dusný je používán jako komponenta celkové anestezie v běžné koncentraci 60–70 %. K inhalační sedaci je podáván nejčastěji v koncentraci 50 % spolu s 50 % kyslíku. Je přitom podáván nádechovým ventilem nebo nazální maskou s průtokem plynu 6–7 l/min.
Provedení inhalační sedace oxidem dusným
Při navození sedace oxidem dusným je velmi důležitý kontakt pacienta s lékařem. Při nástupu účinku hovoří lékař uklidňujícím hypnotizujícím hlasem s pozitivním obsahem. Zdravotnický pracovník hodnotí vliv oxidu dusného na pacienta otázkou „Jak se cítíte?“ nebo „Jak byste popsal své pocity a náladu?“. Volba řeči zdravotnickým pracovníkem je velmi důležitá, protože tím je dána celková atmosféra při ošetření. Pacient se sedací oxidem dusným je totiž velmi přístupný slovní sugesci. Negativní vjemy, hlasitý hovor nebo nešetrné harašení s nástroji (výskyt hyperakuzie při inhalaci oxidu dusného) znamenají negativní zážitek pro pacienta. V průběhu vyšetření neprojevujeme netrpělivost, nespěcháme. Pacient je během sedace ve vulnerabilním stavu a citlivě vnímá přítomný spěch nebo nezájem lékařského týmu a reaguje strachem nebo neklidem. Těsný kontakt mezi zdravotnickým personálem a pacientem u něho vyvolává pocit bezpečí. Odpovídající řeč těla a eventuálně přiměřené dotýkání se pacienta (např. rukou v lopatkové krajině) podporuje pozitivní atmosféru během vyšetření. Pacient má být během vyšetření klidný, psychicky uvolněný a oslovitelný. Je schopný kooperace se zdravotnickým personálem. Vnímání bolestivých pocitů je výrazně redukováno. I injekce lokálního anestetika v zubním lékařství je dobře tolerována. Na prvním místě však stojí sedace navozená oxidem dusným, která však v žádném případě nemůže nahradit analgetický účinek lokálního anestetika.
Praktické provedení inhalační sedace oxidem dusným
N ejsnadnější je aplikace směsi 50 % N2O/50 % O2, která je nabízena jako registrovaný přípravek.
ejsnadnější je aplikace směsi 50 % N2O/50 % O2, která je nabízena jako registrovaný přípravek.
Směs je dodávána v odlehčené hliníkové tlakové lahvi o velikosti 5 nebo10 litrů, která je opatřena integrovaným redukčním ventilem pro snadné připojení nádechového ventilu nebo nosní masky (obr. 8). Není třeba nasazovat žádný redukční ventil, a tím odpadá riziko práce s vysokým tlakem. Součástí integrovaného ventilu je uzavírací ventil, aktivní manometr, který ukazuje množství plynu v lahvi i při zavřeném uzavíracím ventilu, ovladač kontinuálního průtoku, který  umožňuje nastavit průtok až do 15 l/min, madlo pro snadný přenos, hák pro zavěšení např. na lůžko a rychlospojka pro připojení nádechového ventilu. Pro inhalační aplikaci se používá nejlépe nádechový ventil, který se otvírá pouze při nádechu pacienta a tím minimalizuje spotřebu plynu (obr. 9). Nádechový ventil umožňuje použít náustek (pro dýchání ústy) nebo inhalační masku (pro dýchání nosem i ústy), je-li to pro pacienta výhodnější nebo pohodlnější. Ve stomatologii je možné použít nosní masku, která se připojuje na výstup kontinuálního průtoku (obr. 10).
umožňuje nastavit průtok až do 15 l/min, madlo pro snadný přenos, hák pro zavěšení např. na lůžko a rychlospojka pro připojení nádechového ventilu. Pro inhalační aplikaci se používá nejlépe nádechový ventil, který se otvírá pouze při nádechu pacienta a tím minimalizuje spotřebu plynu (obr. 9). Nádechový ventil umožňuje použít náustek (pro dýchání ústy) nebo inhalační masku (pro dýchání nosem i ústy), je-li to pro pacienta výhodnější nebo pohodlnější. Ve stomatologii je možné použít nosní masku, která se připojuje na výstup kontinuálního průtoku (obr. 10).
 Manipulace s lahví, připojení nádechového ventilu nebo nosní masky, kontrola funkčnosti systému před aplikací i po jejím ukončení jsou jednoduché a rychle proveditelné kroky, a proto podávání snadno zvládá i proškolený střední zdravotnický personál.
Manipulace s lahví, připojení nádechového ventilu nebo nosní masky, kontrola funkčnosti systému před aplikací i po jejím ukončení jsou jednoduché a rychle proveditelné kroky, a proto podávání snadno zvládá i proškolený střední zdravotnický personál.
Při použití nádechového ventilu pacient drží ventil s filtrem a náustkem v ruce a inhaluje ústy. Hluboké nádechy musí být pouze ústy, výdechy mohou být jak nosem, tak ústy. Pokud pacient není schopen inhalovat pouze ústy (nadechuje se zároveň nosem), nasadíme na filtr místo náustku inhalační masku – pacient tak může inhalovat i vydechovat jak nosem, tak ústy. Automatický nádechový ventil se otevře a umožní přívod plynu pouze při nádechu pacienta, následně je pak automaticky uzavřen při výdechu nebo přerušení inhalace. Pacient by měl před zahájením zákroku inhalovat déle než 1 minutu. Maxima účinku se dosahuje po 2–3 minutách. Pacientovi stačí 4–5 hlubokých nádechů, aby se začaly projevovat účinky inhalovaného plynu (viz Klinické projevy).
Při použití nosní masky se použije výstup u ovladače kontinuálního průtoku, který umožňuje nastavení požadovaného průtoku inhalační směsi. Nosní masku nasadíme na obličej pacienta, upevníme popruhy a nastavíme zvolený průtok inhalačního plynu ovladačem kontinuálního průtoku. Dříve než po zákroku a skončení inhalace umožníme pacientovi odejít, vždy se ujistíme, že účinky inhalovaného plynu (závratě, ospalost aj.) odezněly. Pacient může obvykle odejít již po několika málo minutách. Již po 30 minutách může pacient řídit auto.
Znečištění životního prostředí a chronická expozice oxidu dusnému na pracovišti
Oxid dusný patří společně s oxidem uhličitým, methanem a fluorokarbony ke skleníkovým plynům. Globální emise oxidu dusného pochází:
- z přirozených zdrojů, zvláště z dusíkatých sloučenin ve vodě a v půdě, které se rozkládají činností mikrobů;
- z nitrifikačních a denitrifikačních procesů v dusíkatých hnojivech v zemědělství;
- ze spalování fosilních paliv;
-
Text nového odstavce.
z průmyslové produkce, mezi jiným také pro medicínské účely.
Přirozená emise je odhadována na 145 milionů tun, z toho medicínská spotřeba tvoří méně než 1 % této hodnoty. Oxid dusný celkově tvoří pouze 5 % roční emise skleníkových plynů, pro účely anestezie pak představuje jeho podíl na skleníkovém efektu jenom 0,05 %. Celkově je skleníkový efekt způsobený anestetiky odhadován pouze na 0,03 %. Oxid dusný nemá přímý vliv na vznik ozonové díry, ale přeměňuje se ve stratosféře na oxidy dusíku, které přispívají k ničení ozonové vrstvy. Anesteziolog může přispět k ochraně životního prostředí používáním tzv. low-flow anestezie i pravidelným testováním těsnosti hadic. Ruská anestezioložka Vaisman v roce 1967 poprvé uveřejnila zprávu o velmi vysoké potratovosti ženského anesteziologického personálu. Od té doby panují diskuse o nebezpečí chronické expozice oxidu dusnému, zvláště u žen ve fertilním věku. Následně vznikla celá řada epidemidologických studií zabývajících se otázkou redukované fertility a zvýšené potratovosti u žen, které byly na svém pracovním místě vystaveny nízkým, ale chronickým koncentracím oxidu dusného. Původně jsme se domnívali, že oxid dusný potlačuje sekreci gonadotropin-releasing hormonu hypothalamu a tím ovlivňuje ovulaci. To bylo však potvrzeno jen na potkanech. Na zvýšeném počtu potratů a redukci fertility se mohou podílet různé faktory. Dosavadní studie mají omezenou platnost z následujících příčin:
- nejedná se o prospektivní, kontrolované randomizované studie, nýbrž pouze o retrospektivní dotazníky, zvláště v zubním lékařství;
- koncentrace oxidu dusného, jimž byli vystaveni zubní lékař a jeho sestra na pracovišti v 80. letech, se nedají srovnat se situací dnes, kdy jsou k dispozici velmi dobré odsávací systémy;
- zvýšený psychický stres anesteziologa a jeho sestry může být rovněž příčinou redukované fertility a zvýšené potratovosti.
Podpořeno grantem IGA MZ ČR NT11284-4/210.
Seznam použité literatury
- [1] Pasternak JJ, Lanier WL. Is nitrous oxide use appropriate in neurosurgical and neurologically at-risk patients? Curr Opin Anaesthesiol 2010; 23: 544–550.
- [2] Moore PA. Psychomotor impairment due to N2O exposure. Anesth Prog 1983; 30: 72–75.
- [3] Moyes D, Cleaton-Jones P, Lelliot J. Evaluation of driving skills after brief exposure to nitrous oxide. S Afr Med J 1979; 56: 1000–1002.
- [4] Quock RM, Emmanouil DE, Vaughn LK, Pruhs RJ. Benzodiazepine receptor mediation of behavioral effects of nitrous oxide in mice. Psychopharmacology (Berl) 1992; 107: 310–314.
- [5] Dwyer R, Bennett HL, Eger EI, Hellbron D. Effects of isoflurane and nitrous oxide in subanesthetic concentrations on memory and responsiveness in volunteers. Anesthesiology 1992; 77: 888–898.
- [6] Ghoneim MM, Mewaldt SP, Petersen RC. Subanesthetic concentration of nitrous oxide and human memory. Prog Neuropsychopharmacol Biol Psychiatry 1981; 5: 395–402.
- [7] Mathers FG. Dentale Sedierung. Lachgas und orale Sedativa in der Praxis. Deutscher Zahnärzte Verlag Köln 2011, 173 s.
- [8] Berkowitz BA, Ngai SH, Finck AD. Nitrous oxide „analgesia“: resemblance to opiate action. Science 1976; 194: 967–968.
- [9] Yang JC, Clark WC, Ngai SH. Antagonism of nitrous oxide analgesia by naloxone in man. Anesthesiology 1980; 52: 414–417.
- [10] Fujinaga M, Maze M. Neurobiology of nitrous oxide induced antinociceptive effects. Mol Neurobiol 2002; 25: 167–189.
- [11] Quock RM, Kouchich FJ, Tseng LF. Does nitrous oxide induce release of brain opioid peptides? Pharmacology 1985; 30: 95–99.
- [12] Guo TZ, Poree L, Golden W, et al. Antinociceptive response to nitrous oxide is mediated by supraspinal opiate and spinal aplha2C adrenergic receptors in the rat. Anesthesiology 1996; 85: 846–852.
- [13] Guo TZ, Davies MF, Kingery WS, et al. Nitrous oxide produces antinociceptive response via aplha2B and/or aplha2C adrenoceptor subtypes in mice. Anesthesiology 1999; 90: 470–476.
- [14] Chapman WP, Arrowood JA, Beecher HK. The analgetic effects of low concentrations of nitrous oxide compared in man with morphine sulphate. J Clin Invest 1943; 22: 871–875.
- [15] Whitwam JG, Morgan M, Hall GM, Petrie A. Pain during continuous nitrous oxide administration. Macmillan Journals Ltd 1976; 48: 425–430.
- [16] James MFM, Manson EDM, Dennett JE. Nitrous oxide analgesia and altitude. Anaesthesia 1982; 37: 185–288.
- [17] Emmanouil DE, Quock RM. Advances in understanding the actions of nitrous oxide. Anesth Prog 2007; 54: 9–18.
- [18] Klein J. Wie wirken Anästhetika? Abbott. Nedatováno. 50 s.
- [19] Rupreht J, Dworacek B, Ducardus R, et al. The involvement of the central cholinergic and endorphinergic systems in the nitrous oxide withdrawal syndrome in mice. Anesthesiology 1983; 58: 524–526.
- [20] Rupreht J, Dworacek B, Bonke B, et al. Tolerance to nitrous oxide in volunteers. Acta Anaesthesiol Scand 1985; 29: 635–638.
- [21] Zacny JP, Cho AM, Coalson DW, et al. Differential acute tolerance development to effects of nitrous oxide in humans. Neuroscience Letters 1996; 209: 73–76.
- [22] Yacoub O, Doell D, Kryger MH, Anthonisen NR. Depression of hypoxic ventilatory response by nitrous oxide. Anesthesiology 1975; 45: 385–389.
- [23] Craig D, Skelly M. Practical conscious sedation. Quintessence Publishing Co. Ltd. London, Berlin, Chicago, Kopenhagen, Paris, Milan, Barcelona, Istanbul, Sao Paulo, Tokyo, New Delhi, Moscow, Prague, Warsaw. 2004, 132 s.
- [24] Schönherr ME, Hollmann MW, Graf B. Lachgas. Sinn oder Unsinn für die heutige Narkoseführung? Anaesthesist 2004; 53: 796–812.
- [25] Migita RT, Klein EJ, Garrison MM. Sedation and analgesia for pedatric fracture reduction in the emergency department. A systematic review. Arch Pediatr Adolesc Med 2006; 160: 46–51.
- [26] Lahoud GY, Averley PA. Comparison of sevoflurane and nitrous oxide with nitrous oxide alone for inhalation conscious sedation in children having dental treatment: a randomised controlled trial. Anaesthesia 2002; 57: 446–450.
- [27] Zier JL, Drake GJ, McCormick PC, et al. Case-series of nurse-administered nitrous oxide for urinary catheterization in children. Anesth Analg 2007; 104: 876–879.
- [28] Gudgin EJ, Besser MW, Graig JIO. EntonoxTM as a sedative for bone marrow aspiration and biopsy. Int Jnl Lab Hem 2008; 30: 65–67.
- [29] Paris A, Horvath R, Basset P, et al. Nitrous oxide-oxygen mixture during care of bedsores and painful ulcers in the elderly: A randomized, cross-over, open-label pilot study. J Pain Symptom Manage 2008; 35: 171–176.
- [30] Layzer RB, Fishman RA, Schafer JA. Neuropathy following abuse of nitrous oxide. Neurology 1978; 28: 504–506.
- [31] Lin CY, Guo WY, Chen SP, et al. Neurotoxicity of nitrous oxide: multimodal evoked potentials in an abuser. Clin Toxicol (Phila) 2007; 45: 67–71.
- [32] Staubli G, Peier K, Tomaske M, Stocker S. What can we do that the children leave our emergency department laughing – is nitrous oxide the answer? Poster P89 beim Kongress der Schweizerischen Gesellschaft für Pediatrie (SGP) 2009.