Pazopanib
Pazopanib je inhibitor tyrozinkinázy na receptorech pro VEGF, PDGF a c-kit, což umožňuje jeho protinádorovou aktivitu přerušením zejména signální trasy pro neoangiogenezi. Pazopanib je určený k perorální léčbě. V klinických studiích prokázal účinnost u metastazujícího světlobuněčného karcinomu ledviny a je registrován k léčbě 1. linie u nepředléčených pacientů a ve 2. linii po selhání cytokinů; podáván je v dávce 800 mg 1krát denně. Probíhají studie upřesňující tuto indikaci a bylo zahájeno testování v adjuvantním podávání.
Farmakologická skupina
Pazopanib (Gw786034) patří do skupiny antineoplastických látek, cytostatik; ATC kód je L01XE11. Jde o inhibitor tyrozinkinázy na receptorech pro vaskulární endoteliální růstový faktor typů 1–3 (VEGFR-1, -2 a -3), receptoru pro destičkový růstový faktor (PDGFR-a a -b) a receptoru pro SCF (stem cell factor, c-kit).
Chemické a fyzikální vlastnosti
Pazopanib je syntetizován ve formě hydrochloridu, chemicky se jedná o 5-[[4-[(2,3-dimethyl-2H-indazol-6-yl)methylamino]-2-pyrimidinyl]amino]-2-methylbenzensulfonamid monohydrochlorid, viz obr. 1. Pazopanib hydrochlorid je bílý až nažloutlý prášek mírně rozpustný ve vodných roztocích při pH 1 a prakticky nerozpustný ve vodných roztocích při pH > 4 [1].
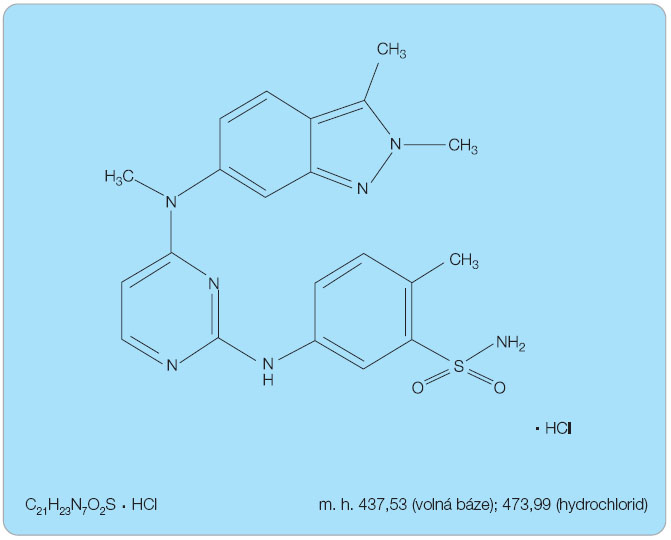 Sumární vzorec: C21H23N7O2S . HCl
Sumární vzorec: C21H23N7O2S . HCl
Molekulová hmotnost:
volná báze: 437,53
hydrochlorid: 473,99
Mechanismus účinku, farmakodynamika
Pazopanib je perorálně podávaný silný inhibitor tyrozinkinázy, který působí na více cílových místech, a to na receptorech pro vaskulární endoteliální růstový faktor typů 1–3 (vascular endothelial growth factor receptor, VEGFR-1, -2 a -3), jako inhibitor receptoru pro destičkový růstový faktor (platelet-derived growth factor receptor, PDGFR-a a -b) a receptoru pro SCF (stem cell factor, c-kit) [2]. V preklinických hodnoceních na buněčných kulturách inhiboval pazopanib (v závislosti na dávce) ligandem indukovanou autofosforylaci receptorů VEGFR-2, c-kit a PDGFR-b. Pazopanib inhibuje in vivo fosforylaci VEGFR-2 indukovanou VEGF v plicích u myší, angiogenezi u různých zvířecích modelů a růst mnohočetných lidských nádorových xenograftů u myší. V případě světlobuněčného karcinomu ledviny byla rozpoznána jeho patogeneze [3, 4] v podobě abnormální funkce VHL genu (tumor supresorový VHL gen lokalizovaný na chromozomu 3p25). Inaktivace VHL genu a jeho produktu (VHL proteinu) vede k odblokování signální trasy zajišťující dostupnost kyslíku, zvyšuje se produkce transkripčního f![Obr. 2 Mechanismus inhibice VHL/HIF signální trasy a místo zásahu pazopanibu; podle [3] – Kaelin, 2002.](https://www.remedia.cz/photo-a-28179---.jpg) aktoru HIF (hypoxií indukovaný faktor) i při normální tenzi kyslíku a to vede ke zvýšené produkci VEGF (vaskulární endotelový růstový faktor) a k aktivaci řady dalších signálních tras. VEGF je pravděpodobně nejdůležitějším růstovým faktorem nádorové angiogeneze, který má významnou úlohu v ovlivnění nádorového růstu většiny solidních nádorů. Zmapování dostředivých signálních tras počínajících receptory pro VEGF umožnilo definovat terčové struktury, jejichž zásah může vést k přerušení signální trasy pro angiogenezi. Jako nejslibnější se jeví tyrozinkinázové inhibitory zastavující přenos signálu směrem od intracytoplazmatické části receptoru pro VEGF (sorafenib, sunitinib, pazopanib, axitinib) a monoklonální protilátky neutralizující cirkulující VEGF (bevacizumab). Alternativní signální trasa je zprostředkována pomocí proteinu mTOR (mammalian target of rapamycin), ovlivňujícího signální trasu fosfatidylinositol 3-kinázy a Akt kinázy a je regulována PTEN tumor supresorovým genem. Inhibice této trasy (temsirolimus, everolimus) vede ke snížení proteiny zprostředkované translace a k následné inhibici angiogeneze a nádorové proliferace. Mechanismus účinku pazopanibu viz obr. 2 [3].
aktoru HIF (hypoxií indukovaný faktor) i při normální tenzi kyslíku a to vede ke zvýšené produkci VEGF (vaskulární endotelový růstový faktor) a k aktivaci řady dalších signálních tras. VEGF je pravděpodobně nejdůležitějším růstovým faktorem nádorové angiogeneze, který má významnou úlohu v ovlivnění nádorového růstu většiny solidních nádorů. Zmapování dostředivých signálních tras počínajících receptory pro VEGF umožnilo definovat terčové struktury, jejichž zásah může vést k přerušení signální trasy pro angiogenezi. Jako nejslibnější se jeví tyrozinkinázové inhibitory zastavující přenos signálu směrem od intracytoplazmatické části receptoru pro VEGF (sorafenib, sunitinib, pazopanib, axitinib) a monoklonální protilátky neutralizující cirkulující VEGF (bevacizumab). Alternativní signální trasa je zprostředkována pomocí proteinu mTOR (mammalian target of rapamycin), ovlivňujícího signální trasu fosfatidylinositol 3-kinázy a Akt kinázy a je regulována PTEN tumor supresorovým genem. Inhibice této trasy (temsirolimus, everolimus) vede ke snížení proteiny zprostředkované translace a k následné inhibici angiogeneze a nádorové proliferace. Mechanismus účinku pazopanibu viz obr. 2 [3].
Farmakokinetické vlastnosti
Absorpce a distribuce
Po perorálním podání jednotlivé dávky 800 mg pazopanibu pacientům se solidními tumory bylo maximální plazmatické koncentrace (cmax) s hodnotou přibližně 19 Ī 13 mg/ml dosaženo po mediánu 3,5 hodiny (rozmezí 1,0–11,9 hodin) a přibližně 650 Ī 500 mg.h/ml byla dosažená AUCnek. Při denním podávání dochází k 1,2–4násobnému zvýšení AUCT. Při dávkách vyšších než 800 mg pazopanibu nebylo pozorováno žádné odpovídající zvýšení AUC ani cmax. Pokud je pazopanib podáván s jídlem, je jeho systémová expozice zvýšena až na dvojnásobek. Z tohoto důvodu se má pazopanib podávat alespoň 2 hodiny po jídle nebo alespoň jednu hodinu před jídlem. Po podání rozdrcené tablety pazopanibu je biologická dostupnost a rychlost perorální absorpce pazopanibu až dvojnásobně vyšší než po podání celé tablety. Vazba pazopanibu na proteiny lidské plazmy in vivo je vyšší než 99 % bez ohledu na koncentraci v rozmezí 10–100 mg/ml. Studie in vitro naznačují, že pazopanib je substrátem P-glykoproteinu a BCRP (breast cancer resistance protein).
Metabolismus a vylučování
Výsledky ze studií in vitro prokazují, že metabolismus pazopanibu je zprostředkován primárně CYP3A4 s malým podílem CYP1A2 a CYP2C8. Čtyři hlavní metabolity pazopanibu zodpovídají pouze za 6 % expozice v plazmě. Jeden z těchto metabolitů inhibuje proliferaci lidských endotelových buněk umbilikální žíly stimulovanou VEGF s podobnou účinností jako pazopanib, ostatní jsou 10–20násobně méně účinné. Proto je aktivita pazopanibu závislá hlavně na expozici původnímu pazopanibu. Pazopanib je po podání doporučené dávky 800 mg eliminován pomalu se středním poločasem 30,9 hodiny. Eliminace probíhá převážně stolicí, renální cestou jsou eliminována méně než 4 % podané dávky.
Farmakokinetika u speciálních skupin pacientů
Porucha renálních funkcí. Výsledky studií naznačují, že méně než 4 % dávky pazopanibu podaného perorálně jsou vyloučena močí ve formě pazopanibu a jeho metabolitů, proto je nepravděpodobné, aby porucha renálních funkcí měla klinicky významný vliv na farmakokinetiku pazopanibu. U pacientů s clearance kreatininu vyšší než 30 ml/min není nutno dávku upravovat. Pacientům s clearance kreatininu nižší než 30 ml/min je třeba věnovat zvláštní pozornost, protože s podáváním pazopanibu této skupině nemocných nejsou žádné zkušenosti. Porucha jaterních funkcí. U subjektů se středně těžkou poruchou jaterních funkcí je medián cmax i AUC(0–6 hodin) pazopanibu normalizovaný k dávce 800 mg/den dvojnásobně nižší v porovnání s hodnotami u subjektů s normálními jaterními funkcemi. Dávkování pazopanibu u subjektů se středně těžkou poruchou jaterních funkcí by mělo být sníženo na 200 mg jednou denně. U subjektů s mírnou poruchou jaterních funkcí nejsou údaje k dispozici. Pazopanib je kontraindikován u pacientů s těžkou poruchou jaterních funkcí.
Klinické zkušenosti
Ve studii fáze I se prokázalo, že pazopanib je absorbován při perorálním podání a jeho podávání v dávce 800 mg je spojeno s přijatelným bezpečnostním profilem a povzbudivou účinností, zejména u nemocných s metastazujícím světlobuněčným karcinomem ledviny (mRCC, metastatic Renal Cell Cancer) [6].
První registrační studie [7] byla navržena jako randomizovaná diskontinuální studie fáze II, ale na základě doporučení monitorovací komise bylo uspořádání změněno na otevřenou studii, protože u prvních 60 pacientů bylo dosaženo četnosti léčebných odpovědí 38 %. Hlavní cíl studie byl změněn na četnost léčebných odpovědí. Pazopanib byl podáván v dávce 800 mg 1krát denně. Studie zařadila 225 nemocných s RCC, 155 z nich (69 %) bez předchozí terapie a 70 nemocných (31 %) dostávalo dříve jeden režim založený na cytokinech nebo bevacizumabu. Celková četnost léčebných odpovědí byla 35 % a střední trvání odpovědi 68 týdnů. Střední doba přežití bez progrese (PFS, progression-free survival) byla 52 týdnů (11,9 měsíce). Pazopanib byl dobře snášen, hlavním nežádoucím účinkem v této studii byly průjmy, slabost a odbarvení vlasů. V laboratorních testech bylo pozorováno zejména zvýšení hladin transamináz AST a ALT.
Bezpečnost a účinnost pazopanibu v léčbě pacientů s mRCC byla následně hodnocena v randomizované, dvojitě zaslepené multicentrické studii kontrolované placebem [8]. Pacienti (n = 435) s lokálně pokročilým a/nebo metastazujícím RCC byli rozděleni do skupiny s pazopanibem v dávce 800 mg jednou denně nebo s placebem. ![Graf 1 Kumulativní incidence progrese onemocnění (PFS) podle nezávislého hodnocení u celé studované populace (A), u nepředléčených pacientů (B) a u skupiny s předchozí léčbou cytokiny (C); podle [8] – Sternberg et al., 2010.](https://www.remedia.cz/photo-a-28181---.jpg) Hlavním cílem studie bylo zhodnocení a porovnání dvou ramen léčby, pokud jde o přežití bez progrese (progression-free survival, PFS); nejdůležitějším vedlejším cílovým parametrem bylo celkové přežití (overall survival, OS). Další vedlejší cílové parametry hodnotily celkovou míru odpovědi a trvání odpovědi. Z celkového počtu 435 pacientů v této studii bylo 233 pacientů dříve neléčených a 202 pacientů již podstoupilo jednu předchozí léčbu na bázi interleukinu 2 nebo interferonu a. Výkonnostní stav nemocných (performance status dle ECOG) byl ve skupině s pazopanibem a placebem podobný (ECOG 0: 42 % vs. 41 %, ECOG 1: 58 % vs. 59 %). Většina pacientů se nacházela ve skupině s nízkým rizikem (39 %) nebo středním rizikem (54 %) podle prognostických faktorů MSKCC (Memorial Sloan Kettering Cancer Centre) [9]. Všichni pacienti měli nádor histologicky tvořený světlými buňkami (clear cell) nebo s převahou světlých buněk. Přibližně u poloviny ze všech pacientů postihlo onemocnění tři nebo více orgánů a většina pacientů měla na počátku léčby metastatická ložiska v plicích (74 %) a/nebo v lymfatických uzlinách (54 %). V obou ramenech byl podobný poměr pacientů dosud neléčených a již dříve léčených cytokiny (53 % a 47 % v rameni s
Hlavním cílem studie bylo zhodnocení a porovnání dvou ramen léčby, pokud jde o přežití bez progrese (progression-free survival, PFS); nejdůležitějším vedlejším cílovým parametrem bylo celkové přežití (overall survival, OS). Další vedlejší cílové parametry hodnotily celkovou míru odpovědi a trvání odpovědi. Z celkového počtu 435 pacientů v této studii bylo 233 pacientů dříve neléčených a 202 pacientů již podstoupilo jednu předchozí léčbu na bázi interleukinu 2 nebo interferonu a. Výkonnostní stav nemocných (performance status dle ECOG) byl ve skupině s pazopanibem a placebem podobný (ECOG 0: 42 % vs. 41 %, ECOG 1: 58 % vs. 59 %). Většina pacientů se nacházela ve skupině s nízkým rizikem (39 %) nebo středním rizikem (54 %) podle prognostických faktorů MSKCC (Memorial Sloan Kettering Cancer Centre) [9]. Všichni pacienti měli nádor histologicky tvořený světlými buňkami (clear cell) nebo s převahou světlých buněk. Přibližně u poloviny ze všech pacientů postihlo onemocnění tři nebo více orgánů a většina pacientů měla na počátku léčby metastatická ložiska v plicích (74 %) a/nebo v lymfatických uzlinách (54 %). V obou ramenech byl podobný poměr pacientů dosud neléčených a již dříve léčených cytokiny (53 % a 47 % v rameni s 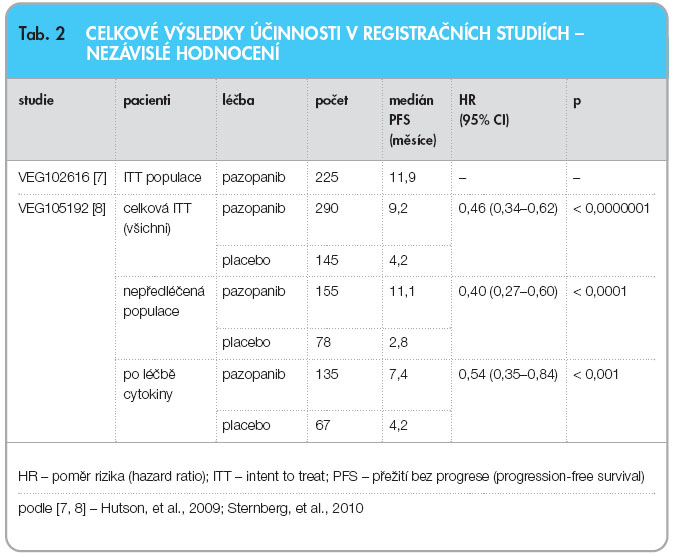 pazopanibem, 54 % a 46 % v rameni s placebem). V podskupině, která byla již dříve léčena cytokiny, podstoupila většina pacientů (75 %) předchozí terapii interferony. V obou ramenech byl podobný poměr pacientů s předchozí nefrektomií (89 % ve skupině s pazopanibem a 88 % ve skupině s placebem) a/nebo s předchozí radioterapií (22 % ve skupině s pazopanibem a 15 % ve skupině s placebem). Analýza PFS je založena na hodnocení onemocnění nezávislým radiologickým vyšetřením v celé studijní populaci (dosud neléčení pacienti i pacienti dříve léčení cytokiny), viz graf 1. Podle nezávislého hodnocení byl u pacientů, kteří odpovídali na léčbu, medián doby k dosažení odpovědi 11,9 týdne a medián trvání odpovědi 58,7 týdne. Výsledky PFS obou studií jsou shrnuty v tab. 2. V dotaznících kvality života (EORTC QLQ-C30 a EuroQoL EQ-5D) nebyl mezi léčebnými skupinami pozorován žádný statisticky významný rozdíl. Po progresi byla pacientům v rameni s placebem umožněna léčba pazopanibem v navazující otevřené studii (VEG107769).
pazopanibem, 54 % a 46 % v rameni s placebem). V podskupině, která byla již dříve léčena cytokiny, podstoupila většina pacientů (75 %) předchozí terapii interferony. V obou ramenech byl podobný poměr pacientů s předchozí nefrektomií (89 % ve skupině s pazopanibem a 88 % ve skupině s placebem) a/nebo s předchozí radioterapií (22 % ve skupině s pazopanibem a 15 % ve skupině s placebem). Analýza PFS je založena na hodnocení onemocnění nezávislým radiologickým vyšetřením v celé studijní populaci (dosud neléčení pacienti i pacienti dříve léčení cytokiny), viz graf 1. Podle nezávislého hodnocení byl u pacientů, kteří odpovídali na léčbu, medián doby k dosažení odpovědi 11,9 týdne a medián trvání odpovědi 58,7 týdne. Výsledky PFS obou studií jsou shrnuty v tab. 2. V dotaznících kvality života (EORTC QLQ-C30 a EuroQoL EQ-5D) nebyl mezi léčebnými skupinami pozorován žádný statisticky významný rozdíl. Po progresi byla pacientům v rameni s placebem umožněna léčba pazopanibem v navazující otevřené studii (VEG107769).
Zařazení do současné palety léčiv
Pazopanib je registrován Evropskou lékovou agenturou (EMA) pro léčbu metastazujícího karcinomu ledviny k 14. 6. 2010 – viz odstavec Indikace. V České republice dosud nejsou stanoveny podmínky úhrady ze zdrojů veřejného zdravotního pojištění.
Indikace
Přípravek obsahující pazopanib je určen k podávání v první linii léčby pokročilého a/nebo metastazujícího karcinomu ledviny (renal cell carcinoma, RCC) a k léčbě pacientů, kterým byly dříve podávány cytokiny pro pokročilé onemocnění [5].
Kontraindikace
Kontraindikací pro podávání pazopanibu je hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku a těžká porucha jaterních funkcí.
Nežádoucí účinky
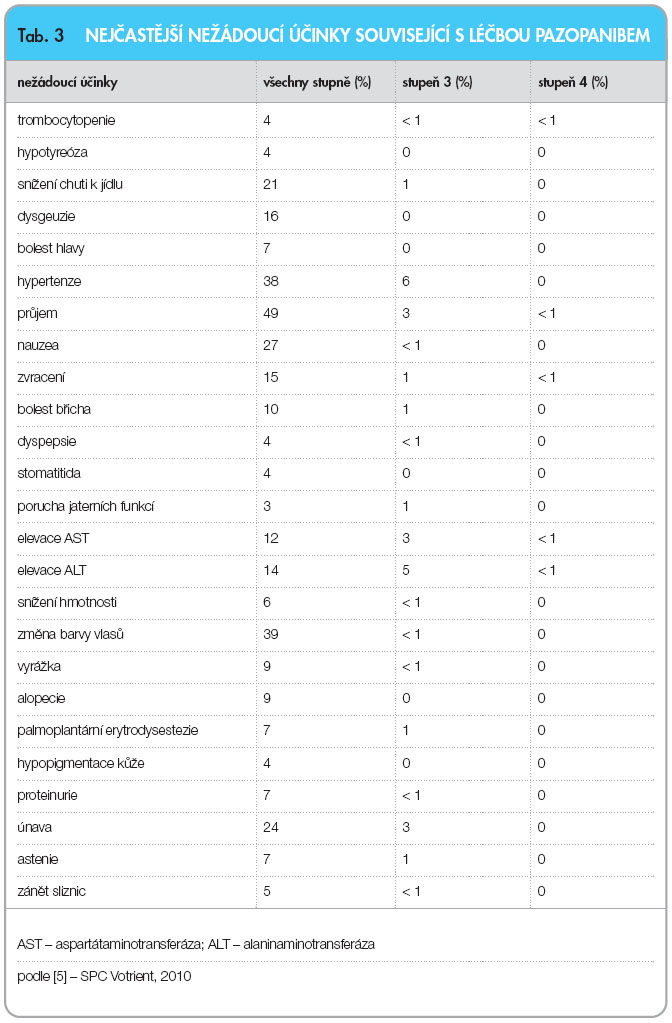 Základní údaje o toxicitě pazopanibu vycházejí z pozorování četnosti a závažnosti nežádoucích účinků v klinických hodnoceních u celkového počtu 586 subjektů s RCC. Údaje pocházejí z pivotní studie RCC (VEG105192, n = 290) [8], rozšířené studie (VEG107769, n = 71) [5] a podpůrné studie fáze II (VEG102616, n = 225) [7]. Nejčastějšími nežádoucími účinky jsou průjem, hypertenze, změna barvy vlasů, porucha chuti k jídlu, nevolnost, únava a vzestup hladiny jaterních enzymů. Závažné nežádoucí účinky byly hlášeny s frekvencí méně než 1 %. Nejčastější nežádoucí účinky s frekvencí vyšší než 4 % všech stupňů závažnosti nebo vyšší než 1 % závažnosti stupně 3 a/nebo 4 jsou shrnuty v tab. 3.
Základní údaje o toxicitě pazopanibu vycházejí z pozorování četnosti a závažnosti nežádoucích účinků v klinických hodnoceních u celkového počtu 586 subjektů s RCC. Údaje pocházejí z pivotní studie RCC (VEG105192, n = 290) [8], rozšířené studie (VEG107769, n = 71) [5] a podpůrné studie fáze II (VEG102616, n = 225) [7]. Nejčastějšími nežádoucími účinky jsou průjem, hypertenze, změna barvy vlasů, porucha chuti k jídlu, nevolnost, únava a vzestup hladiny jaterních enzymů. Závažné nežádoucí účinky byly hlášeny s frekvencí méně než 1 %. Nejčastější nežádoucí účinky s frekvencí vyšší než 4 % všech stupňů závažnosti nebo vyšší než 1 % závažnosti stupně 3 a/nebo 4 jsou shrnuty v tab. 3.
Účinky na játra
Při užívání pazopanibu byly hlášeny případy jaterního selhání (včetně případů končících úmrtím). Bezpečnost a farmakokinetika pazopanibu nebyla zatím u pacientů s preexistující poruchou jaterních funkcí plně stanovena. Podávání pazopanibu pacientům s mírnou až středně těžkou poruchou jaterních funkcí má probíhat pouze za zvýšené opatrnosti a pečlivého monitorování. U pacientů se středně těžkou poruchou jaterních funkcí je doporučena snížená dávka 200 mg pazopanibu jednou denně. U pacientů s mírnou poruchou jaterních funkcí jsou k dispozici pouze nedostatečné údaje, na jejichž základě nelze učinit žádná doporučení ohledně úpravy dávkování u těchto nemocných. Pazopanib je kontraindikován u pacientů s těžkou poruchou jaterních funkcí. V klinických studiích s pazopanibem bylo pozorováno zvýšení hladin sérových transamináz (ALT, AST) a bilirubinu. Ve většině těchto případů bylo hlášeno izolované zvýšení hladin ALT a AST, bez současných elevací alkalické fosfatázy nebo bilirubinu. Sérové jaterní testy je třeba provést před zahájením léčby pazopanibem, nejméně jednou za každé 4 týdny v průběhu prvních 4 měsíců léčby a podle klinického zvážení. Pravidelné monitorování má poté pokračovat následujícím způsobem: Pacienti s izolovanými elevacemi transamináz ≤ 8násobek ULN (horní hranice normy, upper limit of normal) mohou pokračovat v užívání pazopanibu s týdenními kontrolami jaterních funkcí až do úpravy hladin transamináz na stupeň 1 nebo k výchozím hodnotám. U pacientů s transaminázami > 8násobek ULN je třeba léčbu pazopanibem přerušit, dokud nedojde k úpravě na stupeň 1 nebo k výchozím hodnotám. Pokud možný prospěch ze znovuzahájení léčby pazopanibem převáží rizika hepatotoxicity, pak se léčba pazopanibem znovu zahájí podáváním snížených dávek a jaterní testy se kontrolují každý týden po dobu 8 týdnů. Když se po znovuzahájení léčby pazopanibem objeví elevace transamináz > 3násobek ULN, léčba pazopanibem se má ukončit. Pokud se objeví zvýšená hladina transamináz > 3násobek ULN společně se zvýšenou hladinou bilirubinu > 2násobek ULN, je třeba provést vyšetření jednotlivých frakcí bilirubinu. Pokud tvoří množství přímého (konjugovaného) bilirubinu > 35 % celkového bilirubinu, léčba pazopanibem se má ukončit.
HypertenzePřed zahájením léčby pazopanibem má být krevní tlak náležitě upraven. Pacienti mají být sledováni, zda se u nich neobjeví hypertenze, a dle potřeby léčeni standardní antihypertenzní terapií. Hypertenze se objevuje časně v průběhu léčby (88 % případů se objeví v průběhu prvních 18 týdnů). V případě hypertenze přetrvávající navzdory antihypertenzní terapii může být dávka pazopanibu snížena. U pacientů s těžkou hypertenzí, která přetrvává, přestože byla zahájena léčba antihypertenzivy a dávka pazopanibu snížena, se doporučuje terapii pazopanibem dočasně přerušit. V léčbě je možné pokračovat, až když je hypertenze dostatečně upravena.
Prodloužení QT intervalu a torsade de pointes
V klinických studiích s pazopanibem se objevily případy prodloužení QT intervalu. U pacientů s preexistujícím relevantním srdečním onemocněním má být pazopanib podáván s opatrností a doporučuje se provést úvodní a pravidelné monitorování EKG. Hladiny elektrolytů (tj. kalcium, magnezium, kalium) je třeba udržovat v rozmezí normálních hodnot.
Arteriální trombotické příhody
V klinických studiích s pazopanibem byly pozorovány infarkt myokardu, ischemická cévní mozková příhoda a tranzitorní ischemická ataka. Pazopanib má být podáván s opatrností u pacientů se zvýšeným rizikem kterékoli z těchto příhod. Rozhodnutí o léčbě má být založeno na zhodnocení prospěšnosti/rizika u každého jednotlivého pacienta.
Krvácivé příhody
V klinických studiích s pazopanibem byly hlášeny hemoragické příhody. Podávání pazopanibu pacientům s anamnézou hemoptýzy, cerebrálního nebo klinicky významného gastrointestinálního krvácení v průběhu posledních 6 měsíců se nedoporučuje. Pazopanib má být podáván s opatrností u pacientů s významným rizikem krvácení.
Gastrointestinální perforace a píštěl
V klinických studiích s pazopanibem se objevily gastrointestinální perforace nebo píštěle. Pazopanib má být podáván pacientům s rizikem gastrointestinální perforace nebo vzniku píštělí s opatrností.
Hojení ran
Žádné formální studie účinku pazopanibu na hojení ran nebyly provedeny. Protože inhibitory VEGF mohou narušovat hojení ran, má být léčba pazopanibem ukončena alespoň 7 dní před plánovaným chirurgickým výkonem. Rozhodnutí o znovuzahájení léčby pazopanibem po chirurgickém výkonu má být založeno na klinickém zhodnocení dostatečného zhojení rány. Léčba pazopanibem má být přerušena u pacientů s dehiscencí rány.
Hypotyreóza
V klinických studiích s pazopanibem byly zaznamenány případy hypotyreózy. Doporučuje se provést vstupní laboratorní vyšetření a průběžné monitorování funkce štítné žlázy laboratorní i klinické.
Proteinurie
V klinických studiích s pazopanibem byly hlášeny případy proteinurie. Doporučuje se provést vstupní a opakované vyšetření moči v průběhu léčby a pacienti mají být sledováni, zda u nich nedochází ke zhoršení proteinurie. U pacientů se 4. stupněm proteinurie má být léčba pazopanibem ukončena.
Lékové interakce
Vzhledem k možnému riziku zvýšení expozice pazopanibu je třeba se vyvarovat souběžné léčby silnými inhibitory CYP3A4, glykoproteinu P (P-gp) nebo BCRP. Je třeba zvážit terapii alternativními souběžně podávanými léčivými přípravky, takovými, které mají nulový nebo minimální potenciál inhibovat CYP3A4, P-gp nebo BCRP. Vzhledem k riziku snížení expozice pazopanibu je třeba se vyvarovat souběžného podávání induktorů CYP3A4. Vzhledem k tomu, že pazopanib je inhibitorem UGT1A1 (uridindifosfát glukuronosyltransferázy 1A1), je při souběžném podávání pazopanibu a substrátů UGT1A1 (např. irinotekanu) nutno postupovat s opatrností.
Účinky jiných léčivých přípravků na pazopanib
Studie in vitro naznačují, že oxidativní metabolismus pazopanibu v lidských jaterních mikrozomech je zprostředkován primárně CYP3A4, s malým podílem CYP1A2 a CYP2C8. Proto mohou metabolismus pazopanibu ovlivňovat inhibitory i induktory CYP3A4. Inhibitory CYP3A4, P-gp, BCRP: Pazopanib je substrátem CYP3A4, P-gp a BCRP. Při společném podávání pazopanibu se silnými inhibitory ze skupiny CYP3A4 (např. ketokonazol, itrakonazol, klarithromycin, atazanavir, indinavir, nefazodon, nelfinavir, ritonavir, sachinavir, telithromycin, vorikonazol) může dojít ke zvýšení koncentrace pazopanibu. Grapefruitový džus obsahuje inhibitor CYP3A4 a může rovněž zvyšovat plazmatické koncentrace pazopanibu.
Podání 1500 mg lapatinibu (substrát a slabý inhibitor CYP3A4 a P-gp a silný inhibitor BCRP) s 800 mg pazopanibu vedlo k přibližně 50% až 60% zvýšení střední AUC(0–24) a cmax pazopanibu v porovnání s podáním 800 mg pazopanibu samotného. Na zvýšení expozice pazopanibu se pravděpodobně podílela inhibice P-gp a/nebo BCRP lapatinibem.
Společné podání jednotlivé dávky očních kapek pazopanibu (v nízké dávce 400 mg, tj. 80 ml o koncentraci 5 mg/ml) s ketokonazolem (silný inhibitor CYP3A4 a inhibitor P-gp) vedlo u zdravých dobrovolníků k 2,2násobnému zvýšení středních hodnot AUC(0–t) pazopanibu a 1,5násobnému zvýšení hodnot cmax pazopanibu. Na zvýšení expozice pazopanibu se pravděpodobně podílela inhibice P-gp a/nebo BCRP ketokonazolem. V současné době nelze pro silné inhibitory CYP3A4 ani ketokonazol učinit žádná dávkovací doporučení. Společné podání pazopanibu s inhibitorem CYP3A4, P-gp a BCRP, jako je např. lapatinib, povede ke zvýšení plazmatických koncentrací pazopanibu. Společné podání se silnými inhibitory P-gp nebo BCRP může rovněž ovlivnit expozici a distribuci pazopanibu, včetně distribuce do centrálního nervového systému (CNS). Je proto třeba se vyvarovat kombinace se silnými inhibitory CYP3A4, P-gp nebo BCRP, nebo se doporučuje zvolit alternativní souběžně podávané přípravky, které mají nulový nebo minimální potenciál inhibovat CYP3A4, P-gp nebo BCRP.
Induktory CYP3A4, P-gp, BCRP: Induktory CYP3A4, jako je např. rifampicin, mohou snižovat plazmatické koncentrace pazopanibu. Společné podávání pazopanibu se silnými induktory P-gp nebo BCRP může ovlivňovat expozici a distribuci pazopanibu, včetně distribuce do CNS. Je proto doporučeno zvolení alternativní souběžné medikace s žádným nebo minimálním potenciálem indukovat enzymy nebo transportní systémy.
Účinky pazopanibu na jiné léčivé přípravky
Ve studiích in vitro s lidskými jaterními mikrozomy bylo prokázáno, že pazopanib inhibuje enzymy CYP1A2, 3A4, 2B6, 2C8, 2C9, 2C19 a 2E1. Možná indukce CYP3A4 u člověka byla prokázána v testu in vitro s PXR. Klinické farmakologické studie s dávkou 800 mg pazopanibu jednou denně prokázaly, že pazopanib nemá u pacientů s karcinomem klinicky významné účinky na farmakokinetiku kofeinu (zkušební substrát CYP1A2), warfarinu (zkušební substrát CYP2C9) ani omeprazolu (zkušební substrát CYP2C19). Pazopanib měl za následek přibližně 30% zvýšení střední AUC a cmax midazolamu (zkušební substrát CYP3A4) a 33% až 64% zvýšení poměru koncentrací dextromethorfanu k dextrorfanu v moči po perorálním podání dextromethorfanu (zkušební substrát CYP2D6). Společné podávání pazopanibu 800 mg jednou denně a paklitaxelu 80 mg/m2 (substrát CYP3A4 a CYP2C8) jednou týdně vedlo k střednímu zvýšení AUC paklitaxelu o 25 % a cmax paklitaxelu o 31 %.
Na základě hodnot IC50 in vitro a plazmatické cmax in vivo lze usoudit, že metabolity pazopanibu GSK1268992 a GSK1268997 se mohou podílet na čistém inhibičním účinku pazopanibu vůči BCRP. Kromě toho nemůže být vyloučena inhibice BCRP a P-gp pazopanibem v gastrointestinálním traktu. Pokud je pazopanib podáván společně s dalšími perorálními substráty BCRP a P-gp, je třeba postupovat s opatrností. Pazopanib in vitro inhibuje lidské organické aniontové transportní polypeptidy (OATP1B1). Nelze vyloučit, že pazopanib bude ovlivňovat farmakokinetiku substrátů OATP1B1 (např. rosuvastatinu).
Těhotenství a kojení
Preklinické studie na zvířatech prokázaly reprodukční toxicitu. Adekvátní údaje o podávání pazopanibu těhotným ženám nejsou k dispozici. Pokud je pazopanib podáván v průběhu těhotenství nebo pokud pacientka během podávání pazopanibu otěhotní, je potřeba jí vysvětlit možné riziko pro plod. Ženy ve fertilním věku by měly být poučeny, aby v průběhu léčby pazopanibem užívaly vhodnou metodu antikoncepce a vyvarovaly se otěhotnění. Bezpečnost pazopanibu v průběhu kojení nebyla stanovena. Není známo, zda se pazopanib vylučuje do lidského mateřského mléka. Riziko pro kojené dítě nelze vyloučit, proto v průběhu léčby pazopanibem by mělo být kojení přerušeno.
Bylo prokázáno, že pazopanib je embryo-toxický a teratogenní u laboratorních zvířat, samců i samic při expozicích vícenásobně nižších, než je expozice u člověka Při testech genotoxicity nezpůsoboval pazopanib genetické poškození. Syntetický meziprodukt při výrobě pazopanibu, který je rovněž v malém množství přítomen v konečném léčivém přípravku, nebyl v Amesově testu mutagenní, ale byl genotoxický v testu s myšími lymfomy a v mikronukleárním testu u myší provedeném in vivo. Studie kancerogenity nebyly s pazopanibem provedeny.
Dávkování
Jedna potahovaná tableta obsahuje pazopanibum 200 mg (jako pazopanibi hydrochloridum). Doporučená dávka pazopanibu je 800 mg jednou denně. Pazopanib se podává nalačno, alespoň jednu hodinu před jídlem nebo dvě hodiny po jídle. Přípravek se užívá celý a zapíjí se dostatečným množstvím vody, nesmí se lámat ani drtit. V průběhu léčby pazopanibem je nutné nepít grapefruitový džus. Podávání pazopanibu s jídlem vede k přibližně 2násobnému zvýšení jeho absorpce, proto by pazopanib by měl být podáván nalačno. Dávka se upravuje postupným přidáváním 200 mg pazopanibu podle individuální snášenlivosti pacienta, aby bylo možné zvládnout nežádoucí účinky. Dávka pazopanibu by neměla překročit 800 mg. Vzhledem k nedostatečným údajům o bezpečnosti a účinnosti se podávání pazopanibu dětem a dospívajícím mladším 18 let nedoporučuje.
Balení
Pazopanib je distribuován v HDPE lahvičce s dětským bezpečnostním uzávěrem obsahující 30 nebo 90 tablet. Doba použitelnosti je 2 roky a přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Poznámky k zařazení pazopanibu do současné palety léčiv
Vzhledem k tomu, že v průběhu registračních studií byl pro první linii léčby metastazujícího karcinomu ledviny registrován jiný tyrozinkinázový inhibitor – sunitinib, je registrace pazopanibu podmíněna komparací s tímto přípravkem u více než 800 nemocných v probíhající otevřené studii fáze III s akronymem COMPARZ (Pazopanib Versus Sunitinib in the Treatment of Subjects With Locally Advanced and/or Metastatic Renal Cell Carcinoma). Další komparativní probíhající studií je studie PISCES (Patient Preference Study of Pazopanib Versus Sunitinib in Advanced or Metastatic Kidney Cancer), která plánuje zařadit celkem 160 nemocných v léčbě 1. linie mRCC v uspořádání randomizovaném, dvojitě zaslepeném a umožňujícím změnu léčebného ramene (cross-over). Cílem je zjistit preference pacientů mezi sunitinibem a pazopanibem. V nejbližších týdnech bude zahájena randomizovaná studie fáze III testující účinnost pazopanibu v adjuvantním podávání po chirurgickém odstranění světlobuněčného nádoru ledviny při vysokém riziku jeho recidivy (VEG113387).
Seznam použité literatury
- [1] Votrient. Prescribing information. http://us.gsk. com/products/assets/us_votrient.pdf Accessed 15. 11. 2010.
- [2] Gotink KJ, Verheul HMW. Anti-angiogenic tyrosine kinase inhibitors: what is their mechanism of action? Angiogenesis 2010; 13: 1–14.
- [3] Kaelin WG. Molecular basis of the VHL hereditary cancer syndrome. Nat Rev Cancer 2002, 2: 673–682.
- [4] Van Spronsen DJ, de Weijer KJ, Mulders PF, et al. Novel treatment strategies in clear-cell metastatic renal cell carcinoma. Anticancer Drugs 2005; 16: 709–717.
- [5] Votrient. Souhrn údajů o přípravku. 14. 6. 2010. http://www.ema.europa.eu/ Accessed 15. 11. 2010.
- [6] Hurwitz HI, Dowlati A, Saini S, et al. Phase I trial of pazopanib (GW786034), an oral multikinase angiogenesis inhibitor, in patients with advanced cancer: Results of safety, pharmacokinetics, and clinical activity. Clin Cancer Res 2009; 15: 4220–4227.
- [7] Hutson TE, Davis ID, Machielis JH, et al. Efficacy and Safety of Pazopanib in Patients With Metastatic Renal Cell Carcinoma. J Clin Oncol 2009; 28: 475–480.
- [8] Sternberg CN, Davis ID, Mardiak J, et al. Pazopanib in Locally Advanced or Metastatic Renal Cell Carcinoma: Results of a Randomized Phase III Trial. J Clin Oncol 2010; 28: 1061–1068.
- [9] Motzer RJ, Bacik J, Schwartz LH, et al. Prognostic Factors for Survival in Previously Treated Patients With Metastatic Renal Cell Carcinoma. J Clin Oncol 2004; 22: 454–463.
