Pemetrexed
Pemetrexed je antifolátové cytostatikum, které prokázalo účinnost v léčbě nemalobuněčného karcinomu plic (NSCLC). V současné době se v klinické praxi používá ve čtyřech indikacích, tj. v první linii léčby maligního mezoteliomu pleury a v první linii, v udržovací terapii a ve druhé linii léčby nemalobuněčného karcinomu plic. Pemetrexed prokazuje stabilně vyšší účinnost u neskvamózních typů tumoru. Poslední výsledky v indikaci udržovací terapie přinesly nový náhled na standardní léčebné režimy NSCLC.
Úvod
Karcinom plic je jedním z nejčastějších zhoubných nádorů, jeho celosvětová incidence činí více než 1,3 milionu případů ročně [1]. V roce 2006 byla v Evropě podle výsledků studií odhadována incidence karcinomu plic na 12,1 % (386 300 případů). Karcinom plic zaujímá třetí místo v incidenci karcinomů a je nejčastější příčinou úmrtí (334 800, tj. 19,7 %) [2]. Ve Spojených státech bylo diagnostikováno v roce 2007 přibližně 213 380 nových případů karcinomu plic, což představovalo asi 15 % všech diagnostikovaných karcinomů a 29 % úmrtí na karcinom [3].
Nemalobuněčný karcinom plic (NSCLC, non-small cell lung cancer) představuje přibližně 80–87 % případů karcinomu plic ve Spojených státech [3], přičemž 65–75 % těchto případů je diagnostikováno v lokálně pokročilém stavu (stadium III) nebo ve stadiu metastatického onemocnění (stadium IV) [4–6], takže často jedinou léčebnou možnost představuje paliativní terapie. Současné trendy léčby prolomily tzv. plató účinnosti (8–10 měsíců) celkového přežití díky individualizaci terapie [5]. Je proto kladen stále větší důraz na přesnější diagnostiku (histologie) a hledání prediktivních faktorů nemoci.
Farmakologická skupina
Chemické a fyzikální vlastnosti
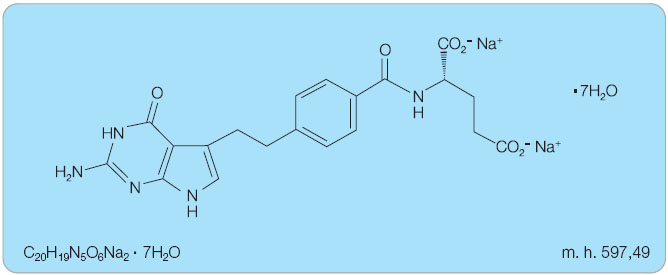 Chemický vzorec pemetrexedu je N-[4-[2-(2-amino-3,4-dihydro-4-oxo-7H-pyrolo[2,3-d]pyrimidin-5-yl)-ethyl]-benzoyl]-L-glutamová kyselina (obr. 1).Vyskytuje se jako disodná sůl, heptahydrát.
Chemický vzorec pemetrexedu je N-[4-[2-(2-amino-3,4-dihydro-4-oxo-7H-pyrolo[2,3-d]pyrimidin-5-yl)-ethyl]-benzoyl]-L-glutamová kyselina (obr. 1).Vyskytuje se jako disodná sůl, heptahydrát.
Mechanismus účinku, farmakodynamika
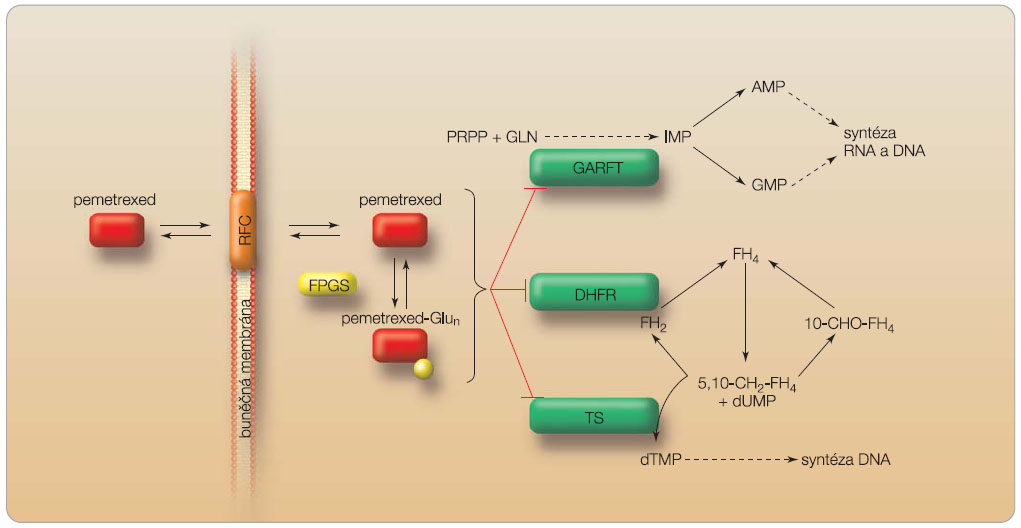 Pemetrexed představuje antifolátové cytostatikum působící na řadu enzymatických systémů. Rozhodující pro jeho účinek je narušení metabolického procesu folátů, které jsou potřebné pro replikaci buněk. Studie in vitro prokázaly, že pemetrexed inhibuje tymidylátsyntázu (TS), dihydrofolátreduktázu (DHFR) a glycinamid ribonukleotid formyltransferázu (GARFT), tedy klíčové enzymy při procesu biosyntézy thymidinu a purinových nukleotidů de novo, viz obr. 2.
Pemetrexed představuje antifolátové cytostatikum působící na řadu enzymatických systémů. Rozhodující pro jeho účinek je narušení metabolického procesu folátů, které jsou potřebné pro replikaci buněk. Studie in vitro prokázaly, že pemetrexed inhibuje tymidylátsyntázu (TS), dihydrofolátreduktázu (DHFR) a glycinamid ribonukleotid formyltransferázu (GARFT), tedy klíčové enzymy při procesu biosyntézy thymidinu a purinových nukleotidů de novo, viz obr. 2.
Pemetrexed se přenáší do buněk dvěma způsoby – usnadněnou difuzí pomocí redukovaného folátového nosiče a selektivní endocytózou s vazbou na α-receptor. V buňce je pemetrexed rychle a efektivně přeměněn na polyglutamátové formy enzymem folylpolyglutamátsyntetázou. Tyto formy způsobují protrahovanou, asi 100krát delší retenci v buňce, čímž je umožněna lepší inhibice TS a GARFT [7–10]. Z buněk je pemetrexed eliminován pomocí MRP (multidrug-resistance protein).
Farmakokinetické vlastnosti
Farmakokinetické vlastnosti pemetrexedu po podání v monoterapii byly hodnoceny u 426 pacientů s různými maligními tumory solidní formy, kterým byla léčivá látka podávána v dávkách od 0,2 mg/m2 do 838 mg/m2 infuzí po dobu 10 minut. Distribuční objem (Vdss) pemetrexedu v ustáleném stavu činil 9 l/m2. Studie in vitro ukazují, že pemetrexed se přibližně z 81 % váže na plazmatické proteiny. Různý stupeň postižení ledvin nevede k významnému ovlivnění této vazby. Pemetrexed je v omezené míře metabolizován v játrech [11]. Pemetrexed se primárně vylučuje močí, přičemž 70–90 % podané dávky se eliminuje močí v nezměněné formě během prvních 24 hodin po jeho podání. Celková systémová clearance (Cl) pemetrexedu je 91,8 ml/min a eliminační poločas plazmy (t1/2) je 3,5 hodiny 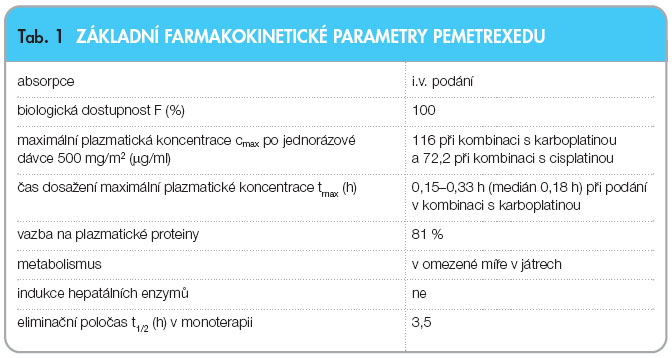 u pacientů s normální funkcí ledvin (clearance kreatininu ClR = 90 ml/min). Variabilita clearance mezi pacienty je střední, a to 19,3 %. Celková systémová expozice pemetrexedu (AUC) a maximální plazmatická koncentrace rostou proporcionálně s dávkou [11]. Farmakokinetika pemetrexedu zůstává shodná i při použití více léčebných cyklů. Farmakokinetické vlastnosti pemetrexedu nejsou ovlivněny souběžně podanou cisplatinou. Suplementace kyselinou listovou perorálně a vitaminem B12 intramuskulárně neovlivňuje farmakokinetiku pemetrexedu [11]. Farmakokinetické vlastnosti shrnuje tab. 1.
u pacientů s normální funkcí ledvin (clearance kreatininu ClR = 90 ml/min). Variabilita clearance mezi pacienty je střední, a to 19,3 %. Celková systémová expozice pemetrexedu (AUC) a maximální plazmatická koncentrace rostou proporcionálně s dávkou [11]. Farmakokinetika pemetrexedu zůstává shodná i při použití více léčebných cyklů. Farmakokinetické vlastnosti pemetrexedu nejsou ovlivněny souběžně podanou cisplatinou. Suplementace kyselinou listovou perorálně a vitaminem B12 intramuskulárně neovlivňuje farmakokinetiku pemetrexedu [11]. Farmakokinetické vlastnosti shrnuje tab. 1.
Klinické zkušenosti
Maligní mezoteliom pleury
Maligní mezoteliom pleury (MPM) je nádor s velmi špatnou prognózou. Málokdy lze provést kurativní chirurgický zákrok. Radioterapie má pouze paliativní účinek s analgetickým efektem. Ovlivnění tohoto onemocnění pomocí chemoterapie je značně problematické, neboť chemosenzitivita je malá. V klinických studiích i v praxi byla v minulosti zkoušena řada léčivých látek jak v monoterapii, tak v různých kombinacích. Bohužel nebyla prokázána výraznější léčebná odpověď.
V roce 2003 publikovali Vogelzang a kol. rozsáhlou studii fáze III u 456 nemocných s dříve neléčeným maligním mezoteliomem pleury [12]. Pacienti byli randomizováni do dvou skupin; léčebná skupina dostala kombinaci pemetrexed 500 mg/m2 s cisplatinou 75 mg/m2 a kontrolní skupině byla podána monoterapie cisplatinou 75 mg/m2. Povinná suplementace vitaminem B12 a kyselinou listovou doporučená SPC byla zařazena jen u pacientů léčených pemetrexedem. Medián přežívání v rameni cisplatina/pemetrexed byl 12,1 měsíce vs. 9,3 měsíce v kontrolním rameni (p = 0,02). Počet objektivních léčebných odpovědí byl také signifikantně vyšší u nemocných léčených pemetrexedem (41,3 % vs. 16,7 %). Tato registrační studie vedla ke schválení indikace a úhrady v léčbě první linie MPM. V současné době není tato kombinace překonána žádným jiným komparátorem, je tudíž možné považovat kombinaci pemetrexed/cisplatina v této indikaci za standard.
Nemalobuněčný karcinom plic
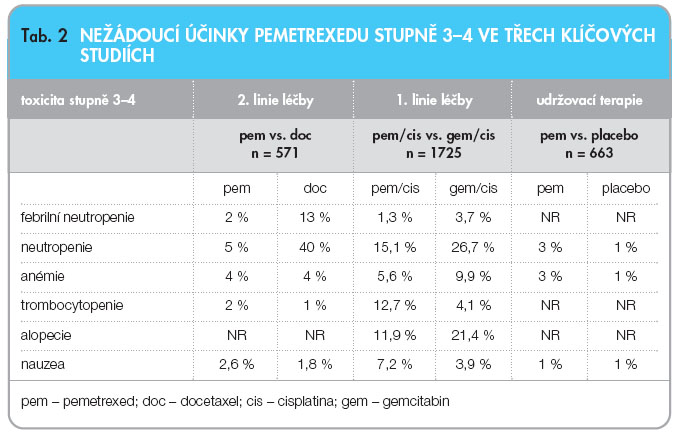 Pemetrexed je v ČR indikován i k léčbě nemalobuněčného karcinomu plic (NSCLC). K dnešnímu dni je v této indikaci plně schválena úhrada jen pro druhou linii léčby. Výsledky studie JMEI [13] – dvojitě zaslepená studie fáze III u pacientů s pokročilým NSCLC – byly publikovány v roce 2004. Randomizováno bylo 571 nemocných do dvou ramen: pemetrexed 500 mg/m2 vs. docetaxel 75 mg/m2. Ve studii byla prokázána non-inferiorita, neboť medián přežívání byl 8,3 vs. 7,9 měsíce bez statistické významnosti. Čím se však výsledky lišily, byla toxicita. U pacientů léčených pemetrexedem byly zaznamenány lepší profily toxicity (stupeň 3/4): neutropenie 5,3 % vs. 40,2 % (p < 0,001), febrilní neutropenie 1,9 % vs. 12,7 % (p < 0,001), neutropenie s infekcí 0 % vs. 3,3 % (p = 0,004), hospitalizace pro febrilní neutropenii 1,5 % vs. 13,4 % (p < 0,001) a také se v menší míře podávaly hemopoetické růstové faktory G-CSF (2,6 % vs. 19,2 %; p < 0,001), méně častá byla rovněž alopecie, viz tab. 2.
Pemetrexed je v ČR indikován i k léčbě nemalobuněčného karcinomu plic (NSCLC). K dnešnímu dni je v této indikaci plně schválena úhrada jen pro druhou linii léčby. Výsledky studie JMEI [13] – dvojitě zaslepená studie fáze III u pacientů s pokročilým NSCLC – byly publikovány v roce 2004. Randomizováno bylo 571 nemocných do dvou ramen: pemetrexed 500 mg/m2 vs. docetaxel 75 mg/m2. Ve studii byla prokázána non-inferiorita, neboť medián přežívání byl 8,3 vs. 7,9 měsíce bez statistické významnosti. Čím se však výsledky lišily, byla toxicita. U pacientů léčených pemetrexedem byly zaznamenány lepší profily toxicity (stupeň 3/4): neutropenie 5,3 % vs. 40,2 % (p < 0,001), febrilní neutropenie 1,9 % vs. 12,7 % (p < 0,001), neutropenie s infekcí 0 % vs. 3,3 % (p = 0,004), hospitalizace pro febrilní neutropenii 1,5 % vs. 13,4 % (p < 0,001) a také se v menší míře podávaly hemopoetické růstové faktory G-CSF (2,6 % vs. 19,2 %; p < 0,001), méně častá byla rovněž alopecie, viz tab. 2.
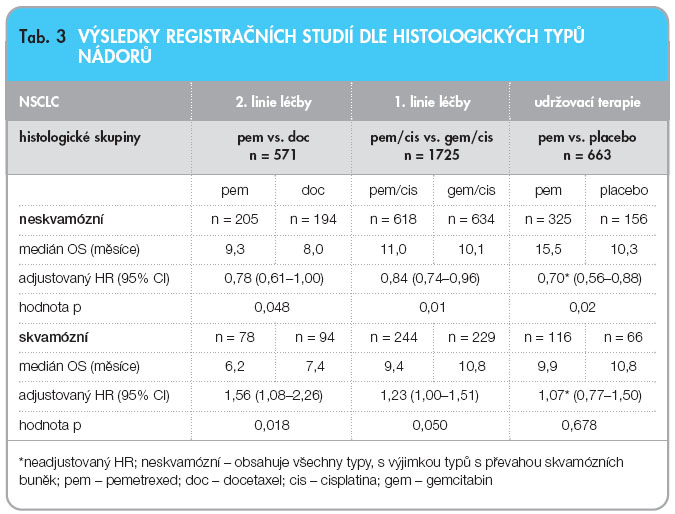 V roce 2007 publikovali Peterson a kol. retrospektivní analýzu této studie s cílem zaměřit se na histologické typy NSCLC a na účinnost pemetrexedu v jednotlivých skupinách [14]. Mediány přežití byly u velkobuněčného karcinomu 12,8 měsíce, u adenokarcinomu 9 měsíců, u skvamocelulárního karcinomu 6,3 měsíce. Výsledky ukázaly, že v podskupině s neskvamocelulárním karcinomem bylo přežití u skupiny s pemetrexedem signifikantně delší než u skupiny léčené docetaxelem (p = 0,048), viz tab. 3.
V roce 2007 publikovali Peterson a kol. retrospektivní analýzu této studie s cílem zaměřit se na histologické typy NSCLC a na účinnost pemetrexedu v jednotlivých skupinách [14]. Mediány přežití byly u velkobuněčného karcinomu 12,8 měsíce, u adenokarcinomu 9 měsíců, u skvamocelulárního karcinomu 6,3 měsíce. Výsledky ukázaly, že v podskupině s neskvamocelulárním karcinomem bylo přežití u skupiny s pemetrexedem signifikantně delší než u skupiny léčené docetaxelem (p = 0,048), viz tab. 3.
Účinnost pemetrexedu v první linii léčby NSCLC byla prokázána dvojitě zaslepenou studií (JMDB) Scagliottiho a kol. v roce 2008 [15]. Jedná se o historicky nejrozsáhlejší klinickou studii u pokročilého/ metastatického NSCLC: 1725 chemonaivních pacientů bylo randomizováno do dvou ramen. V prvním rameni byli pacienti léčeni kombinací pemetrexed 500 mg/m2 plus cisplatina 75 mg/m2 (PC), ve druhém rameni kombinací gemcitabin 1250 mg/m2 plus cisplatina 75 mg/m2 (GC). Hlavním cílem studie bylo celkové přežívání (OS). V této studii byla předem naplánována analýza dle histologických typů, což se v závěru ukázalo jako klíčové, neboť u celkově testované populace bylo OS v obou ramenech identické, a to 10,3 měsíce. Nebyl prokázán statisticky významný rozdíl ani v časovém intervalu do počátku progrese, v přežití jednoho a dvou let a ani v odpovědi na léčbu. Rozdíly byly opět v toxicitě. Skupina s pemetrexedem prokázala opět nižší profil hematologické i nehematologické toxicity, viz tab. 2. Výsledky se ale značně lišily v jednotlivých histologických typech. Kombinovaná léčba s pemetrexedem prokázala lepší celkové přežití u pacientů s adenokarcinomem, kde byl zaznamenán medián přežití 12,6 vs. 10,9 měsíce (p superiority = 0,033). Ještě větší rozdíl byl zjištěn u nemocných s velkobuněčným karcinomem, kde byl medián přežití 10,4 vs. 6,7 měsíce (p superiority = 0,027) pro pemetrexed. U skvamocelulárního karcinomu se ukázala jako výhodnější léčba GC s výsledným mediánem přežití 10,8 vs. 9,4 měsíce (p superiority = 0,050). Kombinace pemetrexed/cisplatina prokázala statisticky významné lepší celkové přežití u skupiny s histologicky neskvamózním typem nádoru (n = 1000; 11,8 vs. 10,4 měsíce), viz tab. 3.
Výsledky této studie vedly k tomu, že kombinace pemetrexed/cisplatina se stala standardem pro léčbu první linie pokročilého NSCLC. Na základě těchto dat je v České republice nyní žádáno o plnou úhradu v této indikaci. Novinkou letošního roku jsou velice příznivé výsledky ze studie JMEN, která se zabývala udržovací léčbou pokročilého NSCLC [16]. Tato studie byla první, která prokázala významné prodloužení jak časového úseku do počátku progrese, tak celkového přežití. Na základě výsledků byl pemetrexed jako první schválen v indikaci pokročilého NSCLC v udržovací terapii. Tato studie opět prokázala mimořádnou účinnost pemetrexedu oproti komparátorům v léčbě pacientů s tumory predominantně jiného typu než s převahou z dlaždicových buněk.
Na setkání ASCO 2009 (American Society of Clinical Oncology) pak prezentovali Ciuleanu a kol. výsledky fáze III dvojitě zaslepené studie, která byla publikována v září 2009 [16]. Do studie bylo zařazeno 745 pacientů s pokročilým NSCLC stadia IIIB/IV. Po absolvování první linie léčby (platinový dublet), nenastala-li progrese, následovala udržovací terapie, která byla podávána až do progrese či do projevu toxicity. Pacienti (n = 663) byli rozděleni do dvou větví: pemetrexed 500 mg/m2 vs. placebo. Primárním cílem, který byl splněn, bylo zhodnotit časový úsek do počátku progrese onemocnění. Detailní výsledky jsou znázorněny v tab. 3 [16].
Tyto tři velké registrační studie také prokázaly vyšší a statisticky významnou účinnost pemetrexedu u tumorů neskvamózního typu. Histologický typ tumoru se tak stal prediktivním faktorem pro terapii pemetrexedem. Můžeme tedy hovořit o individualizované terapii na základě histologie, viz tab. 4.
Zařazení do současné palety léčiv
Pemetrexed se plně etabloval ve druhé linii léčby pacientů s pokročilým NSCLC a v první linii léčby u nemocných s MPM. Nyní je v jednání úhrada přípravku z veřejného pojištění pro první linii terapie pokročilého NSCLC. Ve většině států Evropy je léčba pemetrexedem standardní terapií jak v první léčebné linii MPM, tak v první i druhé linii léčby NSCLC, ale je již indikován i v udržovací terapii NSCLC u histologicky neskvamózních typů tumorů, viz tab. 4.
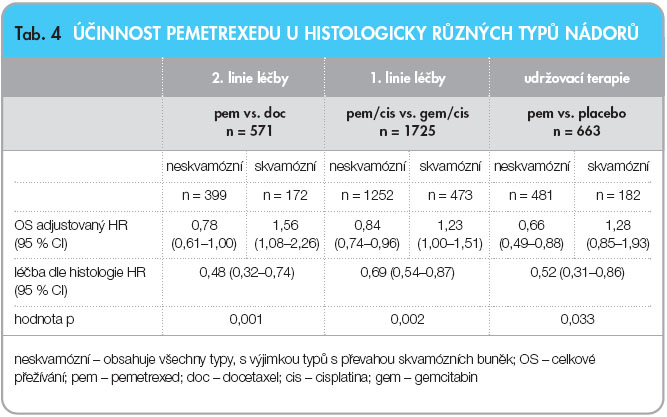
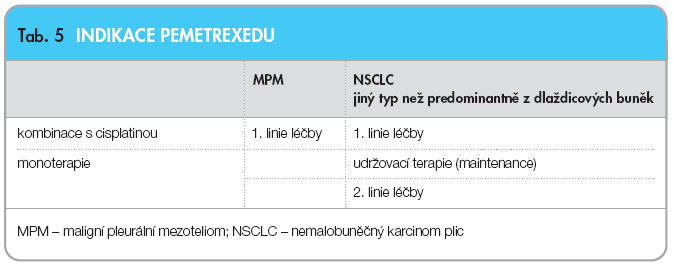 Vyšší účinnost u neskvamózní histologie nádorů, a tudíž i přítomnost tohoto prediktivního faktoru nám umožňuje určit, jaká je pozice pemetrexedu v terapii, viz tab. 5. Nesmíme zapomenout ani na příznivý toxikologický profil pemetrexedu, a tudíž na možnost prodloužení života nemocných se zachováním jeho kvality.
Vyšší účinnost u neskvamózní histologie nádorů, a tudíž i přítomnost tohoto prediktivního faktoru nám umožňuje určit, jaká je pozice pemetrexedu v terapii, viz tab. 5. Nesmíme zapomenout ani na příznivý toxikologický profil pemetrexedu, a tudíž na možnost prodloužení života nemocných se zachováním jeho kvality.
Kontraindikace
Pemetrexed je kontraindikován u pacientů s prokázanou hypersenzitivitou na léčivou látku či na kteroukoli pomocnou látku obsaženou v léčivém přípravku. Dále nesmí být přípravek podáván při kojení a taktéž nesmí být podáván současně s vakcínou proti žluté zimnici.
Nežádoucí účinky
Hematologická toxicita: leukopenie, neutropenie, trombocytopenie, anémie. Nehematologická toxicita: mukozitida, nauzea, zvracení, průjem, zácpa, alergická reakce, alopecie. Tab. 2 ukazuje výskyt nežádoucích účinků ve třech klíčových studiích.
Lékové interakce
Vzhledem ke způsobu vylučování ledvinami doporučuje výrobce opatrnost při současném podávání nefrotoxických léků. U pacientů s renální insuficiencí (clearance kreatininu ≤ 80 ml/min) může současné podávání protizánětlivých léků a kyseliny acetylsalicylové zvýšit profil nežádoucích účinků. Díky omezenému průchodu játry nelze předpovědět klinicky významnou interakci mezi léčivými látkami metabolizovanými CYP3A, CYP2D6, CYP2C9 a CYP1A2. Běžnými interakcemi všech cytostatik jsou: variabilita koagulačního stavu při současném podávání antikoagulační léčby, kontraindikace podání vakcíny proti žluté zimnici, nedoporučuje se aplikace atenuovaných očkovacích vakcín.
Dávkování
Běžná dávka pemetrexedu v kombinaci s cisplatinou je 500 mg/m2; podává se formou intravenózní infuze po dobu 10 minut první den každého 21denního cyklu. Doporučená dávka cisplatiny je 75 mg/m2 podaných infuzí během dvou hodin přibližně 30 minut po ukončení infuze pemetrexedu v první den každého 21denního cyklu. Pacienti musí dostávat přiměřenou antiemetickou terapii a hydrataci před podáním cisplatiny, případně i po jejím podání (informace o dávkování cisplatiny – viz rovněž Souhrn údajů o přípravku pro přípravky s obsahem cisplatiny). Pemetrexed v monoterapii: doporučená dávka pemetrexedu je 500 mg/m2 podávaných ve formě intravenózní infuze po dobu 10 minut první den každého 21denního cyklu. Režim premedikace: ke snížení výskytu a závažnosti kožních reakcí se podává kortikosteroid den před podáním pemetrexedu, v den jeho podání a v den po jeho podání. Kortikoid by měl být ekvivalentní 4 mg dexamethasonu podávaným perorálně 2krát denně.
Ke snížení toxicity musí pacienti léčení pemetrexedem dostávat rovněž vitaminovou suplementaci. Pacienti užívají denně kyselinu listovou perorálně nebo multivitaminy s obsahem kyseliny listové (350–1000 µg). Během sedmi dnů před aplikací první dávky pemetrexedu se musí podat nejméně pět dávek kyseliny listové a její podávání musí pokračovat po celý průběh léčby a po dobu 21 dní po podání poslední dávky pemetrexedu. Pacienti musí rovněž dostat intramuskulární injekci vitaminu B12 (1000 µg) v týdnu před aplikací první dávky pemetrexedu a jednou každé tři cykly poté. Další injekce vitaminu B12 se mohou podávat ve stejný den jako pemetrexed.
Seznam použité literatury
- [1] Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world. J Clin Oncol 2006; 24: 2137–2150.
- [2] Ferlay J, Autier P, Boniol M, et al. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol 2007; 18: 581–592.
- [3] American Cancer Society, Cancer facts and figures 2007. Atlanta GA http://www.cancer.org/ downloads/STT/CAF2007PWSecured.pdf; 2007 accessed 31. 1. 2008.
- [4] Ihde DC. Chemotherapy of lung cancer. N Engl J Med 1992; 327: 1434–1441.
- [5] Shepherd FA. Induction chemotherapy for locally advanced non-small cell lung cancer. Ann Thorac Surg 1993; 55: 1585–1592.
- [6] Walling J. Chemotherapy for advanced non-small-cell lung cancer. Respir Med 1994; 88: 649–657.
- [7] Longo-Sorbello GS, Chen B, Budak-Alpdogan T, Bertino JR. Role of pemetrexed in non-small cell lung cancer. Cancer Invest 2007; 25: 59–66.
- [8] Gibbs D, Jackman A. Pemetrexed disodium. Nat Rev Drug Discov 2005, 5: S16–S17.
- [9] Orbaugh KK. Nursing considerations for administering pemetrexed (Alimta®) in combination with cisplatin for malignant pleural mesothelioma. Clin J Oncol Nurs 2004; 8: 242–247.
- [10] Alimta. Souhrn zprávy EPAR určený pro veřejnost. http://www.emea.europa.eu/humandocs/ PDFs/ EPAR/alimta/102004cs1.pdf; 23. 10. 2009.
- [11] Alimta. Souhrn údajů o přípravku. http://www. emea.europa.eu/humandocs/PDFs/EPAR/alimta/emea-combined-h564cs.pdf; 23. 10. 2009.
- [12] Vogelzang NJ, Rusthoven JJ, Symanowski J, et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol 2003; 21: 2636–2644.
- [13] Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22: 1589–1597.
- [14] Peterson P, Park K, Fossella FV, et al. Is pemetrexed more effective in adenocarcinoma and large cell lung cancer than in squamous cell carcinoma? A retrospective analysis of a phase III trial of pemetrexed vs docetaxel in previously treated patients with advanced non-small cell lung cancer (NSCLC). Eur J Cancer Suppl 2007; 5: 363–364.
- [15] Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol 2008; 26: 3543–3551.
- [16] Ciuleanu T, Brodowicz T, Zielinski C, et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet 2009; 24: 1432–1440.