Rabeprazol
Rabeprazol je zástupcem tzv. druhé generace inhibitorů protonové pumpy. V porovnání se zástupci první generace má potenciál překonat některé jejich farmakokinetické a farmakodynamické limitace. Rabeprazol je přednostně metabolizován neenzymatickým jaterním systémem, z toho vyplývá zejména jeho snížený potenciál k lékovým interakcím na úrovni cytochromu P450. Velkou výhodou rabeprazolu je rychlost nástupu jeho účinku v porovnání s ostatními zástupci skupiny inhibitorů protonové pumpy. Snášenlivost a výskyt nežádoucích účinků u rabeprazolu jsou obdobné jako u ostatních inhibitorů protonové pumpy.
Farmakologická skupina
Rabeprazol je substituovaný benzimidazol potlačující sekreci žaludeční kyseliny specifickou nekompetitivní inhibicí enzymu H+/K+ ATPázy (protonová pumpa) gastrických parietálních buněk. Účinek je závislý na dávce a vede k inhibici bazální i stimulované sekrece kyseliny bez ohledu na druh podnětu. V léčivých přípravcích je k dispozici ve formě svojí sodné soli [1–3].
Rabeprazol byl pod názvem Aciphex® (Eisai Company) zaregistrován americkým Úřadem pro kontrolu potravin a léčiv (FDA) v roce 1999. V České republice byly přípravky obsahující rabeprazol registrovány v roce 2010, na trhu se však objevily až v roce 2012 [4].
Rabeprazol je řazen do skupiny inhibitorů protonové pumpy, ATC kód A02BC04.
Chemické a fyzikální vlastnosti
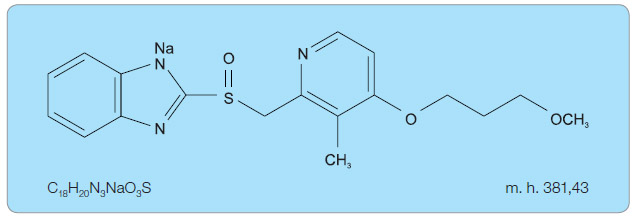 Chemicky se jedná o (RS)-2-([4-(3--methoxypropoxy)-3-methylpyridin-2-yl]methylsulfinyl)-1H-benzo[d]imidazol (obr. 1).
Chemicky se jedná o (RS)-2-([4-(3--methoxypropoxy)-3-methylpyridin-2-yl]methylsulfinyl)-1H-benzo[d]imidazol (obr. 1).Sumární vzorec: C18H20N3NaO3S
Molekulová hmotnost: 381,43
Je to bílý nebo téměř bílý prášek, který je rozpustný ve vodě, methanolu, ethanolu a chloroformu [5].
Mechanismus účinku, farmakodynamika
Rabeprazol stejně jako ostatní inhibitory protonové pumpy (PPI) inhibuje sekreci žaludeční kyseliny z gastrických parietálních buněk [1–3, 6].
Lipofilní slabá báze rabeprazol po absorpci z tenkého střeva přestupuje do kyselého prostředí parietální buňky, kde dochází k jeho protonaci. Následně dochází k jeho pře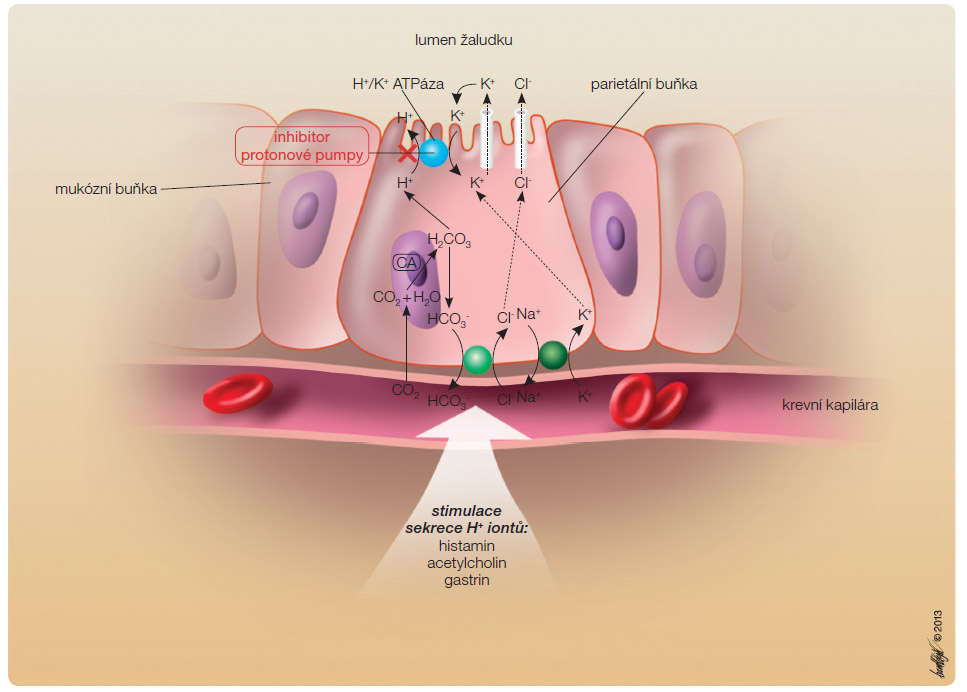 měně na sulfenamidový kation, který je již účinnou formou rabeprazolu a který se kovalentně váže na extracytoplazmatická cysteinová rezidua H+/K+ ATPázy. Tím inhibuje její aktivitu a sekreci žaludeční kyseliny [1–3], viz obr. 2.
měně na sulfenamidový kation, který je již účinnou formou rabeprazolu a který se kovalentně váže na extracytoplazmatická cysteinová rezidua H+/K+ ATPázy. Tím inhibuje její aktivitu a sekreci žaludeční kyseliny [1–3], viz obr. 2.
Zatímco mechanismus účinku rabeprazolu je shodný s celou skupinou PPI, jeho strukturální rozdíly jsou zodpovědné za jeho odlišné fyzikálně-chemické vlastnosti. Rabeprazol je aktivován v širším rozmezí pH (pKa ~ 5,0) a konvertován na sulfenamidovou formu mnohem rychleji než jiná PPI. Právě díky hodnotě disociační konstanty kolem 5,0 dochází k aktivaci molekuly rabeprazolu i v prostředí slabě kyselém, ve kterém se jiné typy PPI s nižší hodnotou pKa ještě neaktivují [1, 7].
Farmakokinetické vlastnosti
. Tak jako ostatní inhibitory protonové pumpy se rabeprazol po perorálním podání rychle vstřebává v horní části tenkého střeva. Aby se zabránilo předčasné přeměně neaktivní látky na látku aktivní v kyselém prostředí žaludku, mají i jeho perorální lékové formy acidorezistentní úpravu. Vstřebávání pak začíná až při vyšších hodnotách pH v duodenu a téměř kompletně dojde ke vstřebání v tenkém střevě [1–3, 8]. Rabeprazol je k dispozici pouze ve formě enterosolventních tablet. Rabeprazol má nízkou biologickou dostupnost díky presystémovému metabolismu. Systémová dostupnost rabeprazolu je silně ovlivněna současným příjmem potravy, která zpožďuje vstřebání (o 1,7 hod.), nicméně maximální plazmatická koncentrace (cmax) a rozsah absorpce ovlivněny nejsou [1–3].
Ve studiích se zdravými dobrovolníky byla při jednorázovém podávání 10–80 mg rabeprazolu zjištěna na dávce závislá farmakokinetika. Zatímco cmax a plocha pod křivkou (AUC) se zvyšovaly přibližně lineárně se zvyšující se dávkou, čas k dosažení cmax byl na dávce nezávislý. Nebyly prokázány rozdíly ve farmakokinetickém profilu mezi jednorázovým a opakovaným podáváním rabeprazolu u zdravých dobrovolníků. V případě opakovaného podávání nebyla prokázána kumulace rabeprazolu v organismu, na rozdíl od omeprazolu. Rabeprazol se ve velké míře váže na plazmatické proteiny (~ 97 %) a jeho distribuční objem byl stanoven na 0,34 l/kg [1–3]. Po jednotlivém perorálním podání rabeprazolu v dávce 20 mg zdravým dobrovolníkům byl bi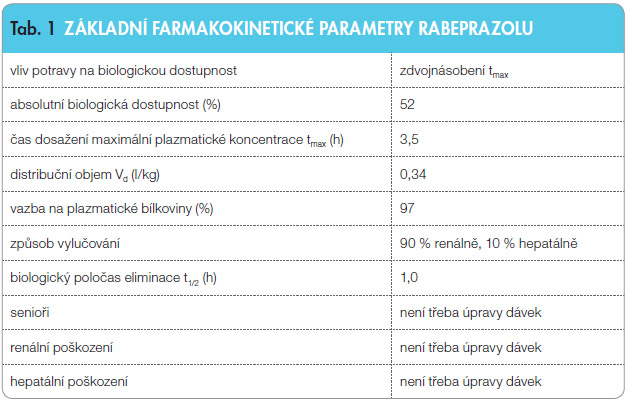 ologický poločas (t1/2) stanoven na 1,02 hodiny.Po sedmidenním podávání dávky 40 mg rabeprazolu 1krát denně byl t1/2 stanoven na 1,49 hodiny [3] Souhrnný přehled farmakokinetických vlastností rabeprazolu zobrazuje tab. 1.
ologický poločas (t1/2) stanoven na 1,02 hodiny.Po sedmidenním podávání dávky 40 mg rabeprazolu 1krát denně byl t1/2 stanoven na 1,49 hodiny [3] Souhrnný přehled farmakokinetických vlastností rabeprazolu zobrazuje tab. 1.
Rabeprazol podstupuje extenzivní jaterní metabolizaci, přednostně neenzymatickou redukci na thioether a v menším rozsahu enzymatickou přeměnu na desmethyl rabeprazol (CYP2C19) a sulfonový metabolit (CYP3A4). Žádný z metabolitů rabeprazolu nemá signifikantní antisekreční aktivitu [1].
Biologický poločas eliminace rabeprazolu je po podání jednorázové dávky (10–80 mg) přibližně jedna hodina, po opakovaném podání bylo pozorováno prodlužování t1/2. V plazmě byl rabeprazol detekován přibližně ještě po 9 hodinách po jednorázovém podání dávky 20 mg. Clearance rabeprazolu se pohybovala v rozmezí 0,26–0,50 l/h/kg, nezávisle na podané dávce (rozmezí 10–80 mg) [7].
Přibližně 90 % podané dávky rabeprazolu je vyloučeno močí, zbytek stolicí.
U pomalých metabolizátorů (nevykazují funkční formu CYP2C19), kterým byla podávána dávka 20 mg rabeprazolu po dobu 7 dnů, došlo k prodloužení t1/2 a AUC o 1,6- až 1,9násobek hodnot pozorovaných u pacientů s normální funkcí CYP2C19. Hodnoty cmax vzrostly přibližně o 40 %. Genotyp pacienta může v tomto případě ovlivnit klinickou účinnost rabeprazolu [1].
Na humánních hepatocytech in vitro byla prokázána schopnost omeprazolu a rabeprazolu indukovat izoenzymy cytochromu P450, přičemž v případě rabeprazolu se jednalo o schopnost výrazně menší v porovnání s omeprazolem. Rabeprazol neindukuje CYP1A2 a pouze mírně a jen při vyšších koncentracích (50 μmol/l) toto vykazuje vůči CYP3A4 [2].
Studie prokázaly, že podávání rabeprazolu je bezpečné i u seniorů a pacientů s renálním a hepatálním poškozením; v případě závažného jaterního poškození je namístě zvýšená opatrnost. V případě pacientů se stabilní kompenzovanou jaterní cirhózou došlo při jednorázovém podání 20 mg rabeprazolu v porovnání se zdravými dobrovolníky k 50% nárůstu cmax, ke 100% nárůstu AUC a t1/2 byl prodloužen trojnásobně [2, 7].
Podobný nárůst cmax a AUC (50 % a 100 %) byl pozorován ve studii se seniory (n = 20, průměrný věk 71 let) v porovnání s mladými zdravými dobrovolníky (n = 20, průměrný věk 23 let). V tomto případě se od sebe biologické poločasy eliminace statisticky významně nelišily [7].
Vzhledem k vysoké vazebnosti na plazmatické proteiny je rabeprazol nedialyzovatelný. Studie u dialyzovaných pacientů (n = 10) s renálním selháním neprokázaly změny ve farmakokinetice rabeprazolu při podávání denní dávky 20 mg [7].
Klinické zkušenosti
Studie porovnávající účinek jednorázové dávky 20 mg rabeprazolu a 40 mg pantoprazolu na 24hodinové intragastrické pH u pacientů s gastroezofageální refluxní chorobou (GERD; n = 52) konstatuje, že rabeprazol je signifikantně účinnější v udržení intragastrického pH > 4 [9].Za použití stejné metody 24hodinového intragastrického měření pH bylo ve studii se zdravými dobrovolníky prokázáno, že jednorázová dávka 15 mg lansoprazolu a 10 mg rabeprazolu vykazuje srovnatelnou inhibici intragastrické acidity [10].Studie porovnávající efekt rabeprazolu a esomeprazolu na 24hodinové intragastrické pH dospěla k závěru, že dávka 20 mg rabeprazolu je účinnější než 20 mg esomeprazolu po jednorázovém i opakovaném podání. Jednotlivé dávky rabeprazolu 10 mg a 20 mg jsou ekvivalentní esomeprazolu 20 mg a 40 mg v 24hodinovém působení na intragastrické pH, účinek esomeprazolu nastupuje rychleji, zatímco rabeprazol působí dlouhodoběji [11].
Otevřená randomizovaná studie na zdravých dobrovolnících (n = 24) porovnávající intragastrické pH při pětidenním podávání rabeprazolu v dávce 20 mg/den
a esomeprazolu 20 mg/den prokázala vyšší efektivitu rabeprazolu v udržení intragastrického pH > 4 [12].Porovnání účinku jednorázové perorální dávky 20 mg rabeprazolu a 40 mg esomeprazolu na 24hodinové intragastrické pH prokázalo srovnatelnou účinnost obou dávek [13].
Čtyřtýdenní prospektivní randomizovaná studie s 83 pacienty s neerozivní GERD porovnávala podávání rabeprazolu (max. 20 mg 2krát denně) a ranitidinu (max. 300 mg 2krát denně) v režimu „on-demand“. Rabeprazol měl srovnatelnou účinnost s ranitidinem, oba režimy byly spojeny se zvýšením kvality života [14].
Cílem studie s 279 pacienty s erozivní ezofagitidou (Los Angeles A, B) s endoskopicky potvrzeným zhojením po 8týdenním podávání PPI bylo prokázat účinnost a nákladovou efektivitu dlouhodobé udržovací terapie rabeprazolem v dávce 10 mg/den a omeprazolem v dávce 10 mg/den. Pacienti byli randomizováni do uvedených skupin a po 42 týdnech byly vyhodnoceny výsledky. Na konci 42. týdne byla většina pacientů z obou skupin bez příznaků (96,4 % užívajících omeprazol, 95,1 % užívajících rabeprazol) a obě léčiva byla plně srovnatelná, pokud jde o závažnost a frekvenci výskytů refluxních symptomů. Z hlediska nákladové efektivity vyzněla studie pozitivně pro omeprazol [15].
Ve studii zahrnující 60 pacientů s mírnou až středně závažnou GERD bylo porovnáváno podávání rabeprazolu v dávce 40 mg/den s esomeprazolem v dávce 40 mg/den po 4 týdny. Obě léčiva byla stejně tolerovaná a nelišila se v míře výskytu nežádoucích účinků. Výskyt symptomů GERD byl statisticky významně nižší ve skupině pacientů užívajících rabeprazol (p = 0,01). Endoskopická vyšetření prokázala ve skupině rabeprazolu vyšší míru absolutního i relativního zlepšení [16].
V randomizovaných studiích prokázal rabeprazol (20–40 mg/den) jako součást trojkombinace v eradikaci Helicobacter pylori velmi dobrou účinnost. Ve standardní kombinaci s klarithromycinem (500 mg 2krát denně) a amoxicilinem (1000 mg 2krát denně) nebo s metronidazolem (400 mg 2krát denně) dosahuje více než 90% úspěšnosti v eradikaci. Ve třech randomizovaných studiích s trojkombinací podávanou po dobu 7 dnů byl rabeprazol srovnatelný s omeprazolem a lansoprazolem. Role genotypu CYP2C19 zůstává v oblasti eradikace H. pylori stále otevřenou otázkou [2].
Byla provedena metaanalýza, která sumarizovala publikované randomizované studie týkající se srovnání rabeprazolu nebo esomeprazolu s ostatními PPI jako součástmi trojkombinace určené k eradikaci H. pylori. Celkem bylo zahrnuto 35 studií s téměř 6000 pacienty. Esomeprazol v porovnání s PPI první generace vykazoval vyšší míru eradikace (82,3 % vs. 77,6 %), v případě rabeprazolu jsou poznatky podobné (80,5 % vs. 76,2 %). Mezi esomeprazolem a rabeprazolem nebyly nalezeny statisticky významné rozdíly v eradikaci (78,7 % vs. 76,7 %). Genotyp CYP2C19 nebyl příčinou signifikantních rozdílů v míře eradikace mezi PPI první a druhé generace [17].
V monoterapii peptického vředu byl rabeprazol v dávkách 10–40 mg/den srovnatelně účinný s omeprazolem a účinnější než ranitidin nebo placebo. V případě aktivního duodenálního vředu prokázal rabeprazol za 4 týdny statisticky významně vyšší míru zhojení než ranitidin podávaný v dávce 150 mg 2krát denně [2].
Ve studii s 20 pacienty se Zollingerovým-Ellisonovým syndromem nebo s idiopatickou gastrickou hypersekrecí byl rabeprazol podáván v jednorázové iniciální dávce 60 mg/den a v případě komplikovaného stavu v dávce 40 mg 2krát denně. Jednalo se až o dvouleté podávání v těchto dávkách. Při podávání 60 mg rabeprazolu denně bylo dosaženo uspokojivé kontroly u 94 % pacientů s nekomplikovaným stavem a s dávkou 40 mg rabeprazolu 2krát denně bylo dosaženo 75% kontroly u pacientů se stavem komplikovaným [1].
Tématem relativní potence a srovnatelnosti jednotlivých PPI se zabývala review zpracovávající 57 studií založených na měření 24hodinového intragastrického pH. Na základě získaných dat byla stanovena relativní potence jednotlivých PPI vztažená k omeprazolu: 0,23 pantoprazol, 0,90 lansoprazol, 1,00 omeprazol, 1,60 esomeprazol a 1,82 rabeprazol. Rabeprazol tedy vykazuje nejvyšší supresi gastrické sekrece a hlavně nejrychlejší nástup účinku ze všech pěti hodnocených PPI [18].
Světová zdravotnická organizace pokládá denní dávku 20 mg omeprazolu, 30 mg esomeprazolu, 30 mg lansoprazolu, 40 mg pantoprazolu a 20 mg rabeprazolu za ekvivalentní pro léčbu refluxní choroby jícnu. Kanadská asociace gastroenterologů považuje v léčbě refluxní choroby jícnu za ekvivalentní dávky 20 mg omeprazolu, 40 mg esomeprazolu, 30 mg lansoprazolu, 40 mg pantoprazolu a 20 mg rabeprazolu [18].
Zařazení do současné palety léčiv
Rabeprazol je společně s esomeprazolem řazen do tzv. druhé generace PPI, protože nabízí několik farmakokinetických výhod. Za prvé je to nižší jaterní metabolismus systémem CYP2C19, což snižuje variace v metabolismu v důsledku genetického polymorfismu tohoto izoenzymu a riziko lékových interakcí. Další výhodou je vyšší kumulace rabeprazolu v parietálních buňkách v důsledku jeho vyšší pKa, což se prakticky projevuje jako rychleji nastupující a konzistentnější suprese gastrické sekrece, v porovnání s ostatními PPI [19]. Rychlost nástupu jeho účinku je velkou výhodou v situacích, kdy je třeba rychlé úlevy od obtíží, např. v režimu léčby inhibitory protonové pumpy „on-demand“.
Indikace
V současnosti je v České republice rabeprazol schválen pro léčbu dospělých v indikacích aktivní duodenální vřed, aktivní benigní žaludeční vřed, symptomatická erozivní nebo ulcerózní gastroezofageální refluxní nemoc, dlouhodobá udržovací léčba gastroezofageální refluxní nemoci, symptomatická léčba středně těžké až velmi těžké gastroezofageální refluxní nemoci a Zollingerova-Ellisonova syndromu. V kombinaci s příslušnými antibakteriálními terapeutickými režimy k eradikaci H. pylori je indikován u pacientů s peptickými vředy vzniklými v souvislosti s H. pylori [6, 20].
Kontraindikace
Kontraindikací léčby rabeprazolem je známá přecitlivělost na rabeprazol, dále těhotenství a kojení [20].
Nežádoucí účinky
Rabeprazol je obecně dobře snášen, jak bylo prokázáno v krátkodobých i dlouhodobých studiích zahrnujících pacienty s GERD, vředovou chorobou a Zollingerovým-Ellisonovým syndromem. Spektrum popisovaných nežádoucích účinků se nijak neliší od ostatních PPI [6]. Nejčastějšími nežádoucími účinky ve studiích byly bolesti hlavy, průjem, bolesti břicha, flatulence, rash a sucho v ústech. Tyto nežádoucí účinky byly ve studiích hodnoceny jako mírné až středně závažné [1–3].
Dobrou tolerabilitu rabeprazolu potvrdily i dlouhodobé až pětileté studie u pacientů s udržovací léčbou GERD. Nejčastějšími nežádoucími účinky byly rinitida, průjem, bolesti hlavy, bolesti (nespecifikované), faryngitida, „flu-like“ symptomy, bolesti břicha a nauzea [21].
Klinické studie neprokázaly signifikantní rozdíly v toleranci jednotlivých trojkombinačních režimů k eradikaci H. pylori v závislosti na použitém PPI. Nebyly pozorovány rozdíly mezi rabeprazolem, omeprazolem, esomeprazolem a pantoprazolem [1, 2].
Při podávání rabeprazolu v dávce 10–20 mg/den dochází během prvních 2–8 týdnů ke zvýšení sérových hladin gastrinu. Tyto zůstávají stabilní po dobu léčby a po jejím ukončení se během dvou týdnů normalizují do stavu před začátkem léčby [1, 2].
Metaanalýza 9 kontrolovaných studií (1987–2006) hledala souvislosti mezi užíváním PPI a výskytem komunitních respiračních infekcí. Závěrem této práce je zjištění, že prvních 30 dní podávání PPI zejména ve vyšších dávkách je asociováno s výskytem komunitních respiračních infekcí. Naproti tomu při podávání PPI po dobu delší než 180 dnů autoři spojitost neprokázali [22].
Bylo publikováno několik ojedinělých případů psychiatrických symptomů (anxie-
ta, panická ataka) asociovaných s podáním rabeprazolu. Je zapotřebí dalších studií k objasnění potenciální role PPI indukované hypergastrinemie v etiologii neuropsychiatrických onemocnění [1].
Ve studiích nebyly pozorovány adenomatózní, dysplastické nebo neoplastické změny žaludeční sliznice při podávání rabeprazolu, stejně jako žádné tendence k intestinální metaplazii [2].
Lékové interakce
Na rozdíl od jiných PPI je rabeprazol v játrech přednostně metabolizován neenzymatickými procesy a cytochromovým systémem pouze v omezené míře. Proto se jeho potenciální lékové interakce zprostředkované cytochromovým systémem považují za málo pravděpodobné.
Nebyly prokázány klinicky signifikantní lékové interakce rabeprazolu s antacidy, warfarinem, theofylinem a intravenózně podaným diazepamem a fenytoinem [1, 7].
K interakcím nedochází ani v případě současného podávání s takrolimem, verapamilem nebo klarithromycinem [1].
Klinicky významné mohou být lékové interakce na základě rabeprazolem zvýšeného gastrického pH u léčivých přípravků, jejichž absorpce je na pH závislá. Biologická dostupnost ketokonazolu může být snížena až o 30 % a plazmatické koncentrace digoxinu se mohou zvýšit až o 20 % při současném podání rabeprazolu. Ketokonazol farmakokinetiku rabeprazolu neovlivňuje [1, 3].
Antiretrovirotikum atazanavir, jehož absorpce je též pH-dependentní, by nemělo být podáváno současně s rabeprazolem [1].Několik publikovaných studií v minulých letech upozornilo na potenciální lékovou interakci PPI a klopidogrelu. Toto protidestičkové léčivo je přeměňováno na vlastní účinnou látku izoenzymem cytochromu P450 2C19, který je pravděpodobně inhibován současným podáním PPI. Snížení metabolismu klopidogrelu na jeho aktivní formu může vést ke zvýšenému výskytu trombotických příhod včetně infarktu myokardu. Evropská léková agentura (EMA) vydala v roce 2009 k této problematice vyjádření, kde doporučuje přehodnotit započetí léčby či podávání PPI u pacientů užívajících klopidogrel. Nedávno publikované práce a metaanalýza však závažnost popsané lékové interakce poněkud zmírňují. Nedoporučuje se automatické přerušování léčby PPI u pacientů užívajících klopidogrel, rozhodujícím faktorem by mělo být riziko gastrointestinálních krvácivých příhod u konkrétního nemocného [23, 24].Recentní studie s 20 zdravými dobrovolníky neprokázala signifikantní změny ve farmakokinetice klopidogrelu, jeho aktivního metabolitu ani rabeprazolu při současném podávání těchto dvou látek [25].
Použití v graviditě
Rabeprazol je dle kategorizace FDA zařazen do skupiny B. Preklinické testy na zvířecích modelech neprokázaly snížení fertility ani zvýšené riziko pro plod, pro konkrétnější závěry týkající se použití u gravidních žen není doposud dostatek dat. Kohortní studie analyzující expozice gravidních žen inhibitorům protonové pumpy v prvním trimestru neprokázala zvýšené riziko podávání těchto léčiv pro plod. Nicméně výpovědní hodnota pro rabeprazol je omezena nízkým počtem případů zahrnutých do studie. Ve třech případech ze 42 gravidních žen (7,1 %) užívajících v prvním trimestru rabeprazol se vyskytly u novorozence závažné defekty, v porovnání s 2,6% výskytem u gravidních žen bez expozice jakémukoli PPI [26]. Údaje o prostupu rabeprazolu do mateřského mléka nejsou k dispozici.
Všechny léčivé přípravky s obsahem rabeprazolu registrované v ČR jsou dle svých SPC kontraindikovány v těhotenství a při kojení [20].
Použití u dětí
Použití rabeprazolu u dětí a adolescentů popisují dvě publikované studie [27, 28]. Klinická studie s 28 dětskými pacienty s GERD ve věkovém rozmezí 1–11 let stanovovala farmakokinetické parametry perorálně podávaného rabeprazolu v dávkách 0,14, 0,5 a 1,0 mg/kg tělesné hmotnosti jak po podání jednorázové dávky, tak po pětidenním podávání. Plazmatické koncentrace rabeprazolu stoupaly se zvyšující se dávkou a nebyla pozorována kumulace v organismu. Variabilita hodnot AUC rabeprazolu nekoreluje ani s věkem, ani s tělesnou hmotností. Hodnoty clearance byly srovnatelné s populací dospělých. Dávky pro udržení plazmatických koncentrací jako u dospělých pacientů byly však přibližně 2–3krát vyšší, což odpovídá dříve publikovaným poznatkům o zvyšující se clearance PPI se snižujícím se věkem dětí [27, 29, 30].
Byla publikována studie popisující farmakokinetiku a tolerabilitu rabeprazolu v kohortě adolescentů ve věku 12–16 let s GERD (n = 24) po opakovaném podávání 10 mg nebo 20 mg rabeprazolu po dobu 5 nebo 7 dní. Obě dávky byly relativně dobře tolerovány, nejčastějšími nežádoucími účinky byly bolesti hlavy a nevolnost (16,7 % a 8,3 %). Při podávání dávky 10 mg/den nebyla prokázána kumulace rabeprazolu nebo jeho metabolitů v organismu. Náznaky kumulace byly zaznamenány při podávání denní dávky 20 mg. Autoři konstatují nutnost dalších rozsáhle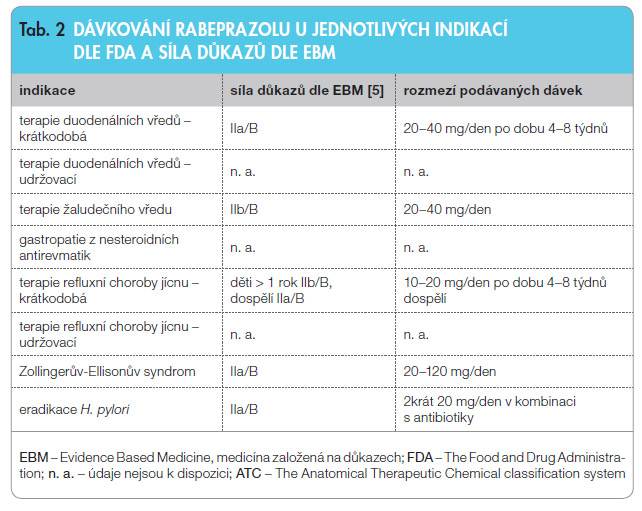 jších studií pro stanovení detailní farmakokinetiky rabeprazolu u pacientů v tomto věkovém rozmezí [28].FDA povoluje použití rabeprazolu u dětí starších než jeden rok pouze v krátkodobé terapii GERD. Souhrny údajů léčivých přípravků s obsahem rabeprazolu registrovaných v ČR nedoporučují používání u dětí, protože chybějí data o bezpečnosti a účinnosti [20].
jších studií pro stanovení detailní farmakokinetiky rabeprazolu u pacientů v tomto věkovém rozmezí [28].FDA povoluje použití rabeprazolu u dětí starších než jeden rok pouze v krátkodobé terapii GERD. Souhrny údajů léčivých přípravků s obsahem rabeprazolu registrovaných v ČR nedoporučují používání u dětí, protože chybějí data o bezpečnosti a účinnosti [20].
Dávkování
Dávkování u jednotlivých indikací dle FDA a sílu důkazů dle medicíny založené na důkazech (EBM, Evidence Based Medicine) sumarizuje tab. 2 [5].
Seznam použité literatury
- [1] Baldwin CM, Keam SJ. Rabeprazole: a review of its use in the management of gastric acid-related diseases in adults. Drugs 2009; 69: 1373–1401.
- [2] Carswell CI, Goa KL. Rabeprazole: an update of its use in acid-related disorders. Drugs 2001; 61: 2327–2356.
- [3] Prakash A, Faulds D. Rabeprazole. Drugs 1998; 55: 261–267.
- [4] http://www.sukl.cz/hodnoceni-vyvoje-distribuce-vybrane-skupiny-lecivych-10 (navštíveno 10. 6. 2013)
- [5] Micromedex® Healthcare Series [intranet database]. Version 1.0
- [6] Martínek J, Lukáš M. Inhibitory protonové pumpy – up to date. Gastroent Hepatol 2011; 65: 331–342.
- [7] Langtry HD, Markham A. Rabeprazole: a review of its use in acid-related gastrointestinal disorders. Drugs 1999; 58: 725–742.
- [8] Shin JM, Sachs G. Pharmacology of proton pump inhibitors. Curr Gastroenterol Rep 2008; 10: 528–534.
- [9] Miner P, Delemos B, Xiang J, et al. Effects of a single dose of rabeprazole 20 mg and pantoprazole 40 mg on 24-h intragastric acidity and oesophageal acid exposure: a randomized study in gastro-oesophageal reflux disease patients with a history of nocturnal heartburn. Aliment Pharmacol Ther 2010; 31: 991–1000.
- [10] Hata S, Arai M, Maruoka D, et al. Intragastric acidity during the first day following administration of low-dose proton pump inhibitors: A randomized crossover study. Clin Res Hepatol Gastroenterol 2013; 37: 296–301.
- [11] Norris V, Baisley K, Dunn K, et al. Combined analysis of three crossover clinical pharmacology studies of effects of rabeprazole and esomeprazole on 24-h intragastric pH in healthy volunteers. Aliment Pharmacol Ther 2007; 25: 501–510.
- [12] Warrington S, Baisley K, Boyce M, et al. Effects of rabeprazole, 20 mg, or esomeprazole, 20 mg, on 24-h intragastric pH and serum gastrin in healthy subjects. Aliment Pharmacol Ther 2002; 16: 1301–1307.
- [13] Warrington S, Baisley K, Dunn K, et al. Effects of single doses of rabeprazole 20 mg and esomeprazole 40 mg on 24-h intragastric pH in healthy subjects. Eur J Clin Pharmacol 2006; 62: 685–691.
- [14] Kobeissy AA, Hashash JG, Jamali FR, et al. A randomized open-label trial of on-demand rabeprazole vs ranitidine for patients with non-erosive reflux disease. World J Gastroenterol 2012; 18: 2390–2395.
- [15] Park JH, Park H, Lee DH, Sung IK. A randomized, double blinded, clinical trial to assess the efficacy and cost effectiveness of omeprazole compared to rabeprazole in the maintenance therapy of patients with gastroesophageal reflux disease. J Neurogastroenterol Motil 2013; 19: 219–226.
- [16] Maiti R, Jaida J, Israel PL, et al. Rabeprazole and esomeprazole in mild-to-moderate erosive gastroesophageal reflux disease: A comparative study of efficacy and safety. J Pharmacol Pharmacother 2011; 2: 150–157.
- [17] McNicholl AG, Linares PM, Nyssen OP, et al. Meta-analysis: esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 2012; 36: 414–425.
- [18] Kirchheiner J, Glatt S, Fuhr U, et al. Relative potency of proton-pump inhibitors-comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009; 65: 19–31.
- [19] de Korwin JD, Ducrotté P, Vallot T. New-generation proton pump inhibitors: progress in the treatment of peptic acid diseases? Presse Med 2004; 33: 746–754.
- [20] Mikro-verze AISLP, 2013.2, stav k 1. 4. 2013.
- [21] Caos A, Breiter J, Perdomo C, Barth J. Long-term prevention of erosive or ulcerative gastro-oesophageal reflux disease relapse with rabeprazole 10 or 20 mg vs. placebo: results of a 5-year study in the United States. Aliment Pharmacol Ther 2005; 22: 193–202.
- [22] Giuliano C, Wilhelm SM, Kale-Pradhan PB. Are proton pump inhibitors associated with the development of community-acquired pneumonia? A meta-analysis. Expert Rev Clin Pharmacol 2012; 5: 337–344.
- [23] Tantry US, Kereiakes DJ, Gurbel PA. Clopidogrel and proton pump inhibitors: influence of pharmacological interactions on clinical outcomes and mechanistic explanations. JACC Cardiovasc Interv 2011; 4: 365–380.
- [24] Siller-Matula JM, Jilma B, Schrör K, et al. Effect of proton pump inhibitors on clinical outcome in patients treated with clopidogrel: a systematic review and meta-analysis. J Thromb Haemost 2010; 8: 2624–2641.
- [25] Wu J, Jia LT, Shao LM, et al. Drug-drug interaction of rabeprazole and clopidogrel in healthy Chinese volunteers. Eur J Clin Pharmacol 2013; 69: 179–187.
- [26] Pasternak B, Hviid A. Use of proton-pump inhibitors in early pregnancy and the risk of birth defects. N Engl J Med 2010; 363: 2114–2123.
- [27] Zannikos PN, Doose DR, Leitz GJ, et al. Pharmacokinetics and tolerability of rabeprazole in children 1 to 11 years old with gastroesophageal reflux disease. J Pediatr Gastroenterol Nutr 2011; 52: 691–701.
- [28] James L, Walson P, Lomax K, et al; Study 119 Pediatric Trial Investigators. Pharmacokinetics and tolerability of rabeprazole sodium in subjects aged 12 to 16 years with gastroesophageal reflux disease: an open-label, single- and multiple-dose study. Clin Ther 2007; 29: 2082–2092.
- [29] Gibbons TE, Gold BD. The use of proton pump inhibitors in children: a comprehensive review. Paediatr Drugs 2003; 5: 25–40.
- [30] Ward RM, Kearns GL. Proton pump inhibitors in pediatrics: mechanism of action, pharmacokinetics, pharmacogenetics, and pharmacodynamics. Paediatr Drugs 2013; 15: 119–131.