Racekadotril
Racekadotril je inhibitor enzymu označovaného jako neutrální endopeptidáza (enkefalináza). Po perorálním podání se rychle metabolizuje na účinný thiorfan, neproniká do centrálního nervového systému. Racekadotril chrání před enzymatickou degradací enkefaliny (endogenní peptidy), prodlužuje jejich účinek na enkefalinergních synapsích enterocytů, čímž snižuje hypersekreci. Nejvýznamnější je tedy jeho antihypersekreční efekt v zažívací trubici bez ovlivnění pasáže. Klinickým korelátem tohoto účinku je terapeutické ovlivnění akutního průjmu u dospělých i dětí.
Farmakologická skupina
Racekadotril patří do farmakoterapeutické skupiny ostatní antidiarrhoika, ATC kód A07XA04.
Chemické a fyzikální vlastnosti
Racekadotril je chemicky N-[2-[(acetylthio)-methyl]-1-oxo-3-fenylpropyl]glycin-fenylmethyl ester. Je to bílý prášek, který je cítit sírou.
Sumární vzorec: C21H23NO4S
Molekulová hmotnost: 385,48 g/mol
Mechanismus účinku, farmakodynamika
Po perorálním podání je racekadotril rychle přeměněn na aktivní metabolit thiorfan (obr. 1), který působí jako selektivní inhibitor enzymu enkefalinázy. Enkefalináza je peptidáza buněčné membrány, která se nachází v různých tkáních, významně také v epitelu tenkého střeva. Přispívá jak k hydrolýze exogenních peptidů, tak ke štěpení endogenních peptidů včetně opioidních pentapeptidů enkefalinů. Hlavním projevem akutního průjmu je hypersekrece vody a ele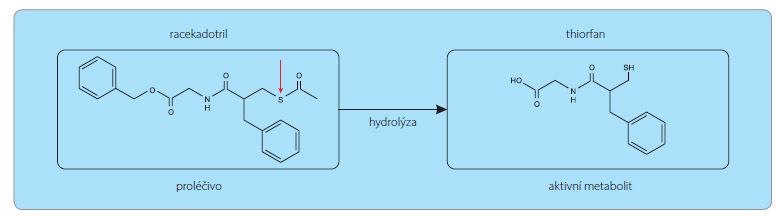 ktrolytů, kterou vyvolávají virové či bakteriální toxiny nebo zánět. Enkefaliny jsou neurotransmitery, které vazbou na receptory delta snižují aktivitu adenylátcyklázy, která zajišťuje přeměnu ATP na cAMP. Snížení hladiny cAMP vede ke snížené fosforylaci buněčných enzymů proteinkinázami. Sekrece tekutin do střevního lumen je řízena prostřednictvím iontového kanálu nazvaného Cystic Fibrosis Transmembrane conductance Regulator (CFTR), který je ve fosfory
ktrolytů, kterou vyvolávají virové či bakteriální toxiny nebo zánět. Enkefaliny jsou neurotransmitery, které vazbou na receptory delta snižují aktivitu adenylátcyklázy, která zajišťuje přeměnu ATP na cAMP. Snížení hladiny cAMP vede ke snížené fosforylaci buněčných enzymů proteinkinázami. Sekrece tekutin do střevního lumen je řízena prostřednictvím iontového kanálu nazvaného Cystic Fibrosis Transmembrane conductance Regulator (CFTR), který je ve fosfory![Obr. 2 Schematické znázornění mechanismu účinku racekadotrilu; upraveno podle [9] – Schwartz, 2000. Enkefaliny snižují vazbou na receptory delta aktivitu enzymu adenylátcyklázy, tím klesne přeměna ATP na cAMP, což ve svém důsledku vede ke sníženému vylučování chloridů do střeva (kanál CFTR je vlivem snížené fosforylace uzavřen) a s tím spojenému sníženému vylučování tekutiny enterocytem. Racekadotril snižuje hypersekreci zachováním aktivity enkefalinů, chrání je před enzymatickou degradací enzymem enkefalinázou. AC – adenylátcykláza; ATP – adenosintrifosfát; cAMP – cyklický adenosinmonofosfát; iontový kanál CFTR (Cystic Fibrosis Transmembrane conductance Regulator); PG – prostaglandiny](https://www.remedia.cz/photo-a-29798---.jpg) lovaném stavu otevřený. Otevřeným kanálem z nitra enterocytu uniká do střevního lumen chloridový ion, který je po osmotickém a elektrickém gradientu následován vodou a dalšími elektrolyty. Snížení fosforylace vede k uzavření tohoto iontového kanálu a ke sníženému vylučování chloridů do střeva a ke sníženému vylučování tekutiny, které je s tím spojeno (obr. 2). Racekadotril snižuje hypersekreci zachováním aktivity enkefalinů tím, že je chrání před enzymatickou degradací a tím prodlužuje jejich účinek na synapsích. Racekadotril neovlivňuje střevní tranzit a nemá vliv na bazální sekreci. Rovněž je bez účinku na centrální nervový systém, neboť jeho lipofilní molekula je prakticky ihned hydrolyzována na thiorfan, který jako hydrofilní látka hematoencefalickou bariérou prakticky neprostupuje.
lovaném stavu otevřený. Otevřeným kanálem z nitra enterocytu uniká do střevního lumen chloridový ion, který je po osmotickém a elektrickém gradientu následován vodou a dalšími elektrolyty. Snížení fosforylace vede k uzavření tohoto iontového kanálu a ke sníženému vylučování chloridů do střeva a ke sníženému vylučování tekutiny, které je s tím spojeno (obr. 2). Racekadotril snižuje hypersekreci zachováním aktivity enkefalinů tím, že je chrání před enzymatickou degradací a tím prodlužuje jejich účinek na synapsích. Racekadotril neovlivňuje střevní tranzit a nemá vliv na bazální sekreci. Rovněž je bez účinku na centrální nervový systém, neboť jeho lipofilní molekula je prakticky ihned hydrolyzována na thiorfan, který jako hydrofilní látka hematoencefalickou bariérou prakticky neprostupuje.
Vliv na jiné peptidázy
Randomizovaná, placebem kontrolovaná studie opakovaných dávek s paralelní skupinou hodnotila racekadotril v dávkách 30 mg, 100 mg a 300 mg třikrát denně, přičemž nebyl zjištěn žádný účinek na angiotenzin konvertující enzym ani na aktivitu reninu v plazmě.
Farmakokinetické vlastnosti
Racekadotril se po perorálním podání rychle vstřebává, načež se působením esteráz rychle a úplně přeměňuje na aktivní metabolit thiorfan, jenž je z devadesáti procent vázán na plazmatické proteiny, zvláště na albumin. Délka a rozsah účinku racekadotrilu závisí na dávce. Doba k dosažení vrcholové inhibice enkefalinázy v plazmě je asi 2 hodiny a při dávce 1,5 mg/kg odpovídá 90% inhibici. Plazmatická inhibice enkefalinázy vydrží asi 8 hodin. U dětí jsou farmakokinetické výsledky podobné jako u dospělých. Kumulace léčiva nebyla pozorována ani po užívání opakovaných dávek v intervalu 8 hodin po dobu jednoho týdne. Racekadotril ani jeho metabolity in vitro neinhibují ani neindukují hlavní izoformy enzymu CYP3A4. Je vylučován v podobě aktivních i neaktivních metabolitů. Hlavní parametry shrnuje tab. 1.
dobu jednoho týdne. Racekadotril ani jeho metabolity in vitro neinhibují ani neindukují hlavní izoformy enzymu CYP3A4. Je vylučován v podobě aktivních i neaktivních metabolitů. Hlavní parametry shrnuje tab. 1.
Klinické zkušenosti
Klinické studie u dospělých
Klinické studie u dospělých pacientů shrnuje tab. 2. Ve dvojitě zaslepené, randomizované, placebem kontrolované studii byli ambulantně léčeni dospělí s akutním průjmem infekčního původu dávkou 100 mg racekadotrilu třikrát denně, res pektive placebem po dobu 6 dnů či do zotavení. Hmotnost stolice první den léčby byla signifikantně nižší ve skupině s racekadotrilem v porovnání s placebem (355 ± 35 g vs. 499 ± 46 g, p = 0,025), stejně jako počet průjmových stolic (4,3 ± 0,4 vs. 5,4 ± 0,4, p = 0,027) [3].
pektive placebem po dobu 6 dnů či do zotavení. Hmotnost stolice první den léčby byla signifikantně nižší ve skupině s racekadotrilem v porovnání s placebem (355 ± 35 g vs. 499 ± 46 g, p = 0,025), stejně jako počet průjmových stolic (4,3 ± 0,4 vs. 5,4 ± 0,4, p = 0,027) [3].
Klinické studie u dětí
Metaanalýza devíti randomizovaných klinických studií s racekadotrilem oproti placebu přidanému k perorálnímu rehydratačnímu roztoku (1384 probandů) prokázala rychlejší úpravu akutního průjmu u skupiny dětských pacientů léčených racekadotrilem ve srovnání s placebem – medián trvání průjmu ve skupině léčené racekadotrilem byl 1,75 dne oproti 2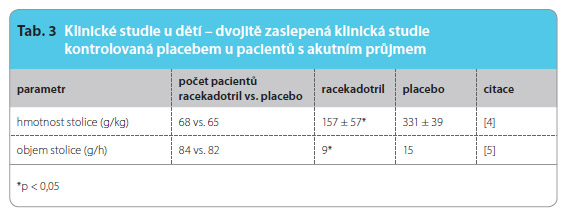 ,81 dne u placeba (poměr rizik, hazard ratio – HR: 2,04; 95% interval spolehlivosti – CI: 1,85–2,32; p < 0,001). Čtyři klinické studie porovnávaly objem průjmových stolic u hospitalizovaných pacientů léčených racekadotrilem a u pacientů, jimž bylo podáváno placebo, s následujícími výsledky: po 48 hodinách došlo v porovnání s placebem ve skupině léčené racekadotrilem ke 41% poklesu výdeje stolice, přičemž po úpravě podle výchozí dehydratace a výskytu rotaviru byl poměr rizik 0,59 (95% CI: 0,51–0,74; p < 0,001). V klinických studiích s dětskými pacienty byl počet průjmových stolic při léčbě racekadotrilem nižší než při podávání placeba (HR 0,63; 95% CI: 0,47–0,85; p < 0,001) [8].
,81 dne u placeba (poměr rizik, hazard ratio – HR: 2,04; 95% interval spolehlivosti – CI: 1,85–2,32; p < 0,001). Čtyři klinické studie porovnávaly objem průjmových stolic u hospitalizovaných pacientů léčených racekadotrilem a u pacientů, jimž bylo podáváno placebo, s následujícími výsledky: po 48 hodinách došlo v porovnání s placebem ve skupině léčené racekadotrilem ke 41% poklesu výdeje stolice, přičemž po úpravě podle výchozí dehydratace a výskytu rotaviru byl poměr rizik 0,59 (95% CI: 0,51–0,74; p < 0,001). V klinických studiích s dětskými pacienty byl počet průjmových stolic při léčbě racekadotrilem nižší než při podávání placeba (HR 0,63; 95% CI: 0,47–0,85; p < 0,001) [8].
Celkově bylo 714 pacientů ve věku méně než jeden rok a 670 pacientů bylo ve věku jeden rok a více. Střední věk dětí byl 12 měsíců. Průměrná hmotnost se pohybovala od 7,4 kg do 12,2 kg ve vše ch studiích. Celková střední délka trvání průjmu po infuzi byla 2,81 dne pro placebo a 1,75 dne pro racekadotril [10]. Klinické studie s dětskými pacienty popisují tab. 3 a 4.
ch studiích. Celková střední délka trvání průjmu po infuzi byla 2,81 dne pro placebo a 1,75 dne pro racekadotril [10]. Klinické studie s dětskými pacienty popisují tab. 3 a 4.
Klinické studie s aktivním komparátorem
V řadě klinických studií provedených u dětí, dospělých i starších osob byl jako aktivní komparátor použit loperamid.
V multicentrické, dvojitě zaslepené komparativní studii s dvojitým placebem a s paralelní skupinou provedené u dětí ve věku 2 roky až 10 let bylo zjištěno, že mezi loperamidem a racekadotrilem není žádný statisticky významný rozdíl, pokud jde o účinnost. Četnost nežádoucích příhod byla ve skupinách léčených racekadotrilem 11,5 %, ve skupinách s loperamidem 22 %. Statisticky významně vyšší podíl pacientů léčených loperamidem hlásil zácpu (58 % vs. 36,5 % u racekadotrilu, p = 0,03) [11].
Obdobné výsledky, pokud jde o účinnost, byly získány v mezinárodní, multicentrické jednoduše zaslepené studii s paralelní skupinou u dospělých, kde byla ve skupině léčené loperamidem rovněž pozorována vyšší míra zácpy (25 % ve skupině léčené loperamidem a 16 % ve skupině léčené racekadotrilem, p = 0,001) a také statisticky významně vyšší míra bolestí břicha a delší trvání abdominální distenze [12].
Randomizovaná, dvojitě zaslepená studie s paralelní skupinou provedená u starších osob (střední hodnota věku 82,9 roku u skupiny léčené racekadotrilem a 81,9 roku u skupiny léčené loperamidem) prokázala významně kratší dobu trvání průjmu ve skupině léčené racekadotrilem (36 hodin vs. 63 hodin), kratší trvání bolestí břicha (14 hodin vs. 28 hodin, p < 0,01) a nižší výdej stolice (120 g/kg vs. 150 g/kg, p < 0,01). Ve skupině léčené racekadotrilem dosahoval výskyt nežádoucích příhod 12 %, ve skupině s loperamidem 60 %. Incidence zácpy byla 60 % ve skupině léčené loperamidem a 15 % ve skupině s racekadotrilem [13].
Zařazení do současné palety léčiv
Racekadotril představuje adjuvantní terapii akutního průjmového onemocnění dětí i dospělých, která nenahrazuje základní terapii, tj. rehydrataci. Ve spojení s úpravou hydratace vede ke zkrácení doby trvání akutního průjmového onemocnění a ke snížení objemu průjmových stolic. Racekadotril tak významně rozšiřuje možnosti v terapii akutních gastroenteritid.
Indikace
Racekadotril je indikován k symptomatické léčbě akutního průjmu u dětí a dospělých v případě, kdy kauzální léčba není možná. Je-li kauzální léčba možná, může být podáván jako adjuvantní léčba.
Kontraindikace
Kontraindikací léčby racekadotrilem je hypersenzitivita na účinnou látku.
Nežádoucí účinky
Pediatričtí pacienti (data jsou k dispozici pro 860 pacientů léčených racekadotrilem a 441 pacientů, kteří dostávali placebo): nežádoucí účinky jsou méně časté, tj. 1/100 až 1/1000, projevují se jako tonzilitida, exantém, erytém.
Dospělí pacienti (data jsou k dispozici pro 2193 pacientů léčených racekadotrilem a 282 pacientů, kteří dostávali placebo): nežádoucí účinky jsou časté, tj. 1/10 až 1/100, projevují se jako bolesti hlavy, méně časté jako exantém a erytém [10].Frekvence výskytu nežádoucích účinků v pediatrických studiích byla při podávání racekadotrilu podobná jako u placeba [4–7].
Lékové interakce
U lidí nebyly popsány interakce s jinými léčivými přípravky. Současná léčba loperamidem nebo nifuroxazidem nemá na kinetiku racekadotrilu u lidí vliv.
Těhotenství a kojení
Údaje o podávání racekadotrilu těhotným ženám nejsou k dispozici, proto by neměl být těhotným podáván. Pro nedostatek informací o vylučování racekadotrilu do mateřského mléka by racekadotril neměl být podáván kojícím ženám.
Ovlivnění pozornosti
U racekadotrilu by se jako u lipofilní sloučeniny dalo očekávat, že snadno prostoupí hematoencefalickou bariérou a bude vykazovat účinky i v CNS, nicméně tomu brání skutečnost, že se ihned po vstřebání rychle a úplně hydrolyzuje na hydrofilní aktivní metabolit thiorfan, který hematoencefalickou bariérou neprostupuje. Racekadotril proto nemá na schopnost řídit nebo obsluhovat stroje žádné účinky, nebo má jen účinky minimální.
Dávkování – děti
U dětí je racekadotril užíván od tří měsíců věku v dávce 1,5 mg/kg podávané třikrát denně v pravidelných intervalech. Délka léčby v klinickém hodnocení byla 5 dní. Léčba by měla pokračovat až do doby, kdy má pacient dvě normální stolice, a neměla by přesáhnout délku 7 dní. Zrněný prášek (sáčky 10 mg a 30 mg) může být přidán k potravě nebo být rozptýlen ve 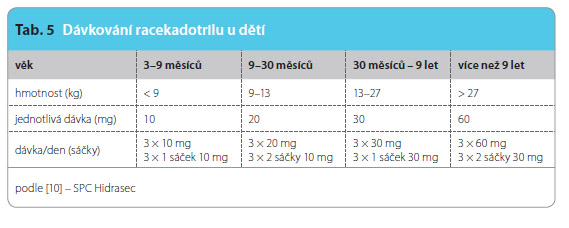 sklenici vody nebo v kojenecké lahvi. Po zamíchání se ihned podává. Potřebné údaje shrnuje tab. 5. U pacientů s jaterním nebo renálním onemocněním je třeba postupovat opatrně – studie u dětí s tímto postižením nejsou k dispozici.
sklenici vody nebo v kojenecké lahvi. Po zamíchání se ihned podává. Potřebné údaje shrnuje tab. 5. U pacientů s jaterním nebo renálním onemocněním je třeba postupovat opatrně – studie u dětí s tímto postižením nejsou k dispozici.
Dávkování – dospělí
Úvodní dávka je jedna tobolka 100 mg, dále jedna tobolka třikrát denně, doporučuje se užívat lék před hlavními jídly. Léčba by měla pokračovat tak dlouho, dokud pacient nemá dvě normální stolice, ne však déle než 7 dní.
Seznam použité literatury
- [1] Eberlin M, Mück T, Michel MC. A comprehensive review of the pharmacodynamics, pharmacokinetics, and clinical effects of the neutral endopeptidase inhibitor racecadotril. Front Pharmacol 2012; 3: 93. doi: 10.3389/fphar.2012.00093.
- [2] Baumer P, Danquechin Dorval E, Bertrand J, et al. Effects of acetorphan, an enkephalinase inhibitor, on experimental and acute diarrhoea. Gut 1992; 33: 753–758.
- [3] Hamza H, Khalifa HB, Baumer, P et al. Racecadotril versus placebo in the treatment of acute diarrhoea in adults. Aliment Pharmacol Ther 1999; 13 (Suppl. 6): 15–19.
- [4] Salazar-Lindo E, Santisteban-Ponce J, Chea-Woo E, et al. Racecadotril in the treatment of acute watery diarrhoea in children. N Engl J Med 2000; 343: 463–467.
- [5] Cezard JP, Duhamel JF, Meyer M, et al. Efficacy and tolerability of racecadotril in acute diarrhoea in children. Gastroenterology 2001; 120: 799–805.
- [6] Cojocaru B, Bocquet N, Timsit S, et al. Effect of racecadotril in the management of acute diarrhoea in infants and children. Arch Pediatr 2002; 9: 774–779.
- [7] Santos M, Maranon R, Miguez CV, et al. Use of racecadotril as outpatient treatment for acute gastroenteritis: a prospective, randomized, parallel study. J Pediatr 2009; 155: 62–67.
- [8] Lehert P, Chéron G, Calatayud GA, et al. Racecadotril for childhood gastroenteritis: an individual patient data meta-analysis. Dig Liver Dis 2011; 43: 707–713.
- [9] Schwartz JC. Racecadotril: a new approach to the treatment of diarrhoea. Int J Antimicrob Agents 2000; 14: 75-79.
- [10] Hidrasec – Souhrn údajů o přípravku, dostupné na www.sukl.cz
- [11] Turck D, Berard H, Fretault N, Lecomte JM. Comparison of racecadotril and loperamide in children with acute diarrhea. Aliment Pharmacol Ther 1999; 13 Suppl 6: 27–32.
- [12] Prado D. A multinational comparison of racecadotril and loperamide in the treatment of acute watery diarrhea in adults. Scand J Gastroenterol 2002; 37: 656–661.
- [13] Gallelli L, Colosimo M, Tolotta GA, et al. Prospective randomized double-blind trial of racecadotril compared with loperamide in elderly people with gastroenteritis living in nursing homes. Eur J Clin Pharmacol 2010; 66: 137–144.