Remimazolam – ultrakrátce působící benzodiazepin
Souhrn:
Hess L. Remimazolam – ultrakrátce působící benzodiazepin. Remedia 2021; 31: 461–464.
Remimazolam je ultrakrátce působící benzodiazepin, který má velmi dobře řiditelný účinek. V molekule má podobně jako remifentanil, opioid s ultrakrátkým účinkem, esterickou vazbu, která je rychle štěpena plazmatickými i tkáňovými esterázami. Remimazolam se váže podobně jako ostatní benzodiazepiny na vazebné místo v GABAergním komplexu s iontovým chloridovým kanálem. Vazbou dochází k alosterickým změnám receptoru a ke zvýšení účinků kyseliny gama‑aminomáselné (GABA), která je hlavním inhibičním neurotransmiterem CNS. Remimazolam je štěpen esterázou na ester kyseliny karboxylové, který má 300krát menší afinitu k receptoru než mateřská látka. Metabolit je klinicky zcela neúčinný a není závislý na enzymech jaterního cytochromu P450. Ovlivnění respirace je větší než po midazolamu, a proto je nutno v průběhu sedace podávat kyslík. Krevní tlak účinkem remimazolamu klesá, srdeční frekvence nejprve stoupá a pak může dojít až k bradykardii. Z nežádoucích účinků se může vyskytnout hypoxemie, hypotenze a bradykardie. Remimazolam představuje první „soft“ derivát benzodiazepinů a teprve budoucnost ukáže jeho význam v různých medicínských oborech. Remimazolam je užíván k procedurální sedaci hlavně při endoskopických výkonech (kolonoskopie, bronchoskopie). Další indikace se hledají.
Summary:
Hess L. Remimazolam – ultra‑short‑acting benzodiazepine. Remedia 2021; 31: 461–464.
Remimazolam is an ultra‑short‑acting benzodiazepine that has a well‑controllable effect. Like remifentanil, the molecule has an ultra‑short‑acting ester bond in it which is rapidly cleaved by plasma and tissue esterases. Remimazolam binds, like other benzodiazepines, to a binding site in the GABAergic complex with an ion chloride channel. Binding leads to allosteric changes in the receptor and an increase in the effects of GABA, a major inhibitory neurotransmitter in the CNS. Remimazolam is cleaved by an esterase to a carboxylic acid ester that has 300‑fold lower affinity for the receptor than the parent compound. The metabolite is clinically ineffective and is not dependent on hepatic cytochrome P450 enzymes. The effect on respiration is greater than after midazolam and therefore oxygen must be administered during sedation. Blood pressure decreases with the effect of remimazolam, the heart rate first rises and then bradycardia may occur. Hypoxemia, hypotension and bradycardia may occur as adverse reactions. Remimazolam is the first “soft” derivative of benzodiazepines and only the future will show its importance in various medical fields. Remimazolam is used for procedural sedation, mainly during endoscopic procedures (colonoscopy, bronchoscopy). Further indications are being sought.
Key words: soft drugs, remimazolam, pharmacodynamics, metabolism, procedural sedation, dosing, side effects
Úvod
V posledních desetiletích se v anesteziologii objevují snahy o syntézu farmak, jejichž účinek by byl velmi dobře řiditelný. Výhodou je dostupnost specifického antagonisty, který zajistí výbornou řiditelnost účinku; tak je tomu v případě opioidů nebo benzodiazepinů. Další možností je syntéza tzv. soft drugs, které jsou metabolicky fragilní, a tak dochází k rychlé biotransformaci a eliminaci ve formě neaktivních metabolitů. Mezi „soft drugs“ patří například suxamethonium, které je štěpeno v plazmě nespecifickými esterázami, ale i esmolol, ultrakrátce působící betablokátor, který je také odbouráván v plazmě esterázami. Patří sem nakonec i rokuronium, jehož účinek se dá řídit podáním sugammadexu; obalením molekul rokuronia dokáže sugammadex ukončit působení rokuronia.
Remifentanil, syntetizovaný v roce 1997, představuje alternativu k imidazobenzodiazepinu midazolamu. Ultrakrátce působící opioid má v molekule esterickou vazbu štěpenou esterázami, čímž je jeho účinek velmi dobře řiditelný. Remimazolam je prvním tzv. měkkým derivátem benzodiazepinů, který byl povolen k lékařskému použití, na trh je dodáván pod obchodním názvem Byfova [1].
Farmakologická skupina
Remimazolam patří mezi
benzodiazepiny, jedná se o ultrakrátce působící
benzodiazepin s esterickou vazbou, která určuje rychlou
hydrolýzu tkáňovými a plazmatickými esterázami.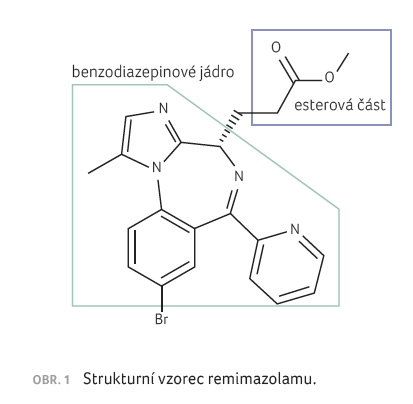
Chemické a fyzikální vlastnosti
Molekulová hmotnost remimazolamu činí 439,3 g/mol. Chemicky je remimazolam C21H19BrN4O2, strukturní vzorec blíže ukazuje obrázek 1 a srovnání strukturního vzorce remimazolamu a midazolamu předkládá obrázek 2A, B.
Mechanismus účinku
Remimazolam se podobně jako ostatní
benzodiazepiny váže na specifická benzodiazepinová vazebná
místa na receptorech A kyseliny
gama aminomáselné (GABAA). U remimazolamu není
jasná selektivita mezi různými subtypy GABAA receptoru.
Protože remimazolam ve své molekule obsahuje esterickou vazbu,
je rychle štěpen na metabolit kyseliny karboxylové (CNS7054),
který má k danému receptoru 300krát nižší afinitu.
Po navázání remimazolamu na receptor se výrazně zvýší
účinnost kyseliny gama aminomáselné (GABA). Dojde
ke zrychlení otevírání chloridového kanálu, chloridové
ionty se dostávají dovnitř neuronu, dochází k hyperpolarizaci
a inhibici nervové aktivity [2].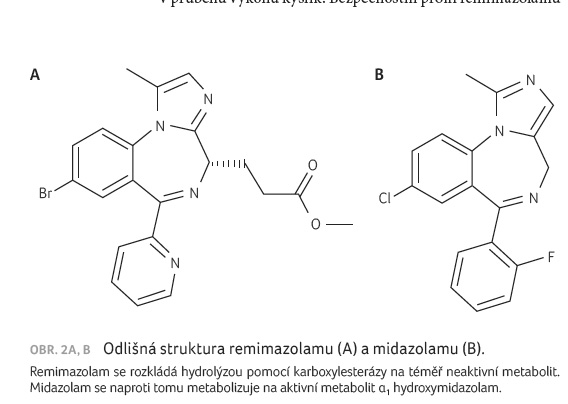
Farmakodynamika
Centrální nervová soustava
U zdravých mladých dospělých byla sedace pozorována při jednorázové bolusové dávce 0,05−0,075 mg/kg, přičemž sedace nastoupí za 1−2 minuty po podání dávky. K navození lehké až středně těžké sedace dochází při plazmatických koncentracích 0,2 µg/ml remimazolamu. Ztráta vědomí je pozorována u zdravých mladých dospělých po dávce 0,2 mg/kg, u starších osob při dávkách 0,1 mg/kg a je spojena s plazmatickými koncentracemi kolem 0,65 µg/ml. Hloubka, trvání a zotavení ze sedace závisejí na dávce. Doba potřebná k nabytí úplné vigility činí při podání remimazolamu v dávce 0,075 mg/kg přibližně 10 minut [3].
Remimazolam může způsobit po aplikaci anterográdní amnézii. Ze 743 pacientů, kteří dostali remimazolam, si 76 % pacientů výkon nevybavilo za 10 minut po nabytí úplné vigility i jeden den po výkonu.
Dýchací systém
Benzodiazepiny v klinických dávkách mají u zdravých pacientů zpravidla zanedbatelný vliv na dýchání. U starších pacientů a při rychlé intravenózní (i.v.) aplikaci však i po midazolamu může dojít k výrazné dechové depresi. V klinických studiích bylo pozorováno, že účinek remimazolamu na dýchání je přísně individuální a u některých osob docházelo k výrazné hypoxemii, proto se doporučuje podávat v průběhu výkonu kyslík. Bezpečnostní profil remimazolamu z hlediska respiračních funkcí je tedy problematičtější než u midazolamu. Sedativní účinky remimazolamu i jeho efekt na respirační funkce lze antagonizovat benzodiazepinovým antagonistou flumazenilem. Vzhledem k tomu, že remimazolam a flumazenil mají srovnatelné biologické poločasy, je riziko resedace nízké ve srovnání s jinými benzodiazepiny s delším biologickým poločasem.
Kardiovaskulární systém
Benzodiazepiny obecně mají malý vliv na oběhový systém, proto jsou často používány v kardioanestezii. Opět podle dosavadních výsledků se zdá, že remimazolam více ovlivňuje kardiovaskulární systém než midazolam. Nejprve dochází ke zvýšení srdeční frekvence o 10−20 %, pak k jejímu poklesu až k výskytu bradykardie. Rovněž krevní tlak zpravidla klesá.
Farmakokinetické vlastnosti
Po intravenózním podání je
distribuční poločas remimazolamu 0,5–2 minuty a distribuční
objem dosahuje 0,76–0,98 l/kg. Remimazolam se váže na bílkoviny
plazmy, především na sérový albumin (z 92 %).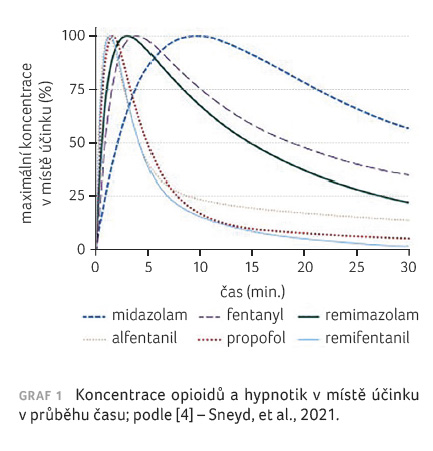
Graf 1 demonstruje křivky dosažení maximální koncentrace farmaka v místě účinku v průběhu času. Koncentrace léčiva v místě účinku je jeho koncentrace v místě biologické aktivity, např. při vazbě na receptory. Je úměrná farmakologickému účinku, zatímco u plazmatické koncentrace to tak nemusí být. Z grafu je patrno, že nejrychlejší nástup účinku mají propofol, remifentanil a alfentanil. U alfentanilu je v čase maximální koncentrace v místě účinku, to znamená v době vrcholného účinku, po 1,4 minuty je do tkání distribuováno pouhých 60 % celkové dávky. Jednotlivá léčiva se liší dobou potřebnou ke snížení koncentrace léčiva v krvi na 50 % po přerušení podávání farmaka (graf 2).
Biotransformace remimazolamu je
zprostředkována jaterními karboxylesterázami, remimazolam
nepodstupuje biotransformaci enzymy jaterního cytochromu P450 ani
tvorbu těchto enzymů neindukuje a neinhibuje [4]. Remimazolam
se vylučuje močí, asi v 80 % jako CNS7054 a pouhé
0,03 % podané dávky se vylučují v nezměněné formě.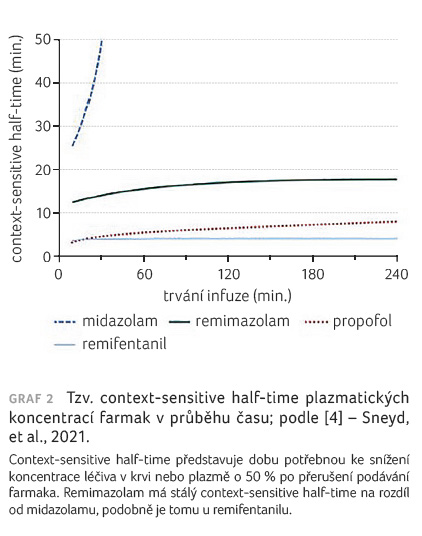
Eliminační poločas remimazolamu činí 37−53 minut, zvyšuje se u pacientů s poruchou funkce jater, což vyžaduje pečlivou titraci dávky u této populace. Eliminační poločas hlavního neaktivního metabolitu CNS7054 je 2,4–3,8 hodiny. Clearance remimazolamu představuje přibližně 24–75 l/h a je nezávislá na tělesné hmotnosti. Tím je asi třikrát rychlejší než u midazolamu.
Klinické studie
Bezpečnost a účinnost remimazolamu ve srovnání s placebem a midazolamem jako zástupci benzodiazepinů byly testovány v multicentrické studii zahrnující celkem 969 pacientů – žen a mužů, kteří podstoupili procedurální sedaci. Studie zahrnovala bělochy, černochy, asiaty a Jihoameričany. Jednalo se o pacienty ASA I–III (anesteziologické riziko dle American Society of Anesthesiologists), kteří se podrobili kolonoskopii. Remimazolam byl podán nejprve v dávce 5 mg (2 ml) jako indukční bolus následovaný 2,5 mg (1 ml). Fentanyl byl podán jako analgetikum ještě před aplikací remimazolamu v počáteční dávce 25−50 µg i.v. V průběhu výkonu byl podáván po 25 µg každých 5−10 minut až do dosažení dostatečné analgezie. Jeho maximální dávka byla 200 µg. V průběhu výkonu byl podáván kyslík rychlostí 1−5 l/min, dokud nebyl pacient plně bdělý po skončení výkonu. Kolonoskopie započala při dosažení dostatečné sedace se skóre MOAA/S (Modified Observer’s Assessment of Alertness/Sedation Scale) ≤ 3. Ve 3,4 % případů z 298 musel být přidán midazolam, v 6 % případů byla sedace příliš hluboká a u 2,3 % případů nebyla studie dokončena. Celková spotřeba remimazolamu byla 10,5 ± 4 mg, fentanylu 89,9 ± 21,7 µg. Čas propuštění byl za 44 minut po poslední dávce remimazolamu [5].
Velmi podobná studie byla provedena u pacientů při bronchoskopickém vyšetření [6].
Další klinické studie ještě v podstatě chybějí, je uvedena jedna kazuistika při použití remimazolamu při kardioanestezii v Japonsku [7] a je navrhována studie, která by měla sledovat nazální aplikaci remimazolamu u dětí.
Pesic a kol. [8] zkoumali perorální dostupnost remimazolamu se současným podáním alkoholu a bez něj. Zjistili, že biologická dostupnost per os je velmi nízká a dosahuje sotva 2 %. Vzhledem k tomu, že remimazolam je velmi hořký a má malou biologickou dostupnost, nepřipadá v úvahu na rozdíl od midazolamu jeho zneužití jako date rape drug. Pesic a spolupracovníci [9] testovali farmakologické účinky a biologickou dostupnost remimazolamu aplikovaného nazálně v prášku a jako roztok. Lyofilizovaný prášek měl po nazální aplikaci biologickou dostupnost okolo 50 %, roztok daleko nižší (okolo 20 %). Kromě toho remimazolam dráždil nosní sliznici a u některých pokusných osob způsobil dokonce bolesti po aplikaci. Proto se nad tímto způsobem aplikace vznáší velký otazník.
Indikace
Remimazolam je indikován k procedurální sedaci při výkonech u dospělých [3].
Zařazení do současné palety léčiv
Remimazolam patří mezi benzodiazepiny a má všechny charakteristické farmakologické účinky. Byl syntetizován ve snaze získat plně řiditelný benzodiazepin k procedurální sedaci kratší než 30 minut. Mohl by se tedy uplatnit hlavně při endoskopických výkonech.
Ve Spojených státech amerických byl remimazolam použit ke kolonoskopii a bronchoskopii. Nejprve byl podán bolus 6–6,5 mg a pak každé 2 minuty remimazolam v dávce 2–2,5 mg. Základní dávkování při endoskopických výkonech je 0,075–0,2 mg/kg. Účinek nastupoval za 1,5–2,5 minuty, což je o trochu dříve než po midazolamu (za 5 minut) [10].
Celková anestezie
V současnosti panují nejasnosti kolem použití remimazolamu při celkové anestezii (total intravenous anesthesia, TIVA).
Koanestezie
Remimazolam podobně jako ostatní benzodiazepiny nemá analgetický účinek, proto je zvažována kombinace s opioidy, např. s remifentanilem a alfentanilem. Remifentanil však redukuje dávku remimazolamu o 90 %!
Dlouhodobá sedace na jednotkách intenzivní péče
Dosud nejsou k dispozici žádné klinické studie.
Kontraindikace
Kontraindikací je v první řadě hypersenzitivita na remimazolam nebo na jiné benzodiazepiny nebo na jakoukoliv pomocnou látku, hlavně na dextran 40. Jinak jsou kontraindikace stejné jako u ostatních benzodiazepinů (myasthenia gravis). Remifentanil nesmí být použit u osob mladších 18 let. O vlivu remimazolamu na těhotenství nejsou k dispozici dostatečná data. U kojících žen je potřeba zachovat časový odstup 5 hodin od podání remimazolamu.
Nežádoucí účinky
Mezi nejčastější nežádoucí účinky patří hypotenze – 37,2 %, respirační deprese se vyskytuje v 13,1 % a bradykardie v 6,8 % případů. Určité nebezpečí představuje výskyt příliš hluboké sedace, který je u remimazolamu vyšší než u midazolamu. Byl také zaznamenán větší výskyt hypoxemie a respirační profil remimazolamu je horší než u midazolamu. Proto se doporučuje v průběhu procedurální sedace vždy podání kyslíku. Již v klinickém testování při endoskopiích, kolonoskopiích a bronchoskopiích se ukázaly velké individuální rozdíly, které byly považovány testujícími lékaři za neočekávané. Dle mého názoru (dosud bez praktických klinických zkušeností s tímto přípravkem) je situace podobná jako u opioidu remifentanilu, kde vzhledem k rychlosti nástupu účinku dojde velmi snadno ke svalové rigiditě. U remimazolamu stačí u některých pacientů již dávka 0,05 mg/kg k navození bezvědomí. Rovněž rychlé odeznění účinku remimazolamu není z určitého hlediska úplně optimální. Může dojít ke stavům náhlé vigility a k excitačním projevům [11].
Z dalších nežádoucích účinků je možný výskyt hypotenze. Srdeční frekvence zpravidla po aplikaci nejprve stoupá o 10–20 tepů/min, posléze klesá a u někoho může dojít až k bradykardii. V pilotních studiích byla relativně častá dechová deprese nebo potřeba rescue terapie midazolamem. Pak byla dosažená sedace adekvátní.
Remimazolam výrazně ovlivňuje naše kognitivní schopnosti a schopnost soustředit se. Má také amnestické účinky. Tím je podstatně ovlivněno řízení auta nebo obsluhování strojů. Ošetřující lékař musí rozhodnout, kdy dojde k plnému obnovení psychických schopností [12].
Lékové interakce
Sedativní účinek remimazolamu může být akcentován současným podáním látek tlumících centrální nervový systém – opioidy, analgetika, jiné benzodiazepiny nebo propofol. Alkohol musí být vynechán 24 hodin před aplikací remimazolamu.
Dávkování
Základní dávka pro dospělé pacienty je 5 mg podaných i.v. v průběhu jedné minuty. Dále počkáme 2 minuty mezi původní a další dávkou, která činí zpravidla 2,5 mg. Uvedené údaje jsou pouze přibližné, dávkování musíme uzpůsobit zejména věku a individualitě každého pacienta.
Při kombinaci s opioidem podáváme opioid před remimazolamem v dávce 25–50 µg u starších osob a 50–75 µg u mladších osob. Následuje úvodní dávka remimazolamu 2,5–5 mg (1–2 ml), kterou aplikujeme po dobu jedné minuty, počkáme 2 minuty a zhodnotíme dosažený stupeň sedace. Jako titrační dávku podáváme remimazolam v dávce 1,25–2,5 mg čili 0,5–1 ml. V průběhu celé sedace musí sledovat vyškolený zdravotnický pracovník základní životní funkce, tj. dýchání, krevní oběh a stupeň dosažené sedace; musí být vyčleněn pouze pro tuto monitoraci, a nemůže se proto věnovat provedení tohoto výkonu. K dispozici by měly být všechny resuscitační pomůcky a specifický antagonista benzodiazepinů flumazenil [3].
Příprava roztoku
K obsahu lahvičky přidáme 8,2 ml sterilního fyziologického roztoku a proud roztoku řídíme proti stěně lahvičky. Jemně otáčíme (netřeseme) lahvičkou, až je obsah plně rozpuštěn. Roztok má nyní koncentraci 2,5 mg v 1 ml. Roztok po přípravě musí být jasný, bezbarvý, ev. bledě žlutý. Prášek remimazolamu může být smísen s glukózovými roztoky, fyziologickým roztokem a Ringerovým roztokem.
Použitelnost
Jestliže nepoužijeme roztok ihned, přechováváme lahvičku až po dobu 8 hodin při pokojové teplotě 20–25 °C. Nevystavujeme ji světlu, po 8 hodinách nespotřebovaný roztok zlikvidujeme.
Seznam použité literatury
- [1] Scheckenbach V, Hofmann P, Drexler B. Remimazolam – The future of TIVA? Anästh Intensivmed 2021; 62: 111–117.
- [2] Bansal S, Singhal S. Remimazolam (CNS7056): an Emerging Sedative and General Anaesthetic. J Clin Diag Research 2018; 12: 1–3.
- [3] Souhrn údajů o přípravku Byfavo. Dostupné na https://www.sukl.cz
- [4] Sneyd JR, Gambus PL, Rigby‑Jones AE. Current status of perioperative hypnotics, role of benzodiazepines and the case for remimazolam: a narrative review. Br J Anaest 2021; 127: 41–55.
- [5] Worthington M, Antonick L, Goldwater D, et al. A phase Ib, dose‑finding study of multiple doses of remimazolam (CNS 7056) in volunteers undergoing colonoscopy. Anesth Analg 2013; 117: 1093–1100.
- [6] Pastis NJ, Yarmus LB, Schippers F, et al. Safety and Efficacy of Remimazolam Compared with Placebo and Midazolam for Moderate Sedation During Bronchoscopy. Chest 2019; 155: 137–146.
- [7] Saito K, Ohno S, Maeda M, et al. Remimazolam anesthesia for cardiac surgery with cardiopulmonary bypass: a case report. JA Clinical Reports 2021; 7: doi:10.1186/s40981‑021‑00424‑0.
- [8] Pesic M, Stöhr T, Ossig J, et al. Remimazolam has low oral bioavailability and no potential for misuse in drug‑facilitated sexual assaults, with or without alcohol: results from two randomised clinical trials. Drugs R D 2020; 20: 267–277.
- [9] Pesic M, Schippers F, Saunders R, et al. Pharmacokinetics and pharmacodynamics of intranasal remimazolam – a randomized controlled clinical trial. Eur J Clin Pharmacol 2020; 76: 1505–1516.
- [10] Wesolowski AM, Zaccagnino MP, Malapero RJ, et al. Remimazolam: Pharmacologic Considerations and Clinical Role in Anesthesiology. Pharmacotherapy 2016; 36: 1021–1027.
- [11] Prescribing information Remimazolam, FDA 2020. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/ 212295s000lbl.pdf
- [12] About remimazolam. PAION (19. 6. 2020). Dostupné na: https://www.paion.com/remimazolam/indikationen/leitsubstanz‑remimazolam