Rifaximinum
Rifaximin je nevstřebatelné antibiotikum se širokým spektrem účinku zahrnujícím grampozitivní a gramnegativní bakterie a anaerobní flóru. Je velmi dobře snášen s minimálními nežádoucími účinky. Široké antibakteriální spektrum a farmakokinetické vlastnosti rifaximinu jej předurčují k širokému využití v gastroenterologii. V současné době se využívá především v terapii průjmů cestovatelů a u střevních infekcí. Kontrolované zkoušky potvrdily terapeutický přínos u nemocných s idiopatickými střevními záněty, ulcerózní kolitidou a Crohnovou nemocí. Byla prokázána vysoká účinnost léku také v léčbě chronické pouchitidy. Jako perspektivní se jeví jeho klinické využití v terapii funkčních střevních poruch, syndromu bakteriálního přerůstání a divertikulární choroby tlustého střeva. Postavení léku v terapii helikobakterové infekce a při dekontaminaci střeva u akutní nekrotizující pankreatitidy bude potřeba ověřit v dalších klinických zkouškách.
Farmakologická skupina
Syntetické antibiotikum vzniklé modifikací rifamycinu.
Chemické a fyzikální vlastnosti
Rifaximin je chemicky (2S,16Z,18E,20S, 21S,22R,23R,24R,25S,26R,27S,28E)-5,6,21,23,25-pentahydroxy-27-methoxy-2,4,11,16,20,22,24,26-oktamethyl-2,7-(epoxypentadeka[1,11,13]trienimino)benzofuro[4,5-e]pyrido[1,2-a]benz-imidazol-1,15-dion,25-acetát.
Sumární vzorec: C43H51N3O11
Molekulová hmotnost: 785,9
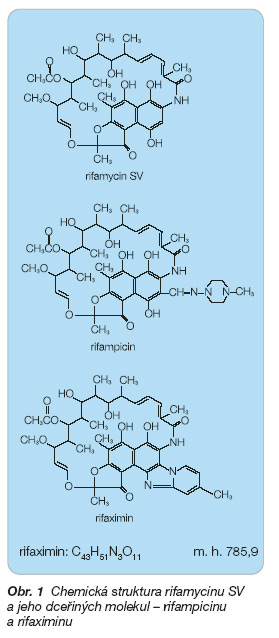
Rifaximin je syntetická látka vzniklá modifikací mateřské látky rifamycinu (4-deoxy4´-methylpyridol[1´, 2´-1,2]imi-dazo-[5,4-c] rifamycin SV) s cílem dosáhnout nízké absorpce ve střevě při udržení dobré antibakteriální aktivity. Jde o derivát rifamycinu SV připravený kondenzací 2-aminopyridinového derivátu s bromorifamycinem S (obr. 1). Struktura rifaximinu, která je tvořena pozitivně nabitým pyrido-nitrogenem a negativně nabitým imidazo-nitrogenem, je zodpovědná za jeho farmakokinetické vlastnosti. Přítomnost dvou opačně nabitých nitrogenů a přítomnost hydroxyfenolů vede v pH obsahu trávicí trubice k ionizaci molekuly a zabraňuje absorpci molekuly. Rifaximin vykazuje tendenci k molekulové asociaci v roztoku i v pevném skupenství a toto zvýšení molekulové hmotnosti také brání absorpci, avšak je stabilní v žaludeční šťávě po dobu 24 hodin [1].
Spektrum antimikrobiální aktivity
Studie provedené in vitro prokázaly, že rifaximin disponuje inhibiční aktivitou proti grampozitivním a gramnegativním aerobním i anaerobním bakteriím. Bylo prokázáno, že účinnost rifaximinu je výraznější proti grampozitivním bakteriím než proti gramnegativním bakteriím. Mezi grampozitivními bakteriemi byla potvrzena citlivost také oxacilin-rezistentního kmene Staphylococcus aureus a Clostridium difficile.
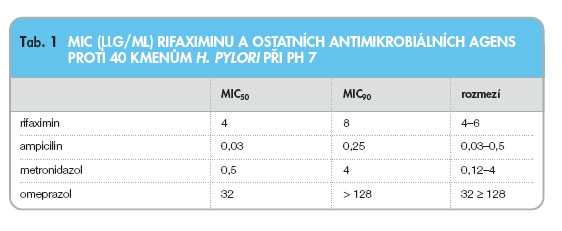
Z gramnegativních bakterií patřících k čeledi Enterobacteriaceae se prokázala senzitivita Helicobacter pylori (tab. 1), kde se hodnoty MIC pohybovaly mezi hodnotami pro amoxicilin a bismuth. Na rozdíl od metronidazolu žádný z testovaných kmenů neprojevil vůči rifaximinu primární rezistenci. Významné je, že aktivita rifaximinu byla jen mírně ovlivněna nízkým pH prostředí, což zvýhodňuje rifaximin oproti ostatním antibiotikům. Nedávná studie prokázala účinnost rifaximinu proti 408 kmenům Vibrio cholerae izolovaným z rozdílných geografických oblastí a s různým typem antimikrobiální rezistence. Hodnoty MIC se pohybovaly mezi 0,5–0,4 mg/ml pro všechny kmeny. Tyto nálezy podporují úvahy o budoucím využití rifaximinu jako léku proti choleře [2].
Antibakteriální aktivita rifaximinu v experimentálních studiích
Účinek rifaximinu byl porovnáván s efektem neomycinu nebo rifampicinu na fekální flóru u myší ve dvou experimentálních pracích. V první studii bylo antibiotikum podáváno po 7 dní v koncentracích 1, 10, 30, 100 mg/kg /den. Po těchto dávkách došlo k zastavení růstu aerobních, zvláště koliformních bakterií a koků, ale také anaerobních bakterií. Antimikrobiální účinek byl stejný jako u neomycinu a výraznější než u rifampicinu. Ve druhé studii autoři sledovali vliv rifaximinu na aerobní flóru v dávce 50 mg/kg po dobu 3 dnů. Tato dávka rifaximinu vedla k významné redukci celkového počtu aerobních bakterií a salmonel, zatímco neomycin snížil pouze počet salmonel, ale neovlivnil významně celkově aerobní bakteriální populaci. Minimální systémová dostupnost léčiva byla demonstrována na myších, kterým byl intraperitoneálně inokulován Stafylococcus aureus Colliva a poté jim byl podán perorálně rifaximin, rifampicin, nebo gentamicin a srovnáván jejich účinek. Efektivitu vykazoval pouze rifampicin. Ostatní antibiotika nebyla účinná ani při vysokém dávkování. Jestliže byl rifaximin podán subkutánně, bylo dosaženo příznivého terapeutického efektu [2].
Mikrobiální rezistence in vitro
Rezistence na rifaximin může být zprostředkovaná plazmidy. Bývá častým mechanismem vzniku bakteriální rezistence na aminoglykosidy, jako je neomycin a bacitracin, nebo vzniká na podkladě jednoduché chromozomální změny v cílovém místě účinku antibiotika – DNA-dependentní RNA polymerázy. Spontánní selekce rezistentních kmenů po expozici rifaximinu byla řídká ve skupině anaerobních bakterií, snadněji se objevovala v aerobních podmínkách u grampozitivních koků. Studium vzniku rezistence na pěti odlišných izolátech Helicobacter pylori prokázalo, že žádný z těchto kmenů nevyvinul primární rezistenci k rifaximinu, ale až po expozici rifaximinu v koncentracích nedosahujících hodnot MIC. Díky vysoké biologické dostupnosti rifaximinu a nízkým koncentracím kyslíku v prostředí trávicí trubice je opodstatněné předpokládat, že selekce rezistentních kmenů je velmi vzácná [1, 3].
Mikrobiální rezistence in vivo
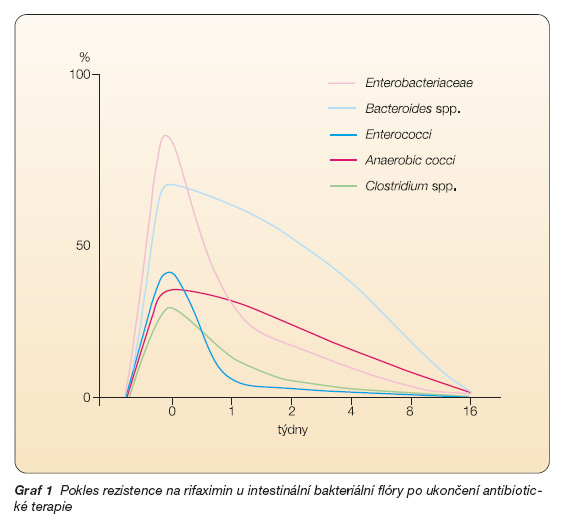
Po krátkodobé terapii rifaximinem v dávkování 800 mg/den po dobu 5 dnů se objevila rezistence u 30–90 % kmenů čeledi Enterobacteriaceae izolovaných ze stolice (rody Enterococcus, Bacteroides, Clostridium, anaerobní koky). Stejné výsledky se objevily u 10 pacientů s jaterní encefalopatií. Po ukončení antibiotické léčby však došlo k rychlému poklesu počtu rezistentních kmenů (graf 1).
Přestože byly zaznamenány rozdíly v rychlosti návratu k původní senzitivitě, již tři měsíce po ukončení léčby nebyly ve stolici žádné rezistentní kmeny detekovány. Tyto závěry podporují oprávněnost cyklického podávání rifaximinu v terapii jaterní encefalopatie, divertikulární nemoci a idiopatických střevních zánětů.
Protože antibiotika odvozená od rifamycinu se používají k léčbě tuberkulózy, existuje teoretické riziko selekce rezistentních kmenů Mycobacterium tuberculosis při terapii rifaximinem. Studie, které probíhaly s guinejskými prasaty za velmi přísných podmínek, však neprokázaly snížení senzitivity mykobakterií na rifamycin po terapii rifaximinem.
V Itálii probíhalo desetileté sledování (1990–2000) u pacientů užívajících rifaximin pro chronické gastrointestinální onemocnění, kteří měli latentní tuberkulózu. Nebyl zaznamenán pokles senzitivity mykobakterií na rifampicin [3, 5, 7].
Mechanismus účinku
Účinky rifaximinu byly zkoumány na růstu kolonií Escherichia coli. Rifaximin inhibuje syntézu RNA vazbou na b-subjednotku bakteriální DNA-dependentní RNA polymerázy, a to v závislosti na koncentraci. Mechanismus účinku je stejný jako u rifampicinu [4].
Farmakokinetika
Základní farmakokinetické charakteristiky rifaximinu u zdravých dobrovolníků po jednorázovém podání udává tab. 2.
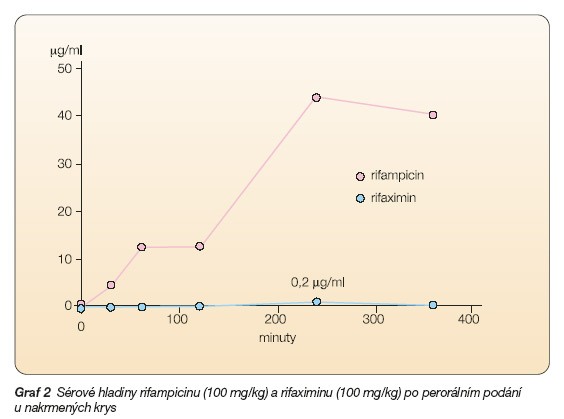
Minimální vstřebávání rifaximinu ve střevě bylo ověřeno použitím radioaktivně značeného léčiva u experimentálních zvířat (graf 2).
Po perorální aplikaci rifaximinu byly v plazmě detekovány hodnoty 0,1–2 % podané látky. Ani při indukované enteropatii a porušení sliznice střeva u experimentálních zvířat nedošlo k ovlivnění vstřebávání rifaximinu. Na zvířecích modelech bylo dále prokázáno, že se rifaximin vylučuje z těla hlavně stolicí a jen minimálně močí. Minimální množství rifaximinu, které se vstřebalo, podléhá enterohepatální cirkulaci. Po perorálním podání je nejvyšší hladiny radioaktivity dosaženo za půl hodiny v žaludku, za 2 hodiny v tenkém střevě a za 7 hodin v céku a tlustém střevě. V jiných orgánech byly hodnoty radioaktivity velmi nízké a v ledvinách a játrech dosahovaly méně než 0,001 % podané dávky.
Farmakokinetika perorálně podaného rifaximinu byla studována u zdravých dobrovolníků a také u pacientů s idiopatickými střevními záněty (IBD) a střevními infekcemi.
Při perorálním podání rifaximinu zdravým dobrovolníkům nalačno nebyla hladina léčiva v séru detekovatelná u poloviny z nich. Ve zbývajících případech byly nalezeny velmi nízké hladiny první 4 hodiny po podání. Stejně tak koncentrace látky v moči byla velmi nízká a často vůbec nezjistitelná. Eliminace léčiva probíhá z největší části stolicí a pouze stopová množství se vylučují močí. Analýzou extraktů ve stolici bylo zjištěno, že se rifaximin vylučuje v nezměněné formě [1].
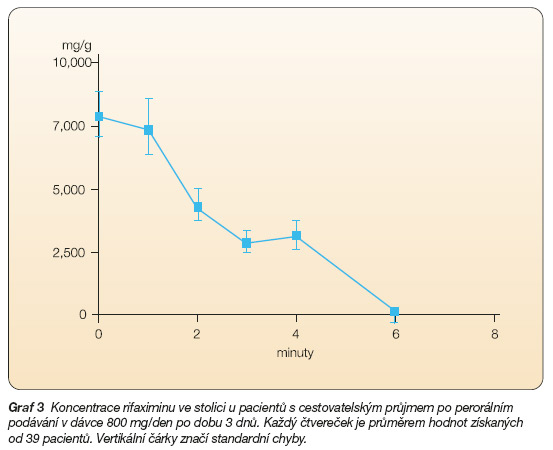
Systémová absorpce dávky 600 mg denně byla zkoumána u 13 pacientů trpících shigelovou infekcí. Nebyla zaznamenána akumulace léčiva po opakovaném podání po dobu 3 dnů ( 9 dávek). Vrchol plazmatické koncentrace po třech a devíti dávkách se pohyboval v rozmezí od 0,81–3,4 ng/ml první den a 0,68–2,26 ng/ml třetí den. Koncentrace rifaximinu ve stolici byla ověřena u 39 pacientů s akutním infekčním průjmem léčených dávkou 800 mg po dobu 3 dnů. Koncentrace ve stolici mnohonásobně překročily hodnoty MIC (graf 3).
Vstřebávání rifaximinu bylo studováno u pacientů s mírnou až středně těžkou ulcerózní kolitidou po podání 800 mg denně. Koncentrace v plazmě byla v největším počtu vzorků pod hranicí detekovatelnosti a v několika vzorcích byly zjištěny nízké koncentrace 8 hodin po podání, v moči byla koncentrace 0,009 % celkové dávky. Nebyla potvrzena korelace mezi hladinami rifaximinu v moči a aktivitou ulcerózní kolitidy. U pacientů s pouchitidou, kteří byli léčeni vysokými dávkami rifaximinu (2 g/denně) společně s ciprofloxacinem (1 g/denně), nebyl v plazmě rifaximin detekován.
Biliární koncentrace rifaximinu byla zkoumána u pacientů, kteří se podrobili cholecystektomii. U sedmi ze 13 vzorků žluče byla zachycena pouze stopová množství antibiotika, u ostatních se koncentrace pohybovaly od 4,5 do 15,6 mg/ml. Pro srovnání, biliární hladiny rifampicinu se po podání 450 mg perorální dávky pohybovaly v koncentraci vyšší než 150 mg/ml. Jelikož se rifaximin vylučuje jen minimálně močí, není nutné upravovat jeho dávkování u pacientů s renální insuficiencí [1, 6].
Klinické zkušenosti
Klinické využití rifaximinu vyplývá ze širokého spektra antimikrobiálního účinku a farmakokinetických vlastností. Používá se především u chorob gastrointestinálního traktu nebo s cílem dekontaminace trávicího traktu nebo eliminace probíhající infekce.
Indikace užívané v klinické praxi
Cestovatelský průjem a střevní infekce
Účinnost rifaximinu při léčbě cestovatelského průjmu byla ověřena multicentrickou, randomizovanou dvojitě slepou studií, ve které pacienti dostávali 600 mg/den nebo 1 200 mg/den rifaximinu, nebo placebo. Do studie bylo zahrnuto 380 pacientů se symptomy akutního průjmu definovaného jako nejméně 3 neformované stolice během 24 hodin před randomizací. Nejčastějšími patogeny izolovanými ze stolice pacientů s cestovatelským průjmem byly Cryptosporidia, Giardia lamblia, Salmonella, Shigella spp. a enterotoxigenní kmeny Escherichia coli. Jako referenční bod účinnosti léčby byla užita délka časového intervalu od první dávky léku do vzniku formované stolice. Terapie rifaximinem vykazovala signifikantně vyšší účinnost než placebo. Nebyly nalezeny významné rozdíly ve výskytu nežádoucích účinků mezi léčenými skupinami [8].
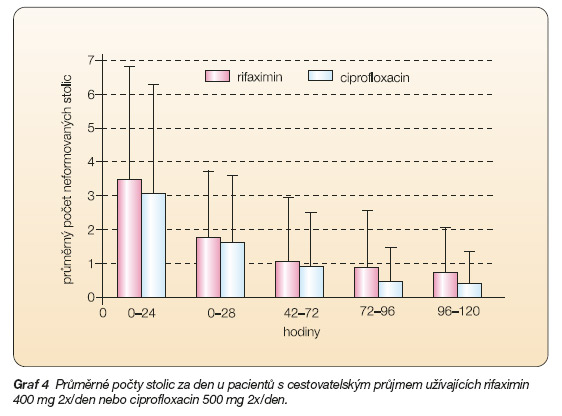
Další kontrolovaná zkouška v terapii cestovatelských průjmů byla zaměřena na srovnání účinnosti rifaximinu s ciprofloxacinem. Do studie bylo zařazeno celkem 187 nemocných. Během tří dnů bylo dosaženo významného zlepšení stavu u 87 % pacientů léčených rifaximinem a 88 % pacientů léčených ciprofloxacinem. Léčba selhala u 9 subjektů léčených rifaximinem (10 %) a u 5 (5 %) léčených ciprofloxacinem (graf 4).
Výskyt nežádoucích účinků byl shodný u obou experimentálních skupin. Podobně příznivé výsledky demonstrovala studie provedená v Mexiku, která porovnávala příznivý účinek rifaximinu s trimethoprim/sulfamethoxazolem (TMP/ SMX). Po 24 hodinách léčby bylo 56 % pacientů užívajících 200 mg, 44 % pacientů užívajících 400 mg a 53 % pacientů užívajících 600 mg rifaximinu bez větších obtíží v porovnání se 65 % nemocných na terapii TMP/SMX. Po 48 hodinách léčby bylo bez obtíží 83 %, 78 % a 89 % léčených ve skupinách s rifaximinem a 76 % pacientů ve skupině TMP/SMX. Selhání léčby se vyskytlo u 11 % pacientů na rifaximinu a u 29 % pacientů léčených TMP/SMX. Převládajícím patogenem byly enterotoxigenní kmeny Escherichia coli [1, 9].
U pacientů s infekčním průjmem léčených rifaximinem, kde byla u 50 % z nich prokázána jako etiologické agens Escherichia coli, došlo k eradikaci u 80 % léčených. Eradikace nebo významné snížení počtu bakterií ve stolici bylo prokázáno také pro ostatní rody čeledi Enterobacteriaceae, a to i po krátkodobé terapii rifaximinem. Při opakovaném perorálním podávání rifaximinu je dosahováno vysoké koncentrace v lumen střeva s následným významným snížením bakteriálního obsahu. Tento efekt je však pouze krátkodobý. Během jednoho až dvou týdnů po skončení léčby dochází k návratu bakteriální flóry do stavu před léčbou. Mykotická kolonizace po léčbě infekčního průjmu se vyskytla velmi zřídka. Candida albicans, která je častým původcem průjmů po užívání systémově působících antibiotik, byla izolována ze stolice pouze u 2 pacientů z 10, kteří užívali 1 200 mg rifaximinu denně, a u žádného z pacientů užívajících dávku 800 mg denně [10].
Účinnost rifaximinu byla prokázána také při léčbě protozoárních infekcí (Cryptosporidium parvum, Blastocystis hominis) u pacientů s již klinicky rozvinutým syndromem AIDS [1].
Idiopatické střevní záněty
Idiopatické střevní záněty (IBD), ulcerózní kolitida a Crohnova nemoc jsou chronická zánětlivá střevní onemocnění zatím blíže neurčené etiologie, u kterých se v patogenezi zánětu významnou měrou uplatňuje mikrobiální osídlení sliznice tlustého a tenkého střeva. Antimikrobiální terapie patří do armamentaria medikamentózní terapie těchto chorob.
Nekontrolovaná studie provedená u 12 pacientů neodpovídajících na standardní léčbu ulcerózní kolitidy prokázala, že přidání 800 mg rifaximinu denně zvyšuje terapeutickou odpověď [13]. Do další studie byli zařazeni pacienti, kteří neodpovídali na léčbu podávanými kortikosteroidy po dobu 7–10 dní. Do studie bylo randomizováno 28 pacientů, kteří dostávali 400 mg rifaximinu denně, nebo placebo po dobu 10 dnů ke standardní kortikosteroidní léčbě. I když nebyly prokázány signifikantní rozdíly v klinické účinnosti mezi oběma skupinami, byl potvrzen příznivý vliv rifaximinu na zlepšení některých symptomů, jako je frekvence stolic, krvácení z konečníku a endoskopický nález. Rifaximin se ukázal být účinným také v navození remise u pacientů s exacerbací UC, kteří v důsledku předchozích vážných nežádoucích účinků nemohli užívat kortikosteroidy [11, 15]. Podobně příznivé výsledky s rifaximinem v dávce 800 mg denně u nemocných s ulcerózní kolitidou ve fázi mírné až střední zánětlivé aktivity byly prokázány také v české multicentrické zkoušce [12].
Jako perspektivní u pacientů s chronickou formou pouchitidy se jeví podávání vysokých dávek rifaximinu (2 g/den) společně s ciprofloxacinem (1 g/den). Terapie trvající celkem 15 dnů přinesla klinickou, endoskopickou a histologickou remisi u 89 % pacientů, a to bez jakýchkoliv vedlejších účinků [14].
Nedávná studie Campieriho potvrdila vysokou účinnost kombinace rifaximinu s vysokými dávkami probiotik (VSL#3) v prevenci těžkého endoskopického relapsu po chirurgickém výkonu u pacientů s Crohnovou nemocí [1].
V současné době probíhá randomizovaná placebem kontrolovaná studie GRACE 2, která sleduje účinnost terapie vysokými dávkami rifaximinu u mírně a středně aktivní Crohnovy nemoci po dobu 3 měsíců.
Prevence jaterní encefalopatie a spontánní bakteriální peritonitidy u jaterní cirhózy
Širokospektrý účinek rifaximinu a vysoká účinnost proti anaerobním bakteriím, zvláště klostridiím, které jsou odpovědné za tvorbu amoniaku v trávicím traktu, předurčují využití rifaximinu u nemocných s pokročilou jaterní cirhózou. Významný je fakt, že nevstřebatelné antibiotikum neovlivňuje porušené jaterní funkce u těchto pacientů. V otevřené studii u nemocných s alkoholickou jaterní cirhózou (Child B, C) byl demonstrován příznivý účinek rifaximinu v dávce 1 200 mg denně na zlepšení známek jaterní encefalopatie. Na základě logaritmické křivky bakteriálního přežívání byla prokázána větší antibakteriální účinnost rifaximinu ve srovnání s paramomycinem proti Enterococcus spp., anaerobním kokům, Bacteroides spp. a Clostridium spp., které byly izolovány ze stolice dvaceti pacientů se subklinickou formou jaterní encefalopatie. E. coli a Klebsiella spp. jevily větší senzitivitu k paramomycinu a obě antibiotika (rifaximin a paramomycin) pak shodně účinkovala proti Proteus spp. Je třeba zdůraznit, že koncentrace rifaximinu ve stolici byly 250–500krát vyšší než MIC90 [16].
Spontánní bakteriální peritonitida je mikrobiální kontaminace původně sterilní ascitické tekutiny, která vzniká v důsledku bakteriální translokace u nemocných s významnou portální hypertenzí při jaterní cirhóze. Etiologické agens představují G-bakterie, jako jsou E. coli a Klebsiella pneumoniae, které tvoří 63 % případů. Vzhledem ke své antimikrobiální aktivitě by rifaximin mohl představovat vhodné antibiotikum k dlouhodobé profylaxi u nemocných s vysokým rizikem vzniku spontánní bakteriální peritonitidy. Účinek rifaximinu byl již ověřen u pacientů s alkoholickou cirhózou, kteří ho užívali jeden týden v měsíci po dobu 12 měsíců. Incidence SBP po této terapii výrazně poklesla [1].
Příprava před chirurgickou léčbou v kolorektální oblasti
Rifaximin v denní dávce 600 mg nebo 800 mg po dobu 3 dnů jako profylaxe před kolorektálním chirurgickým výkonem významně snížil počet aerobních i anaerobních bakterií ve stolici. Při srovnávání perorálně podávaného rifaximinu s parenterálně podávaným gentamicinem a perorálně podávaným paramomycinem byla potvrzena srovnatelná účinnost v prevenci vzniku pooperačních infekcí. Další studie srovnávala účinnost rifaximinu společně s intravenózně podávaným cefotaximem (3 g/denně po dobu 5 dní) proti samotnému cephalosporinu intravenózně. Výsledek prokázal vyšší účinnost antibiotické kombinace než samostatně podávaného cephalosporinu. V jiné studii byla hodnocena účinnost rifaximinu (800 mg denně) v prevenci vzniku pooperačních infekcí aplikací do nazogastrické sondy během 5 pooperačních dní s perorálním preoperačním podáním. Byla prokázána shodná účinnost obou léčebných konfigurací. Je možné shrnout, že třídenní preoperační perorální podávání rifaximinu je efektivní v prevenci rozvoje pooperačních infekčních komplikací [17].
Infekce Clostridium difficile
Infekce Clostridum difficile je relativně velmi častou příčinou nozokomiálních infekcí u nemocných léčených širokospektrými antibiotiky. Byla prokázána dobrá účinnost rifaximinu proti klostridiové infekci in vitro. Ve srovnání s metronidazolem a vancomycinem, které jsou standardně používány k léčbě pseudomembranózní kolitidy, jsou hodnoty MIC u rifaximinu nižší než u těchto dvou antibiotik. Další z výhod léčby rifaximinem je i nízká selekce rezistentních kmenů (< 1.10–9). Randomizované otevřené studie prováděné u pacientů s pseudomembranózní kolitidou srovnávaly účinnost léčby rifaximinem (600 mg denně) s vancomycinem (1 000 mg denně). Výsledkem byl průkaz shodné účinnosti obou antibiotik [1].
Perspektivní indikace
Prevence enteropatie indukované nesteroidními antirevmatiky (NSA)
Studie na zvířecích modelech prokázaly komplikovanou patogenezi poškození sliznice tenkého a tlustého střeva při užívání NSA. Jde zejména o ovlivnění enterohepatální cirkulace, epiteliální permeability, oxidativní fosforylace epiteliálních buněk a bakteriální infekce. Několik studií potvrdilo důležitou roli bakteriální střevní flóry na NSA indukované poškození střeva. Bylo prokázáno, že metronidazol chrání sliznici tenkého střeva před poškozením indukovaným indomethacinem u zdravých dobrovolníků a snižuje vznik krvácení ze střevní sliznice u pacientů užívajících dlouhodobě NSA z revmatologické indikace. Výhodou užití rifaximinu v této indikaci je hlavně nepřítomnost systémových účinků a jeho účinnost na anaerobní mikroorganismy. To by mohlo být velmi důležité u starších pacientů, kteří často užívají NSA pro osteoartrózu. Cyklické preventivní podávání rifaximinu by mohlo být efektivní, zejména s ohledem na častou přítomnost divertikulární nemoci u těchto pacientů [1].
Infekce Helicobacter pylori
Všechny deriváty rifamycinu vykazují antibakteriální aktivitu proti H. pylori. Jejich výhodou je nízká prevalence rezistentních kmenů H. pylori. První slepá randomizovaná studie prokázala účinnost rifaximinu v monoterapii nebo v kombinované terapii u pacientů s H. pylori pozitivní antrální gastritidou. Zvláště účinná se ukázala kombinovaná léčba rifaximinem a clarithromycinem. Potenciální využití rifaximinu může být u nemocných s infekcí Helicobacter pylori rezistentních na běžnou terapii [18].
Dekontaminace střeva u akutní pankreatitidy
Infekční komplikace provázející akutní pankreatitidu jsou časté a potenciálně smrtící.
Bakteriální infekce je způsobena mikroorganismy translokovanými ze střeva do pankreatické nekrózy. Všichni pacienti s těžkou pankreatitidou jsou ve vysokém riziku rozvoje pankreatické infekce. Recentní metaanalytické studie prokázaly, že antibiotická profylaxe snížila riziko rozvoje sepse. Nebyla však prokázána výhoda antibiotické profylaxe s ohledem na rozvíjející se infikovanou pankreatickou nekrózu. Velmi podstatná se jeví i cesta podání antibiotika. Výsledky pokusů na zvířecích modelech dokázaly, že nejvýhodnější, s ohledem na zmenšení bakteriální translokace a časné mortality, je perorální či rektální podání antibiotika. Podobné pokusy také prokázaly snížení poškození pankreatu v experimentu při terapii rifaximinem [1].
Funkční střevní poruchy
Existují studie, které prokázaly příznivý vliv rifaximinu na syndrom bakteriálního přerůstání, především na ústup některých symptomů, zejména nadýmání. V současné době reprezentuje rifaximin optimální antibiotickou volbu v této indikaci, a to zejména vzhledem k šíři jeho antimikrobiálního spektra a topickým účinkům. V současnosti probíhají v USA randomizované dvojitě slepé studie hodnotící účinek rifaximinu při léčbě syndromu bakteriálního přerůstání u syndromu dráždivého tračníku.
Divertikulární choroba tlustého střeva
Nekomplikovaná forma divertikulární nemoci tlustého střeva je velmi častým onemocněním. Klinicky je charakterizována bolestmi v levém podbřišku a poruchou defekačního rytmu. Základem léčby je vysokozbytková dieta, přesto u některých pacientů dochází ke vzniku komplikací, jako je divertikulitida nebo krvácení. Tři multicentrické placebem kontrolované studie u nemocných s nekomplikovanou formou divertikulární choroby potvrdily, že cyklické podávání rifaximinu 7 dnů v měsíci po dobu jednoho roku společně s vysokozbytkovou stravou je účinnější na zlepšení symptomového skóre než dieta samotná. Ve dvou studiích se ukázalo, že dlouhodobé cyklické podávání rifaximinu významně snižuje frekvence komplikací divertikulární nemoci [19–22].
Indikace
Přehled současných indikací k podání rifaximinu ukazuje tab. 3, přehled perspektivních indikací tab. 4.
Kontraindikace
Rifaximin by neměl být podáván u pacientů s přecitlivělostí na účinnou látku, se střevními obstrukcemi a závažnými střevními ulceracemi.
Lékové interakce
Většina studií prokázala, že rifaximin v koncentracích od 2 do 200 ng/ml neinhibuje žádné izoenzymy (1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 a 3A4) cytochromu P-450. Nebyla prokázána interakce s perorálními kontraceptivy obsahujícími ethinyl estradiol a norgestimat. Stejně tak nebyla pozorována interakce s midazolamem a rifaximin též neovlivňuje farmakokinetiku profylakticky podávaných léčiv, např. antimalarik [1].
Nežádoucí účinky
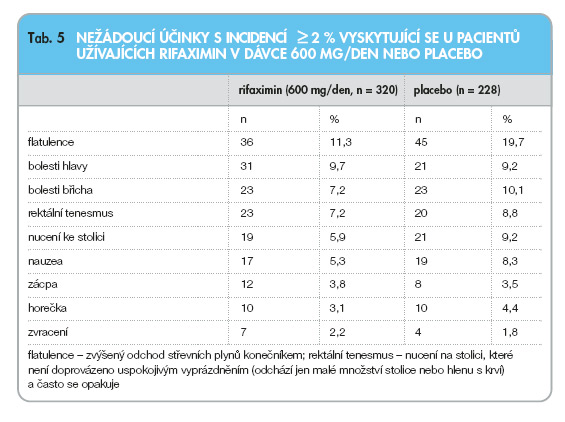
Výskyt nežádoucích účinků během léčby rifaximinem je velmi nízký. Nejčastěji se jedná o gastrointestinální příznaky, jako jsou flatulence, nauzea, bolesti břicha a zvracení.
Bezpečnost rifaximinu byla ověřena u 320 pacientů ve dvou placebem kontrolovaných klinických studiích. Všechny zjištěné nežádoucí příhody se vyskytovaly s nízkou frekvencí (tab. 5).
Dlouhodobá terapie může být spojena s výskytem kopřivky. Bylo zjištěno zvýšení sérových hladin natria a kalia, které však nepřekročilo fyziologické hranice. Od uvedení léku na trh bylo ošetřeno více než 8,5 milionu pacientů. Bylo hlášeno 26 nežádoucích účinků u 17 pacientů. U 4 z nich byly hodnoceny jako závažné. V jednom případě šlo o rozvoj angioneurotického edému, v dalším případě se objevil kožní exantém a ve dvou případech byl zaznamenán výskyt urtikarie. Rifaximin se jeví jako velmi bezpečný lék, který je dobře snášen [1].
Při zkoumání efektu rifaximinu na žaludeční sekreci nebylo prokázáno ovlivnění množství, pH žaludečního obsahu ani aktivity pepsinu. Ukazuje se, že rifaximin by mohl příznivě ovlivnit střevní motilitu u syndromu bakteriálního přerůstání, a to zejména u diabetiků a pacientů s Crohnovou chorobou.
Účinek rifaximinu na kardiovaskulární a respirační systém byl ověřen na zvířecích modelech a nebylo prokázáno žádné ovlivnění těchto systémů rifaximinem.
Dávkování
Trvání léčby rifaximinem by obvykle nemělo přesáhnout 7 dní. U akutních průjmů by měla být podávána dávka 800 mg rifaximinu denně rozdělená na 200 mg každých 6 hodin. U jaterní encefalopatie by měla být dávka vyšší – 400 mg každých 8 hodin. U dětí od 6 do 12 let je možno dávkování snížit až na polovinu dávek pro dospělé.
Balení
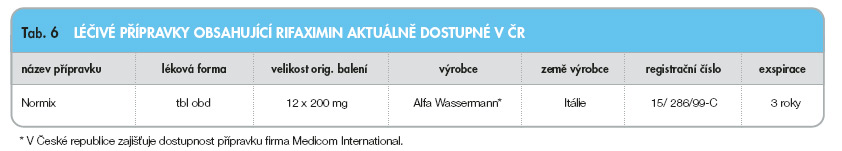
Viz tab. 6.
Seznam použité literatury
- [1] Scarpignato C, Pelosini I. Rifaximin, a poorly absorbed antibiotic: Pharmacology and clinical potential. Chemotherapy 2005; 51 (suppl 1): 36–66.
- [2] Juany ZD, DuPont HL. Rifaximin: In vitro and in vivo antibacterial activity. A review. Chemotherapy 2005; 51 (suppl 1): 67–72.
- [3] DuPont HL, Juany ZD. Influence of rifaximin treatment on succeptibility of intestinal Gram-negative flora and Enterococci. Clin Microbiol Infect 2004; 10: 1009–1011.
- [4] Umezawa H, Mizuno S, Yamazali H, et al. Inhibition of DNA-dependent RNA synthesis by rifamycins. J Antibiot (Tokyo) 1968; 21: 234–236.
- [5] Miglioli PA, Allerberger F, Calabro GB, et al. Effects of daily oral administration of rifaximin and neomycin on faecal aerobic flora in rats. Pharmacol Res 2001; 44: 373–375.
- [6] Lal R, Lal S. Recent trends in rifamycin research. Bioessay 1994; 16: 211–216.
- [7] Barchese A, Salerno A, Pesce A, et al. In vitro activity of rifaximin, metronidazole and vancomycin against Clostridium difficile and the rate of selection of spontaneously resistent mutants against representative anaerobic and aerobic bacteria, including amonia-producing species. Chemotherapy 2000; 46: 253–266.
- [8] Pakyz AL. Rifaximin: A new treatment for traveler´s diarrhea. Ann Pharmacother 2005; 39: 284–289.
- [9] Shlim DR. Update in traveler´s diarrhea. Infect Dis Clin N Am 2005; 19: 137–149.
- [10] Lacour M, Zunder T, Huber R, et al. The pathogenetic significance of intestinal Candida colonization. A systematic review from interdisciplinary and environmental medical point of view. Int J Hyg Environ Health 2002; 205: 257–268.
- [11] Gionchetti P, Rizzello F, Morselli C, et al. Management of inflammatory bowel disease: Does rifaximin offer any promise? Chemotherapy 2005; 51 (suppl 1): 96–102.
- [12] Lukáš M, Konečný M, Zbořil V. Rifaximin in patients with mild to moderate activity of ulcerative colitis: An open label study. Gastroenterology 2002; 122 (suppl 1): A 434.
- [13] Pinto A, Borrutto G, Deall´Anna A, et al. An open, uncontrolled trial of oral rifaximin, a non-absorbable antibiotic, in inflammatory bowel disease refractory to conventional therapy. Eur J Clin Res 1997; 9: 217–224.
- [14] Gionchetti P, Rizzello F, Ventura A, et al. Antibiotic combination therapy in patients with chronic, treatment – resistant pouchitis. Aliment Pharmacol Ther 1999; 13: 713–718.
- [15] Gionchetti P, Rizzello, Ferrieri A, et al. Rifaximin in patients with moderate or severe ulcerative colitis refractory to steroid-treatment. A double-blind, placebo controlled trial. Dig Dis Sci 1999; 44: 1220–1221.
- [16] Testa R, Eftimiadi C, Sukkar GS, et al. A non-absorbable rifamycin for treatment of hepatic encephalopathy. Drugs Exp Clin Res 1985; 11: 387–392.
- [17] Esposito S. Is single-dose antibiotic prophylaxis sufficient for any surgical procedure? J Chemother 1999; 11: 556–564.
- [18] Mégraud F, Bouffant F, Camou Juncas C. In vitro activity of rifaximin against Helicobacter pylori. Eur J Clin Microbiol Dis 1994; 13: 184–186.
- [19] Latella G, Pimpo MT, Soptili S, et al. Rifaximin improves symptomas of acquired uncomplicated diverticular disease of the colon. Int J Colorectal Dis 2003; 18: 55–62.
- [20] Papi C, Ciacon A, Koch M, et al. Efficacy of rifaximin on symptoms of uncomplicated diverticular disease of the colon. Ital J Gastroenterol 1992; 24: 452–456.
- [21] Papi C, Ciacon A, Koch M, et al. Efficacy of rifaximin in the treatment of symptomatic diverticular disease of the colon. A multicentre double blind placebo-controlled trial. Aliment Pharmacol Ther 1995; 9: 33–39.
- [22] Papi C, Koch M, Capurso L. Management of diverticular disease: Is there room for rifaximin? Chemotherapy 2005; 51 (suppl 1): 110–114.