Risdiplam
Souhrn:
Lapka M. Risdiplam. Remedia 2021; 31: 554–560.
Spinální svalová atrofie (SMA) je vzácná a klinicky různorodá skupina chorob, které jsou typické degenerací alfa motoneuronů předních rohů míšních. Pokrok ve výzkumu terapie onemocnění přinesl naději ve formě kauzální léčby. Tu představuje risdiplam, což je modifikátor sestřihu pre‑mRNA vzniklé přepisem genu SMN2 (survival of motor neuron 2). Risdiplam je indikován k léčbě SMA vázané na dlouhé raménko 5. chromozomu u pacientů ve věku od dvou měsíců s klinickou diagnózou SMA 1., 2. nebo 3. typu nebo s jednou až čtyřmi kopiemi genu SMN2. Článek předkládá farmakokinetický, farmakodynamický a bezpečnostní profil léčivé látky.
Summary:
Lapka M. Risdiplam. Remedia 2021; 31: 554–560.
Spinal muscle atrophy (SMA) is a rare and clinically variable group of diseases, manifesting with degeneration of alpha motor neurons in the anterior horn of the spinal cord. An advance in disease therapy research brought hope in the form of causal treatment represented by risdiplam, a splicing modifier for a pre‑mRNA expressed from the SMN2 (survival of motor neuron 2) gene. Risdiplam is indicated for the treatment of SMA bound to the long arm of the fifth chromosome in patients aged from 2 months with the clinical diagnosis of type 1, 2, or 3 SMA, or for those with one to four copies of the SMN2 gene. The article summarizes the pharmacokinetic, pharmacodynamic, and safety drug profile.
Key words: spinal muscle atrophy – risdiplam – therapy – survival of motor neuron.
Úvod
Spinální svalová atrofie (SMA) je hlavní genetickou příčinou úmrtí u kojenců a 5q SMA je nejběžnější formou onemocnění. SMA je závažné neurologické onemocnění s následky, které mohou vést k respirační nedostatečnosti. SMA je navíc druhým nejčastějším neuromuskulárním onemocněním v dětském věku. Jedná se o nejčastější příčinu úmrtnosti kojenců v důsledku vrozené choroby a symptomatická léčba SMA s cílem předejít kloubním komplikacím, deformitám páteře a infekcím zůstává nadále omezená. Recentně byl registrován přípravek obsahující risdiplam pro léčbu 5q SMA u pacientů ve věku od dvou měsíců s diagnózou SMA typu 1, typu 2 nebo typu 3 nebo s jednou až čtyřmi kopiemi genu SMN2. Registrace byla podložena výsledky dvou klíčových klinických studií, v nichž risdiplam prokázal účinnost u dospělých, dětí a kojenců ve věku dva měsíce a starších. Článek přináší shrnutí informací o této látce.
Spinální svalová atrofie
Spinální svalová atrofie je klinicky různorodou skupinou chorob, které jsou typické degenerací alfa motoneuronů předních rohů míšních, někdy v kombinaci s degenerací motorických jader hlavových nervů. Jedná se o vzácné onemocnění s každoroční incidencí 10 dětí v České republice [1]. Nejčastější formou SMA je proximální typ s vazbou na mutaci genu SMN1. Forma dominuje svalovou slabostí, která postupně přechází v rozvoj svalových atrofií a skoliózy. Slabost je pak progresivní, vede ke ztrátě schopnosti chůze a u těžkých forem může vést k rozvoji respirační insuficience a k riziku předčasného úmrtí [2].
Stávající terapie
Nedávný pokrok ve výzkumu přinesl kauzální léčbu pro pacienty s tímto dosud neléčitelným onemocněním. Naději vzbuzují klinické studie terapií založených zejména na modulaci splicingu a kauzální genová terapie [3]. Americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) schválil tři terapie pro SMA: nusinersen, onasemnogen a risdiplam. Nusinersen je intratekálně podávaná antisense oligonukleotidová léčba pro dospělé a děti cílená na SMN2 [4] a onasemnogen je intravenózně podávaná léčba s adenoasociovaným virovým vektorovým přenosem genů pro použití u pacientů mladších dvou let [5]. Každá z obou látek vedla ke zlepšení přežití a motorických funkcí u pacientů se SMA [6]. Risdiplam se však dnes jeví jako první a jediná léčba SMA s prokázanou účinností, kterou lze užívat v domácím prostředí.
Mechanismus účinku
Risdiplam je modifikátor sestřihu pre mRNA vzniklé přepisem genu SMN2 (survival of motor neuron 2) a je zařazen do skupiny Jiná léčiva pro poruchy muskuloskeletálního systému (ATC kód: M09AX10). Risdiplam je určen k léčbě SMA způsobené mutacemi genu SMN1 na dlouhém raménku chromozomu 5, které vedou k deficitu SMN proteinu. Deficit funkčního proteinu SMN přímo souvisí s patofyziologií SMA. Risdiplam upravuje sestřih pre mRNA genu SMN2 tak, že posunuje rovnováhu od mRNA s vyloučeným exonem 7 ve prospěch mRNA se zařazeným exonem 7. Tím se zvyšuje tvorba funkčního a stabilního proteinu SMN [7].
Risdiplam vedl v klinických studiích ke zvýšení plazmatické koncentrace proteinu SMN s více než dvojnásobným mediánem změny po čtyřech týdnech od zahájení léčby oproti počáteční hodnotě (baseline). Zvýšení bylo zaznamenáno během léčebného období (nejméně 12 měsíců) u SMA typů 1, 2 a 3 [7].
Schválené indikace a dávkování
Risdiplam je indikován k léčbě SMA vázané na dlouhé raménko 5. chromozomu u pacientů ve věku od dvou měsíců s klinickou diagnózou SMA 1., 2. nebo 3. typu nebo s jednou až čtyřmi kopiemi genu SMN2. Léčba risdiplamem má být zahájena lékařem se zkušenostmi s léčbou SMA [7,8].
Přípravek dosud nemá v České republice stanovenu úhradu ze zdravotního pojištění.
Doporučená denní dávka risdiplamu se stanovuje podle věku a tělesné hmotnosti pacienta, přičemž léčba denní dávkou vyšší než 5 mg nebyla studována. Risdiplam se podává perorálně jednou denně po jídle vždy přibližně ve stejnou denní dobu a kojencům po kojení [9].
Zvláštní populace
U starších pacientů se nevyžaduje žádná úprava dávkování. Risdiplam nebyl u populace starší 65 let studován. U pacientů s poruchou funkce ledvin se nepředpokládá žádný požadavek na úpravu dávkování. Ani u pacientů s lehkou až středně těžkou poruchou funkce jater se nevyžaduje žádná úprava. Pacienti s těžkou poruchou funkce jater nebyli studováni a může u nich dojít ke zvýšení expozice léku [7].
Klinická účinnost a bezpečnost
Účinnost risdiplamu v léčbě pacientů se SMA s nástupem v dětství (SMA 1. typu) i u pacientů, u nichž došlo k pozdějšímu nástupu SMA (SMA 2. a 3. typu), byla hodnocena ve dvou pivotních klinických studiích – FIREFISH a SUNFISH. Nemocní s klinickou diagnózou SMA 4. typu nebyli v klinických studiích hodnoceni [9,10].
SMA s nástupem v dětství
Studie BP39056 (FIREFISH) byla koncipována jako otevřená a rozdělená na dvě části s cílem hodnotit účinnost, bezpečnost, farmakokinetiku a farmakodynamiku risdiplamu v léčbě symptomatické SMA 1. typu (s genetickým průkazem onemocnění se dvěma kopiemi genu SMN2). Část 1 studie FIREFISH byla určena ke stanovení dávky. V konfirmační části 2 studie se hodnotila účinnost risdiplamu, přičemž pacienti z části 1 se neúčastnili části 2. Hlavním cílovým parametrem účinnosti byla schopnost sedu bez pomoci po dobu nejméně 5 sekund měřená pomocí položky 22 motorické vývojové škály dle Bayleyové (Bayley Scales of Infant and Toddler Development – Third Edition, BSID III) po 12 měsících léčby [9].
Studie FIREFISH, část 2
Do části 2 studie FIREFISH bylo
zařazeno 41 pacientů se SMA 1. typu. Medián věku při
nástupu klinických projevů a příznaků SMA 1. typu byl
1,5 měsíce a medián věku při zařazení 5,3 měsíce.
Medián výchozího skóre testu Children’s Hospital of
Philadelphia Infant Test for Neuromuscular Disease (CHOP INTEND)
byl 22,0 bodu (rozmezí 8,0–37,0) a medián výchozího skóre
testu Hammersmith Infant Neurological Examination Module 2 (HINE 2)
činil 1,0 (rozmezí 0,0–5,0) [9].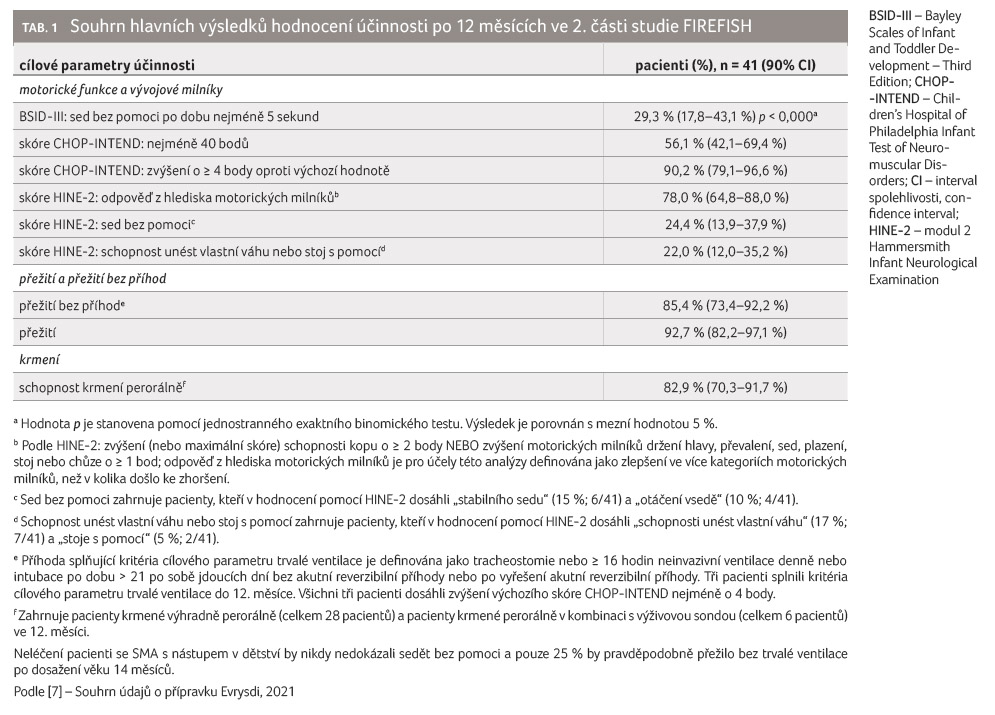
Primárním cílovým parametrem byl podíl pacientů schopných sedu bez pomoci po dobu nejméně 5 sekund po 12 měsících léčby (položka 22 motorické škály BSID III). Hlavní cílové parametry účinnosti uvádí tabulka 1.
Studie FIREFISH, část 1
Účinnost risdiplamu v léčbě SMA 1. typu dokládají výsledky 1. části studie FIREFISH. Výchozí charakteristiky 21 pacientů odpovídaly symptomatickým pacientům se SMA 1. typu. Medián věku při zařazení do studie byl 6,7 měsíce a medián doby od nástupu příznaků do první dávky byl 4,0 měsíce [9]. Terapeutickou dávku užívalo celkem 17 pacientů. Po 12 měsících léčby dokázalo sedět bez pomoci po dobu nejméně 5 sekund (položka 22 BSID III) 41 % pacientů. Po 24 měsících léčby dokázali sedět bez pomoci po dobu nejméně 5 sekund další tři pacienti; tedy celkově dosáhlo schopnosti sedu bez pomoci po dobu nejméně 5 sekund 10 pacientů (59 %) [9]. Po 12 měsících léčby přežilo bez příhody (trvalé ventilace) a dosáhlo věku nejméně 15 měsíců 90 % (19/21) pacientů. Po nejméně 24 měsících léčby přežilo bez příhody a dosáhlo věku nejméně 28 měsíců 81 % pacientů. Během léčby zemřeli tři pacienti a jeden pacient zemřel 3,5 měsíce po předčasném ukončení léčby [7].
SMA s pozdějším nástupem
Studie BP39055 (SUNFISH) byla multicentrická a tvořená dvěma částmi zaměřenými na hodnocení účinnosti, bezpečnosti, farmakokinetiky a farmakodynamiky risdiplamu v léčbě pacientů se SMA 2. nebo 3. typu ve věku od 2 do 25 let. Část 1 byla určena ke stanovení dávky a část 2 byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná konfirmační [10]. Primárním cílovým parametrem byla změna skóre motorické škály Motor Function Measure 32 (MFM32) po 12 měsících oproti výchozí hodnotě. Skóre dokáže zhodnotit širokou škálu motorických funkcí u nejrůznějších pacientů se SMA a celkové skóre se vyjadřuje jako procenta (rozmezí: 0–100) maximálního možného skóre; vyšší skóre přitom vyjadřuje lepší motorické funkce [7].
Studie SUNFISH, část 2
Studie SUNFISH zahrnula 180 nechodících
pacientů se SMA 2. typu (71 %) nebo 3. typu (29 %).
Pacienti byli randomizováni v poměru 2 : 1 do ramen
s risdiplamem a placebem. Randomizace byla stratifikována
podle věkové skupiny (2–5, 6–11, 12–17, 18–25 let) [10].
Medián věku pacientů při zahájení léčby byl 9,0 roku a medián
doby od nástupu počátečních příznaků SMA do první
dávky byl 102,6 měsíce. Při zařazení do studie bylo celkem
30 % pacientů ve věku od 2 do 5 let, 32 %
bylo ve věku od 6 do 11 let, 26 % od 12 do 17
let a 12 % pacientů bylo ve věku od 18 do 25
let. Výchozí skoliózu mělo 67 % pacientů (32 % trpělo
těžkou skoliózou). Pacienti měli průměrné výchozí skóre
MFM32 = 46,1 a skóre Revised Upper Limb Module
(RULM) = 20,1. Demografické charakteristiky byly mezi
rameny vyváženy s výjimkou skoliózy (63 % pacientů
s risdiplamem a 73 % pacientů s placebem) [7].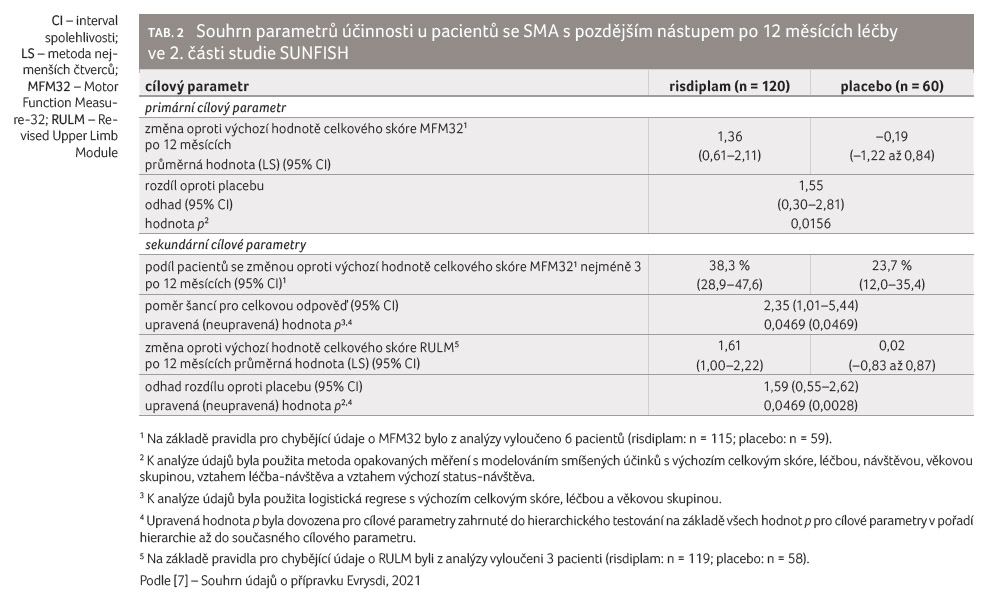
Primární analýza výsledků studie pro změnu celkového skóre MFM32 po 12 měsících oproti baseline prokázala klinicky a statisticky významný rozdíl mezi pacienty v rameni s risdiplamem proti placebu. Výsledky primární analýzy a hlavní cílové parametry uvádí tabulka 2.
Po dokončení 12měsíční léčby pokračovalo 117 pacientů v léčbě risdiplamem. Analýza po 24 měsících ukázala, že u pacientů léčených risdiplamem bylo celkové zlepšení motorických funkcí zachováno v období mezi 12. a 24. měsícem. Průměrná změna skóre MFM32 oproti baseline byla 1,83 (95% interval spolehlivosti [CI] 0,74–2,92) a skóre RULM 2,79 (95% CI 1,94–3,64) [7].
Studie SUNFISH, část 1
Účinnost u pacientů se SMA s pozdějším nástupem byla doložena i výsledky části 1 studie SUNFISH. Do části 1 bylo zařazeno 51 pacientů se SMA 2. a 3. typu (včetně 7 chodících pacientů) ve věku od 2 do 25 let. Po jednom roce léčby došlo ke klinicky významnému zlepšení motorických funkcí měřených pomocí škály MFM32 s průměrnou změnou o 2,7 bodu (95% CI 1,5–3,8). Zlepšení skóre MFM32 trvalo po dva roky léčby (průměrná změna o 2,7 bodu [95% CI 1,2– 4,2]) [10].
Farmakokinetické vlastnosti
Farmakokinetické parametry byly charakterizovány u zdravých subjektů a nemocných pacientů. Farmakokinetika (PK) risdiplamu po podání ve formě perorálního roztoku byla přibližně lineární v dávkovém rozmezí 0,6–18 mg. PK risdiplamu nejlépe popisuje PK model s absorpcí ve třech tranzitních kompartmentech a eliminací 1. řádu. PK je významně ovlivněna hmotností a věkem [11]. Odhadovaná expozice (průměrná plocha pod křivkou plazmatické koncentrace [AUC0 24h]) pro pacienty se SMA s nástupem v dětství při dávce 0,2 mg/kg 1× denně byla 1 930 ng.h/ml. Odhadovaná expozice pro pacienty se SMA s pozdějším nástupem ve studii SUNFISH při dávce 0,25 mg/kg 1× denně pro pacienty s hmotností < 20 kg a 5 mg 1× denně pro pacienty s tělesnou hmotností ≥ 20 kg byla 2 070 ng.h/ml. Pozorovaná maximální koncentrace (průměrná cmax) byla 194 ng/ml při dávce 0,2 mg/kg ve studii FIREFISH a 120 ng/ml v části 2 studie SUNFISH [10].
Absorpce
Risdiplam se nalačno rychle vstřebá, čas potřebný k dosažení cmax (tmax) se pohybuje v rozmezí 1–4 hodiny po perorálním podání. Podle omezených údajů (n = 3) nemělo jídlo (vysokokalorická snídaně s vysokým obsahem tuku) na expozici risdiplamu žádný významný účinek [7].
Distribuce
Risdiplam je rovnoměrně distribuován do celého organismu včetně centrálního nervového systému. Koncentrace risdiplamu v plazmě a proteinu SMN v krvi jsou odrazem distribuce a účinků ve tkáních. Odhadované PK parametry byly 98 l pro zdánlivý objem distribuce v centrálním kompartmentu, 93 l pro periferní objem a 0,68 l/h pro interkompartmentální clearance. Risdiplam se váže převážně na sérový albumin bez vazby na alfa 1 kyselý glykoprotein s volnou frakcí 11 % [7].
Biotransformace
Risdiplam je metabolizován primárně prostřednictvím flavinových monooxygenáz FMO1, FMO3 a cytochromu P450 CYP 1A1, 2J2, 3A4 a 3A7. Souběžné podání inhibitoru CYP3A itrakonazolu 200 mg 2× denně s jednorázovou perorální dávkou risdiplamu 6 mg nemělo klinicky významný účinek na PK risdiplamu (11% zvýšení AUC, 9% snížení cmax) [7].
Eliminace
Zdánlivá clearance (Cl/F) risdiplamu odhadnutá pomocí populačních PK analýz byla 2,6 l/h. Efektivní poločas risdiplamu byl přibližně 50 hodin. Přibližně 53 % dávky (14 % nezměněné látky) bylo vyloučeno stolicí a 28 % močí. Hlavní složkou v plazmě byl nemetabolizovaný lék, který odpovídal 83 % cirkulujícího, neaktivního metabolitu [7].
Pediatrická populace
Kovariatami v populační PK analýze byly tělesná hmotnost a věk, proto se dávka upravuje podle věku (do 2 let a nad 2 roky) a tělesné hmotnosti (až do 20 kg). U dětí ve věku do dvou měsíců nejsou dostupné žádné údaje [12].
Starší populace
Nebyly provedeny žádné studie přímo určené k hodnocení PK u pacientů starších 60 let. Subjekty bez SMA až do věku 69 let byly zařazeny do klinických PK studií, podle kterých není u pacientů do 69 let třeba žádná úprava dávkování [7].
Bezpečnostní údaje
U pacientů se SMA s nástupem
v dětství byly nejčastějšími nežádoucími účinky (NÚ)
zjištěnými v klinických studiích s risdiplamem pyrexie
(48,4 %), vyrážka (27,4 %) a průjem (16,1 %).
U pacientů se SMA s pozdějším nástupem byly
nejčastějšími NÚ zjištěnými v klinických studiích
pyrexie (21,7 %), bolest hlavy (20,0 %), průjem (16,7 %)
a vyrážka (16,7 %). Uvedené NÚ se vyskytovaly bez zjevného
klinického či časového vzorce a u pacientů se SMA přes
pokračující léčbu obecně odezněly [9–12].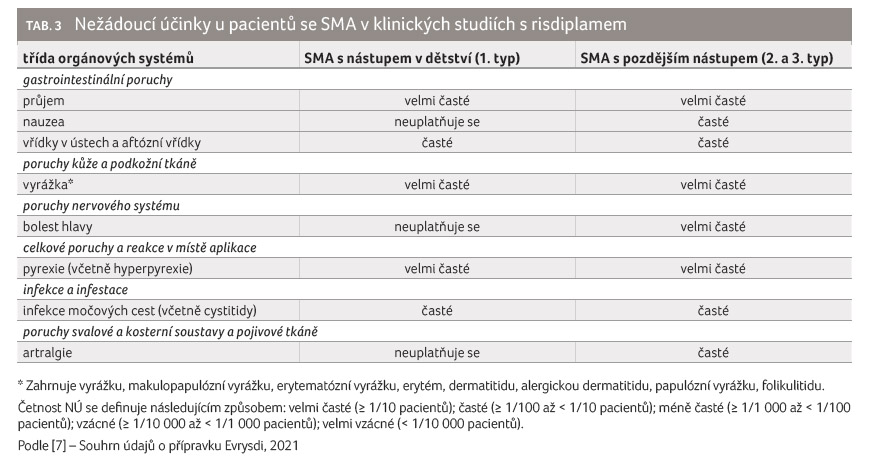
Nežádoucí účinky hlášené v klinických studiích (tab. 3) jsou uvedeny podle třídy orgánových systémů MedDRA.
Možná embryofetální toxicita
V animálních studiích byla po podání risdiplamu zjištěna embryofetální toxicita s nižší hmotností plodu a opožděným vývojem. Úroveň bez pozorovaných nepříznivých účinků vyjadřovaná hodnotou NOAEL (no observed adverse effect level) byla přibližně dvojnásobná ve srovnání s terapeutickou dávkou. Ve studiích in vivo byly zjištěny dysmorfogenní účinky po dávkách přibližně čtyřnásobných ve srovnání s terapeutickými dávkami [7]. Risdiplam prochází placentou a vylučuje se do mléka a pacienti ve fertilním věku musejí používat antikoncepci během léčby a nejméně jeden měsíc po poslední dávce u žen a čtyři měsíce po poslední dávce u mužů [13].
Možné účinky na mužskou fertilitu
Na základě údajů z animálních studií nemají muži během léčby a čtyři měsíce po poslední dávce risdiplamu darovat sperma. V reprodukčních orgánech potkanů a opic byla zjištěna degenerace a snížený počet spermií, což způsobila degenerace spermatocytů, nekróza epitelu semenotvorných kanálků a oligospermie/aspermie v nadvarleti. U samic nebyly zjištěny žádné účinky na reprodukční orgány [7].
Retinální toxicita
Chronické podávání risdiplamu opicím vyvolalo degeneraci fotoreceptorů s počátkem na okrajích sítnice. Účinky byly po vysazení částečně reverzibilní, nicméně degenerace fotoreceptorů reverzibilní nebyla. Účinky byly zjištěny při expozici překračující dvojnásobek terapeutické dávky u člověka. Účinky risdiplamu v neklinických studiích však nebyly v klinických studiích pozorovány [7,14].
Registrace
Společnost Roche oznámila, že Evropská komise (EK) schválila přípravek Evrysdi (risdiplam) pro léčbu SMA u pacientů starších dvou měsíců s klinickou diagnózou onemocnění typu 1–3 nebo s jednou až čtyřmi kopiemi SMN2. Schválení je založeno na údajích obou výše zmíněných klinických studií, kde risdiplam prokázal příznivý profil účinnosti a bezpečnosti [9,10].
Přípravek je od dubna 2021 k dispozici pacientům v Německu a ve Francii prostřednictvím dočasného povolení k použití. V České republice je přípravek dostupný pro pacienty se SMA typu 1 a 2 formou specifického léčebného programu od října 2020. Rozhodnutí EK následovalo po kladném doporučení Výboru pro humánní léčivé přípravky z února 2021. Přezkum byl dokončen v rámci zrychleného postupu hodnocení, který je umožněn u léčivých přípravků považovaných za zajímavé pro veřejné zdraví a terapeutické inovace [15].
Schválení platí pro všech 27 členských států Evropské unie a také pro Island, Norsko a Lichtenštejnsko. Přípravek Evrysdi získal označení PRIME od Evropské lékové agentury (European Medicines Agency, EMA) v roce 2018 a označení léčiva pro vzácná onemocnění (orphan) v roce 2019. Zachování označení léčiva pro vzác
ná onemocnění bylo nedávno potvrzeno Výborem pro léčivé přípravky pro vzácná onemocnění na základě předpokladu významného přínosu Evrysdi oproti stávající léčbě. Evrysdi již byl schválen v celkem 38 zemích světa a předložen k registraci v dalších 33 zemích. Od registrace EMA je přípravek v České republice dostupný dle schválených indikací na individuální žádost dle paragrafu 16 [15].
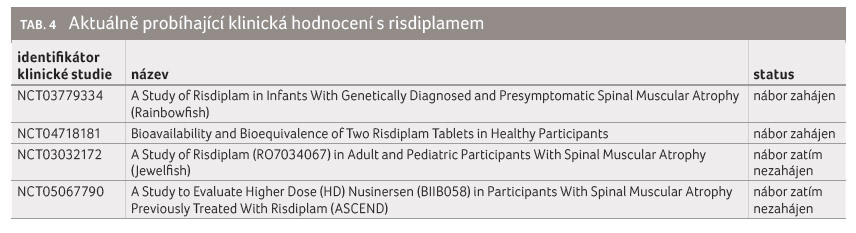
Probíhající studie
Seznam aktuálně probíhajících studií ze října 2021 je uveden v tabulce 4.
Závěr
Spinální svalová atrofie představuje kvůli svým následkům závažné neurologické onemocnění, které může vést i k respirační nedostatečnosti. Risdiplam přinesl výborné výsledky v této indikaci u dospělých, dětí a kojenců ve věku od dvou měsíců a léčba je spojena s dobrou tolerancí a příznivým bezpečnostním profilem.
Komentář: Risdiplam
MUDr. Zdenka Bálintová
Klinika dětské neurologie FN Brno
Spinální svalová atrofie (SMA) byla ještě v nedávné době onemocněním, které vedlo k rychlému zhoršování motorických funkcí a ke zkrácení délky a kvality života. Při přirozeném průběhu onemocnění nedochází při symptomatické terapii nikdy ke zlepšení motorických funkcí ani k dosažení nových motorických milníků. Od roku 2017 máme k dispozici účinné léky, které zcela proměnily fenotyp onemocnění a prognózu pacientů. Tyto léky jsou schopny nejen zastavit progresi onemocnění, ale dokonce zlepšit motorické funkce pacientů i v pokročilém stadiu nemoci.
Aktuálně máme k dispozici již tři léky: nusinersen, onasemnogen abeparvovek a risdiplam. Risdiplam svoji účinnost prokázal v několika klinických studiích u dětí i dospělých pacientů. Tento efekt můžeme potvrdit i z naší praxe. Jedná se o lék s velmi příznivým farmakologickým profilem s minimem nežádoucích účinků. Obrovskou výhodou je perorální forma podání v jedné denní dávce. Drobnou nevýhodou by mohla být nutnost skladování léku v chladovém řetězci.
Přestože risdiplam přišel na trh s léčivy jako třetí, velmi rychle si našel mezi ostatními přípravky svoje místo. Umožnil nám léčbu pacientů, kteří doposud léčeni vůbec nebyli, a to kvůli obtížné až nemožné aplikaci nusinersenu z důvodu velmi těžké skoliózy (pacienti po korekčních operacích páteře) nebo onasemnogen abeparvoveku (věk pacientů).
Risdiplamem nyní na našem pracovišti léčíme čtyři pacienty, tři z nich již déle než rok. Naše praktické zkušenosti potvrzují výsledky klinických studií. Risdiplam je velmi dobře tolerován, nezaznamenali jsme žádné závažné nežádoucí účinky. Pacienti referují zlepšení motorických funkcí: zejména držení hlavy a trupu a zlepšení hybnosti horních končetin. Transport a skladování léků rodinám nečiní výraznější obtíže.
To, co se může zdravému člověku jevit jako nepatrný pohyb, má pro pacienta se SMA obrovský význam. I minimální pohyb ruky, který umožní pacientovi samostatně ovládat elektrický vozík nebo počítačovou myš, výrazně ovlivní celkovou kvalitu života daného pacienta. Proto je nutné bojovat o zachování jakéhokoliv pohybu, v čemž našim pacientům pomáhá také risdiplam.
Seznam použité literatury
- [1] Strenková J, Voháňka S, Haberlová J, et al. REaDY – český registr svalových dystrofií. Cesk Slov Neurol N 2014; 77/110: 230–234.
- [2] Kolb SJ, Kissel JT. Spinal Muscular Atrophy A Timely Review. Arch Neurol 2011; 68: 979–984.
- [3] Chiriboga CA, Swoboda KJ, Darras BT, et al. Results from a phase 1 study of nusinersen (ISIS‑SMN(Rx)) in children with spinal muscular atrophy. Neurology 2016; 86: 890–897.
- [4] Food and Drug Administration. Spinraza (nusinersen) prescribing information. 2021. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/209531lbl.pdf
- [5] Food and Drug Adminishttps://www.fda.gov/media/126109/downloadtration. Zolgensma (onasemnogene abeparvovec‑xioi) prescribing information. 2021. Dostupné na:
- [6] Mercuri E, Darras BT, Chiriboga CA, et al. Nusinersen versus sham control in later‑onset spinal muscular atrophy. N Engl J Med 2018; 378: 625–635.
- [7] Souhrn údajů o přípravku Evrysdi [online]. Copyright© [cit. 23.10.2021]. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/evrysdi‑epar‑product‑information_cs.pdf
- [8] Ramdas S, Servais L. New treatments in spinal muscular atrophy: an overview of currently available data. Expert Opin Pharmacother 2020; 21: 307–315.
- [9] Baranello G, Darras BT, Day JW, et al. FIREFISH Working Group. Risdiplam in Type 1 Spinal Muscular Atrophy. N Engl J Med 2021; 384: 915–923.
- [10] Mercuri E, Barisic N, Boespflug‑Tanguy O, et al. SUNFISH Part 2: Efficacy and Safety of Risdiplam (RG7916) in Patients with Type 2 or Non‑Ambulant Type 3 Spinal Muscular Atrophy (SMA). Neurology 2020; 94: 1260.
- [11] Sturm S, Günther A, Jaber B, et al. A phase 1 healthy male volunteer single escalating dose study of the pharmacokinetics and pharmacodynamics of risdiplam (RG7916, RO7034067), a SMN2 splicing modifier. Br J Clin Pharmacol 2019; 85: 181–193.
- [12] Darras BT, Masson R, Mazurkiewicz‑Bełdzińska M, et al; FIREFISH Working Group. Risdiplam‑Treated Infants with Type 1 Spinal Muscular Atrophy versus Historical Controls. N Engl J Med 2021; 385: 427–435.
- [13] Ratni H, Ebeling M, Baird J, et al. Discovery of Risdiplam, a Selective Survival of Motor Neuron‑2 (SMN2) Gene Splicing Modifier for the Treatment of Spinal Muscular Atrophy (SMA). J Med Chem 2018; 61: 6501–6517.
- [14] Sergott RC, Amorelli GM, Baranello G, et al; FIREFISH, SUNFISH, JEWELFISH Working Groups. Risdiplam treatment has not led to retinal toxicity in patients with spinal muscular atrophy. Ann Clin Transl Neurol 2021; 8: 54–65.
- [15] First oral treatment for spinal muscular atrophy (SMA) recommended for approval | European Medicines Agency. [online]. Copyright© 1995 [cit. 25.10.2021]. Dostupné na: https://www.ema.europa.eu/en/news/first‑oral‑treatment‑spinal‑muscular‑atrophy‑sma‑recommended‑approval