Farmakologická skupina
Rotigotin je neergolinový agonista dopaminu D
3
/D
2
/D
1
pro léčbu Parkinsonovy nemoci. Předpokládá se, že antiparkinsonský účinek je vyvolán aktivací receptorů D
3
, D
2
a D
1
ve striatu. Rotigotin zmírňuje motorické projevy idiopatické Parkinsonovy nemoci. Je řazen do skupiny antiparkinsonik, ATC kód: N04BC09 [2].
Chemické a fyzikální vlastnosti
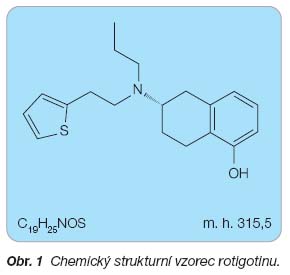
Rotigotin je chemicky (-)-(S)-6-[propyl(2-thiofen-2-ylethyl)amino]-5,6,7,8-tetrahydronaftalen-1-ol (
obr. 1
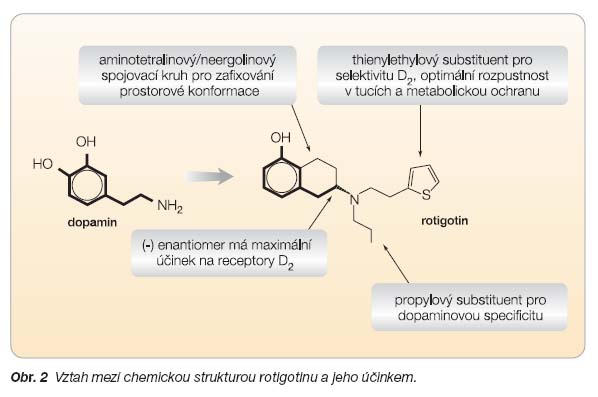
) [3]. Rotigotin je (-) enantiomer aminotetralinu se strukturou porovnatelnou s apomorfinem a dopaminem (
obr. 2
).
Sumární vzorec: C
19
H
25
NOS
Molekulová hmotnost: 315,5

Mechanismus účinku, farmakodynamika
Rotigotin působí agonisticky na všechny podtypy dopaminových receptorů, přičemž upřednostňuje receptory D
3
před receptory D
2
(20násobně nižší afinita) a D
1
(100násobně nižší afinita) [5]. Rotigotin jako agonista D
3
/D
2
/D
1
dokáže tyto receptory aktivovat současně. Pro řízení pohybové aktivity má význam interakce se všemi třemi podtypy receptorů [6]. Proto může být současné agonistické působení rotigotinu na všechny tři podtypy dopaminových receptorů základem více fyziologické odpovědi. Kromě toho má rotigotin afinitu také k jiným receptorům, např. 5-HT
1A
(jako agonista) a
a
2B
(jako antagonista) [5]. Působení na tyto receptory může mít různé pozitivní účinky, např. antidepresivní působení [7, 8]. Zároveň se uvažuje, že stimulace receptorů 5-HT
1A
by mohla podpořit prevenci motorických komplikací indukovaných levodopou u pacientů s Parkinsonovou nemocí [9]. Na rozdíl od ergolinových derivátů rotigotin nejeví afinitu k receptorům 5-HT
2B
[5]. Předpokládá se, že právě aktivita receptorů 5-HT
2B
je zodpovědná za fibrotické vedlejší účinky pozorované u ergolinových dopaminových agonistů [10, 11].
Farmakokinetické vlastnosti
Po aplikaci je rotigotin průběžně uvolňován z transdermální náplasti a vstřebáván pokožkou. Za jeden až dva dny od první aplikace náplasti je dosaženo rovno
vážné koncentrace rotigotinu, která se udr
žuje na stálé úrovni nalepením nové náplasti jednou denně na dobu 24 hodin.
Plazmatické koncentrace rotigotinu se zvy
šují v rozsahu od 1 mg/24 h do 24 mg/24
h proporcionálně k dávce [2].
Přibližně 45 % léčivé látky obsažené v náplasti se uvolní do kůže během 24 hodin. Absolutní biologická dostupnost po transdermální aplikaci je přibližně 37 %.
Obměna místa aplikace náplasti může způ
sobit rozdíly v plazmatických hladinách ze dne na den. Rozdíly v biologické dostupnosti rotigotinu se pohybovaly v rozmezí od 2 % (paže vs. bok) až do 46 % (záda vs. stehno) [2]. Neexistuje ale žádný náznak významného ovlivnění klinického výsledku. Vazba rotigotinu
in vitro
na plazmatické bílkoviny je přibližně 92 %. Zdánlivý distribuční objem u lidí je přibližně 84 l/kg. Rotigotin je z velké části metabolizován, a to N-dealkylací stejně jako přímou a sekundární konjugací. Podle výsledků studií
in vitro
jsou různé izoformy CYP schopny katalyzovat N-dealkylaci rotigotinu. Hlavními metabolity jsou sulfáty a glukuronidové konjugáty mateřské sloučeniny, dále pak biologicky inaktivní N-desalkyl metabolity. Informace o metabolitech není úplná. Přibližně 71 % dávky rotigotinu je vyloučeno močí, menší podíl stolicí (asi 23 %). Clearance rotigotinu po transdermálním podání je přibližně 10 l/min a jeho poločas eliminace 5 až 7 hodin. Náplast je aplikována transdermálně, proto nelze očekávat vliv potravy nebo stavu gastrointestinálního systému [2].
Zvláštní skupiny pacientů
Léčba rotigotinem se zahajuje nízkou dávkou, která se postupně titruje až k optimálnímu léčebnému účinku podle klinické snášenlivosti pacienta. Není proto nutná úprava dávky podle pohlaví, hmotnosti nebo věku. Terapie se zahajuje dávkou 4 mg za 24 h a postupně se navyšuje, týdně
o 2–4 mg/24 h. Doporučená dávka v časných stadiích je 6–8 mg/24 h, v pozdních stadiích do 16 mg/24 hodin.
U pacientů se středně závažnou poruchou funkce jater nebo s mírnou až závažnou poruchou funkce ledvin nebylo pozorováno zvýšení hladiny rotigotinu v plazmě. U pacientů se závažnou poruchou funkce jater nebyl rotigotin předmětem klinického zkoušení.
Plazmatické hladiny konjugátů rotigotinu s jeho N-desalkyl metabolity se zvyšují u pacientů s poruchou funkce ledvin. Tyto metabolity ale pravděpodobně nepřispívají ke klinickému účinku rotigotinu [2].
Klinické zkušenosti
Účinnost rotigotinu v léčbě známek a příznaků idiopatické Parkinsonovy nemoci byla hodnocena v nadnárodním programu vývoje léčiv složeném ze čtyř pivotních, paralelních, randomizovaných dvojitě zaslepených studií kontrolovaných placebem.
Počáteční fáze Parkinsonovynemoci
Dvě studie zabývající se účinností rotigotinu při léčbě známek a příznaků idiopatické Parkinsonovy nemoci byly prováděny u pacientů v počáteční fázi, kteří nebyli současně léčeni jinými agonisty dopaminu a buď předtím nebyli léčeni levodopou nebo jejich dřívější léčba levodopou trvala nejvýše 6 měsíců. Primární hodnocení výsledku obsahovalo skóre pro složku běžné denní činnosti (ADL – Activities
of Daily Living, část II) a složku motorické
ho
vyšetření (část III) Jednotné škály pro hod
no
cení Parkinsonovy nemoci (UPDRS – Unified
Parkinson s Disease Rating Scale
). Účin
nost byla stanovena podle reakce pacien
ta na léčbu z jeho hlediska a podle absolut
ního počtu bodů ve skóre ADL v kombi
naci s motorickým vyšetřením (UPDRS část II + III). V jedné dvojitě zaslepené studii dostávalo 177 pacientů rotigotin a 96 pacientů placebo. U pacientů byla titrována startovací dávka rotigotinu i placeba 2 mg/ 24 h až do optimální hodnoty v týdenních navýšeních o 2 mg/24 h (maximální dávka byla 6 mg/24 h). V každé léčené skupině dostávali pacienti optimální dávku určenou titrací po dobu 6 měsíců [12].
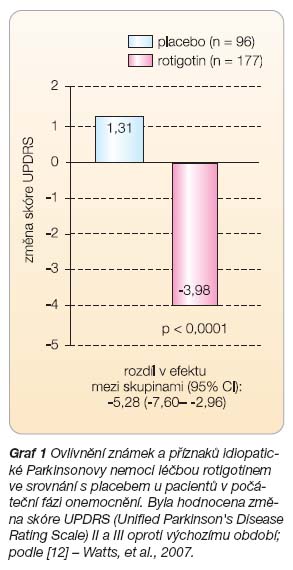
Na konci této udržovací léčby byla optimální dávka u 91 % pacientů v rotigotinové skupině maximální povolenou dávkou, tj. 6 mg/24 h. U 48 % pacientů z těch, kteří byli léčeni rotigotinem, a u 19 % pacientů z těch, kteří dostávali placebo, bylo pozorováno zlepšení o 20 % (rozdíl 29 %; 95% CI: 18–39 %; p < 0,0001). U rotigotinu bylo průměrné zlepšení skóre UPDRS (části II + III) o 3,98 bodu (výchozí stav 29,9 bodu), zatímco ve skupině s placebem došlo ke zhoršení o 1,31 bodu (výchozí stav 30,0 bodů). Rozdíl mezi oběma skupinami byl 5,28 bodu a byl statisticky významný (p < 0,0001), viz
graf 1
.
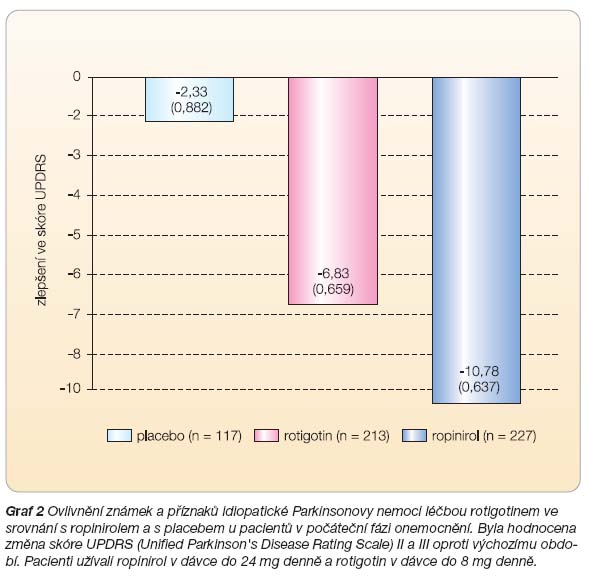
V druhé dvojitě zaslepené studii dostávalo 213 pacientů rotigotin, 227 ropinirol a 117 placebo. U pacientů byla titrována startovací dávka 2 mg/24 h rotigotinu během 4 týdnů až do maximální dávky 8 mg/24 h s týdenním nárůstem dávky o 2 mg/24 h. Ve skupině s ropinirolem byla
u pacientů titrována optimální dávka až do
maxima 24 mg/den po dobu 13 týdnů. U pacientů v každé léčené skupině byla dávka udržována po dobu 6 měsíců.
Na konci udržovací léčby byla u 92 % pacientů v rotigotinové skupině optimální hodnotou maximální povolená dávka, tj.
8 mg/24 h. Zlepšení o 20 % bylo pozo
ro
váno u 52 % z léčených rotigotinem, u 68
% z léčených ropinirolem a u 30 % pacientů s placebem. (Rozdíl rotigotin vs.
placebo byl 21,7 %; 95% CI: 11,1–32,4
%, rozdíl ropinirol vs. placebo 38,4 %; 95% CI: 28,1–48,6 %, rozdíl ropinirol vs. rotigotin 16,6 %; 95% CI: 7,6–25,7 %). Průměrné zlepšení skóre UPDRS (části II a III) bylo 6,83 bodu (výchozí hodnota 33,2 bodu) v rotigotinové skupině, 10,78 bodu v ropinirolové skupině (výchozí hodnota 32,2 bodu) a 2,33 bodu ve skupině s placebem (výchozí hodnota 31,1 bodu), viz
graf 2
. Všechny rozdíly mezi účinnou léčbou a placebem byly statisticky významné. Rozdíl v účinku mezi ropinirolem a rotigotinem byl také statisticky významný ve prospěch ropinirolu [13].
Pokročilá fáze Parkinsonovy nemoci
Dvě další studie byly prováděny u paccientů v pokročilé fázi Parkinsonovy nemoci léčených současně levodopou. Primárním výsledkem hodnocení bylo snížení „off" doby (hodiny). Účinnost byla stanovena podle reakce pacienta na léčbu z jeho hlediska a podle absolutního zlepšení v době strávené „off".
V první dvojitě zaslepené studii bylo léčeno 113 pacientů rotigotinem až do
maximální dávky 8 mg/24 h, 109 pacien
tů
dostávalo rotigotin až do maximální dáv
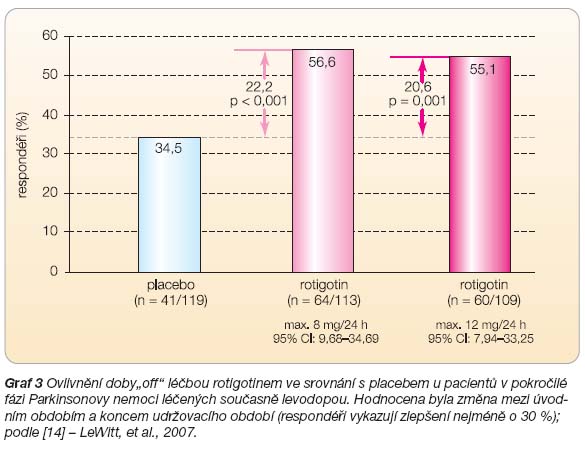
ky 12 mg/24 h a 119 pacientů dostávalo placebo. U pacientů byla titrována optimální dávka rotigotinu nebo placeba s týdenním navýšením 2 mg/24 h (startovací dávka byla 8 mg/24 h). Pacienti v každé skupině dostávali vytitrovanou optimální dávku po dobu 6 měsíců. Na konci udržovací léčby bylo pozorováno zlepšení nejméně o 30 % u 57 % pacientů léčených rotigotinem v dávce 8 mg/24 h, u 55 % pacientů s dávkou rotigotinu 12 mg/24 h a u 34 % pacientů ve skupině placeba (rozdíly 22 % a 21 %, 95% CI: 10–35% a 8–33 %; p <
0,001 pro obě skupiny rotigotinu),
graf
3
. U rotigotinu bylo průměrné snížení doby
„off" 2,7 a 2,1 hodiny, u placeba 0,9 hodi
ny. Rozdíly byly statisticky významné (p < 0,001, p = 0,003) [14].
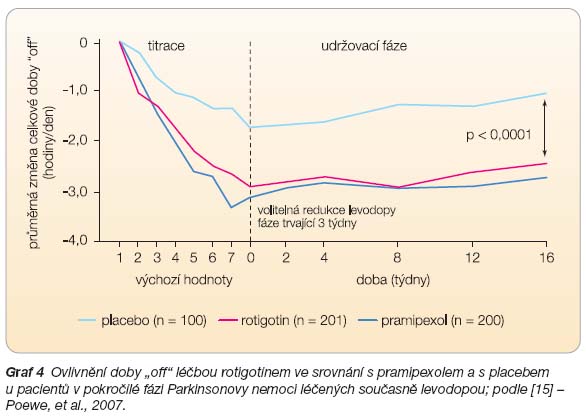
V druhé dvojitě zaslepené studii dostávalo 201 pacientů rotigotin, 200 pacientů pramipexol a 100 pacientů placebo. Optimální dávka u rotigotinu byla titrována s týdenním navýšením 2 mg/24 h (startovací dávka byla 4 mg/24 h) až do maximální dávky 16 mg/24 h. V pramipexolové skupině byli pacienti léčeni dávkou 0,375 mg pramipexolu během prvního týdne léčby, dávkou 0,75 mg během druhého týdne, a dále pak titrací s týdenním zvýšením 0,75 mg až k dosažení individuální optimální dávky s maximem 4,5 mg denně. V každé skupině byla dávka udržována po dobu 4 měsíců. Po ukončení udržovací léčby bylo pozorováno zlepšení nejméně o 30 % u 60 % pacientů léčených rotigotinem, u 67 % pacientů léčených pramipexolem a u 35 % pacientů ve skupině placeba (rozdíl rotigotin vs. placebo 25 %; 95% CI: 13–36 %, rozdíl pramipexol vs. placebo 32 %; 95% CI: 21–43 %, rozdíl pramipexol vs. rotigotin 7 %; 95% CI: -2–17 %). Průměrné snížení v době „off" bylo 2,5 hod. u rotigotinu, 2,8 hod. u pramipexolu a 0,9 hod. u placeba (
graf 4
).
Všechny rozdíly mezi účinnou léčbou
a pla
cebem byly statisticky významné [15].
Zařazení do současné palety léčiv
Rotigotin prokázal účinnost v terapii
časného i pozdního stadia Parkinsonovy
nemoci s potenciálním dlouhodobým přínosem [1, 16, 17] a je dobře tolerován [16–18]. Jedná se o první transdermální antiparkinsonikum (náplasti), které zabezpečuje stabilní a kontinuální dodáváni léčiva během 24 hodin [2].
Indikace
Rotigotin se v České republice indikuje jako monoterapie k léčbě známek a příznaků počátečního stadia idiopatické Parkinsonovy nemoci (tj. bez levodopy) nebo v kombinaci s levodopou, tj. v průběhu nemoci až do pozdních stadií, kdy se účinek levodopy ztrácí nebo přestává být konzistentní a nastávají fluktuace terapeutického účinku (fluktuace na konci dávky nebo „on off" fluktuace) [2].
V České republice byl rotigotin schválen pro monoterapii 15. 2. 2006 a pro přídatnou léčbu 10. 1. 2007.
Kontraindikace
Kontraindikaci představuje hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku obsaženou v přípravku a zobrazování pomocí magnetické rezonance nebo kardioverze [2].
Nežádoucí účinky
Podle analýzy klinických studií kontrolovaných placebem, které zahrnuly 1083 pacientů léčených rotigotinem a 508 pac
ientů léčených placebem, uvádělo 73,0
% pacientů léčených rotigotinem a 56,3 % pacientů léčených placebem nejméně jednu nežádoucí reakci [2, 16].
Na počátku terapie se mohou objevit dopaminergní nežádoucí reakce, jako je nauzea a zvracení. Tyto reakce mají obvyk
le mírnou nebo středně závažnou intenzi
tu a jsou přechodné, i když se v léčbě pokračuje [2, 16].
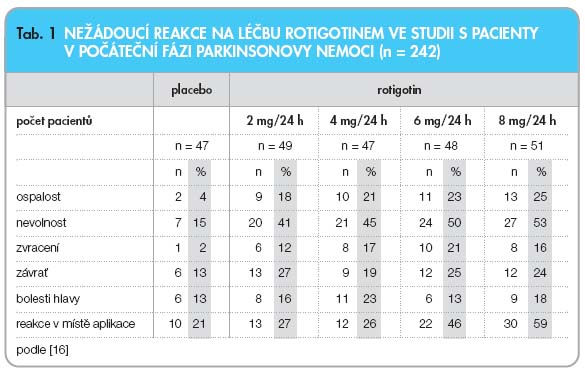
Nežádoucí lékové reakce hlášené u více než 10 % pacientů léčených rotigotinem jsou nauzea, závratě, somnolence a reakce v místě aplikace (
tab. 1
) [2, 16].
Ve studiích, kde se místa aplikace obměňovala, jak je to popsáno v pokynech uvedených v SPC a příbalové informaci, trpělo reakcemi v místě aplikace 35,7 % z 830 pacientů používajících transdermální náplast s rotigotinem. Většina z těchto reakcí měla mírnou nebo středně závažnou intenzitu, omezovala se na plochy aplikace a vedla k přerušení léčby pouze u 4,3 % pacientů léčených rotigotinem [2, 16].
Lékové interakce
Protože je rotigotin agonista dopaminu,
předpokládá se, že antagonisté dopami
nu, jako jsou neuroleptika (např. fenothiaziny, butyrofenony, thioxanteny) nebo metoklopramid, mohou snižovat účinnost rotigotinu, a je třeba vyvarovat se společného podávání. Navíc jsou klasická neuroleptika kontraindikovaná u Parkinsonovy nemoci. Kvůli možným aditivním účinkům je třeba postupovat opatrně v případě, že pacienti užívají sedativní léčivé přípravky nebo jiné léčivé přípravky tlumící činnost centrálního nerovového systému (např. benzodiazepiny, antipsychotika, antidepresiva) nebo alkohol v kombinaci s rotigotinem. Současné podávání levodopy a karbidopy s rotigotinem nemělo vliv na farmakokinetiku těchto léčiv. Současné podávání domperidonu a rotigotinu neovlivnilo farmakokinetiku rotigotinu. Současné podávání omeprazolu (inhibitoru CYP2C19) v dávkách 40 mg/
den nemělo žádný vliv na farmakokinetiku a metabolismus rotigotinu u zdravých dobrovolníků. Rotigotin může umocnit dopaminergní nežádoucí reakci na léčbu levodopou a může způsobit a/nebo zhoršit již dříve přítomné hyperkineze typu „peak of dose", jak je to popsáno u jiných agonistů dopaminu. Současné podávání
rotigotinu (3 mg/24 h) neovlivnilo farma
kodynamiku a farmakokinetiku perorálních kontraceptiv (0,03 mg ethinylestradiolu, 0,15 mg levonorgestrelu). Interakce s jinými formami hormonální antikoncepce nebyly předmětem studií [2].
Těhotenství a kojení
Adekvátní údaje o podávání rotigotinu těhotným ženám nejsou k dispozici. Studie na zvířatech nenaznačují žádné teratogenní účinky u potkanů a králíků, ale u potkanů a myší byla pozorována embryonální toxicita při maternálně toxických dávkách. Potenciální riziko pro člověka není známé. Rotigotin by neměl být používán během těhotenství. Protože rotigotin snižuje vylučování prolaktinu u člověka, očekává se inhibice laktace. Studie na potkanech ukázaly, že rotigotin a/nebo jeho metabolit(y) jsou vylučovány v mateřském mléce. Údaje o vlivu na člověka nejsou k dispozici, proto by mělo být kojení přerušeno [2].
Dávkování
Dávkování u pacientů s počátečním stadiem Parkinsonovy nemoci
Jediná denní dávka by měla začínat na 2 mg/24 h, poté se zvyšovat v týdenních přírůstcích o 2 mg/24 h na účinnou dávku až do maxima 8 mg/24 h. Rotigotin 4 mg/24 h může představovat účinnou
dávku u některých pacientů. U většiny
pac
ientů se účinné dávky dosahuje během
3 nebo 4 týdnů při dávkování 6 mg/24 h nebo 8 mg/24 h. Maximální dávka je 8 mg/24 h [2].
Dávkování u pacientů s pokročilým stadiem Parkinsonovy nemoci s fluktuacemi
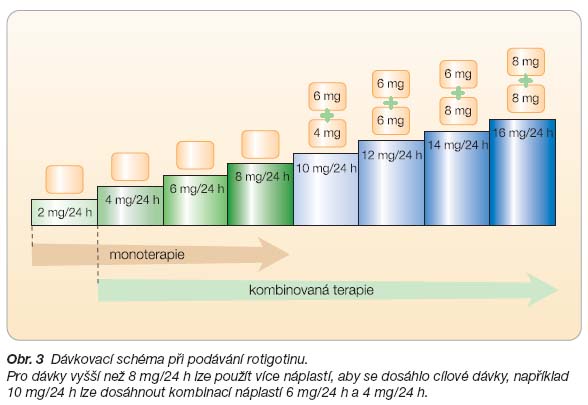
Jediná denní dávka by měla začínat na 4 mg/24 h, poté by se měla zvyšovat v týdenních přírůstcích o 2 mg/24 h na účinnou dávku až do maximální dávky 16 mg/24 h.
Dávka 4 mg/24 h nebo 6 mg/24 h může být účinnou dávkou u některých pacientů. U většiny pacientů se účinné dávky dosahuje během 3 až 7 týdnů při dávkách 8 mg/24 h až do maximální dávky
16 mg/24 h, viz
obr. 3
[2]. Recentní stu
die prokázala dobrou účinnost i snášenlivost dávky 24 mg/24 hodin [19].
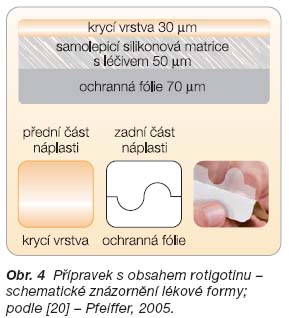
Balení
Rotigotin je obsažen v přípravku Neupro. Jedná se o transdermální náplasti
matricového typu, které tvoří tři vrstvy
(
obr.
4
) [2, 4]:
• �flexibilní krycí vrstva béžové barvy
• �samolepicí silikonová matrice s léčivem
• �ochranná fólie.