Sakubitril‑valsartan v léčbě chronického srdečního selhání se sníženou ejekční frakcí levé komory
Souhrn:
Vzrůstající incidence chronického srdečního selhání a nepříznivá prognóza tohoto onemocnění vyžadují stále nové farmakoterapeutické postupy. Do terapie srdečního selhání se sníženou ejekční frakcí levé komory nyní vstupuje nová skupina léčiv pod označením ARNI (angiotenzin receptor/neprilysin inhibitor), u jejíhož zatím jediného zástupce sakubitril‑valsartanu byl prostřednictvím studie PARADIGM‑HF prokázán statisticky a klinicky signifikantní účinek ve snížení kardiovaskulární mortality a rizika rehospitalizace pro srdeční selhání. Lékovou třídu ARNI indikovanou u pacientů se stabilizovaným srdečním selháním v klinickém stadiu NYHA II–III a se sníženou ejekční frakcí levé komory lze tedy považovat za alternativu současné standardní léčby inhibitory systému renin‑angiotenzin‑aldosteron.
Key words: chronic heart failure – left ventricular ejection fraction – sacubitril‑valsartan – PARADIGM‑HF trial.
Summary:
Increasing incidence of chronic heart failure and its unfavorable prognosis keep calling for novel pharmacotherapeutic approaches. New class of drugs described as ARNI (angiotensin receptor/neprilysin inhibitor) recently widened the spectrum of possibilities how to treat heart failure with decreased left ventricular ejection fraction. Statistically and clinically significant lowering of cardiovascular mortality and risk of rehospitalization for heart failure was shown in the PARADIGM‑HF trial following the treatment with sacubitril‑valsartan, so far the only representative of ARNI. The ARNI drugs are indicated in patients with stabilized heart failure NYHA II–III and decreased left ventricular ejection fraction; they can be considered an alternative of the current standard treatment with renin‑angiotensin‑aldosterone system blockers.
Úvod
Chronické srdeční selhání (CHSS) je zásadním problémem současné kardiologie, jeho léčba je náročná medicínsky, logisticky i finančně. Incidence CHSS stoupá, a to jak formy se sníženou, tak se zachovalou ejekční frakcí levé komory [1]. Přes pokroky v terapii je prognóza srdečního selhání nepříznivá, jakýkoliv nový postup či farmakoterapie tak může zásadním způsobem zlepšit prognózu nemocných. V tomto přehledu se budeme věnovat především poznatkům o léčbě CHSS se sníženou ejekční frakcí (heart failure with reduced ejection fraction, HFrEF) levé komory novým perorálním přípravkem, který obsahuje účinný komplex látek: sakubitril valsartan.
Léková třída ARNI a sakubitril valsartan
Přípravek obsahuje komplex sodné soli sakubitril valsartan, který působí jako duální inhibitor neprilysinu (prostřednictvím sakubitrilu) a AT1 receptorů (účinek valsartanu), čímž potencuje prospěšné kardiovaskulární účinky natriuretických peptidů (NP) a blokuje hyperaktivaci systému renin angiotenzin aldosteron (RAAS) způsobující vazokonstrikci, retenci sodíkových iontů, proliferaci vaziva, remodelaci cév i levé srdeční komory, hypertrofii kardiomyocytů a jejich apoptózu.
Přípravek byl registrován v Evropské unii (EU) v říjnu 2015 pod názvem Entresto a je indikován k léčbě symptomatického chronického srdečního selhání s redukovanou ejekční frakcí levé komory u dospělých pacientů [2]. Léčivo je registrováno ve třech silách: 24 mg/26 mg, 49 mg/51 mg a 97 mg/103 mg; ATC skupina: valsartan a sakubitril (C09DX04) [2].
Fyzikálně chemické vlastnosti
Valsartan je chemicky L valin, N (1 oxopentyl) N [[2‘ (2Htetrazol 5 yl)[1,1‘ bifenyl] 4 yl]metyl] – C24H29N5O3; jedná se o bílý prášek bez zápachu rozpustný v etanolu, metanolu a lehce rozpustný ve vodě. Molekulová hmotnost je 435,52 kDa. Disociační konstanta činí 3,9 pKa pro uhličitou skupinu a 4,7 pKa pro HN tetrazolovou. Sakubitril je chemicky [1,1‘ bifenyl] 4 pentanová kyselina, γ [(3 karboxy 1 oxopropyl)amino] α metyl , α etyl ester, (αR, γS) – C24H29NO5; látka nebyla izolována. Molekulová hmotnost je 411,49 kDa; disociační konstanta činí 4,6 pKa [3].
Mechanismus účinku
Ačkoliv je stávající dostupná
farmakoterapie cílena především na inhibici RAAS
a sympatického nervového systému (SNS), a tím
na potlačení jejich nepříznivých účinků
na kardiovaskulární systém, u HFrEF dochází
rovněž k aktivaci dalších neurohumorálních systémů,
jež jsou kontraregulační a jejichž účinky jsou naopak
kardiovaskulárně prospěšné. Jejich aktivace v různé míře
způsobuje pokles krevního tlaku a sympatického tonu (inhibicí
RAAS a SNS), vazodilataci, natriurézu, inhibici fibrotických
procesů a rozvoje hypertrofie cévní stěny a uvolňování
vazopresinu [4,5]. Nejvíc prozkoumaným systémem s těmito
účinky je systém natriuretických peptidů (NP). Mezi NP patří
atriální NP (ANP), mozkový NP (BNP) a natriuretický
peptid C (CNP). I přesto, že jsou si NP strukturálně
podobné, jsou kódovány odlišnými geny ‒ ANP a BNP
vznikají hlavně v srdci a CNP především
v endoteliálních buňkách systémové vaskulatury [5,6].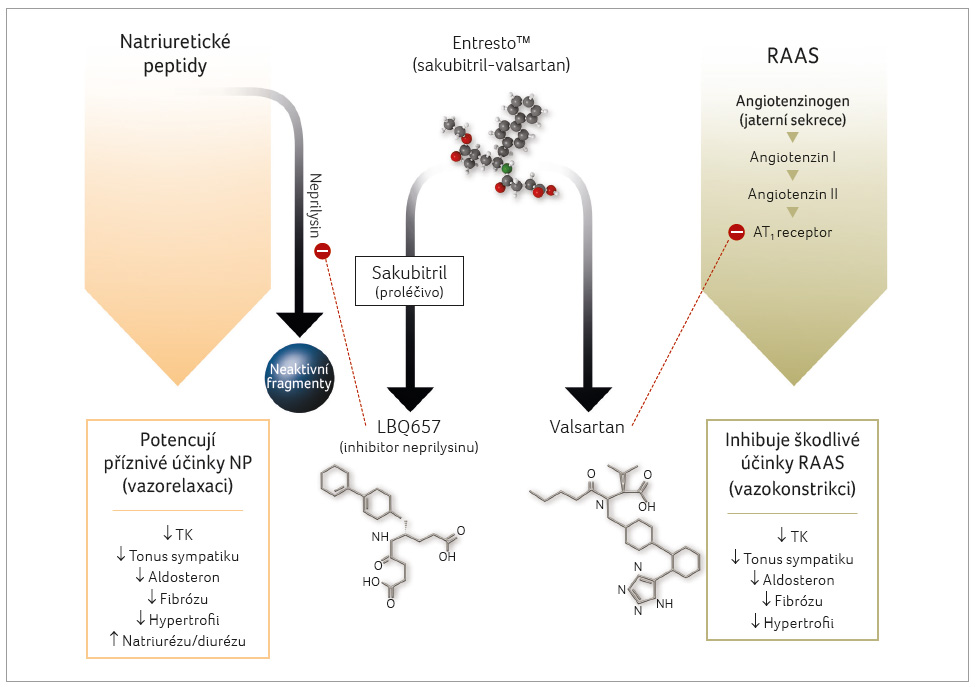
Natriuretické peptidy jsou degradovány neprilysinem (neutrální endopeptidázou, NEP), enzymem, který degraduje také angiotenzin II a další vazoaktivní peptidy. Proto se pozornost zaměřila na vývoj molekul s duální účinkem, jež simultánně inhibují NEP a zároveň inhibují RAAS [6]. Molekulou založenou na tomto mechanismu účinku, která jako jediný zástupce byla dosud uvedena do klinické praxe, je právě sakubitril valsartan (zprvu vedený pod kódovým označením LCZ696) (obr. 1).
Farmakokinetické vlastnosti
Absorpce
Valsartan obsažený v přípravku Entresto je lépe biologicky dostupný než valsartan v jiných lékových formách tablet: 26 mg, 51 mg a 103 mg valsartanu v přípravku Entresto je ekvivalentní 40 mg, 80 mg a 160 mg valsartanu v jiných lékových formách tablet. Po perorálním podání se přípravek Entresto disociuje na valsartan a proléčivo sakubitril. Sakubitril je dále metabolizován na aktivní metabolit sakubitrilát (LBQ657). Tyto látky dosahují maximálních plazmatických koncentrací za 2 h (sakubitril), 1 h (valsartan) a 2 h (sakubitrilát). Perorální absolutní biologická dostupnost sakubitrilu a valsartanu se odhaduje na více než 60 % (sakubitril) a 23 % (valsartan). Při podávání přípravku Entresto je dosaženo ustáleného stavu koncentrací sakubitrilu, sakubitrilátu a valsartanu do tří dnů. V ustáleném stavu se sakubitril a valsartan významně nekumulují, zatímco sakubitrilát se kumuluje 1,6násobně. Podání s jídlem nemá klinicky významný vliv na systémové expozice sakubitrilu, sakubitrilátu a valsartanu. Přípravek Entresto může být podáván s jídlem nebo bez jídla.
Distribuce
Sakubitril, sakubitrilát a valsartan jsou vysoce vázány na plazmatické proteiny (z 94‒97 %). Na základě srovnání expozic v plazmě a cerebrospinálním moku prochází LBQ657 hematoencefalickou bariérou v omezeném množství (0,28 %). Průměrný zdánlivý distribuční objem valsartanu a sakubitrilu byl 75–103 litrů.
Biotransformace
Sakubitril je rychle konvertován karboxylesterázami 1b a 1c na sakubitrilát, který není dále ve významném objemu metabolizován. Valsartan je metabolizován minimálně, protože pouze asi 20 % dávky je přeměňováno na metabolity. V plazmě byl identifikován metabolit hydroxylu valsartanu v nízkých koncentracích (< 10 %). Protože metabolismus sakubitrilu a valsartanu, zprostředkovaný enzymem cytochromu P450, je minimální, neočekává se, že by současné podávání s léčivými přípravky ovlivňujícími enzymy cytochromu P450 působilo na farmakokinetiku.
Eliminace
Po perorálním podání je 52–68 % sakubitrilu (primárně jako sakubitrilát) a přibližně 13 % valsartanu a jeho metabolitů vylučováno v moči, 37‒48 % sakubitrilu (primárně jako sakubitrilát) a 86 % valsartanu a jeho metabolitů je vylučováno ve stolici. Sakubitril, sakubitrilát a valsartan jsou vylučovány z plazmy s průměrným poločasem eliminace (t1/2) přibližně 1,43 hodiny (sakubitril), 11,48 hodiny (sakubitrilát) a 9,90 hodiny (valsartan).
Klinický význam lékové skupiny sakubitril valsartan
V roce 2016 byli publikovány aktualizované doporučené postupy Evropské kardiologické společnosti (European Society of Cardiology, ESC) [1], které byly následně přijaty i Českou kardiologickou společností pro léčbu srdečního selhání [7], kde největší novinkou v rámci léčebného algoritmu je právě zařazení nové lékové skupiny ARNI (angiotenzin receptor/neprilysin inhibitor) zastoupené sakubitril valsartanem.
Klinické hodnocení
Přípravek sakubitril valsartan je indikován k léčbě pacientů se stabilním symptomatickým CHSS s redukovanou ejekční frakcí levé komory u dospělých pacientů. Schválení této indikace v EU a následnému zařazení do guidelines pro léčbu srdečního selhání s doporučením třídy I předcházelo publikování rozsáhlé mortalitně morbiditní studie PARADIGM HF [4,8]. Ve studii bylo randomizováno celkem 8 399 nemocných, 4 187 do větve se sakubitril valsartanem a 4 212 do větve s enalaprilem. Všichni pacienti museli splňovat tato vstupní kritéria: věk nad 18 let, stabilizované CHSS, ejekční frakce levé komory ≤ 40 %, což bylo záhy po zahájení studie upraveno na ≤ 35 %, dále zvýšení plazmatické koncentrace BNP (≥ 150 pg/ml) nebo NT proBNP (N terminální fragment natriuretického peptidu typu B; ≥ 600 pg/ml), či pokud byli pacienti v předchozích 12 měsících hospitalizováni pro srdeční selhání, koncentrace BNP ≥ 100 pg/ml nebo NT proBNP ≥ 400 pg/ml. Účastníci studie byli před zařazením léčeni nejméně čtyři týdny stabilními dávkami inhibitorů angiotenzin konvertujícího enzymu (ACE) nebo sartanů v ekvivalentu minimálně 10 mg enalaprilu denně v kombinaci s betablokátory. Mezi vyřazovací kritéria patřila hypotenze, renální insuficience, hyperkalemie a anamnéza angioedému či jiných významných nežádoucích účinků při léčbě inhibitory ACE nebo sartany. Pacienti s hodnotou systolického krevního tlaku < 100 mm Hg, závažnou poruchou funkce ledvin (odhad glomerulární filtrace [eGFR] < 30 ml/min/1,73 m2) a závažnou poruchou funkce jater byli vyloučeni při screeningu, a proto nebyli prospektivně sledováni.
V průběhu zařazení pacientů do studie byla použita metoda tzv. run in periody, kdy byli pacienti titrováni nejprve na dávku 2× 10 mg enalaprilu a následně po dobu 4‒6 týdnů na dávku 2× 49 mg/51 mg, resp. 97 mg/103 mg sakubitril valsartanu. Teprve pokud nemocní úspěšně absolvovali run in fázi, byli randomizováni v poměru 1 : 1 k dvojitě zaslepené léčbě enalaprilem (2× 10 mg denně) nebo sakubitril valsartanem v dávce 97 mg/103 mg dvakrát denně. V obou léčebných větvích byly zkoušené látky přidávány ke standardní terapii srdečního selhání (k betablokátorům, antagonistům mineralokortikoidních receptorů, pokud je pacient toleroval a byl indikován, a k diuretikům). Nemocní mohli mít rovněž implantovanou přístrojovou léčbu (implantabilní defibrilátory nebo srdeční resynchronizační léčbu či jejich kombinaci).
PARADIGM HF je doposud největší provedenou studií u pacientů s CHSS. Obě skupiny se nelišily v základních charakteristikách, přibližně 70 % zařazených pacientů bylo klasifikováno do třídy NYHA II a 24 % do třídy NYHA III (klasifikace dle New York Heart Association). Primárním sledovaným cílovým ukazatelem byl součet úmrtí z kardiovaskulárních příčin a hospitalizací pro srdeční selhání. Sekundární cílové ukazatele tvořily úmrtí z jakékoliv příčiny, změna v kvalitě života hodnocená Kansaským kardiomyopatickým dotazníkem (KCCQ) a bezpečnostní cílové ukazatele ‒ výskyt fibrilace síní a zhoršení renálních funkcí. Medián délky sledování nemocných byl 27 měsíců.
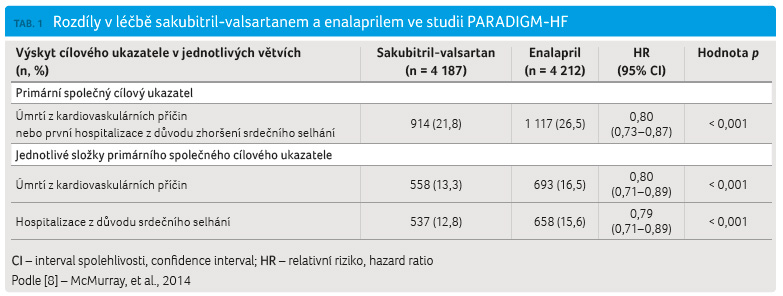 Hlavní výsledky studie PARADIGM HF
jednoznačně prokázaly prospěch léčby sakubitril valsartanem
oproti enalaprilu. Po léčbě sakubitril valsartanem bylo
docíleno 20% redukce rizika primárního sledovaného parametru
(kardiovaskulárního úmrtí a hospitalizace pro srdeční
selhání). Pro jednotlivé komponenty primárního cílového
ukazatele byl pak zaznamenán pokles relativního rizika o 20 %
u úmrtí z kardiovaskulárních příčin a o 21 %
u hospitalizace pro srdeční selhání. Všechny tyto rozdíly
byly vysoce statisticky významné a efekt léčby byl patrný
velmi brzy po jejím zahájení (tab. 1). Rovněž celková mortalita byla snížena, a to
o 16 % ve prospěch terapie sakubitril valsartanem,
přičemž těchto výsledků bylo dosaženo při léčbě ostatními
přípravky zlepšujícími prognózu pacientů s CHSS (tedy
betablokátory a inhibitory mineralokortikoidních receptorů)
a se symptomatickou terapií diuretiky. Léčba
kombinací sakubitril valsartan byla oproti monoterapii
enalaprilem také spojena s významným zlepšením kvality
života.
Hlavní výsledky studie PARADIGM HF
jednoznačně prokázaly prospěch léčby sakubitril valsartanem
oproti enalaprilu. Po léčbě sakubitril valsartanem bylo
docíleno 20% redukce rizika primárního sledovaného parametru
(kardiovaskulárního úmrtí a hospitalizace pro srdeční
selhání). Pro jednotlivé komponenty primárního cílového
ukazatele byl pak zaznamenán pokles relativního rizika o 20 %
u úmrtí z kardiovaskulárních příčin a o 21 %
u hospitalizace pro srdeční selhání. Všechny tyto rozdíly
byly vysoce statisticky významné a efekt léčby byl patrný
velmi brzy po jejím zahájení (tab. 1). Rovněž celková mortalita byla snížena, a to
o 16 % ve prospěch terapie sakubitril valsartanem,
přičemž těchto výsledků bylo dosaženo při léčbě ostatními
přípravky zlepšujícími prognózu pacientů s CHSS (tedy
betablokátory a inhibitory mineralokortikoidních receptorů)
a se symptomatickou terapií diuretiky. Léčba
kombinací sakubitril valsartan byla oproti monoterapii
enalaprilem také spojena s významným zlepšením kvality
života.
Z dalších dostupných výsledků
analýz studie PARADIGM HF stojí za zmínku analýza
u přežívajících pacientů, u nichž byly mimo jiné
zjištěny následující prospěšné účinky při léčbě
sakubitril valsartanem [9]. Došlo k významnému snížení
rizika první návštěvy pohotovosti a opakovaných
mnohočetných návštěv pohotovosti o 30 % (p = 0,017),
snížení rizika první hospitalizace pro srdeční selhání
a opakovaných mnohočetných hospitalizací pro srdeční
selhání (o 29 %; p = 0,001),
bylo zaznamenáno i méně hospitalizací z kardiovaskulárních
příčin (p < 0,001)
a o 23 % méně hospitalizací pro srdeční selhání
(p < 0,001)
[10] (graf 1).![GRAF 1 přehled hlavních klinických parametrů ze studie paradiGM‑hf; podle [8,10] – McMurray, et al., 2014, McMurray, 2015. Shrnutí klinického přínosu léčby sakubitril-valsartanem oproti enalaprilu. Výsledky jsou zaznamenány u pacientů, kteří prodělali nejméně jednu příhodu (opětovné výskyty nefatálních příhod nejsou zahrnuty). V případě pohotovosti jsou míněny návštěvy, které nevedly k přijetí do péče. Péče o ambulantní pacienty se zhoršením stavu je defi nována jako: přidání nového léku k terapii zhoršujícího se srdečního selhání, zvýšení dávky diuretika po dobu déle než jeden měsíc, potřeba nitrožilní terapie. Ci – interval spolehlivosti, confi dence interval; hr – poměr rizik, hazard ratio; Jip – jednotka intenzivní péče; kv – kardiovaskulární; ss – srdeční selhání](https://www.remedia.cz/photo-a-31067---.jpg)
Ze studie PARADIGM HF jsou rovněž známa data hodnotící příčiny úmrtí pacientů s CHSS se sníženou ejekční frakcí levé komory. Většina úmrtí ve studii nastala z kardiovaskulárních příčin (80,9 %) a riziko tohoto úmrtí bylo léčbou sakubitril valsartanem sníženo o 20 % ve srovnání s enalaprilem (HR [hazard ratio, poměr rizik] = 0,80, 95% CI [confidence interval, interval spolehlivosti] 0,72–0,89, p < 0,001). Nejčastějšími příčinami kardiovaskulárního úmrtí byla náhlá srdeční úmrtí (44,8 %) a úmrtí z důvodu zhoršení srdečního selhání (26,5 %). Po terapii sakubitril valsartanem oproti enalaprilu došlo ke snížení rizika náhlého srdečního úmrtí o 20 % (HR = 0,80, 95% CI 0,68–0,94, p = 0,008) a ke snížení rizika úmrtí pro zhoršení srdečního selhání o 21 % (HR = 0,79, 95% CI 0,64–0,98, p = 0,034). Účinek léčby na snížení rizika náhlých srdečních úmrtí nebyl ovlivněn implantací defibrilátoru (ICD) (HR pro pacienty s ICD = 0,49, 95% CI 0,25–0,98; HR pro pacienty bez ICD = 0,82, 95% CI 0,69–0,98, p = 0,17) [11].
Bezpečnostní profil sakubitril valsartanu
Z pohledu bezpečnosti se po terapii sakubitril valsartanem vyskytlo více případů symptomatické hypotenze oproti terapii enalaprilem, jež však nevedly k častějšímu přerušení studijní léčby. V ostatních případech byl bezpečnostní profil srovnatelný s enalaprilem. Naopak u signifikantně menšího počtu pacientů léčených sakubitril valsartanem byla oproti léčbě enalaprilem zaznamenána nižší četnost výskytu kašle, hyperkalemie a zvýšených koncentrací kreatininu [8]. Při analýze podskupin nebylo možné identifikovat žádnou, která by z léčby sakubitril valsartanem měla větší přínos než ostatní. Snížení relativního rizika pro primární sledovaný ukazatel bylo přítomno velmi konzistentně napříč všemi 18 předem specifikovanými podskupinami včetně: pohlaví, věku, rasy, geografické polohy, třídy NYHA (II/III), ejekční frakce levé komory, funkce ledvin, diabetu nebo hypertenze v anamnéze, předchozí léčby srdečního selhání a fibrilace síní [8] (graf 2).
Praktická doporučení
Ze studie PARADIGM HF a další dostupné evidence vzešlo kromě významných výsledků i několik praktických doporučení, jež je třeba mít při iniciaci léčby sakubitril valsartanem na paměti. Při převodu pacienta z léčby inhibitory ACE je nutno před zahájením terapie sakubitril valsartanem vždy dodržet 36hodinovou tzv. vymývací (wash out) periodu. Přičemž současné podání sakubitril valsartanu a inhibitorů ACE je kontraindikováno. Doporučená zahajovací dávka je 49 mg/51 mg dvakrát denně, kromě specifických stavů vyžadujících zahájení léčby dávkou 24 mg/26 mg dvakrát denně (např. u pacientů s hodnotou systolického krevního tlaku ≥ 100‒110 mm Hg, se středně těžkou a těžkou poruchou funkce ledvin [eGFR 30‒60 ml/min/1,73 m2] nebo středně těžkou poruchou funkce jater [podle Childovy‒Pughovy klasifikace kategorie B] nebo s hodnotami AST/ALT [aspartátaminotransferáza/alaninaminotransferáza] dosahujícími více než dvojnásobku horní hranice normálního rozmezí). Dávka by měla být poté titrována do dosažení cílového podání jedné tablety 97 mg/103 mg dvakrát denně, podle tolerance pacienta. V dávce 97 mg/103 mg sakubitril valsartanu je obsažen ekvivalent dávky 160 mg valsartanu, z toho důvodu se nedoporučuje podávat ani v kombinaci s jiným sartanem.
Vzhledem k mechanismu účinku, kdy dochází k inhibici degradace BNP a tím ke vzestupu jeho koncentrací, což přináší prospěšné kardiovaskulární účinky, není BNP vhodným biomarkerem srdečního selhání u pacientů léčených sakubitril valsartanem. Vhodným biomarkerem pro pacienty léčené sakubitril valsartanem je tedy NT proBNP [2].
Závěr
K dostupným důkazům z klinických studií o snížení mortality a morbidity u pacientů se srdečním selháním se sníženou ejekční frakcí levé komory pro terapii na bázi inhibitorů ACE, betablokátorů nebo blokátorů mineralokortikoidních receptorů (obvykle společně s diuretiky, jež zmírňují příznaky a známky městnání) přibyla i nová skupina tzv. ARNI (angiotenzin receptor/neprilysin inhibitor). Její zatím jediný zástupce sakubitril valsartan po přidání ke standardní terapii betablokátory a blokátory mineralokortikoidních receptorů v robustní mortalitně morbiditní studii PARADIGM HF prokázal statisticky, ale především klinicky významný účinek ve snížení kardiovaskulární mortality (o 20 %; p = 0,00004) a ve snížení rizika rehospitalizace pro srdeční selhání (o 21 %; p = 0,00004), a to při redukci celkové mortality (o 16 %; p = 0,0005) oproti současné standardní léčbě – inhibitoru ACE. Nová léková třída ARNI je tedy indikována u pacientů se stabilizovaným srdečním selháním v klinickém stadiu NYHA II–III a se sníženou ejekční frakcí levé komory (≤ 35 %) – zlepšuje prognózu těchto nemocných a lze předpokládat, že se stane alternativou současné standardní terapie inhibitory RAAS.
Seznam použité literatury
- [1] Ponikowski P, Voors AA, Anker SD, et al. Authors/Task Force Members; Document Reviewers. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016; 18: 891–975. doi: 10.1002/ejhf.592. Epub 2016 May 20.
- [2] SPC Entresto, Státní ústav pro kontrolu léčiv: Databáze léků [online]. Dostupné na: http://www.sukl.cz/modules/medication/detail.php?code=0209042
- [3] PRODUCT MONOGRAPH Entresto, Novartis Pharmaceuticals Canada Inc., 2016.
- [4] McMurray JJ, Packer M, Desai AS, et al. Dual angiotensin receptor and neprilysin inhibition as an alternative to angiotensin‑converting enzyme inhibition in patients with chronic systolic heart failure: rationale for and design of the Prospective comparison of ARNI with ACEI to Determine Impact on Global Mortality and morbidity in Heart Failure trial (PARADIGM‑HF). Eur J Heart Fail 2013; 15: 1062–1073.
- [5] Potter LR. Natriuretic peptide metabolism, clearance and degradation. FEBS J 2011; 278: 1808–1817.
- [6] Bayes‑Genis A, Barallat J, Richards AM. A test in context: neprilysin: function, inhibition, and biomarker. J Am Coll Cardiol 2016; 68, 639–653.
- [7] Špinar J, Hradec J, Špinarová L, Vítovec J. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Připraven Českou kardiologickou společností. Cor Vasa 2016; 58: 597–636.
- [8] McMurray JJV, Packer M, Desai AS, et al. Angiotensin‑neprilysin inhibition vs enalapril in heart failure. N Engl J Med 2014; 371: 993–1004.
- [9] Packer M, McMurray JJV, Desai AS, et al., for the PARADIGM‑HF Investigators and Coordinators. Angiotensin receptor neprilysin inhibition compared with enalapril on the risk of clinical progression in surviving patients with heart failure. Circulation 2015; 131: 54–61.
- [10] McMurray JJ. Neprilysin inhibition to treat heart failure: a tale of s science, serendipity, and second chances. Eur J Heart Fail 2015; 17: 242–247.
- [11] Desai AS, McMurray JJ, Packer M, et al. Effect of the angiotensin‑receptor‑neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J 2015; 36: 1990–1997.