Stabilizovaná hyaluronová kyselina non‑animálního původu (NASHA) pro intraartikulární podání − profil přípravku Durolane
Souhrn:
Juřica J. Stabilizovaná hyaluronová kyselina non‑animálního původu (NASHA) pro intraartikulární podání − profil přípravku Durolane. Remedia 2019; 29: 536–542.
Hyaluronová kyselina je endogenní molekula, která má v medicíně několikero využití. V ortopedii se používá především intraartikulárně v terapii osteoartrózy kolenního kloubu. Tento článek je profilem zdravotnického prostředku Durolane, podává přehled farmakokinetiky hyaluronové kyseliny po intraartikulární aplikaci, přehled mechanismů působení, všímá si bezpečnosti intraartikulárně aplikované hyaluronové kyseliny a dokládá evidenci účinků a současná klinická doporučení.
Summary:
Jurica J. Non‑animal stabilized hyaluronic acid (NASHA) for intra‑articular administration – Durolane medicinal product profile. Remedia 2019; 29: 536–542.
Hyaluronic acid is an endogenous molecule that has several uses in medicine. In orthopaedics, it is mainly used in the form of intra‑articular injections for the treatment of osteoarthritis of the knee. This article presents the profile of Durolane, provides an overview of the pharmacokinetics of intra‑articular hyaluronic acid administration, an overview of the mechanisms of action, the safety of intra‑articular hyaluronic acid administration and reviews the current scientific evidence of effects and clinical recommendations.
Key words: hyaluronic acid, pharmacological profile, osteoarthritis, anti‑inflammatory effect, antinociceptive effect, pharmaceutical drug dosage forms
Úvod
Hyaluronová kyselina (HA, hyaluronic
acid) byla izolována v roce 1934 Karlem Meyerem a Johnem
Palmerem z hovězího sklivce. Název pochází z řeckého
„hyalos“ (sklo) a z názvu její komponenty, uronové
(glukuronové) kyseliny [1]. Denní obrat
HA v lidském těle je zhruba 15 g [2].
Hyaluronová kyselina je polyaniont se strukturou opakujícího se
disacharidu [(1→3) β D glukuronyl (1→4) β D N acetylglukosamin].
Chemicky se jedná o lineární polysacharid,
(2 acetamido 2 deoxy D gluko) D glukuronoglykan
[1]. Hyaluronová kyselina je
syntetizována z aktivovaných forem základních jednotek –
UDP glukuronové kyseliny a UDP N acetylglukosaminu.
Hyaluronová kyselina má charakteristické vlastnosti, které
předurčují její fyziologické funkce i možné medicínské
využití. Jedná se o hydrofilitu, rheologické vlastnosti
(viskoelasticitu), schopnost vychytávat volné kyslíkové radikály,
ale snad i schopnost fungovat jako signální molekula [3,4].
Hydrofilita je dána chemickou strukturou bohatou na hydroxylové
( OH) a karboxylové ( COOH) skupiny. Hyaluronová
kyselina je údajně schopná zadržet až tisícinásobek vlastního
objemu vody.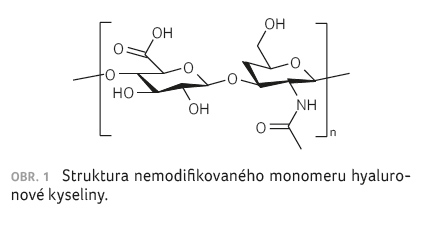
Do kloubů je HA vylučována synoviálními buňkami, fibroblasty a chondrocyty. Její fyziologickou funkcí v kloubu je zvyšovat viskozitu a elasticitu synoviální tekutiny, působit tedy jako lubrikant a díky viskoelastickým vlastnostem i jako tlumič nárazů [5]. V současné době je snaha využít výhodných vlastností HA v oftalmologii, ortopedii, kardiologii nebo estetické chirurgii [1]. V srpnu 2019 bylo registrováno 73 klinických hodnocení fáze I–IV s HA/hyaluronátem sodným (clinicaltrials.gov); ve většině se jedná o klinické zkoušení s intervencí při osteoartróze (OA), v plastické chirurgii nebo oftalmologii. Tento článek je farmakologickým profilem zdravotnického prostředku Durolane, v kontextu s ostatními přípravky, které jsou schváleny pro použití v terapii OA kolenního kloubu. Cílem intraartikulární aplikace HA je zabezpečit a udržet lubrikační a viskoelastické vlastnosti synovie, proto se tato terapie často označuje jako „viskosuplementace“ [6]. Klinické účinky viskosuplementace přitom mohou být pozorovány i dlouho poté, co exogenní HA již byla vyloučena z těla. Mezi uvažovaným působením je obnovení homeostatických mechanismů v kloubu, včetně stimulace produkce endogenní HA [6–12].
Použití
Zdravotnický prostředek Durolane je určen k použití v intraartikulární injekci pro symptomatickou léčbu lehké až středně těžké OA kolene nebo kyčle. Přípravek Durolane je navíc schválen pro symptomatickou léčbu v souvislosti s mírnou až středně závažnou osteoartritickou bolestí kotníku, ramene, lokte, zápěstí a prstů na rukou i nohou. Přípravek Durolane je také indikován u pacientů s OA v případě bolesti po artroskopii během tří měsíců po zákroku.
Dávkování
Durolane se podává intraartikulárně‚ jednodávkově, jedenkrát za léčebný cyklus. Doporučená dávka je 3 ml pro kolenní, kyčelní nebo ramenní kloub. Pro středně velké klouby (např. loketní a hlezenní) se doporučuje objem 1−2 ml a přibližně 1 ml pro malé klouby (např. kloub palce). Cyklus (tzn. jednorázové podání) lze zopakovat nejdříve za 6 měsíců.
Zařazení do současné palety zdravotnických prostředků
Na trhu je několik zdravotnických prostředků s obsahem HA určených pro terapii OA, většinou kolenního kloubu. Jedná se o zdravotnické prostředky Orthovisc, Arthrovisc, Biovisc, Crespine, Durolane, Fermathron, Monovisc, Optivisc, Hyalone, Hyalubrix, Synolis a Sinovial One. Všechny jmenované zdravotnické prostředky mají ovšem ve srovnání s Durolane nižší molekulovou hmotnost i kratší rezidenční čas v kloubu (u většiny však tato informace není dostupná). Dále do této skupiny patří kombinovaný přípravek s obsahem triamcinolonu a HA (Cingal), který ovšem není s čistou HA srovnatelný, a to především spektrem dlouhodobých negativních dopadů na rozvoj OA [13]. Mezi zdravotnickými prostředky s obsahem HA jsou značné rozdíly z hlediska původu, molekulové hmotnosti a způsobu kovalentní i nekovalentní chemické modifikace HA. Tyto rozdíly jsou diskutovány v oddílech „Faktory ovlivňující účinek“ a „Zvláštnosti jednotlivých farmaceutických forem“.
V kategorii léčivých přípravků je v ATC skupině M09AX registrován jeden přípravek s hyaluronátem sodným s indikací pro terapii OA (Hyalgan). Tento přípravek je deklarován jako vysokomolekulární forma HA o molekulové hmotnosti 500–730 kDa (přestože se většina zdrojů shoduje, že vysokomolekulární je HA s molekulovou hmotností nad 6 000 kDa) a s eliminačním poločasem asi 17 hodin [14]. Oproti tomu HA obsažená ve zdravotnickém prostředku Durolane je sice vysokomolekulární, avšak zdroje uvádějí molekulovou hmotnost od zhruba 90 000 kDa přes 100 000 kDa až po 1013 Da. V případě údaje 1013 Da se jedná o faktor, kterým se zvýší molekulová hmotnost uspořádáním molekul NASHA do supramolekulárních komplexů („gel beads“) [15]. Vysoká molekulová hmotnost spolu se stabilizací je pak příčinou, proč má HA terminální eliminační poločas po intraartikulárním podání 28 dní [16].
Doporučené postupy pro léčbu OA uvádějí perorální podávání nesteroidních antiflogistik a intraartikulární aplikaci glukokortikoidů (metylprednisolon acetát) [17–21]. V preklinických modelech bylo testováno podání botulotoxinu A [22]. Přestože recentní klinická doporučení jsou k použití HA spíše rezervovaná, chronické podávání nesteroidních antiflogistik i aplikace glukokortikoidů intraartikulárně jsou spojeny s typickými nežádoucími účinky (gastrotoxicita, hepatotoxicita, resp. kardiovaskulární toxicita nesteroidních antiflogistik a katabolické, antiproliferativní a v dlouhodobém důsledku spíše negativní vlivy na chrupavku v případě glukokortikoidů). Hyaluronová kyselina je tak jistě zajímavou alternativou zmíněných doporučení.
Mechanismy účinku
Jak již bylo uvedeno, HA má charakteristické viskoelastické vlastnosti dané chemickou strukturou a minimálně část účinků je předurčena fyzikálně chemickými vlastnostmi, a tedy nespecifickým působením.
Viskoelastické chování
Viskoelasticita je vlastnost materiálu, který při mechanickém namáhání, deformaci, vykazuje jak viskózní, tak elastické vlastnosti. Fyzikálně chemické vlastnosti přitom úzce souvisejí s molekulovou hmotností. Hyaluronová kyselina má schopnost zadržovat objem vody až tisíckrát větší ve srovnání s vlastním objemem [23,24], a díky své vysokomolekulární a vzájemně zesíťované struktuře (intramolekulární nekovalentní nebo i kovalentní vazby) se chová viskoelasticky a dokáže absorbovat nárazy. Molekulová hmotnost a koncentrace tělu vlastní HA je při OA snížena [5], odtud patrně pochází přesvědčení, že intraartikulární injekce HA/hyaluronanu mohou obnovit viskoelastické vlastnosti synovie a omezit progresi onemocnění [5,25–27]. Při zánětu se snižuje koncentrace i molekulová hmotnost HA, přestože celkové množství HA se z důvodu zvýšené syntézy synovie patrně zvyšuje [28]. Viskoelastické vlastnosti NASHA (non animal stabilized hyaluronic acid) jsou s ohledem na molekulovou hmotnost výjimečné. Právě obrovská molekulová hmotnost a forma stabilizace přináší oproti jiným formám HA (především nízkomolekulárním formám a formám stabilizovaným chemicky) výrazně lepší fyzikálně chemické vlastnosti, které umožňují u OA plnit lépe roli absorbentu rázů a vůbec role synoviální tekutiny ve zdravém kloubu.
Ovlivnění tuhosti chrupavky
Při OA je v synoviální tekutině HA depolymerizována na fragmenty s molekulovou hmotností 2 700–4 500 kDa a tento obrat je rychlejší než ve zdravém kloubu (přibližně 11 hodin vs. 20 hodin) [6]. Hyaluronová kyselina v preklinickém experimentu zvyšuje tuhost nově tvořené chrupavky při tlakovém zatížení a zvyšuje množství sulfatovaných glykosaminoglykanů o 35 %. Efekt ovšem závisí na molekulové hmotnosti a je patrný pouze u HA s molekulovou hmotností vyšší než 1 700 kDa [3]. Hyaluronová kyselina také v preklinickém zkoušení dokázala zpomalit degeneraci chrupavky v modelu monojodoacetátem indukované OA u potkana [29].
Protizánětlivé působení
Hyaluronová kyselina působí protizánětlivě inhibicí uvolňování arachidonové kyseliny z fibroblastů, potlačením aktivity leukocytů a snížením koncentrace prostaglandinů, oxidu dusnatého, fibronektinu a cyklického adenosinmonofosfátu (cAMP) v synovii [30]. V preklinických modelech HA tzv. up reguluje množství genů, řada z nich je spojena se signalizací prostřednictvím TGF β1 (transforming growth factor beta 1) [3]. Patrně nejprozkoumanějším receptorem v signalizaci HA je CD44, který zprostředkovává komunikaci mezi buňkami a extracelulární matrix [2]. Již delší dobu je známo, že HA snižuje množství produkovaných prozánětlivých mediátorů a matricových metaloproteináz [10].
Existují však rozdíly v účinku mezi formami HA. Hyaluronová kyselina může mít různou molekulovou hmotnost; bývá klasifikována jako HA s nízkou molekulovou hmotností (500–1 200 kDa), střední (2 400–3 600 kDa) nebo vysokou molekulovou hmotností (zhruba 6 000 kDa nebo více) [31]. Kyselina hyaluronová s molekulovou hmotností vyšší než 1 200 kDa inhibuje aktivaci transkripčního faktoru NF κB a cytokiny regulované NF κB, interleukin 1α, interleukin 6 a tumor nekrotizující faktor alfa (TNFα) [4], a celkově tedy inhibuje angiogenezi a proliferaci [32]. Působí spíše imunosupresivně prostřednictvím 1) aktivace toll like receptorů, 2) vazbou na již zmíněný receptor CD44 na buněčném povrchu a 3) stimulací FoxP3 + CD25 + regulačních T lymfocytů [2]. Dalším důkazem protizánětlivého účinku je preklinická studie s lidskými makrofágy, ve které HA potlačila indukci cyklooxygenázy 2 (COX-2) navozenou podáním LPS (bakteriální lipopolysacharid), což mělo za následek snížení tvorby prostaglandinu PGE2. Tento efekt byl potlačen při podání anti CD44 protilátky, což je v souladu s jinými studiemi, které odkazují na tento mechanismus účinku HA [27,33]. Hyaluronová kyselina zvyšuje expresi povrchových signálních molekul, jako jsou syndecan 4, α7 integrin, stejně jako expresi složek matrix (kolagenu II i kolagenu XI) [3]; stimuluje rovněž proliferaci a migraci chondrocytů, které ovlivňuje prostřednictvím povrchových receptorů CD44 [34].
Analgetické působení
Analgetický účinek HA je dán inhibicí nociceptorů, inhibicí syntézy bradykininu a potlačením signalizace prostřednictvím substance P [30]. Hyaluronová kyselina vykázala antinociceptivní působení v několika preklinických modelech, stejně jako v randomizovaných klinických hodnoceních [25, 35]. V preklinickém modelu využívajícím intraartikulární jednostranné podání bradykininu + PGE2 dokázala HA snížit vnímání bolestivého podnětu přibližně o 50 % (placebo bráno jako nulové potlačení bolesti) [25]. Podobně dopadlo hodnocení HA i v jiném preklinickém modelu (králík) [26]. Hyaluronová kyselina také dokázala snížit hypersenzitivitu po mechanickém a termickém dráždění v modelu monojodoacetátem indukované OA u potkana [29].
Farmakokinetické vlastnosti
Farmakokinetika HA po intraartikulárním
podání je určující pro účinek při OA. Rychlost eliminace však
velmi závisí na formě HA a jsou tu jednak rozdíly mezi
vysokomolekulární a nízkomolekulární HA, ale také mezi
přípravky s různým způsobem stabilizace. Zatímco
nízkomolekulární HA (90 kDa)
má v experimentálních modelech eliminační poločas z kloubu
okolo 10 hodin, vysokomolekulární HA (6 000 kDa) má
ve stejných podmínkách eliminační poločas o tři
hodiny delší [36]. Eliminační poločas
se tedy zdá být závislým na molekulové hmotnosti [36].
Podobně se ukazuje, že HA stabilizovaná, ať už příčnými
vazbami, nebo nekovalentním způsobem, má delší rezidenční čas
v kloubu [37], který v případě
přípravku Durolane může dosáhnout až 28 dní [16],
což je obrovský rozdíl oproti několika hodinám
u nízkomolekulární HA [36] (graf 1).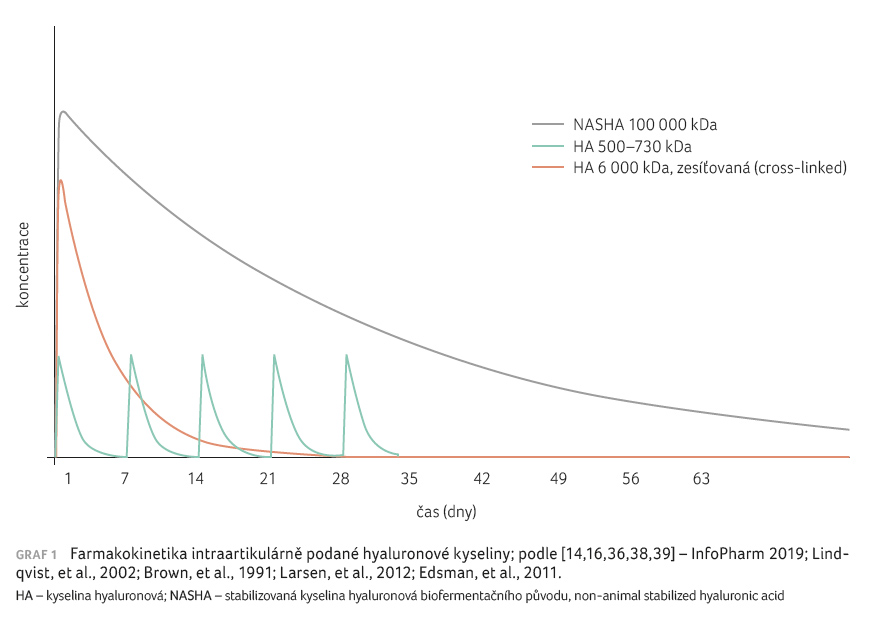
Klinické zkušenosti
Na téma viskosuplementace HA při OA bylo publikováno téměř 30 metaanalýz, často s rozporuplnými závěry. Už v roce 2006 bylo publikováno review, které srovnávalo 19 různých přípravků s HA, resp. s hyaluronátem sodným. Celkem bylo hodnoceno 76 klinických zkoušení, počet pacientů se pohyboval od 12 po 495, a přes tuto značnou heterogenitu se prokázala účinnost HA v parametrech snížení bolesti, zlepšení hybnosti a celkové subjektivní hodnocení, a to 5–13 týdnů po aplikaci. Review také poukázalo na srovnatelnou účinnost s nesteroidními antiflogistiky. Přímých srovnání HA a nesteroidních antiflogistik však bylo zatím provedeno příliš málo na to, aby bylo možné tato nepřímá srovnání potvrdit [30]. Recentní review přinášející závěry randomizovaných klinických studií a metaanalýz shrnuje, že účinnost HA u OA kolenního kloubu se prokázala ve 13 ze 17 metaanalýz, dvě ukázaly jen nevýrazný efekt a dvě byly negativní [21].
Hyaluronová kyselina se ukazuje jako lepší než injekce glukokortikoidů v perspektivě dlouhodobého účinku [40]; krátkodobá (1 měsíc) účinnost je v zásadě podobná jako u glukokortikoidů [40,41]. Ve srovnání s intraartikulárním podáním glukokortikoidů poskytuje opakovaná aplikace HA vyšší pravděpodobnost dlouhodobého zmírnění bolesti (i více než 12 týdnů), a to při výrazně lepším bezpečnostním profilu [13,17].
Odborná společnost Osteoarthritis Research Society International (OARSI) doporučuje intraartikulární injekce HA při OA kolenního kloubu (síla doporučení 1b/2) hned za nesteroidními antiflogistiky [17]. Doporučení se týká především pacientů s rizikem nežádoucích účinků na gastrointestinální trakt a kardiovaskulární systém.
Na rozdíl od OA kolene nepanuje konsenzus v názoru na používání HA při OA kyčelního kloubu. Doporučení OARSI je zde vysloveně proti aplikaci HA z důvodu nedostatečně prokázaného efektu u OA kyčelního kloubu při současně bolestivé aplikaci. Na druhou stranu OARSI přiznává, že oproti intraartikulárnímu podání kortikoidů vykazuje HA opožděný nástup účinku, avšak výraznější finální symptomatickou úlevu [5].
Podobně nedoporučuje HA u OA ani American Academy of Orthopaedic Surgeons (AAOS) z důvodu nedostatečné evidence účinnosti [19]. American College of Rheumatology nemá ohledně aplikace HA u OA kyčelního kloubu žádné doporučení [5].
Je také třeba zmínit, že doporučení odborných společností jsou zpravidla publikována s určitou latencí za současným stavem poznání (doba nutná pro sběr informací, zpracování a projednání doporučeného postupu).
Faktory ovlivňující účinek
S ohledem na mnohdy konfliktní závěry studií by bylo dobré vymezit tzv. confounding factors, tedy vliv kovariát léčebné odpovědi při terapii OA přípravky s HA. Logickým faktorem je dávka a typ terapie, resp. počet cyklů/injekcí. Často diskutovaným je také zejména původ HA (animální/biofermentační), dalším faktorem je molekulová hmotnost, jejíž vliv je částečně diskutován v odstavci „Zvláštnosti jednotlivých farmaceutických forem“, dále pak modifikace struktury. Právě modifikace struktury je velkou neznámou, protože se jedná téměř vždy o patentované postupy, jejichž detaily nejsou pokaždé veřejně známy. Tyto procesy mají zabezpečit zesíťování, a tedy delší účinek vlivem pomalejší eliminace a lepší fyzikálně-chemické vlastnosti. Podstatným, přitom neovlivnitelným faktorem je preference pacienta a dále technika aplikace injekce. Dalším faktorem, který nebývá často diskutován, je, že i samotná artrocentéza je při OA účinná, a proto by na kontrolní skupinu léčenou placebem mohlo být nahlíženo jako na „aktivní kontrolu“, a nikoliv jako na čisté placebo [42,43]. Tím pádem může být obtížné prokázat signifikantní účinek.
Signifikance je dalším problémem metaanalýz – recentní doporučení odborných společností jsou založena nikoliv na prostém hodnocení signifikantního zmírnění bolestivosti a zlepšení hybnosti (subjektivní hodnocení, škálování), ale na tzv. minimálním klinicky důležitém rozdílu (minimally clinically important difference, MCID); ten je definován jako minimální změna sledovaného parametru, kterou by pacient vnímal jako důležitou (ve smyslu přínosu i zhoršení), která by vedla ke změně léčby. Pokud bylo použito k hodnocení efektu MCID (velikost efektu arbitrárně stanovena na –0,37), ukázalo se, že HA sice signifikantně, avšak klinicky nevýznamně ovlivňuje bolest. Pokud byly stejnou metodikou analyzovány podskupiny léčené vysokomolekulární HA a HA upravenou zesíťováním, pak bylo dosaženo signifikantního a zároveň klinicky významného zlepšení [30,44]. Podobně dopadla i novější analýza 19 randomizovaných klinických studií z roku 2015 [45], kde s použitím MCID pro hodnocení efektu jen čistě u zaslepených, dvojitě zaslepených studií neprokázala HA přínos; prospěch se opět prokázal při použití zesíťované HA, popř. při delším sledování (follow up) [45].
Opakovaně se ukazuje, že mezi formami HA jsou podstatné rozdíly v účinnosti – lepší vlastnosti prokazuje vysokomolekulární HA biofermentačního původu [46]. Podobné výsledky prezentuje i jedna z nejnovějších studií, která srovnává vysokomolekulární, stabilizovanou HA biofermentačního původu (NASHA) s ostatními typy léčby (placebo, resp. fyziologický roztok, plazma obohacená růstovými faktory, metylprednisolon acetát, nízkomolekulární HA) [47].
Kontraindikace
Kontraindikace intraartikulárního podání HA představují hypersenzitivita na léčivou látku nebo na pomocné látky přípravku, infekce nebo kožní onemocnění v oblasti aplikace.
Nežádoucí účinky a bezpečnost
Obecně je intraartikulární HA dobře tolerována, výskyt nežádoucích účinků se pohybuje od 0 do 13 %, což je srovnatelné s placebem [10,48]. Nežádoucí účinky jsou spíše dány způsobem a technikou aplikace. Například ve studii Altmanna a kol. dosahoval u 347 subjektů výskyt nežádoucích účinků souvisejících s léčbou 12,7 % ve skupině léčené NASHA (celkem 22 ze 174 pacientů) a 8,0 % v placebové skupině (15 ze 173 pacientů) [49].
Většina nežádoucích účinků je přitom mírná a zahrnuje bolest v místě aplikace (1–33 %), lokální bolestivost a otok (< 1–30 %), lokální podráždění kůže v místě aplikace (3–21 %). Vzácněji se objevují vážnější nežádoucí účinky, jedním z nich je pseudoseptická reakce charakterizovaná zánětem a otokem; vyskytuje se po senzibilizaci (2. nebo 3. dávka) [6].
Původ HA má pravděpodobně vliv na rozvoj imunologické odpovědi po její aplikaci. Hyaluronová kyselina non animálního původu je v tomto smyslu lépe tolerována než HA izolovaná ze zvířecích zdrojů, která je následně upravena chemicky pro zvýšení molekulové hmotnosti [50].
V literatuře se také objevují zmínky o horším bezpečnostním profilu HA s vyšší molekulovou hmotností [6]. V rozporu s tím však metaanalýza z roku 2016 prokázala jak lepší bezpečnost, tak i lepší účinnost u produktů s molekulovou hmotností nad 3 000 kDa [51]. Zde však může také hrát roli další způsob modifikace – zesíťování struktury HA. V jedné studii [52] se ukázalo, že zesíťovaná HA o molekulové hmotnosti 10 000 kDa má sice lepší účinnost v porovnání s vysokomolekulární (lineární, nestabilizovanou) HA, lineární HA (s molekulovou hmotností 3 000 kDa) je však, co se týče celkového počtu nežádoucích účinků, bezpečnější [52]. V tomto světle se jeví, že i způsob stabilizace s cílem prodloužit efektivní rezidenční poločas HA v kloubu může hrát roli v bezpečnosti léčby.
Těhotenství a kojení
Intraartikulární přípravky s HA nebyly zkoušeny u těhotných nebo kojících žen. Informace z preklinických testů na březích samicích nenaznačují přímé ani nepřímé škodlivé účinky na embryonální/fetální vývoj, porod nebo postnatální vývoj. Obecně se podání během těhotenství a kojení spíše nedoporučuje [5,14].
Zvláštnosti jednotlivých farmaceutických forem
Na trhu je v současné době množství přípravků jak s HA, tak s jejími solemi, nejčastěji s hyaluronátem sodným, vzácně pak draselným nebo vápenatým. Ve světle novějších studií se jeví, že mezi přípravky existují výrazné rozdíly ve farmakokinetice, účinnosti i bezpečnosti v závislosti na původu, molekulové hmotnosti, a právě způsobu modifikace.
Hyaluronová kyselina může být v zásadě dvojího původu, a sice zvířecího, např. izolovaná z kohoutích hřebínků (kdy se získá HA o molekulové hmotnosti 1,2 mil. Da), popř. z jiných zvířat (prasata, hovězí dobytek), nebo biofermentačního původu, kdy je HA produkována modifikovanými mikroorganismy [2,5,25].
Hyaluronová kyselina také může být modifikována vytvořením příčných vazeb, tzv. zesíťováním (cross link), které mají za cíl zlepšit mechanické (viskozita, rozpustnost) a biologické vlastnosti (odtud tzv. NASHA). Míra zesíťování, resp. procento příčných vazeb může ovlivnit nejen rychlost degradace, ale i jiné biologické vlastnosti, avšak bohužel ne vždy zcela pozitivně [52]. Ke vzniku intramolekulárních příčných vazeb dochází především na hydroxylových, karboxylových a acetamidových skupinách polymeru HA, nicméně způsobů modifikace struktury HA je více, včetně modifikace fyzikálními způsoby [23].
Hyaluronová kyselina s nízkou a střední molekulovou hmotností má lepší vazebné schopnosti a lepší schopnost stimulace produkce endogenní HA [31]; také stimuluje genovou expresi v makrofázích, endoteliálních buňkách, eozinofilech nebo epiteliálních buňkách [1].
Hyaluronová kyselina s vyšší
molekulovou hmotností má zase lepší vlastnosti stran obnovení
viskoelastických vlastností synoviální tekutiny [53].
Přípravek Durolane obsahuje NASHA, která je ovšem stabilizována
minimem chemických kovalentních příčných vazeb (zhruba 1 %),
zato ale je patentovanou technologií dále modifikována
„zapletením“ dlouhých řetězců HA, čímž je dosaženo
extrémně vysoké molekulové hmotnosti [54].
Tato forma dosahuje výrazně lepších parametrů viskoelasticity,
které jsou (měřeno in vitro)
dokonce o jeden až dva řády lepší než u HA
s molekulovou hmotností 6 000 kDa (graf 2A, B) [54].
Zvýšená molekulová hmotnost a stabilizace také stojí
za prodloužením eliminačního poločasu z kloubu až
na 28 dní [16], což je skutečně
podstatný rozdíl oproti několika hodinám, resp. desítkám hodin
u nízkomolekulární nestabilizované HA [38],
HA o molekulové hmotnosti 6 000 kDa [36]
nebo stabilizované jen chemickou modifikací [54].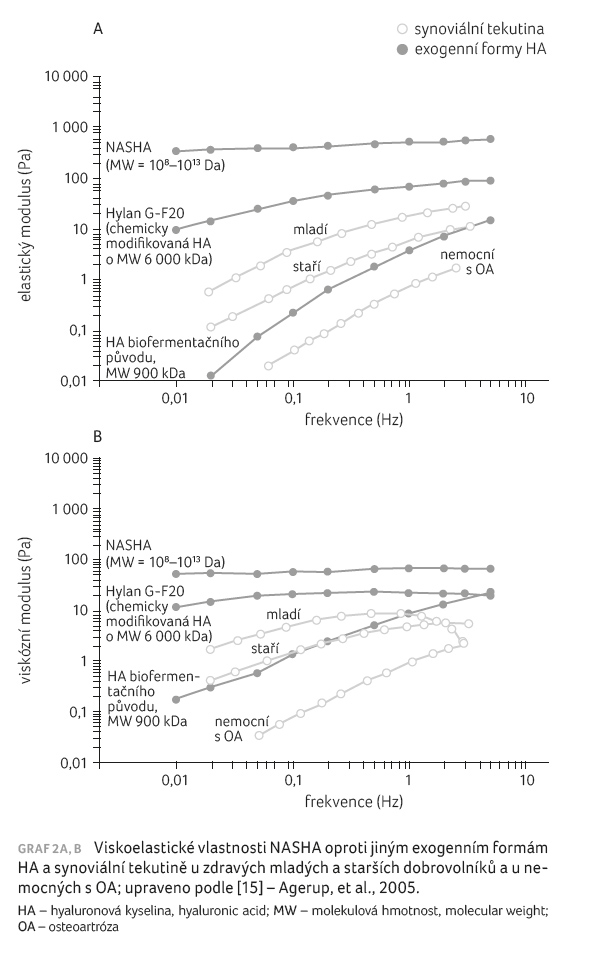
Závěr
Intraartikulární podání HA je všeobecně dobře tolerováno, nicméně mezi přípravky jsou, pokud jde o bezpečnost (četnost a závažnost nežádoucích účinků), signifikantní rozdíly. Lépe je tolerována HA nízkomolekulární než vysokomolekulární, lépe nezesíťovaná, resp. stabilizovaná nechemickou cestou než zesíťovaná chemicky [50,52]. Jako účinnější se naopak jeví formy vysokomolekulární HA (ve srovnání s nízkomolekulárními), biofermentačního původu (ve srovnání s HA zvířecího původu) a také stabilizované formy, které mají delší eliminační poločas. Intraartikulární HA může být účinnou a bezpečnou léčbou u OA kolenního kloubu, zcela jistě rovnocennou nebo lepší v porovnání s intraartikulárním podáním glukokortikoidů [55]. Zdravotnický prostředek Durolane je jako jediný ve své kategorii určen k terapii OA nejen kolenního a kyčelního kloubu, ale je navíc schválen pro symptomatickou léčbu osteoartritické bolesti menších kloubů – ramene, kotníku, lokte, zápěstí a prstů na rukou i nohou. Oproti jiným formám HA má NASHA výrazně delší eliminační poločas a lepší viskoelastické vlastnosti, a tím pádem i výrazně dlouhodobější efekt.
Seznam použité literatury
- [1] Necas J, Bartosikova L, Brauner P, Kolar J. Hyaluronic acid (hyaluronan): a review. Veterinarni Medicina 2008; 53: 397–411.
- [2] Kudva AK, Patterson J. Hyaluronic acid Incorporation into Scaffolds for Bone and Cartilage Regeneration. In: Hyaluronic acid for biomedical and pharmaceutical applications. Edited by Collins MN. Shawbury, Shrewsbury, Shropshire, United Kingdom: Smithers Rapra; 2014.
- [3] Responte D, Natoli R, Athanasiou K. Identification of potential biophysical and molecular signalling mechanisms underlying hyaluronic acid enhancement of cartilage formation. J R Soc Interface 2012; 9: 3564–3573.
- [4] Neumann A, Schinzel R, Palm D, et al. High molecular weight hyaluronic acid inhibits advanced glycation endproduct‑induced NF‑kappa B activation and cytokine expression. Febs Letters 1999; 453: 283–287.
- [5] DynaMed [Internet]. Ipswich (MA): EBSCO Information Services. 1995 – 2018 [cited 2019 May 15]. Available from http://www.dynamed.com
- [6] Hunter D. Viscosupplementation for Osteoarthritis of the Knee. N Engl J Med 2015; 372: 1040–1047.
- [7] Balazs E, Watson D, Duff I, Roseman S. Hyaluronic avid in synovial fluid. I. Molecular Parameters of hyaluronic acid in normal and arthritic human fluids. Arthritis Rheum 1967; 10: 357−376.
- [8] Balazs E, Denlinger J. Viscosupplementation – A new concept in the treatment of osteoarthritis. J Rheumatol 1993, 20: 3−9.
- [9] Strauss E, Hart J, Miller M, et al. Hyaluronic Acid Viscosupplementation and Osteoarthritis: Current Uses and Future Directions. Am J Sports Med 2009; 37: 1636–1644.
- [10] Moreland L. Intra‑articular hyaluronan (hyaluronic acid) and hylans for the treatment of osteoarthritis: mechanisms of action. Arthritis Res Ther 2003; 5: 54−67.
- [11] Yoshioka M, Shimizu C, Harwood F, et al. The effects of hyaluronan during the development of osteoarthritis. Osteoarthritis Cartilage 1997; 5: 251−260.
- [12] Schiavinato A, Lini E, Guidolin D, et al. Intraarticular sodium hyaluronate injections in the Pond‑Nuki experimental al‑model off osteoarthritis in dogs. II. Morphological findings. Clin Orthop Relat Res 1989: 286−299.
- [13] Kompel AJ, Roemer FW, Murakami AM, et al. Intra‑articular Corticosteroid Injections in the Hip and Knee: Perhaps Not as Safe as We Thought? Radiology 2019: 190341.
- [14] InfoPharm: AISLP. In.; 2019.
- [15] Agerup B, Berg P, Akermark C. Non‑animal stabilized hyaluronic acid: a new formulation for the treatment of osteoarthritis. BioDrugs 2005; 19: 23−30.
- [16] Lindqvist U, Tolmachev V, Kairemo K, et al. Elimination of stabilised hyaluronan from the knee joint in healthy men. Clin Pharmacokinet 2002; 41: 603−613.
- [17] Bannuru RR, Osani MC, Vaysbrot EE, et al. OARSI guidelines for the non‑surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthritis Cartilage 2019; 27: 1578–1589.
- [18] Carlson VR, Ong AC, Orozco FR, et a. Compliance With the AAOS Guidelines for Treatment of Osteoarthritis of the Knee: A Survey of the American Association of Hip and Knee Surgeons. J Am Acad Orthop Surg 2018; 26: 103–107.
- [19] Lu Z, MacDermid J. Appraisal of Clinical Practice Guideline: American Academy of Orthopaedic Surgeons Clinical Practice Guideline on the Management of Osteoarthritis of the Hip. J Physiother 2018; 64: 199–199.
- [20] Scott J, Checketts JX, Horn JG, et al. Knee osteoarthritis and current research for evidence‑are we on the right way? Int Orthop 2018; 42: 2105–2112.
- [21] Maheu E, Bannuru RR, Herrero‑Beaumont G, et al. Why we should definitely include intra‑articular hyaluronic acid as a therapeutic option in the management of knee osteoarthritis: Results of an extensive critical literature review. Semin Arthritis Rheum 2019; 48: 563–572.
- [22] Hameed F, Ihm J. Injectable Medications for Osteoarthritis. PM R 2012; 4: S75−S81.
- [23] Khunmanee S, Jeong Y, Park H. Crosslinking method of hyaluronic‑based hydrogel for biomedical applications. J Tissue Eng 2017, 8: doi: 10.1177/2041731417726464.
- [24] Mero A, Campisi M. Hyaluronic Acid Bioconjugates for the Delivery of Bioactive Molecules. Polymers 2014; 6: 346−369.
- [25] Boettger M, Kummel D, Harrison A, Schaible H. Evaluation of long‑term antinociceptive properties of stabilized hyaluronic acid preparation (NASHA) in an animal model of repetitive joint pain. Arthritis Res Ther 2011; 13: R110.
- [26] Hashizume M, Koike N, Yoshida H, et al. High molecular weight hyaluronic acid relieved joint pain and prevented the progression of cartilage degeneration in a rabbit osteoarthritis model after onset of arthritis. Mod Rheumatol 2010; 20: 432−443.
- [27] Nicholls MA, Fierlinger A, Niazi F, Bhandari M. The Disease‑Modifying Effects of Hyaluronan in the Osteoarthritic Disease State. Clin Med Insights Arthritis Musculoskelet Disord 2017; 10:1179544117723611.
- [28] Dahl LB, Dahl IM, Engström‑Laurent A, Granath K. Concentration and molecular weight of sodium hyaluronate in synovial fluid from patients with rheumatoid arthritis and other arthropathies. Ann Rheum Dis 1985; 44: 817−822.
- [29] Jimbo S, Terashima Y, Teramoto A, et al. Antinociceptive effects of hyaluronic acid on monoiodoacetate‑induced ankle osteoarthritis in rats. J Pain Res 2019; 12: 191−200.
- [30] Johal H, Devji T, Schemitsch EH, Bhandari M. Viscosupplementation in Knee Osteoarthritis: Evidence Revisited. JBJS Rev 2016; 4: e11−e111.
- [31] Shewale AR, Barnes CL, Fischbach LA, et al. Comparison of Low‑, Moderate‑, and High‑Molecular‑Weight Hyaluronic Acid Injections in Delaying Time to Knee Surgery. J Arthroplasty 2017; 32: 2952−2957.e2921.
- [32] Slevin M, Krupinski J, Gaffney J, et al. Hyaluronan‑mediated angiogenesis in vascular disease: Uncovering RHAMM and CD44 receptor signaling pathways. Matrix Biol 2007; 26: 58−68.
- [33] Yasuda T. Hyaluronan inhibits prostaglandin E2 production via CD44 in U937 human macrophages. Tohoku J Exp Med 2010; 220: 229−235.
- [34] Bhosale AM, Richardson JB. Articular cartilage: structure, injuries and review of management. Br Med Bull 2008; 87: 77−95.
- [35] Tran K, Loshak H. Intra‑Articular Hyaluronic Acid for Viscosupplementation in Osteoarthritis of the Hand, Shoulder, and Temporomandibular Joint: A Review of Clinical Effectiveness and Safety. In.; 2019.
- [36] Brown TJ, Laurent UB, Fraser JR. Turnover of hyaluronan in synovial joints: elimination of labelled hyaluronan from the knee joint of the rabbit. Exp Physiol 1991; 76: 125−134.
- [37] Jackson DW, Simon TM. Intra‑articular distribution and residence time of Hylan A and B: a study in the goat knee. Osteoarthritis Cartilage 2006; 14: 1248−1257.
- [38] Larsen N, Dursema H, Pollak C, Skrabut E. Clearance kinetics of a hylan‑based viscosupplement after intra‑articular and intravenous administration in animal models. J Biomed Mater Res B Appl Biomater 2012; 100B: 457−462.
- [39] Edsman K, Hjelm R, Larkner H, et al. Intra‑articular Duration of Durolane (TM) after Single Injection into the Rabbit Knee. Cartilage 2011; 2: 384−388.
- [40] Leighton R, Akermark C, Therrien R, et al. NASHA hyaluronic acid vs. methylprednisolone for knee osteoarthritis: a prospective, multi‑centre, randomized, non‑inferiority trial. Osteoarthritis Cartilage 2014; 22: 17−25.
- [41] Kaulback K, Jones S, Wells C, Felipe E. Viscosupplementation for Knee Osteoarthritis: A Review of Clinical and Cost‑Effectiveness and Guidelines. In.; 2017.
- [42] Gurung T, Singh RK, Mohammad S, et al. Efficacy of arthrocentesis versus arthrocentesis with sodium hyaluronic acid in temporomandibular joint osteoarthritis: A comparison. Natl J Maxillofac Surg 2017; 8: 41−49.
- [43] Schumacher HR. Aspiration and injection therapies for joints. Arthritis Rheum 2003; 49: 413−420.
- [44] Rutjes AW, Jüni P, da Costa BR, et al. Viscosupplementation for osteoarthritis of the knee: a systematic review and meta‑analysis. Ann Intern Med 2012; 157: 180−191.
- [45] Jevsevar D, Donnelly P, Brown GA, Cummins DS. Viscosupplementation for Osteoarthritis of the Knee: A Systematic Review of the Evidence. J Bone Joint Surg Am 2015; 97: 2047−2060.
- [46] Estades‑Rubio FJ, Reyes‑Martín A, Morales‑Marcos V, et al. Knee Viscosupplementation: Cost‑Effectiveness Analysis between Stabilized Hyaluronic Acid in a Single Injection versus Five Injections of Standard Hyaluronic Acid. Int J Mol Sci 2017; 18: E658.
- [47] Leighton R, Fitzpatrick J, Smith H, et al. Systematic clinical evidence review of NASHA (Durolane hyaluronic acid) for the treatment of knee osteoarthritis. Open Access Rheumatol 2018, 10: 43−54.
- [48] Altman R, Hackel J, Niazi F, et al. Efficacy and safety of repeated courses of hyaluronic acid injections for knee osteoarthritis: A systematic review. Semin Arthritis Rheum 2018; 48: 168−175.
- [49] Altman RD, Akermark C, Beaulieu AD, et al. Efficacy and safety of a single intra‑articular injection of non‑animal stabilized hyaluronic acid (NASHA) in patients with osteoarthritis of the knee. Osteoarthritis Cartilage 2004; 12: 642−649.
- [50] Kirchner M, Marshall D. A double‑blind randomized controlled trial comparing alternate forms of high molecular weight hyaluronan for the treatment of osteoarthritis of the knee. Osteoarthritis Cartilage 2006; 14: 154−162.
- [51] Altman RD, Bedi A, Karlsson J, et al. Product Differences in Intra‑articular Hyaluronic Acids for Osteoarthritis of the Knee. Am J Sports Med 2016; 44: 2158−2165.
- [52] Ha C, Park Y, Choi C, et al. Efficacy and safety of single injection of cross‑linked sodium hyaluronate vs. three injections of high molecular weight sodium hyaluronate for osteoarthritis of the knee: a double‑blind, randomized, multi‑center, non‑inferiority study. BMC Musculoskelet Disord 2017, 18: 223.
- [53] Gupta RC, Lall R, Srivastava A, Sinha A. Hyaluronic Acid: Molecular Mechanisms and Therapeutic Trajectory. Front Vet Sci 2019, 6: 192.
- [54] Lindenhayn K, Heilmann HH, Niederhausen T, et al. Elimination of tritium‑labelled hyaluronic acid from normal and osteoarthritic rabbit knee joints. Eur J Clin Chem Clin Biochem 1997; 35: 355−363.
- [55] Liu Y, Wu J, Fei W, et al. Is There a Difference in Intra‑Articular Injections of Corticosteroids, Hyaluronate, or Placebo for Temporomandibular Osteoarthritis? J Oral Maxillofac Surg 2018; 76: 504−514.