Sulodexid
Sulodexid je sulfonovaný glykosaminoglykan s antitrombotickým účinkem. Skládá se ze dvou složek – středněmolekulárního heparinu a dermatan-sulfátu. Podobně jako heparin a z něj odvozené látky patří sulodexid mezi léčiva užívaná k ovlivnění krevní srážlivosti. Snižuje tvorbu trombů a podporuje přirozenou fibrinolytickou aktivitu organismu. Nověji je popisováno i komplexní působení na metabolismus lipidů, ovlivnění endotelií a také bazální glomerulární membrány v ledvinách. Účinkem na hladinu fibrinogenu a protidestičkovým působením též snižuje viskozitu krve a zlepšuje perfuzi některých tkání. Sulodexid nachází uplatnění především v případech, kdy není plná antikoagulační léčba vyžadována, nebo tam, kde není takováto léčba bezpečná. Díky svému příznivému bezpečnostnímu profilu při silném antitrombotickém účinku se hodí jako náhrada kumarinových derivátů u pacientů, pro něž je léčba těmito látkami příliš riziková. Sulodexid je u nás dostupný ve formě jak injekční, tak v tabletách, chronická perorální léčba navazuje na 10–30denní intravenózní podávání sulodexidu, případně na léčbu jinými antikoagulancii (heparin, nízkomolekulární hepariny). Léčba sulodexidem nevyžaduje pravidelné kontroly koagulace, ovlivňuje tedy o něco méně kvalitu života pacienta a má potenciál představovat ve svém důsledku i menší ekonomickou zátěž pro zdravotní systém.
Farmakologická skupina
Antitrombotikum, antisklerotikum, endotelprotektivum.
Chemické a fyzikální vlastnosti
Sulodexid patří chemicky mezi sulfonované glykosaminoglykany (GAG). Glykosaminoglykany se skládají z disacharidových podjednotek, které obsahují uronové kyseliny (glukuronovou, příp. iduronovou kyselinu). Vlastnosti GAG jsou určeny karboxylovými a sulfátovými skupinami. GAG obsahují negativní náboj, patří tedy mezi anionické polyelektrolyty.
Sulodexid je přírodní směs látek získávaná ze střevní mukózy vepřů enzymatickou hydrolýzou. Obsahuje 80 % středněmolekulárního heparinu a 20 % dermatanové složky. Středněmolekulární heparin obsahuje v porovnání s nefrakcionovaným heparinem stejné dimerické složky, ale má menší míru sulfatace a jeho polysacharidový řetězec je kratší. Jeho molekulová hmotnost je nižší, pohybuje se v rozmezí 6000 až 8000 daltonů. Dermatan obsahuje místo glukosaminu galaktosamin a liší se i počtem 1 3 vazeb mezi disacharidy řetězce.
Průměrná celková molekulární hmotnost sulodexidu se pohybuje okolo 8000 daltonů [1]. Elektroforeticky rychle pohyblivá heparinová frakce je charakterizována střední molekulovou hmotností 7000 daltonů. Dermatansulfát je polydisperzní polysacharid střední molekulové hmotnosti 25 000 daltonů. Elektroforeticky rychle pohyblivá heparinová frakce má afinitu k antitrombinu III, dermatansulfát má afinitu k heparinovému kofaktoru II.
Mechanismus účinku, farmakodynamika
Mechanismus účinku
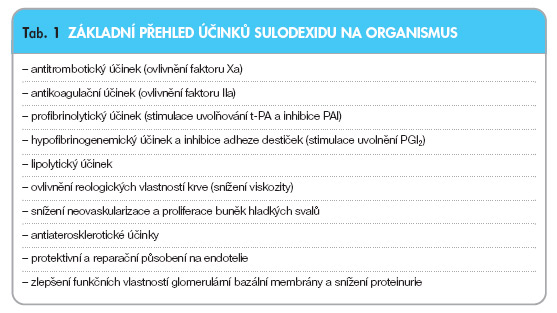
Sulodexid má komplexní mechanismus působení, který není dodnes na některých úrovních přesně popsán. Základní přehled účinků sulodexidu je uveden v tab. 1.
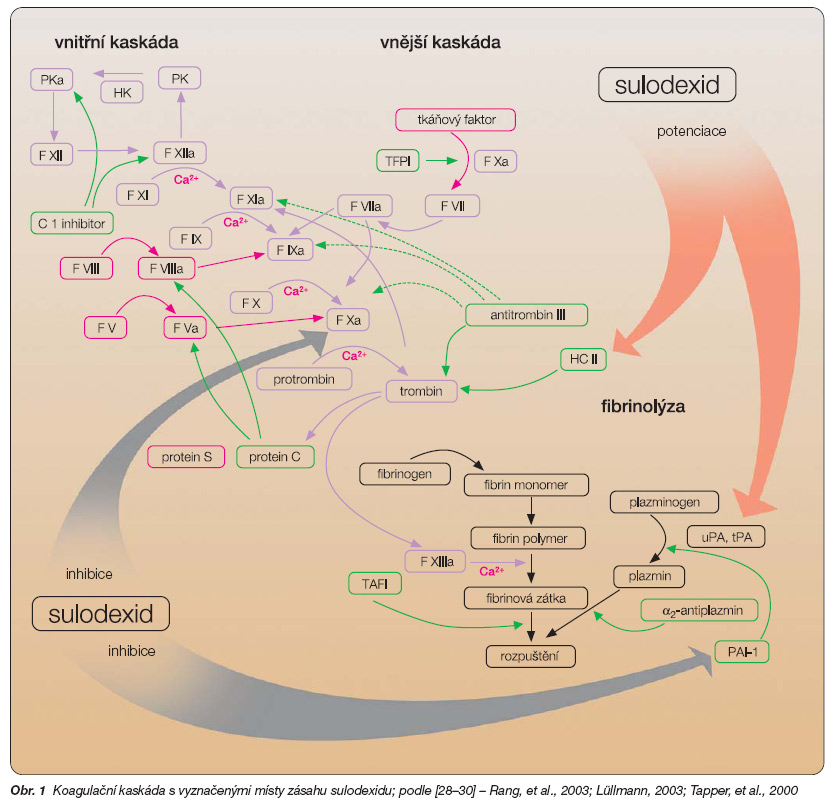
Směs heparinu a dermatanu vede k inhibici aktivovaného faktoru X (faktor Xa) – děje se tak prostřednictvím potenciace inhibičního účinku antitrombinu III (AT III), inhibitoru sérových proteáz. To vede ke snížení pohotovosti ke srážení krve v plazmatickém systému, dojde však i k zábraně narůstání trombu a k ovlivnění primární hemostázy. Heparinová složka dále ovlivňuje uvolňování tkáňového aktivátoru plazminogenu (t-PA) a snižuje aktivitu inhibitoru aktivátoru plazminogenu (PAI) tvořeného převážně v endoteliálních buňkách.
Dermatan vede především k ovlivnění uvolňování prostacyklinu (PGI2) a vazbou na heparin kofaktor II (HC II) podněcuje inhibici trombinu. Navíc pravděpodobně stimuluje fibrinolytické mechanismy podobně jako heparinová složka, tedy zvýšením uvolňování t-PA a inhibicí PAI (obr. 1).
Hypofibrinogenemické účinky sulodexidu (snížení hladiny fibrinogenu) souvisejí pravděpodobně s jeho profibrinolytickým působením a uplatňují se zřejmě pouze při patologicky zvýšených hladinách fibrinogenu [2].
Aktivace lipoproteinové lipázy je zodpovědná za lipolytické účinky sulodexidu, které jsou zřejmě hlavním mechanismem snížení krevní viskozity. Kromě tohoto lipolytického účinku se na ovlivnění viskozity podílí zřejmě i působení hypofibrinogenemické. V posledních letech se do popředí dostává působení sulodexidu na cévní endotelie, kde sulodexid působí protektivně a reparačně, snižuje adhezi trombocytů a leukocytů na cévní stěnu, zvyšuje tvorbu a sekreci tkáňového aktivátoru plazminogenu a působí inhibičně na uvolňování růstových faktorů. Komplexním účinkem vede k stimulaci přirozených antitrombotických vlastností endotelu.
Tento modulační účinek na funkce různých buněčných typů ovlivňuje složení a syntézu extracelulární matrix nezávisle na antitrombotickém a antikoagulačním působení [3, 4].
V dané souvislosti je účinek sulodexidu zkoumán s ohledem na možný pozitivní vliv na glomerulární bazální membránu (GBM) u pacientů s albuminurií, zejména při diabetické nefropatii. Je popsáno, že GAG mají schopnost snižovat albuminurii mimo jiné ovlivněním nábojové selektivity glomerulární membrány [5].
Kromě účinku na glomerulární membránu a ovlivnění její permeability vedou popsané účinky sulodexidu též obecně ke zlepšení funkce cévní výstelky u mikroangiopatie, například u retinopatie jako komplikace diabetes mellitus [6].
Farmakodynamické vlastnosti
GAG patří mezi přírodní látky tvořené endoteliemi a uvolňované do oběhu. Ovlivňují procesy krevního srážení, metabolismus lipidů, metabolismus cévních endotelií, inhibují též enzymy nukleotidového metabolismu.
Farmakodynamické účinky sulodexidu jsou komplexní, jak vyplývá z výše popsaných mechanismů působení. Účinek na krevní srážlivost je zřejmě prostudován nejlépe. Sulodexid má přibližně čtyřikrát výraznější antitrombotický účinek ve srovnání se svým účinkem antikoagulačním, neovlivňuje proto při běžném dávkování (podobně jako nízkomolekulární hepariny – LWMH) parametry běžných koagulačních testů (aPTT – aktivovaný parciální tromboplastinový čas a trombinový čas) [7] sledovaných při léčbě nefrakciovaným heparinem. K jejich ovlivnění dochází pouze při podání vysokých dávek sulodexidu, kdy se projeví i jeho aktivita proti trombinu (f IIa).
V závislosti na místě trombózy se více uplatní účinek proti trombocytům (tepenná trombóza) či účinek antitrombotický s ovlivněním koagulační kaskády (žilní trombóza) [8].
Ovlivnění uvolňování t-PA podporujícího fibrinolýzu a inhibice PAI, který ji tlumí, vede k profibrinolytickému působení sulodexidu. Povzbuzením endogenní fibrinolytické aktivity a zamezením dalšího růstu trombu tedy sulodexid posouvá rovnováhu směrem k rozpuštění trombu, a rozhoduje tak o osudu trombózy.
Komplexní účinek na metabolismus cévní stěny, včetně ovlivnění lipoproteinové lipázy, ovlivnění permeability cévní stěny, antitrombotické a hypofibrinogenemické působení sulodexidu vedou k jeho antiaterosklerotickému působení. Tomu napomáhá i tlumivý účinek na sekreci růstových hormonů, inhibice proliferace hladkých svalových buněk a neoangiogeneze [9].
Ovlivnění krevní viskozity spolu s antitrombotickým a antitrombocytárním působením též zlepšuje perfuzi tkání a může být využito například v léčbě diabetické angiopatie spojené s ischemickou chorobou dolních končetin [10].
Farmakokinetické vlastnosti
Absorpce a distribuce
Kinetika sulodexidu byla studována pomocí radioaktivně značených molekul 14C či 131I [11]. Hodnoty zjištěné u lidských dobrovolníků odpovídají datům ze studií se zvířaty. Po perorálním podání se sulodexid dobře vstřebává, biologická dostupnost dosahuje takřka 100 %. Průběh hladin je ovlivněn iniciálním hromaděním v endotelu cév, prvního vrcholu hladin je dosaženo za cca 1–2 hodiny, poté hladina klesá, aby dosáhla druhého maxima za cca 4–6 hodin. Za 12 hodin klesají hladiny k neměřitelným hodnotám, ale poté se opět zvyšují a od 24 do 48 hodin po podání zůstávají stabilní. Tohoto průběhu hladin je dosaženo proto, že se sulodexid jako přirozený GAG predilekčně ukládá v některých tkáních (ledviny, játra, endotel cév), z nichž se potom uvolňuje zpět do krevního oběhu. Dochází tedy k neustálé distribuci a vyrovnávání hladin mezi těmito kompartmenty. Při opakovaném podání sulodexidu je dosaženo steady state (ustáleného stavu) za cca 96–144 hodin.
Metabolismus a vylučování
Sulodexid je metabolizován v játrech, kde dochází k jeho biotransformaci, poté je z větší části vylučován ledvinami (asi 55 %) a žlučí (23 %). Dynamika renálního vylučování je nejvyšší v prvních 48 hodinách po podání, kdy dojde k vyloučení přibližně 40 % léčiva (za prvních 12 hodin 17,6 %, za 24–48 hodin 22 %). Mezi 48. a 96. hodinou, kdy je renální vylučování ukončeno, se vyloučí zbývajících 15 % léčiva. Biliární vylučování ustává po 48 hodinách. Průměrný čas pobytu (mean residence time) molekuly sulodexidu se uvádí v závislosti na podání 15–60 hodin (intravenózní podání) a 24–41 hodin (perorální podání). Nedochází tedy k akumulaci léčiva v organismu.
Farmakokinetické parametry sulodexidu jsou shrnuty v tab. 2.
Klinické zkušenosti
Vzhledem ke svým antitrombotickým účinkům nachází tradičně sulodexid uplatnění v léčbě a prevenci u nemocných s rizikem či projevy žilní, tepenné či kapilární trombózy [12]. Pozitivní účinek sulodexidu v sekundární prevenci tepenných trombóz je dobře prokázán. Ve studii zahrnující 2016 nemocných [13] (randomizovaná prospektivní multicentrická studie) byl sulodexid podáván pacientům 7–10 dnů po prodělaném infarktu myokardu. Po dobu 12 měsíců užívali pacienti sulodexid v běžné dávce, tedy po první měsíc 600 LSU denně intramuskulárně a poté 500 LSU dvakrát denně po dobu dalších 11 měsíců. Studie prokázala snížení rizika recidivy infarktu či intrakardiální trombózy a snížení kardiovaskulární mortality. Lze jej použít i v léčbě pacientů s intrakardiálním trombem, jak prokázala další studie [14]. Díky vlivu na viskozitu krve a mikrocirkulaci lze sulodexid využít i v neurologii u senilní vaskulární deteriorace, tranzitorních ischemických atak či u periferních tepenných obstrukcí [15].
Zkušenosti s léčbou žilní trombózy se týkají jak trombózy hluboké, tak povrchové či postflebitického syndromu [16].
Významná je aplikace sulodexidu v prevenci tromboembolických příhod u pacientů se zvýšeným rizikem (obézní pacienti, starší pacienti, imobilizace, varikózní žíly, nádorová onemocnění, metabolické poruchy či chronická zánětlivá onemocnění) či u pacientů s anamnézou takovýchto příhod. Sulodexid potom nachází místo především u takových pacientů, kde z různých důvodů nepřichází v úvahu plná heparinizace či podávání perorální antikoagulace, případně u takových pacientů, kde tyto postupy nejsou vhodné. Výhodou sulodexidu je možnost perorální aplikace a při standardním dávkování absence nutnosti kontrol koagulačních parametrů.
Užití sulodexidu v léčbě žilních vředů dolních končetin sledovala multicentrická dvojitě slepá randomizovaná placebem kontrolovaná studie zahrnující 230 pacientů. Tato studie sledovala účinnost a bezpečnost sulodexidu u pacientů s vředy na terénu chronické žilní insuficience. Za dva měsíce byla míra zhojení 35 % ve skupině sulodexidu ve srovnání s 20,9 % ve skupině placeba. Za tři měsíce se tento rozdíl dále zvýšil na 52,5 % oproti 32,7 % (p = 0,004) [17].
V otevřené studii s 50 nemocnými s okluzí retinální žíly (většinou s postižením periferních větví) byl podáván sulodexid po dobu 12 měsíců (30 dnů 600 LSU i.m. a po zbytek doby 500 LSU p.o.). Po roce užívání prokázala vyšetření vizu statisticky významné zlepšení ostrosti u 71 % nemocných [18].
V oftalmologické indikaci byl sulodexid též sledován u 64 pacientů (126 očí) ve věku 12 až 75 let (průměr 61 let) s diabetes mellitus I. typu (n = 38) a II. typu (n = 26). Velká část těchto pacientů trpěla též hypertenzí či měla anamnézu kardiovaskulárního onemocnění. Po třech měsících podávání sulodexidu došlo ke zlepšení zrakové ostrosti u 18,25 % sledovaných očí. U části těchto pacientů byl také zaznamenán pokles albuminurie. Vzhledem k tomu, že stav některých pacientů si během studie vyžádal ošetření laserem, byl sulodexid vnímán jako účinné léčivo u pacientů s nejjednodušší formou diabetické retinopatie a jako vhodné adjuvantní léčivo u pacientů vyžadujících ošetření laserem [6]. Ani jedna z uvedených oftalmologických studií bohužel nebyla zaslepená či kontrolovaná.
Efekt sulodexidu v terapii onemocnění periferních tepen byl sledován v randomizované multicentrické dvojitě slepé placebem kontrolované studii, kde byl sulodexid podáván 286 nemocným s periferní obstrukční chorobou tepen dolních končetin, stadium II dle Leriche-Fontaina. Polovina pacientů dostávala po 27 týdnů placebo, druhá polovina sulodexid (60 mg i.m. prvních 20 dnů a poté 100 mg denně p.o. rozdělených do dvou 50mg dávek). Primárním cílem bylo zdvojnásobení vzdálenosti chůze bez bolesti, toho bylo dosaženo u 23,8 % pacientů léčených sulodexidem a u 9,1 % pacientů, jimž bylo podáváno placebo (p = 0,001) [10].
Protektivní účinek na endotel cév a GBM lze využít k ovlivnění projevů diabetické nefropatie či u proteinurie u pacientů s nefrotickým syndromem. V placebem kontrolované zaslepené studii byl u 28 pacientů s DM I. typu a s albuminurií (50 % mikroalbuminurie a 50 % makroalbuminurie) sledován vliv i.m. podávaného sulodexidu v dávce 600 LSU denně na exkreci albuminu (AER). U pacientů léčených sulodexidem došlo po týdnu ke snížení AER, výrazněji a významněji u skupiny s mikroalbuminurií, tam také efekt přetrvával i na konci sledování (9 týdnů). U pacientů s hypercholesterolémií byl též při léčbě sulodexidem pozorován pokles plazmatických hladin cholesterolu a triglyceridů [19].
Rozsáhlejší studie, též placebem kontrolovaná, byla provedena s 223 pacienty s DM I. či II. typu, sérovým kreatininem do 150 mmol/l a kompenzovanou hypertenzí. Pacienti léčení sulodexidem měli oproti těm, kterým bylo podáváno placebo, statisticky významně snížené hodnoty renální exkrece albuminu, a to jak po čtyřech, tak po osmi měsících. Tohoto výsledku bylo dosaženo bez ovlivnění metabolické kompenzace či hladiny kreatininu v séru. Účinek sulodexidu byl dlouhodobý, na dávce závislý a zdá se být aditivní s účinkem inhibitorů ACE [20].
Zařazení do současné palety léčiv
Antitrombotika představují neodmyslitelnou součást léčby pacientů s tromboembolickou nemocí či pacientů ve zvýšeném riziku, brzdí rozvoj aterosklerózy. Významné místo v této skupině samozřejmě představuje nefrakcionovaný heparin a jeho nízkomolekulární deriváty (enoxaparin, dalteparin, nadroparin) a perorální antikoagulancia, u kterých se dnes prosazuje jejich podávání v nízkých preventivních dávkách, případně i v kombinaci s antiagregační léčbou [21].
Oproti těmto léčivům nabízí sulodexid snadnější aplikaci a sledování léčby. Perorální podání s dobrou absorpcí a absencí nutnosti komplikovaného a zatěžujícího sledování přispívá ke komfortu pacienta. Terapie je v běžném dávkovacím rozmezí bezpečná a v porovnání s warfarinem je méně ovlivňována dietními výkyvy či konkomitantní léčbou. Oproti samotné antiagregační léčbě např. kyselinou acetylsalicylovou (ASA) nabízí sulodexid širší mechanismus ovlivnění koagulačních a agregačních pochodů, ovlivnění krevní viskozity mechanismy souvisejícími s aktivací lipázy a příznivé působení na endotelie.
Vzhledem k jednoduchosti užívání ve srovnání s parenterální aplikací heparinů a vzhledem k bezpečnosti a komfortu při srovnání s podáváním warfarinu se sulodexid hodí jako alternativa u pacientů, kde není tato léčba vhodná. Na rozdíl od ASA se v případě sulodexidu není třeba obávat nepříznivého ovlivnění protektivních faktorů žaludeční sliznice.
Ve srovnání s warfarinem jsou náklady na léčbu sulodexidem přibližně dvojnásobné, odpadá však nutnost pravidelných kontrol a stanovování koagulačních parametrů. Studie provedená ve Španělsku [22], která srovnávala účinnost sulodexidu oproti acenokumarolu (byla srovnatelná), též uvádí výraznou úsporu finančních prostředků při léčbě sulodexidem, zejména díky eliminaci nákladných pravidelných kontrol.
Indikace
Vzhledem ke svému komplexnímu účinku na koagulaci, krevní destičky, metabolismus lipidů a ovlivnění endotelu a GMB je u nás sulodexid schválen v široké škále indikací:
– choroby žilního systému (trombóza, postflebitický syndrom),
– choroby tepenného systému (ICHS, okluze mozkových tepen, ICHDKK),
– poruchy mikrocirkulace (diabetická retinopatie),
– komplikace diabetu (makroangiopatie, nefropatie, diabetická noha, neuropatie),
– neurologické cévní poruchy (senilní deteriorace, prevence CMP),
– prevence okluze a trombózy venae centralis retinae, makulární degenerace,
– dlouhodobá sekundární prevence po IM, prevence formace intrakardiálního trombu.
U žilních trombóz je sulodexid vhodný jako pokračování úvodní heparinizace u pacientů, u kterých není léčba kumarinovými antikoagulancii nutná či není s ohledem na pacienta bezpečná (špatná compliance, starší pacienti, lékové interakce, vředová choroba). Podobná pravidla platí u léčby po prodělané plicní embolii [23].
Svůj komplexní účinek může sulodexid uplatnit při léčbě mikro- a makrovaskulárních komplikací diabetu. Účinek byl demonstrován například u retinopatií, u nefropatie snižuje sulodexid výrazně exkreci albuminu ledvinami, speciálně u mikroalbuminurie. Ovlivnění proteinurie se zdá být nadějnou indikací i u pacientů s nefrotickým syndromem, kteří netrpí diabetem [24, 25].
Kontraindikace
Sulodexid je samozřejmě kontraindikován při prokázané přecitlivělosti na některou z účinných složek, dále obecně při přecitlivělosti na heparinové deriváty. Při krvácivých stavech je nutno před zahájením léčby nejdříve dosáhnout úpravy koagulace. Podávání sulodexidu je třeba zvážit u osob se závažnějším postižením kognitivních funkcí, u osob s aktivní vředovou chorobou gastroduodena či nekorigovanou arteriální hypertenzí. U těchto osob je však nutno vhodnost léčby posoudit a rozhodnout individuálně, protože právě u nich volíme sulodexid jako bezpečnější alternativu.
Nežádoucí účinky
Sulodexid je obecně dobře snášen, mezi ojediněle se vyskytující nežádoucí účinky patří nespecifické GIT potíže, jako je nauzea, zvracení či bolest v epigastriu. Při parenterálním podání může dojít k objevení se bolesti či pálení v místě aplikace.
Lékové interakce
Vzhledem ke svému působení na koagulační kaskádu může sulodexid zvyšovat účinek heparinu a perorálních antikoagulancií. V případě jejich současného podávání je nutné pečlivě sledovat odpovídající koagulační parametry.
Antiagregační účinek sulodexidu může být potencován současným podáváním jiných antiagregancií, jako je ASA, dipyridamol, fenylbutazon, indometacin či jiná nesteroidní antiflogistika.
Těhotenství a kojení
Studie zaměřené na embryotoxicitu a fetotoxicitu sice tyto účinky neprokázaly, přesto by měl být sulodexid v těhotenství podáván jen z obzvláště závažných důvodů. Dále nebylo prokázáno, zda sulodexid proniká do mateřského mléka, proto je lepší nepodávat jej kojícím matkám.
Ovlivnění pozornosti
Sulodexid neovlivňuje pozornost či schopnost řídit motorová vozidla či ovládat stroje.
Dávkování
Léčbu je možno zahájit parenterální (i.m. či i.v.) aplikací 600 LSU sulodexidu po dobu 10–20 dní, u pacientů s vyšším rizikem až po dobu 30 dnů. Poté se přechází na perorální podávání, nejčastěji v dávce 250–500 LSU 2x denně po jídle. Někdy se dle stavu volí cyklické podávání, kdy se léčivo pacientovi podává po 3–4 měsíce dvakrát do roka. Pokud se na aplikaci sulodexidu přechází z léčby heparinem, jeho deriváty či perorálními antikoagulancii, není počáteční parenterální aplikace nutná, je však nutné se vyvarovat synergistického působení v případě překrývání účinnosti těchto léčiv.
U nemocných s chorobou jater či ledvin není nutné dávku paušálně snižovat, doporučuje se však sledovat koagulační parametry a dávku upravit v případě jejich ovlivnění.
Dávkování u dětí nebylo v klinických studiích stanoveno, proto se podávání sulodexidu dětem nedoporučuje.
Balení
Sulodexid je v ČR v současné době k dispozici v podobě přípravku Vessel Due F, a to jednak ve formě kapslí, jednak ve formě injekcí pro parenterální podání – viz tab. 3.
Stabilita a inkompatibility
Doba použitelnosti u nás registrovaného přípravku je 5 let při skladování do 30 °C. Jako kyselý polysacharid může sulodexid nahodile reagovat s bazickými látkami, např. vitaminem K, komplexem vitaminů B, hydrokortizonem, glukonátem, kvarterními amonnými solemi, chloramfenikolem, streptomycinem, tetracyklinem a dalšími.
Léčivé přípravky obsahující sulodexid aktuálně dostupné v ČR
Obr. 1 Koagulační kaskáda s vyznačenými místy zásahu sulodexidu; podle [28–30] – Rang, et al., 2003; Lüllmann, 2003; Tapper, et al., 2000
Seznam použité literatury
- [1] Lauver DA, Booth EA, White AJ, et al. Sulodexide attenuates myocardial ischemia/reperfusion injury and the deposition of C-reactive protein in areas of infarction without affecting hemostasis. J Pharmacol Exp Ther 2005; 312: 794–800.
- [2] Ceriello A, Quatraro A, Ettore M, et al. Glucosaminoglycans administration decreases high firinogen plasma levels in diabetic patients. Diab Nutr Metab 1993; 6: 1–4.
- [3] Gambaro G, Baggio B. Role of glycosaminoglycans in diabetic nephropathy. Acta Diabetol 1992; 29: 149–155.
- [4] Gambaro G, Baggio B. Glycosaminoglycans: a new paradigm in the prevention of proteinuria and progression of glomerular disease. Nephrol Dial Transplant 1996; 11: 762–764.
- [5] Kanwar YS, Liu ZZ, Kashihara N, Wallner EI. Current status of the structural and functional basis of glomerular altration and proteinuria. Semin Nephrol 1991; 11: 390–413.
- [6] d´Aloia A, Dati M, Della Corte M, et al. Assessment of the effectiveness of sulodexide on diabetic patients, Seconda Universita degli Studi, Naples, Italy Public Ophthalmologic Health Department.
- [7] Boneu B. Low molecular weight heparin therapy: Is monitoring needed? Review article. Tromb Haemost 1994; 72: 330–334.
- [8] Biancardi G, Frigieli F, Palummo N, et al. Thromboresistence of the arterial wall: the role of heparin and glycosaminoglycans. Wien Klin Wochenschr 1991; 103: 412–415.
- [9] Jablonická K, et al. Pharmacological effect of sulodexide on endothelaemia in tourniquet shock in rats. Abstract, Mefa 95 Congress, Milano, October 24–27, 1995.
- [10] Coccheri S, Scondotto G, Agnelli G, et al. Sulodexide in the treatment of intermittent claudication Results of a randomized, doubleblind, multi centre, placebo-controlled study. European Heart Journal 2002; 23: 1057–1065.
- [11] Milani MR, et al. Pharmacokinetics of sulodexide evaluated from 131I-labelled fast moving heparin after single intravenous and oral administration of different doses in man. Br J Clin Res 1992; 3: 161–178.
- [12] Buchanan MR, Brister SJ, Ofosu F. Prevention and treatment of thrombosis: Novel strategies arising from our understanding the heatlhy endothelium. Wien Klin Wochenschr 1993; 105: 309–313.
- [13] Cospite M, Milio G, Ferrara F, et al. Haemodynamic effects of sulodexide in post-thrombophlebitic syndromes. Acta Ther 1992; 18: 149–160.
- [14] Traini AM, Cervi V, Melandri G, et al. Pharmacodynamic characteristics of low-molecular-weight dermatan sulphate after subcutaneous administration in acute myocardial infarction. J Int Med Res 1994; 22: 323–331.
- [15] Liuori L, Saviano M, Lampugnani R, et al. Efficacy, tolerability, and dose-effect relationship of oral sulodexide in obstructive peripheral arterial disorders. Adv Ther 1992; 2: 52–66.
- [16] Colombo F, Cristadoro F, Troyer L, Varini F. Flebopatie superficiali: tolerabilita e efficacia del farmaco Sulodexide. Geriatrics 1991; 8: 45–48. Abstract.
- [17] Coccheri S, Scondotto G, Agnelli G, et al. Venous arm of the SUAVIS (Sulodexide Arterial Venous Italian Study) Group., Randomised, double blind, multicentre, placebo controlled study of sulodexide in the treatment of venous leg ulcers. Thromb Haemost 2002; 87: 947–952.
- [18] Rubbi F, et al. Retinal vein occlusions: clinical study of treatment with sulodexide. Eur J Clin Res 1993; 4: 19–27.
- [19] Dedov I, Shestakova M, Vorontzov A, Palazzini E. A randomized, controlled study of sulodexide therapy for the treatment of diabetic nephropathy. Nephrol Dial Transplant 1997; 12: 2295–2300.
- [20] Gambaro G, Kinalska I, Oksa A, et al. Oral sulodexide reduces albuminuria in microalbuminuric and macroalbuminuric type 1 and type 2 diabetic patients: the Di.N.A.S. randomized trial. J Am Soc Nephrol 2002; 13: 1615–1625.
- [21] Goodman SG, Langer A, Durica SS, et al. Safety and anticoagulation effect of a low-dose combination of warfarin and aspirin in clinically stable coronary artery disease. CARS pilot study. Am J Cardiol 1994; 74: 713–731.
- [22] Cirujeda JL, Granado PC. A Study on the Safety, Efficacy, and Efficiency of Sulodexide Compared with Acenocoumarol in Secondary Prophylaxis in Patients with Deep Venous Thrombosis. Angiology 2006; 57: 53–64.
- [23] Penka M, Matýšková M, Krahulcová E. Naše zkušenosti s fraxiparinem v prevenci TEN u onkologicky nemocných. Hematol Transfuziol 1992; 3: 42–45.
- [24] Baggio B, Gambaro G. Antiproteinuric effect of glycosaminoglycans. Nephron 1993; 64: 643–644.
- [25] Gambaro G, Baggio B. Role of glycosaminoglycans in diabetic nehropathy. Acta Diabetic 1992;, 29: 826–833.
- [26] Williams ME, Tuttle KR. The next generation of diabetic nephropathy therapies: an update, Adv Chronic Kidney Dis 2005; 12: 212–222.
- [27] Tamsma JT, van der Woude FJ, Lemkes HH. Effect of sulphated glycosaminoglycans on albuminuria in patients with overt diabetic (type 1) nephropathy. Nephrol Dial Transplant 1996; 182–185.
- [28] Rang HP, Dale MM, Ritter JM, Moore PK. Pharmacology, 5th edition. Edinburgh, Churchill Livingstone, 2003.
- [29] Lüllmann H. Pharmakologie und Toxikologie (15). Berlin, Georg Thieme Verlag, 2003.
- [30] Tapper H, Herward H. Modulation of hemostatic mechanisms in bacterial infectious diseases. Blood 2000; 96: 2329–2337.