Telaprevir
Chronická hepatitida C je celosvětově závažným zdravotním problémem s nepochybnými riziky rozvoje jaterní cirhózy a jejích komplikací. Během posledních deseti let představovala standardní léčbu HCV (hepatitis C virus) infekce kombinace pegylovaného interferonu α (PEG-IFN) a ribavirinu (RBV), jejíž podávání vedlo k vyléčení asi 40–50 % nemocných s genotypem 1 a asi 75–85 % pacientů s genotypem 2 nebo 3. Šance pacientů na vyléčení v případě opakování shodné léčby byly daleko nižší (8–20 %). V roce 2011 byla schválena ke klinickému použití přímá protivirová léčiva (DAAs) – boceprevir a telaprevir, která blokují virovou proteázu a tím interferují s virovou replikací. Tato léčiva jsou indikována pouze v kombinaci s PEG-IFN a RBV u nemocných s genotypem 1.
Použití kombinované léčby s telaprevirem vedlo k výraznému zvýšení její účinnosti u pacientů dosud neléčených i v minulosti již neúspěšně léčených. Efektivita léčby se zvýšila o 25–31 % u dosud neléčených nemocných, o 40–62 % u pacientů v minulosti relabujících, o 33–45 % u pacientů s parciální odpovědí na předchozí léčbu a o 24–28 % u nemocných, kteří na předchozí léčbu neodpovídali (non-respondenti). Článek shrnuje dosavadní informace o telapreviru a zkušenosti s léčbou.
Úvod
Chronická hepatitida C celosvětově postihuje kolem 130–210 milionů osob (asi 3 % světové populace) [1] a kolem 3 milionů osob se každý rok nově nakazí (převážně v důsledku expozice infikované krvi či sdílením předmětů běžné hygieny kontaminovaných krví) [2]. HCV (hepatitis C virus) infekce je jednou z nejčastějších příčin chronického zánětu jater, jaterní cirhózy a hepatocelulárního karcinomu (HCC) [1]. Ještě donedávna byla standardní léčbou HCV infekce kombinace pegylovaného interferonu α (PEG-IFN) a virostatika ribavirinu (RBV). Cílem léčby hepatitidy C je setrvalá eradikace viru – tzv. setrvalá virologická odpověď (SVR), definovaná jako nedetekovatelná ribonukleová kyselina viru (HCV RNA), která prokazatelně vede k poklesu morbidity i mortality pacientů a ke zpomalení progrese jaterního onemocnění [3, 4]. SVR bylo uvedenou léčbou dosaženo průměrně u 50 % léčených pacientů, přičemž nemocní s genotypem 1 měli nižší SVR (průměrně kolem 40–45 %) a pacienti s genotypem 2 a 3 dosáhli SVR průměrně v 70–80 % [5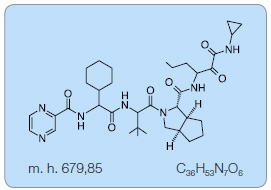 , 6]. Některé skupiny pacientů mají ještě nižší šanci na vyléčení (pacienti s koinfekcí HIV, human immunodeficiency virus, ve 14–29 % [7], Afroameričané v 19–23 % [8] či pacienti s jaterní cirhózou v 20–30 % [1, 5, 9]).
, 6]. Některé skupiny pacientů mají ještě nižší šanci na vyléčení (pacienti s koinfekcí HIV, human immunodeficiency virus, ve 14–29 % [7], Afroameričané v 19–23 % [8] či pacienti s jaterní cirhózou v 20–30 % [1, 5, 9]).
Z důvodu této neuspokojivé efektivity kombinované léčby PEG-IFN s RBV a vzhledem k terapeutickým úspěchům při léčbě HIV infekce (HIV-1 proteázovými inhibitory) byl výzkum soustředěn analogicky směrem k vývoji přímo působících antivirotik (direct-acting antivirals, DAAs), především inhibitoru NS3/4 serinové proteázy a inhibitoru NS5B virové polymerázy [10].
Cyklus viru hepatitidy C
Virus hepatitidy C patří mezi RNA viry, vyznačuje se velkou genetickou diverzitou a v důsledku rychlé replikace, velkého obratu viru a nepřesné funkce RNA-dependentní RNA polymerázy snadno vytváří mutace (tzv. quasispecies), které mají vliv na efektivitu léčby a potenciální rezistenci k léčbě [11–13]. Po připojení a splynutí viru HCV s buněčnou membránou hepatocytu je virová nukleokapsida uvolněna intracelulárně a rozbalena s následnou syntézou virového polyproteinu. Tento virový polyproteinový prekurzor je upravován buněčnými i virovými proteázami na 10 jednotlivých proteinů. Tyto proteiny jsou jednak strukturální (core, E1, E2 a p7) a dále je vytvořeno 6 nestrukturálních proteinů (NS2, NS3, NS4A, NS4B, NS5A a NS5B) [14, 15], které jsou důležité pro replikaci HCV genomu. Translace a další zpracování virového polyproteinu je řízeno především NS5B RNA-dependentní RNA polymerázou a NS3/4A serinovou proteázou. HCV replikace proto může být blokována inhibitory NS3/4A proteázy [12, 16].
Farmakologie a mechanismus účinku
Telaprevir (TPV) je selektivní inhibitor NS3/4A proteázy [17–19]. Váže se kovalentně a reverzibilně na její aktivní místo a specificky blokuje zpracování virového polyproteinu, čímž blokuje replikaci viru [14, 17]. Poločas disociace komplexu TPV s NS3/4A proteázou je zhruba 60 minut [14, 17]. TPV je v současné době indikován pouze pro kombinační léčbu pacientů infikovaných HCV genotypem 1, při které vykazoval ve studiích in vitro dobrou účinnost. Rozdíl mezi citlivostí a vnímavostí jednotlivých genotypů HCV vůči TPV může být až 4násobný [20], a to zřejmě proto, že virové proteázy jsou specifické pro jednotlivé genotypy. Ve studii in vitro se významně lišily inhibiční koncentrace IC50 pro jednotlivé genotypy, přičemž nejmenší byla pro genotyp 1b (IC50 830 nmol/l), dále pro genotyp 2a (IC50 1100 nmol/l) a 3a (IC50 1410 nmol/l). Nejvyšší potřebnou IC50 (a tedy nejnižší citlivost vůči TPV) vykazoval HCV genotyp 4a (IC50 2300 nmol/l) a 5a (IC50 2700 nmol/l) [20].
Rezistence k telapreviru
Rezistence vůči TPV má velký klinický význam. Vliv na její rozvoj má výrazná genetická diverzita viru, velká rychlost jeho replikace (velký obrat viru) a nízká přesnost virové replikace vedoucí k tvorbě virových quasispecies [18, 20]. Variabilita v konstituci NS3 proteázy je zodpovědná za odlišnou citlivost vůči TPV a za rozdíly v odpovědi na léčbu mezi jednotlivými pacienty [15, 20]. TPV může být užíván jedině jako součást kombinační terapie s PEG-IFN a RBV při léčbě HCV infekce genotypu 1, poněvadž při monoterapii TPV dochází velmi rychle k selekci rezistentních HCV quasispecies [13, 21]. I u pacientů dosud neléčených (tzv. naivní pacienti) se mohou nacházet mutace s nízkou úrovní rezistence vůči TPV (u 8,6 % pacientů s genotypem 1a a u 1,4 % pacientů s genotypem 1b). Mutace s vysokou rezistencí vůči TPV (R155K či duální mutace) byly přítomny u 0,8 % pacientů [22]. U pacientů ve studiích fáze II a III (viz Klinické zkušenosti) byla přítomnost rezistence k TPV před léčbou řídká (< 1 %) [19]. U pacientů, u kterých došlo k selhání léčby či k relapsu onemocnění po ukončení léčby, byla zjištěna řada mutací zvyšujících rezistenci k léčbě. Některé mutace mohou způsobovat velmi vysokou rezistenci k léčbě (IC50 zvýšena minimálně 25krát), především A156V/T a dvojitá mutace V36M a R155K. Tzv. wild-type HCV má vyšší replikační kapacitu než tzv. TPV-rezistentní varianty [19]. Po úvodní léčbě TPV vymizí rezistentní varianty viru HCV průměrně za 5,7 roku (4,9–6,0). Rezistentní varianty viru se v organismu neuchovávají a jsou postupně opět nahrazeny wild-type HCV [23]. Ve studiích fáze I byl u pacientů léčených monoterapií TPV pozorován po iniciálním poklesu viremie velmi rychlý vzestup (během 8–12 dnů) hladiny HCV RNA (tzv. breakthrough) v důsledku selekce vysoce rezistentních mutací viru (V36 + R155). Následná léčba PEG-IFN s RBV u těchto předléčených pacientů však vedla k supresi viremie a k dosažení SVR. Výsledky této studie dokládají, že signifikantní a vysoce riziková rezistence na monoterapii TPV vzniká velmi rychle. Dále je také zřejmé, že současná léčba PEG-IFN a RBV dokáže kontrolovat i onemocnění s vysoce rezistentními (vůči TPV) variantami viru HCV infekce [21].
V registračních studiích fáze III (n = 1169 pacientů, viz Klinické zkušenosti) se u celkem 215 pacientů léčených TPV projevilo buď selhání léčby (n = 125) nebo relaps (n = 90) [19]. Z těchto pacientů se TPV-rezistentní varianty viru prokázaly v 84 % případů selhání léčby a u 61 % pacientů s relapsem. Primární selhání léčby bylo nejčastěji spojeno s vysoce rezistentními variantami viru, relaps po ukončení léčby byl častěji spojen s wild-type virem či s málo rezistentními mutacemi viru vůči TPV. Virus s genotypem 1b má zřejmě větší bariéru proti vzniku vysoce rezistentních mutací (především V36M a R155K), a má tedy vyšší šanci na SVR. Vysoce riziková kombinovaná mutace V36M + R155K byla přítomna přibližně u 30 % pacientů [18]. V klinické praxi ale zatím vyšetřování typu mutace význam nemá.
Farmakokinetické vlastnosti
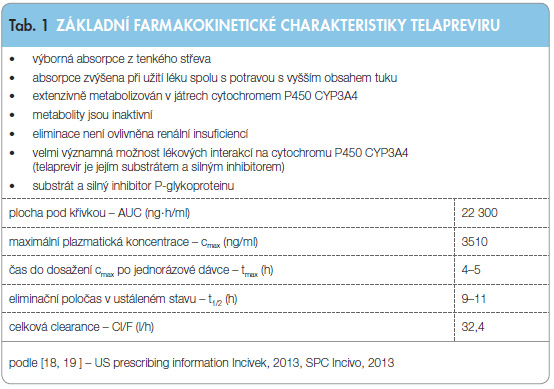 Základní farmakokinetické parametry TPV jsou shrnuty v tab. 1.
Základní farmakokinetické parametry TPV jsou shrnuty v tab. 1.
Absorpce
Po perorálním (p.o.) podání léku je TPV dobře resorbován s dosažením maximální plazmatické koncentrace (cmax) za 4–5 hodin po podání jednorázové dávky [18, 19]. Systémová dostupnost TPV je vyšší, je-li podáván v kombinaci s PEG-IFN (bez ohledu na typ) a RBV [18, 19]. Absorpci TPV významně ovlivňuje podání léčiva během jídla a množství tuku v potravě. Absorpce je zvýšena, pokud je TPV podáván s jídlem, resp. s jídlem s dostatečným množstvím tuku [18, 19]. Ze srovnání plochy pod křivkou (AUC) TPV podaného nalačno s AUC TPV podaného s jídlem vyplývá, že AUC vzrůstá o 230 % při podání s jídlem s běžným množstvím tuku, o 330 % při podání s jídlem o vyšším obsahu tuku a o 117 % při podání s nízkotučnou potravou [18]. Ve většině klinických studií byl proto TPV podáván během 30 minut po požití potravy obsahující zhruba 20 g tuku [18]. Z tohoto důvodu by měla být potrava při podávání léku alespoň částečně standardizována.
Metabolismus
TPV podstupuje extenzivní metabolickou přeměnu v játrech a je metabolizován na R-diastereomer TPV (30krát méně aktivní než TPV). Tento metabolit je detekován v plazmě, moči a ve stolici. TPV je významným substrátem a současně silným inhibitorem cytochromu P450, především izoenzymu CYP3A4, který je využíván při metabolismu celé řady jiných léků. Tato vlastnost výrazně zvyšuje význam lékových interakcí mezi TPV a léčivy predominantně metabolizovanými prostřednictvím tohoto izoenzymu (blíže viz oddíl Lékové interakce) [18, 19].
Eliminace
Po podání jedné dávky 750 mg radioaktivně značeného 14C-TPV zdravým dobrovolníkům byl TPV eliminován stolicí (82 %), vydechovaným vzduchem (9 %) a močí (1 %). Odhadovaná clearance léčiva je 32,4 l/h [18]. Po jednorázovém podání TPV je poločas eliminace 4–4,7 hodiny, v případě rovnovážného stavu činí poločas 9–11 hodin [18, 19], což pro dosažení optimální plazmatické koncentrace znamená interval dávkování léku 3krát denně po 8 hodinách. Renální insuficience nehraje zásadní roli ve farmakokinetice léku, dávku léku není nutné redukovat [19]. V současné době nejsou dostupné údaje o farmakokinetice TPV u pacientů se selháním ledvin či u dialyzovaných nemocných. Aktuálně jsou k dispozici jen omezené údaje o farmakokinetice TPV u pacientů se středně významnou či těžkou jaterní insuficiencí. U pacientů s jaterní insuficiencí hodnocenou podle Childova-Pughova skóre jako stupeň B (7–9 bodů) došlo k poklesu cmax a AUC TPV o 49 %, resp. o 46 % [19]. Vzhledem k tomu není možné této populaci pacientů TPV podávat. U pacientů s lehkou jaterní insuficiencí není nutné dávku léku upravovat [18, 19].
Interakce
Charakter metaboli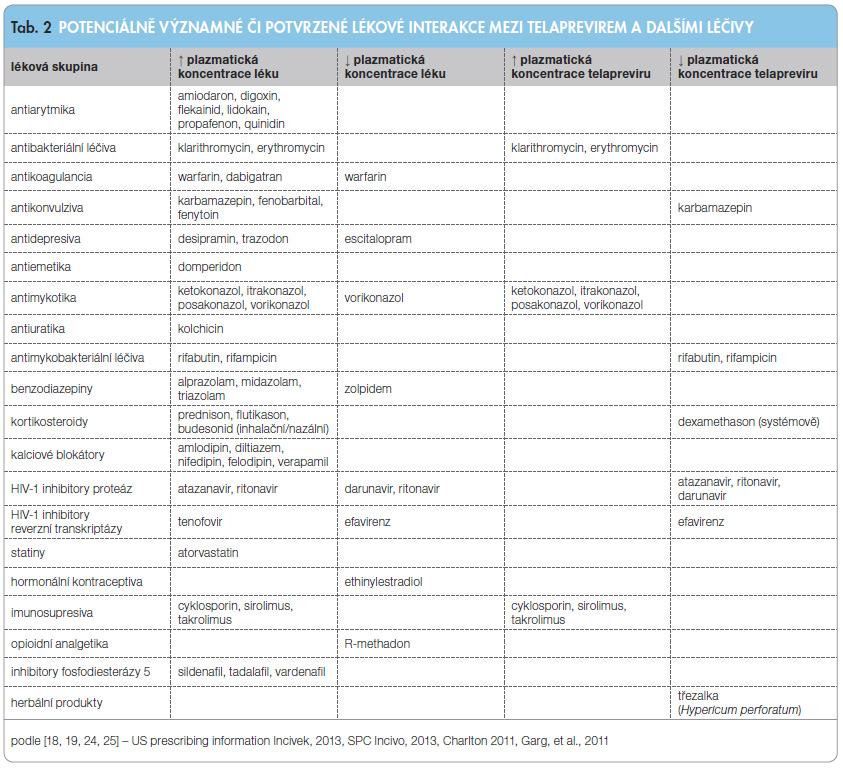 smu a transmembránového transportu predisponuje TPV k významným lékovým interakcím. Metabolismus TPV prostřednictvím izoformy CYP3A4, který současně silně inhibuje, a rovněž silná inhibice P-glykoproteinu vytváří zásadní potenciál pro závažné lékové interakce s léčivy, která jsou uvedenými enzymy či proteiny metabolizována či transportována. Některé interakce mohou být závažné včetně možných fatálních následků.
smu a transmembránového transportu predisponuje TPV k významným lékovým interakcím. Metabolismus TPV prostřednictvím izoformy CYP3A4, který současně silně inhibuje, a rovněž silná inhibice P-glykoproteinu vytváří zásadní potenciál pro závažné lékové interakce s léčivy, která jsou uvedenými enzymy či proteiny metabolizována či transportována. Některé interakce mohou být závažné včetně možných fatálních následků.
Souhrn signifikantních lékových interakcí mezi TPV a současně podávanými léky je uveden v tab. 2. Léčiva, jejichž užití je během léčby TPV kontraindikováno, jsou uvedena v tab. 3. Je zřejmé, že je 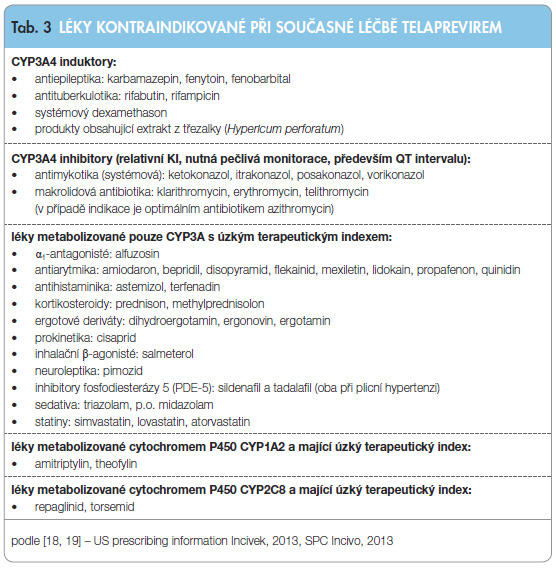 nutné přesně dodržovat preskripční doporučení či omezení vyplývající ze souhrnů údajů o registrovaném přípravku [18, 19] a potenciálně významné interakce ověřit v on-line konfigurátoru lékových interakcí (The University of Liverpool website) [26]. Z hlediska potenciálně fatálních komplikací je nutné zmínit p.o. midazolam (vzestup AUC a cmax midazolamu podaného p.o. 8,96krát, resp. 2,86krát) [27]. P.o. podání midazolamu současně s TPV je absolutně kontraindikováno. Závažné interakce jsou zaznamenány i při podání s dalšími benzodiazepiny, se statiny (simvastatin, lovastatin, atorvastatin), imunosupresivy (cyklosporin, takrolimus) a hormonální antikoncepcí [25, 28–31].
nutné přesně dodržovat preskripční doporučení či omezení vyplývající ze souhrnů údajů o registrovaném přípravku [18, 19] a potenciálně významné interakce ověřit v on-line konfigurátoru lékových interakcí (The University of Liverpool website) [26]. Z hlediska potenciálně fatálních komplikací je nutné zmínit p.o. midazolam (vzestup AUC a cmax midazolamu podaného p.o. 8,96krát, resp. 2,86krát) [27]. P.o. podání midazolamu současně s TPV je absolutně kontraindikováno. Závažné interakce jsou zaznamenány i při podání s dalšími benzodiazepiny, se statiny (simvastatin, lovastatin, atorvastatin), imunosupresivy (cyklosporin, takrolimus) a hormonální antikoncepcí [25, 28–31].
Klinické zkušenosti
Pro účely léčebných režimů byly použity zkratky podávaných léčiv: P – pegylovaný interferon α, R – ribavirin, T – telaprevir.
Písmena označují léčiva podávaná v dané větvi studie, čísla označují počet týdnů léčby.
Klinické studie fáze II
Terapeutická účinnost a bezpečnost TPV v kombinační léčbě hepatitidy C s genotypem 1 (současně s PEG-IFN a RBV) byla nejdříve potvrzena v klinických studiích fáze II. Mezi nejdůležitější studie této skupiny patří studie PROVE (Protease Inhibition for Viral Evaluation) 1 [32], PROVE 2 [33] a PROVE 3 [34]. Tyto studie byly randomizované a kontrolované placebem. Studie PROVE 1 a 2 se zabývaly léčbou naivních pacientů, studie PROVE 3 se zabývala léčbou pacientů, kteří již byli pro HCV jednou neúspěšně léčeni. Ve všech studiích dostávali pacienti shodné dávky všech léků: TPV 750 mg tbl. 3krát denně, PEG-IFN-α-2a 180 µg s.c. 1krát týdně a 1000 mg či 1200 mg RBV denně (dle hmotnosti větší či menší než 75 kg).
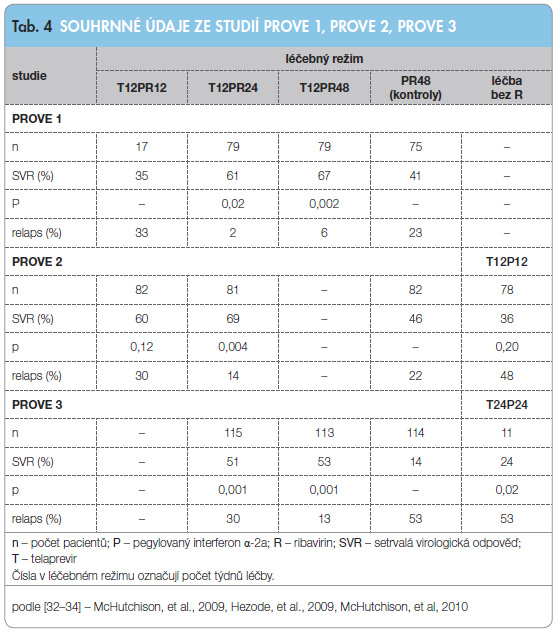 Výsledky klinického hodnocení jsou shrnuty v tab. 4. Studie PROVE 1 a PROVE 2 prokazují, že přidání TPV ke standardní léčbě PEG-IFN + RBV zvyšuje šanci na SVR u naivních pacientů ve srovnání s kontrolou (61–69 % vs. 41–46 %). U pacientů, kteří selhali při předchozí kombinované léčbě (PEG-IFN a RBV), se přidáním TPV k této dvojkombinaci rovněž zvyšuje šance na dosažení SVR ve srovnání s kontrolní skupinou (51 % a 53 % vs. 14 %). Studie prokazují, že je možné zvážit zkrácení doby léčby (dle typu a monitorace virologické odpovědi v jednotlivých týdnech léčby, tedy tzv. response-guided therapy) na 24 týdnů v případě trojkombinační léčby a při dosažení eRVR (extendované rychlé virologické odpovědi, která je definována dosažením negativní viremie ve 4. a 12. týdnu léčby). Zkrácení doby léčby na 12 týdnů však vedlo k vyššímu počtu relapsů. RBV zůstává nadále nezbytnou komponentou kombinované léčby.
Výsledky klinického hodnocení jsou shrnuty v tab. 4. Studie PROVE 1 a PROVE 2 prokazují, že přidání TPV ke standardní léčbě PEG-IFN + RBV zvyšuje šanci na SVR u naivních pacientů ve srovnání s kontrolou (61–69 % vs. 41–46 %). U pacientů, kteří selhali při předchozí kombinované léčbě (PEG-IFN a RBV), se přidáním TPV k této dvojkombinaci rovněž zvyšuje šance na dosažení SVR ve srovnání s kontrolní skupinou (51 % a 53 % vs. 14 %). Studie prokazují, že je možné zvážit zkrácení doby léčby (dle typu a monitorace virologické odpovědi v jednotlivých týdnech léčby, tedy tzv. response-guided therapy) na 24 týdnů v případě trojkombinační léčby a při dosažení eRVR (extendované rychlé virologické odpovědi, která je definována dosažením negativní viremie ve 4. a 12. týdnu léčby). Zkrácení doby léčby na 12 týdnů však vedlo k vyššímu počtu relapsů. RBV zůstává nadále nezbytnou komponentou kombinované léčby.
V další studii fáze II Marcellina a kol. [35] bylo hodnoceno jako shodně účinné dávkování TPV 2krát denně vs. 3krát denně a nebyl zjištěn rozdíl v SVR dle typu použitého PEG-IFN (α-2a či α-2b).
Studie fáze II prokázaly, že kombinační léčba PEG-IFN + RBV + TPV zvyšuje šanci na dosažení SVR u pacientů s HCV infekcí (genotyp 1). Možnost dávkování TPV 2krát denně je nutné dále potvrdit. Typ použitého PEG-IFN (α-2a nebo α-2b) nemá vliv na celkový výsledek léčby [35].
Klinické studie fáze III – dosud neléčení pacienti
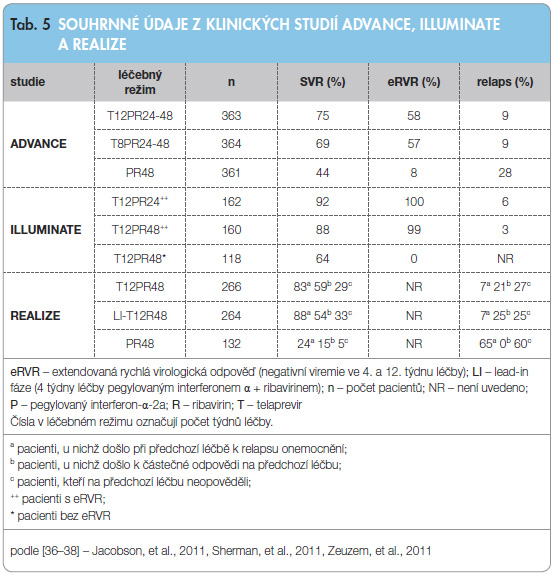 Klinickými studiemi fáze III, jejichž výsledky se staly podkladem pro registraci léčby TPV u naivních pacientů, byly ADVANCE [36] a ILLUMINATE [37]. Studie ADVANCE byla dvojitě slepá randomizovaná a ILLUMINATE nezaslepená noninferiorní studie. Hlavní výsledky z těchto studií jsou uvedeny v tab. 5. Obě studie měly podobná vstupní kritéria: věk 18–70 let, HCV genotyp 1, vyloučená jiná onemocnění jater, absence HIV pozitivní sérologie a adekvátní krevní obraz (hladiny neutrofilů, trombocytů a hemoglobinu) odpovídající kompenzovanému jaternímu onemocnění. Primárním cílem obou studií byla SVR definovaná jako negativní viremie (nulová HCV RNA) 24 týdnů po ukončení léčby. Sekundární cíle obou studií byly podobné: počet pacientů s negativní viremií ve 4. a 12. týdnu léčby (eRVR), negativní viremie na konci léčby, počet relapsů a počet selhání léčby v důsledku virové rezistence. V obou studiích bylo shodné dávkování léků: TPV 750 mg 3krát denně, RBV dle hmotnosti 1000–1200 mg denně a PEG-IFN-α-2a v dávce 180 µg inj. s.c. 1krát týdně.
Klinickými studiemi fáze III, jejichž výsledky se staly podkladem pro registraci léčby TPV u naivních pacientů, byly ADVANCE [36] a ILLUMINATE [37]. Studie ADVANCE byla dvojitě slepá randomizovaná a ILLUMINATE nezaslepená noninferiorní studie. Hlavní výsledky z těchto studií jsou uvedeny v tab. 5. Obě studie měly podobná vstupní kritéria: věk 18–70 let, HCV genotyp 1, vyloučená jiná onemocnění jater, absence HIV pozitivní sérologie a adekvátní krevní obraz (hladiny neutrofilů, trombocytů a hemoglobinu) odpovídající kompenzovanému jaternímu onemocnění. Primárním cílem obou studií byla SVR definovaná jako negativní viremie (nulová HCV RNA) 24 týdnů po ukončení léčby. Sekundární cíle obou studií byly podobné: počet pacientů s negativní viremií ve 4. a 12. týdnu léčby (eRVR), negativní viremie na konci léčby, počet relapsů a počet selhání léčby v důsledku virové rezistence. V obou studiích bylo shodné dávkování léků: TPV 750 mg 3krát denně, RBV dle hmotnosti 1000–1200 mg denně a PEG-IFN-α-2a v dávce 180 µg inj. s.c. 1krát týdně.
Cílem studie ADVANCE bylo potvrdit vyšší účinnost kombinované léčby s TPV u naivních pacientů (response-guided therapy, viz výše). Pacienti byli randomizováni do tří větví. V první větvi dostávali 12 týdnů kombinovanou léčbu TPR a pacienti s eRVR pokračovali 12 týdnů v léčbě PR. Pacienti bez eRVR byli léčeni 36 týdnů PR. Ve druhé větvi pacienti dostávali 8 týdnů TPR (poté 4 týdny PR + placebo), pacienti s eRVR poté pokračovali 12 týdnů v léčbě PR a pacienti bez eRVR pokračovali 36 týdnů v léčbě PR. Třetí větev byla kontrolní – 48 týdnů léčby PR. Pacienti v obou větvích s TPV (8 a 12 týdnů) dosáhli vyšší odpovědi, než tomu bylo v kontrolní větvi (p < 0,001, 69 % a 75 % vs. 44 %). Pacienti v obou větvích s TPV dosáhli negativní viremie ve 4. týdnu v 66 % a 68 %, v kontrolní větvi bylo tohoto cíle dosaženo pouze u 9 % pacientů. Pacienti s eRVR (ve větvích s TPV 57 %, resp. 58 %) se kvalifikovali pro zkrácenou léčbu po dobu 24 týdnů. Z těchto nemocných dosáhlo SVR 83 % a 89 % léčených. Ve srovnání s kontrolní větví pacientů (PR) prokázala kombinační léčba s 12 týdny TPV (aktuálně schválený léčebný režim) významně vyšší účinnost v dosažení SVR i u jednotlivých podskupin pacientů (genotyp 1a či 1b, vysoká vstupní viremie > 800 000 IU/ml, černoši, jednotlivé skupiny dle body mass indexu, BMI, včetně skupiny s BMI > 30). K relapsu po ukončení léčby došlo u 9 % pacientů léčených TPV oproti 28 % v kontrolní větvi.
Cílem studie ILLUMINATE bylo prokázat, že u pacientů s eRVR je kombinovaná léčba s TPV po dobu 24 týdnů podobně účinná jako kombinovaná léčba s TPV po dobu 48 týdnů a je možné ji zkrátit bez rizika snížení celkové účinnosti. Pacienti byli léčeni po dobu 12 týdnů standardní kombinovanou léčbou s TPV, po níž pokračovala léčba PR. Pacienti s eRVR byli ve 20. týdnu randomizováni do skupin s celkovou délkou léčby 24 týdnů nebo 48 týdnů. Pacienti bez eRVR pokračovali bez randomizace do celkové délky 48 týdnů (jednalo se tedy o větve s eRVR + T12PR24 nebo T12PR48 a bez eRVR + T12PR48). Kratší doba léčby byla lépe tolerována a 24týdenní léčbu dokončilo 99 % oproti 74 % léčených po dobu 48 týdnů; eRVR bylo celkově dosaženo u 65 % pacientů. Tito byli poté randomizováni pro 24týdenní či 48týdenní léčbu. SVR v těchto větvích dosáhla 92 % ve větvi s léčbou trvající 24 týdnů a 88 % ve větvi s léčbou trvající 48 týdnů. I u pacientů bez eRVR bylo dosaženo vysoké SVR (64 %). Riziko relapsu bylo velmi nízké, celková frekvence relapsu byla 8 %. Je zřejmé, že dosažení eRVR je pro predikci efektu léčby zásadní a umožňuje zkrátit dobu léčby na 24 týdnů. Zkrácená léčba je lépe tolerována, dokončí ji větší počet pacientů a přináší i ekonomická pozitiva. I pacienti bez eRVR mají vysokou šanci na vyléčení (SVR).
Klinická studie fáze III – pacienti s neúspěšnou předcházející léčbou
Účinnost a bezpečnost TPV v kombinační léčbě po předcházející neúspěšné terapii (PEG-IFN + RBV) byla hodnocena ve studii REALIZE [38]. Tato studie byla randomizovaná a kontrolovaná placebem. Pacienti byli stratifikováni do skupin podle typu předchozí léčebné odpovědi:
- non-respondent (NR) – pokles viremie o méně než 2 log10 ve 12. týdnu léčby;
- parciální respondent (PR) – pokles viremie o více než 2 log10 ve 12. týdnu léčby a miniminálně 1krát detekovatelná viremie mezi 24. a 48. týdnem léčby, nedošlo k SVR;
- relaps (RE) – nedetekovatelná viremie na konci léčby s následující pozitivitou během sledování.
Pacienti byli randomizováni do tří větví. V první dostávali TPR 12 týdnů s následující léčbou PR do celkových 48 týdnů léčby. Ve druhé větvi se po úvodní 4týdenní léčbě PR (tzv. lead-in fáze) pokračovalo podáváním kombinace TPR po dobu 12 týdnů a následně léčbou kombinací PR do celkové doby 48 týdnů. Ve třetí větvi byli pacienti léčeni kombinací PR (kontrolní skupina). Cirhóza byla přítomna u 25 % všech pacientů. Výsledky studie jsou uvedeny v tab. 5 včetně rozlišení SVR mezi jednotlivými subpopulacemi pacientů. TPV v kombinační léčbě prokázal vysokou účinnost v obou větvích a statistická významnost dosáhla p < 0,001 pro všechna srovnání s kontrolní skupinou. Přidání lead-in fáze do léčby nepřineslo žádný aditivní efekt. Kombinační léčba s TPV byla účinná i v obtížně léčitelných skupinách u pacientů s vysokou vstupní viremií, s pokročilou fibrózou či cirhózou. Nejvyšší účinnost kombinační léčby s TPV byla pozorována u pacientů, u nichž při předchozí léčbě došlo k relapsu onemocnění. Nebyly pozorovány signifikantní rozdíly v SVR (včetně stratifikace dle typu předchozí odpovědi) mezi oběma rameny s kombinační léčbou s TPV (64 % bez lead-in fáze vs. 66 % s lead-in fází). V obou skupinách s TPV byl zaznamenán nižší počet relapsů než v kontrolní skupině. Selekce virových variant se sníženou senzitivitou k TPV byla zodpovědná za 73 % všech případů relapsu či neodpovídavosti na léčbu.
Tolerance a nežádoucí účinky
TPV je užíván v kombinaci s PEG-IFN a RBV, řada nežádoucích účinků (dále NÚ) se proto překrývá s těmito léčivy. N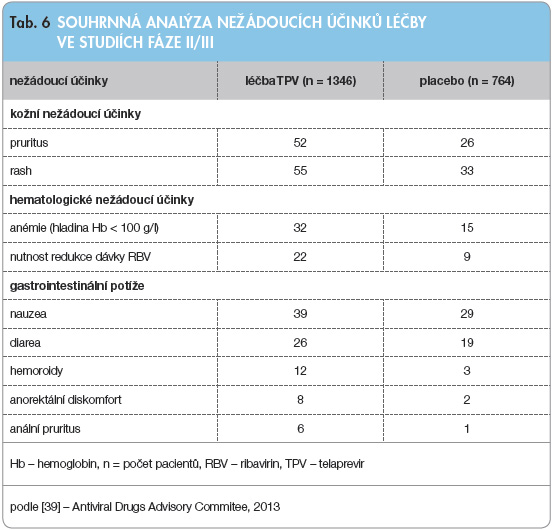 ěkteré NÚ jsou však u pacientů léčených kombinační léčbou s TPV zvýrazněné či nové. Řada NÚ může vést k předčasnému ukončení léčby. Na základě souhrnné analýzy studií fáze II a III (viz tab. 6) je zřejmé, že nejčastějšími NÚ spojenými s užíváním TPV jsou pruritus a rash a dále anémie, únava a gastrointestinální nežádoucí účinky. Pacienti léčení kombinovanou léčbou s TPV museli častěji vysadit či ukončit léčbu ve srovnání s pacienty v kontrolních skupinách. Ve studii ADVANCE [36] muselo léčbu s TPV předčasně ukončit 10 % pacientů vs. 7 % v kontrolní skupině. K ukončení léčby pouze TPV došlo u 11 %, respektive u 7 % pacientů z větví s TPV vs. u 1 % pacientů léčených placebem v kontrolní skupině. K ukončení léčby nejčastěji vedla anémie a rash. Hladina hemoglobinu se významněji a rychleji snížila ve skupině léčené TPV. Celkem u 36 % pacientů s léčbou TPV a u 17 % pacientů v kontrolní skupině klesla hladina hemoglobinu pod 100 g/l a u 14 % pacientů, respektive u 5 % pacientů, pod 85 g/l [18, 19, 36–38]. Anémie byla korigována úpravou dávky RBV. Přítomnost anémie ani eventuální korekce dávky RBV neměly vliv na celkovou SVR [40].
ěkteré NÚ jsou však u pacientů léčených kombinační léčbou s TPV zvýrazněné či nové. Řada NÚ může vést k předčasnému ukončení léčby. Na základě souhrnné analýzy studií fáze II a III (viz tab. 6) je zřejmé, že nejčastějšími NÚ spojenými s užíváním TPV jsou pruritus a rash a dále anémie, únava a gastrointestinální nežádoucí účinky. Pacienti léčení kombinovanou léčbou s TPV museli častěji vysadit či ukončit léčbu ve srovnání s pacienty v kontrolních skupinách. Ve studii ADVANCE [36] muselo léčbu s TPV předčasně ukončit 10 % pacientů vs. 7 % v kontrolní skupině. K ukončení léčby pouze TPV došlo u 11 %, respektive u 7 % pacientů z větví s TPV vs. u 1 % pacientů léčených placebem v kontrolní skupině. K ukončení léčby nejčastěji vedla anémie a rash. Hladina hemoglobinu se významněji a rychleji snížila ve skupině léčené TPV. Celkem u 36 % pacientů s léčbou TPV a u 17 % pacientů v kontrolní skupině klesla hladina hemoglobinu pod 100 g/l a u 14 % pacientů, respektive u 5 % pacientů, pod 85 g/l [18, 19, 36–38]. Anémie byla korigována úpravou dávky RBV. Přítomnost anémie ani eventuální korekce dávky RBV neměly vliv na celkovou SVR [40].
Tolerance a NÚ u pacientů ve studii REALIZE [38] byly podobné. Nejčastějšími NÚ byly anémie, rash, pruritus, nauzea a průjem. Pacienti ve skupině s TPV měli daleko častěji NÚ vedoucí k ukončení léčby (13 % vs. 3 %) a častější vážné NÚ (12 % vs. 5 %) oproti nemocným v kontrolní skupině. Ve skupině s TPV byl zjištěn častější výskyt těžkého pruritu a rashe (stupně 3–4) než v kontrolní skupině (4 % vs. 0 %) [18, 19].
Nejčastějším NÚ kombinované léčby je rash. U pacientů léčených TPV se rash všech stupňů objevil častěji než v kontrolních skupinách (56 % vs. 34 %) [18]. Rash je typicky svědivý, edematózní či makulopapulární a u většiny pacientů (> 50 %) se objevuje během prvních čtyř týdnů léčby (může se ale objevit kdykoliv během léčby) [41]. Více než 90 % případů je lehkých či středně těžkých, tzn. zahrnují maximálně 30 %, resp. 50 % kožního povrchu [19] a lze je intenzivní lokální léčbou spolu s antihistaminiky ovlivnit bez nutnosti léčbu ukončit [41]. U většiny pacientů rash odezní při ukončení léčby TPV [19]. U pacientů léčených TPV se objevily i závažné kožní nežádoucí účinky léčby. U 11 pacientů (0,4 %) se vyvinul tzv. DRESS syndrom a u 3 pacientů (0,1 %) se objevila TEN (toxická epidermální nekrolýza) či SJS (Stevensův-Johnsonův syndrom). Žádná tato kožní reakce nevedla k úmrtí [19]. Uvedené reakce jsou vzácné, ale potenciálně život ohrožující a je nutné je u pacientů aktivně monitorovat.
U pacientů s jaterní cirhózou riziko komplikací a NÚ kombinované léčby stoupá. Ze studie CUPIC (296 pacientů s kompenzovanou jaterní cirhózou léčených kombinovanou léčbou s TPV, primární data ze 16. týdne léčby) vyplývá, že kombinovaná léčba s TPV vede k vyšší frekvenci závažných nežádoucích účinků (48,6 %), k častějšímu přerušení terapie (26,0 %) i k úmrtí (2 %). U pacientů s kombinovanou léčbou a cirhózou stoupá především riziko závažných infekcí [42].
Indikace
V současné době může být TPV indikován ke kombinované léčbě s PEG-IFN a RBV u pacientů s chronickou hepatitidou C genotypu 1 a kompenzovaným jaterním onemocněním (včetně jaterní cirhózy), kteří dosud nebyli léčeni, nebo byli již dříve neúspěšně léčeni interferonem (pegylovaným/nepegylovaným) buď samostatně, nebo v kombinaci s RBV u pacientů starších 18 let [19].
Během léčby je nutné přesně a pravidelně monitorovat viremii (HCV RNA v séru) a hodnoty srovnávat s virologickými ukončovacími kritérii, která jsou stanovena jak výrobcem, tak i doporučenými postupy při léčbě HCV infekce [1, 3, 43].
Kontraindikace
Mezi hlavní kontraindikace patří současné podávání TPV s léčivy, jejichž eliminace je vysoce závislá na CYP3A a jejichž vyšší hladina může vést k závažným či život ohrožujícím následkům, a s léčivy indukujícími CYP3A4, která mohou vést ke snížení účinnosti TPV [19] (viz tab. 2, 3).
Zařazení do současné palety léčiv
Schválení a uvedení DAAs první generace (boceprevir a TPV) do klinické praxe v roce 2011 znamenalo velký pokrok v efektivitě léčby chronické HCV infekce [44]. Hlavním cílem léčby chronické hepatitidy C je eradikace viru (SVR) vedoucí ke zpomalení či zastavení progrese onemocnění a snížení rizika pozdních komplikací (komplikace cirhózy, HCC) [1, 4]. Kombinovaná léčba TPV + PEG-IFN + RBV vedla ke zvýšení účinnosti léčby u pacientů s genotypem 1 z 38–44 % na 63–75 % [5, 36, 37]. Ještě výraznější posun je patrný u pacientů, kteří neodpověděli na předchozí léčbu HCV infekce (studie REALIZE). Tato skupina pacientů měla při opakování dvojkombinační léčby jen malou šanci na SVR (8–20 %) [34, 45, 46]. Účinnost léčby s TPV se zvýšila u všech typů předchozí léčebné odpovědi [38]. Výhodou trojkombinační léčby je možnost zkrácení léčby na 24 týdnů (z dosavadních 48 týdnů). Zkrácení léčby bude možné u 50–66 % pacientů. Podmínkou zkrácení léčby je pečlivá monitorace virologické odpovědi a dosažení eRVR – tedy léčba je řízena typem virologické odpovědi [36–38]. Trojkombinační léčba je rovněž efektivnější u skupin pacientů, u kterých jsou přítomny faktory negativně ovlivňující výsledek léčby (vysoká vstupní viremie, pokročilá fibróza nebo cirhóza, diabetes mellitus aj.) [36, 37]. Jsou ale nutné další studie, které eventuálně potvrdí efektivitu léčby u pacientů s pokročilou (kompenzovanou) cirhózou, neboť ve všech studiích fáze III byla trombocytopenie (asociovaná s jaterní cirhózou) vylučovacím kritériem. Ve všech studiích s TPV byla pozorována vyšší frekvence nežádoucích účinků léčby s vyšším rizikem předčasného ukončení terapie. Toto riziko je při indikaci léčby třeba vždy brát v úvahu.
Aktuální pozici TPV v léčbě chronické HCV infekce upravují doporučené postupy jednotlivých odborných společností. Americká hepatologická společnost (AASLD) stanovila trojkombinační léčbu s DAA (TPV/boceprevir) jako optimální terapii první volby jak pro naivní pacienty, tak pro nemocné již dříve neúspěšně léčené [3] za přísného dodržení ukončovacích virologických pravidel (viz níže). Doporučené postupy Evropské hepatologické společnosti (EASL) z června 2011 zatím jako standardní léčbu určují dvojkombinační léčbu PEG-IFN + RBV, ale trojkombinační léčbu označují za perspektivní a odkazují na pravděpodobné časné přepracování těchto postupů. Upozorňují rovněž na nutnost pečlivé monitorace viremie a přesného dodržování ukončovacích virových kritérií a přísné adherence pacienta k léčbě (zabránění vzniku rezistence) [1]. Jednotlivé národní hepatologické společnosti si v závislosti na lokálních podmínkách (včetně ekonomických) stanoví vlastní terapeutická pravidla, např. ve Velké Británii (selekce skupin pacientů, kteří mají přínos z léčby DAAs) [47]. V České republice schválil Státní ústav pro kontrolu léčiv (SÚKL) obě virostatika (boceprevir, TPV) ke klinickému použití a v současné době jsou dostupná pro opakovanou léčbu pacientů, kteří neodpověděli na dvojkombinační terapii. Indikace k léčbě stanovují v ČR lokální publikované doporučené postupy [43]. Nebyla provedena žádná srovnávací studie mezi boceprevirem a TPV a není stanoveno žádné doporučení, které z uvedených virostatik použít v léčbě.
Ukončovací kritéria
Ukončovací kritéria (stopping-rules) jsou zásadní součástí algoritmu léčby HCV infekce. Dle přesných virologických kritérií se ve stanovené době léčby rozhoduje o předčasném ukončení léčby u pacientů, u kterých je velmi nízká šance na SVR (vyplývající z hodnoty viremie) [18, 19]. U TPV byla stanovena hodnota > 1000 IU/ml ve 4. nebo 12. týdnu trojkombinační terapie (ve 4. týdnu se ukončuje léčba všemi třemi přípravky, ve 12. týdnu se ukončuje léčba PEG-IFN + RBV).
Dávkování
TPV je dostupný v tabletách obsahujících 375 mg účinné látky. Doporučené dávkování je 750 mg třikrát denně (každých 8 hodin). TPV musí být podáván současně s PEG-IFN a RBV. Celková délka této kombinované léčby je 12 týdnů. U pacientů s eRVR poté následuje 12týdenní léčba PEG-IFN a RBV. U pacientů bez eRVR následuje 36týdenní léčba kombinací PEG-IFN a RBV. U již léčených pacientů je dávkování shodné, pouze u nemocných s předchozí parciální či nulovou odpovědí je celková délka léčby vždy 48 týdnů.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00669806 – FN Plzeň.
Seznam použité literatury
- [1] EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011; 55: 245–264.
- [2] Ghany MG, Strader DB, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology 2009; 49: 1335–1374.
- [3] Ghany MG, Nelson DR, Strader DB, et al. An update on treatment of genotype 1 chronic hepatitis C virus infection: 2011 practice guideline by the American Association for the Study of Liver Diseases. Hepatology 2011; 54: 1433–1444.
- [4] Morgan TR, Ghany MG, Kim HY, et al. Outcome of sustained virological responders with histologically advanced chronic hepatitis C. Hepatology 2010; 52: 833–844.
- [5] Manns MP, McHutchison JG, Gordon SC, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358: 958–965.
- [6] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–982.
- [7] Chung RT, Andersen J, Volberding P, et al. Peginterferon Alfa-2a plus ribavirin versus interferon alfa-2a plus ribavirin for chronic hepatitis C in HIV-coinfected persons. N Engl J Med 2004; 351: 451–459.
- [8] Muir AJ, Bornstein JD, Killenberg PG. Peginterferon alfa-2b and ribavirin for the treatment of chronic hepatitis C in blacks and non-Hispanic whites. N Engl J Med 2004; 350: 2265–2271.
- [9] Veldt BJ, Heathcote EJ, Wedemeyer H, et al. Sustained virologic response and clinical outcomes in patients with chronic hepatitis C and advanced fibrosis. Ann Intern Med 2007; 147: 677–684.
- [10] Moradpour D, Penin F, Rice CM. Replication of hepatitis C virus. Nat Rev Microbiol 2007; 5: 453–463.
- [11] Kato N. Genome of human hepatitis C virus (HCV): gene organization, sequence diversity, and variation. Microb Comp Genomics 2000; 5: 129–151.
- [12] Pawlotsky JM, Chevaliez S, McHutchison JG. The hepatitis C virus life cycle as a target for new antiviral therapies. Gastroenterology 2007; 132: 1979–1998.
- [13] Sarrazin C, Kieffer TL, Bartels D, et al. Dynamic hepatitis C virus genotypic and phenotypic changes in patients treated with the protease inhibitor TPV. Gastroenterology 2007; 132: 1767–1777.
- [14] Lin K, Perni RB, Kwong AD, Lin C. VX-950, a novel hepatitis C virus (HCV) NS3-4A protease inhibitor, exhibits potent antiviral activities in HCv replicon cells. Antimicrob Agents Chemother 2006; 50: 1813–1822.
- [15] Zhou Y, Bartels DJ, Hanzelka BL, et al. Phenotypic characterization of resistant Val36 variants of hepatitis C virus NS3-4A serine protease. Antimicrob Agents Chemother 2008; 52: 110–120.
- [16] Pockros PJ. New direct-acting antivirals in the development for hepatitis C virus infection. Therap Adv Gastroenterol 2010; 3: 191–202.
- [17] Perni RB, Almquist SJ, Byrn RA, et al. Preclinical profile of VX-950, a potent, selective, and orally bioavailable inhibitor of hepatitis C virus NS3-4A serine protease. Antimicrob Agents Chemother 2006; 50: 899–909.
- [18] Vertex Pharmaceuticals Inc.,TPV (IncivekTM) US prescribing information [online]. Available from URL :http://pi.vrtx.com/files/uspi_TPV.pdf [accessed 2013 Jan 17].
- [19] European Medicines Agency. TPV (Incivo): EU summary of product characteristics [online]. Available from URL: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002313/WC500115529.pdf [accessed 2013 Jan 17].
- [20] Imhof I, Simmonds P. Genotype differences in susceptibility and resistance development of hepatitis C virus to protease inhibitors TPV (VX--950) and danoprevir (ITMN-191). Hepatology 2011; 53: 1090–1099.
- [21] Kieffer TL, Sarrazin C, Miller JS, et al. TPV and pegylated interferon-alpha-2a inhibit wild-type and resistant genotype 1 hepatitis C virus replication in patients. Hepatology 2007; 46: 631–639.
- [22] Kuntzen T, Timm J, Berical A, et al. Naturally occurring dominant resistance mutations to hepatitis C virus protease and polymerase inhibitors in treatment-naive patients. Hepatology 2008; 48: 1769–1778.
- [23] Sarrazin C, Reesink HW, Zeuzem S, et al. Retreatment with TPV/Peg-IFN/RBV after a short exposure to TPV in phase I studies: interim results from a phase IIIb rollover trial (C129) [abstract]. Hepatology 2011; 54: 377A.
- [24] Charlton M. TPV, boceprevir, cytochrome P450 and immunosuppressive agents – a potentially lethal cocktail. Hepatology 2011; 54: 3–5.
- [25] Garg V, van HR, Lee JE, et al. Effect of TPV on the pharmacokinetics of cyclosporine and tacrolimus. Hepatology 2011; 54: 20–27.
- [26] The University of Liverpool. Hepatitis drug interactions [online]. Available from URL: http://www.hep-druginteractions.org [accessed 2013 Jan 18].
- [27] Garg V, Chandorkar G, Smith F, et al. Effect of TPV on the pharmacokinetics of midazolam and digoxin [Abstract 12]. In: 6th International Workshop on Clinical Pharmacology of Hepatitis Therapy, Cambridge, MA, June 22–23, 2011.
- [28] Luo X, van Heeswijk R, Alves K, et al. The effect of TPV on pharmacokinetics of alprazolam and zolpidem in healthy volunteers [abstract]. In: 6th International Workshop on Clinical Pharmacology of Hepatitis Therapy, Cambridge, MA, June 22–23, 2011.
- [29] Williams D, Feely J. Pharmacokinetic-pharmacodynamic drug interactions with HMG-CoA reductase inhibitors. Clin Pharmacokinet 2002; 41: 343–370.
- [30] Perelson AS, Ribeiro RM. Mutagenic effects of ribavirin in vivo. J Hepatol 2005; 43: 553–555.
- [31] Garg V, van Heeswijk R, Yang Y, et al. The pharmacokinetic interaction between an oral contraceptive containing ethinyl estradiol and norethindrone and the HCV protease inhibitor TPV. J Clin Pharmacol 2012; 52: 1574–1583.
- [32] McHutchison JG, Everson GT, Gordon SC, et al. TPV with peginterferon and ribavirin for chronic HCV genotype 1 infection. N Engl J Med 2009; 360: 1827–1838.
- [33] Hezode C, Forestier N, Dusheiko G, et al. TPV and peginterferon with or without ribavirin for chronic HCV infection. N Engl J Med 2009; 360: 1839–1850.
- [34] McHutchison JG, Manns MP, Muir AJ, et al. TPV for previously treated chronic HCV infection. N Engl J Med 2010; 362: 1292–1303.
- [35] Marcellin P, Forns X, Goeser T, et al. TPV is effective given every 8 or 12 hours with ribavirin and peginterferon alfa-2a or -2b to patients with chronic hepatitis C. Gastroenterology 2011; 140: 459–468.
- [36] Jacobson IM, McHutchison JG, Dusheiko G, et al. TPV for previously untreated chronic hepatitis C virus infection. N Engl J Med 2011; 364: 2405–2416.
- [37] Sherman KE, Flamm SL, Afdhal NH, et al. Response-guided TPV combination treatment for hepatitis C virus infection. N Engl J Med 2011; 365: 1014–1024.
- [38] Zeuzem S, Andreone P, Pol S, et al. TPV for retreatment of HCV infection. N Engl J Med 2011; 364: 2417–2428.
- [39] Vertex. Antiviral Drugs Advisory Committee. 2011 April 28. Available from URL: http://www.fda.gov/downloads/AdvisoryCommittees/Commitees/MeetingMaterials/Drugs/AntiviralDrugsAdvisoryCommitee/UCM252562.pdf [Accessed 2013 Jan 16].
- [40] Sulkowski MS, Roberts S, Afdhal N, et al. Ribavirin dose modification in treatment-naive and previously treated patients who received TPV combination treatment: no impact on sustained virologic response in phase III studies. J Hepatol 2012; 56 (Suppl. 2): S459–S460.
- [41] Hezode C. Boceprevir and TPV for the treatment of chronic hepatitis C: safety management in clinical practice. Liver Int 2012; 32 (Suppl. 1): 32–38.
- [42] Hezode C, Dorival F, Zoulim T. Safety of TPV or boceprevir in combination with peginterferon alfa/ribavirin in cirrhotic non responder. First results of the French Early Acces Program (ANRS CO20-CUPIC). J Hepatol 2012; 56 (Suppl. 2): S4.
- [43] Urbanek P, Husa P, Galsky J, et al. Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV). Gastroent Hepatol 2012; 66: 214–229.
- [44] Jensen DM. A new era of hepatitis C therapy begins. N Engl J Med 2011; 364: 1272–1274.
- [45] Jensen DM, Marcellin P, Freilich B, et al. Re-treatment of patients with chronic hepatitis C who do not respond to peginterferon-alpha2b: a randomized trial. Ann Intern Med 2009; 150: 528–540.
- [46] Poynard T, Colombo M, Bruix J, et al. Peginterferon alfa-2b and ribavirin: effective in patients with hepatitis C who failed interferon alfa/ribavirin therapy. Gastroenterology 2009; 136: 1618–1628.
- [47] Ramachandran P, Fraser A, Agarwal K, et al. UK consensus guidelines for the use of the protease inhibitors boceprevir and TPV in genotype 1 chronic hepatitis C infected patients. Aliment Pharmacol Ther 2012; 35: 647–662.