Temozolomid
Perorální alkylační cytostatikum temozolomid prokazuje účinnost v léčbě maligních gliomů, meduloblastomů u dětí, mozkových metastáz maligního melanomu a bronchogenních karcinomů. Konkomitantní podání temozolomidu zvyšuje účinek radioterapie. Sdělení podává aktuální přehled o možnostech léčebného využití temozolomidu.
Farmakologická skupina
Temozolomid patří do farmakologické skupiny protinádorové léky – ostatní alkylační látky, ATC kód L01AX03. Má schopnost pronikat přes hematoencefalickou bariéru [1].
Chemické a fyzikální vlastnosti
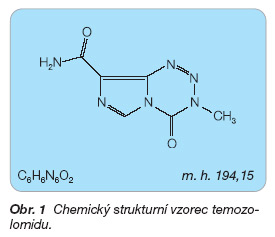
Temozolomid je chemicky 3-methyl-2-oxo-1,3,4,5,8-pentaazabicyklo[4.3.0]nona-4,6,8-trien-7-karboxamid (obr. 1).
Sumární vzorec: C6H6N6O2
Molekulová hmotnost: 194,15
Temozolomid je bílý až světle žlutohnědý nebo světle růžový prášek, těžce rozpustný ve vodě. Temozolomid je stabilní v kyselém prostředí (pH < 5). V neutrálním a alkalickém prostředí podléhá neenzymatickému rozkladu, jehož produktem je farmakologicky aktivní 5-(3-methyltriazen-1-yl)imidazol-4-karboxamid (MTIC).
Mechanismus účinku, farmakodynamika
Temozolomid při fyziologickém pH prochází rychlou chemickou konverzí na aktivní metabolit 5-(3-methyltriazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC se spontánně hydrolyzuje na 5-amino-imidazol-4-karboxamid (AIC), což je meziprodukt biosyntézy purinů a nukleových kyselin, a na methylhydrazin, o kterém se předpokládá, že je aktivní alkylační látkou. Předpokládá se, že cytotoxické účinky MTIC jsou primárně důsledkem alkylace DNA, zejména na pozici O6 guaninu. Následně vznikající cytotoxické léze jsou vysvětlovány nejspíše aberantní reparací metylovaného zbytku (deplece DNA reparačního enzymu MGMT – methyl-guanin-metyltransferázy). Tato aktivace je spontánní a nezávisí na hepatálních a renálních funkcích. Výsledná aktivita temozolomidu tak může záviset na množství aktivní MGMT a na míře inaktivace (metylace) promotorových sekvencí genu pro MGMT. Metylace DNA vede k jejímu poškození a následně k přerušení vlákna DNA; výsledkem je navození apoptózy. Zvýšená buněčná aktivita MGMT znamená snížení odpovědi buňky na temozolomid, naopak její snížená aktivita zvyšuje účinek temozolomidu [1–3]. V předklinických testech prokázal temozolomid aktivitu proti různým typům solidních i hematologických nádorů. V současné době se temozolomid používá především v kombinované léčbě primárních mozkových nádorů a metastazujícího maligního melanomu [4–8].
Farmakokinetické vlastnosti
Základní farmakokinetické parametry temozolomidu jsou přehledně shrnuty v tab. 1.
Absorpce
Po perorálním podání dospělým pacientům je temozolomid rychle absorbován a maximální koncentrace dosahuje již za 20 minut po podání (průměr 0,5–1,5 hodiny). Biologická dostupnost po perorálním podání je 100 %. Plazmatické koncentrace vzrůstají v závislosti na velikosti dávky. U dětských pacientů byla AUC větší než u dospělých; nicméně maximální tolerovaná dávka činila 1000 mg/m2 na jeden cyklus jak u dětí, tak u dospělých. Expozice MTIC a AIC je asi 2,4 %, resp. 23 % v poměru k AUC temozolomidu.
Distribuce
Výsledky studie s pozitronovou emisní tomografií u člověka i preklinické údaje prokázaly, že temozolomid rychle prostupuje hematoencefalickou bariérou a je přítomný v mozkomíšním moku. Hladina účinné látky v centrální nervové soustavě dosahuje přibližně 30–40 % plazmatické koncentrace. Plazmatická clearance, distribuční objem a poločas jsou na velikosti dávky nezávislé. Temozolomid se vyznačuje nízkou vazbou na plazmatické proteiny (10–20 %), a proto se neočekává jeho interakce s látkami, které se na plazmatické bílkoviny váží ve značné míře.
Metabolismus
Po perorálním podání se přibližně 5–10 % podané dávky vylučuje v průběhu 24 hodin v nezměněné podobě močí a zbytek se vylučuje jako kyselina temozolomidová, 5-aminoimidazol-4-karboxamid (AIC) nebo neidentifikované polarizované metabolity. V samostatné farmakokinetické studii byl farmakokinetický profil u pacientů s mírnou až středně těžkou jaterní dysfunkcí podobný jako u pacientů s normální funkcí jater.
Exkrece
Po perorálním podání temozolomidu značeného 14C činila průměrná exkrece radionuklidu ve stolici za 7 dnů po podání dávky 0,8 %, což svědčí pro kompletní absorpci [1]. Hlavní cestou pro vylučování 14C jsou ledviny. Analýza populační farmakokinetiky temozolomidu prokázala, že jeho plazmatická clearance je nezávislá na věku, renální funkci nebo konzumaci tabáku. Eliminační poločas činí přibližně 1,8 hodiny. In vivo byl biologický poločas MTIC podobný jako u temozolomidu (1,8 hod.).
Farmakokinetika u speciálních skupin pacientů
Pohlaví
Pohlaví nemá vliv na plazmatické koncentrace temozolomidu. Temozolomid může mít genotoxické účinky. Vzhledem k tomu se mužům léčeným temozolomidem nedoporučuje, aby se v průběhu léčby nebo do 6 měsíců po jejím ukončení stali otci; naopak se doporučuje, vzhledem k možnosti ireverzibilní neplodnosti po léčbě temozolomidem, ještě před jejím zahájením konzultovat s lékařem možnost kryokonzervace předem odebraných spermií.
Porucha funkce jater a ledvin
Farmakokinetika temozolomidu je u pacientů s normální jaterní funkcí a s mírnou nebo středně závažnou jaterní dysfunkcí srovnatelná. Údaje o podání temozolomidu u pacientů s těžkou jaterní dysfunkcí nebo se závažnou dysfunkcí ledvin nejsou k dispozici. Vzhledem k uvedeným farmakokinetickým vlastnostem temozolomidu je však pravděpodobné, že ani u nemocných s těžkým jaterním nebo ledvinovým selháním není snižování jeho dávek nutné. Při podávání přípravku těmto nemocným je však nutná zvýšená opatrnost.
Starší pacienti (nad 70 let věku)
Clearance temozolomidu není ovlivňována věkem. Nicméně při aplikaci přípravku u starších pacientů je namístě zvýšená opatrnost, neboť ve srovnání s mladšími osobami mají vyšší riziko vzniku neutropenie a trombocytopenie.
Aplikace u dětí
S podáváním temozolomidu dětem ve věku nižším než 3 roky nejsou dosud žádné klinické zkušenosti, u starších dětí není dosud k dispozici dostatečné množství údajů [1].
Klinické zkušenosti
Gliomy s vysokým stupněm malignity (high-grade gliomy, HGG) jsou nejčastějšími primárními mozkovými nádory u dospělých, v ČR je ročně diagnostikováno asi 500–550 pacientů. Základní léčebnou metodou je neurochirurgický výkon. Ten by měl být maximálně radikální. Radikalita a úspěšnost výkonu je rozhodujícím prognostickým faktorem. Parciální výkon má vždy horší léčebné výsledky. Histologické ověření nádoru, i při neradikálním výkonu, je pro další léčbu rozhodující. Při zjevné inoperabilitě je nutné zvážit provedení verifikační stereotaktické biopsie. Do 24 hodin po operaci je nutné provést kontrolní CT nebo MR k vyloučení rezidua, event. krvácení. Po histologické verifikaci HGG je indikována radioterapie a případně i chemoterapie [6].
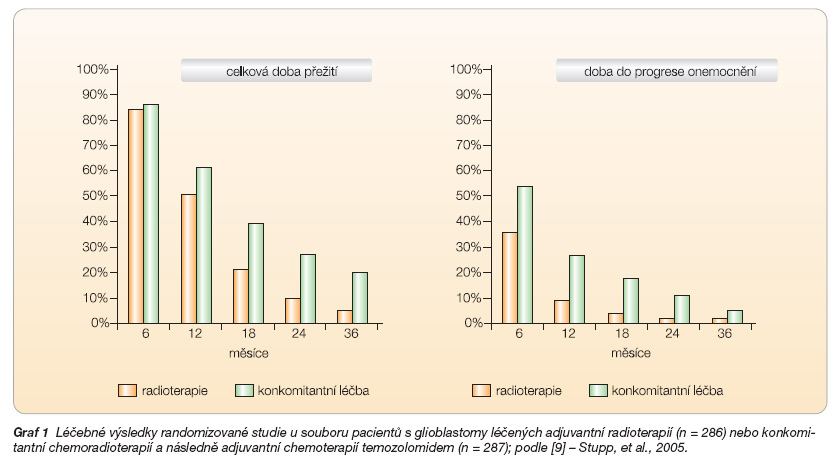
Žádná randomizovaná studie ani jejich metaanalýza dosud neprokázaly jednoznačný přínos adjuvantní chemoterapie s využitím preparátů nitrosourey (BCNU) u vysoce maligních gliomů. Randomizovanými studiemi byl ověřen efekt temozolomidu v kombinované léčbě HGG. Schéma Stuppovy studie (obr. 2) je pokládáno za standardní přístup v léčebné strategii glioblastomů a dalších HGG v naší republice.
Jedno rameno studie tvořili pacienti jen s adjuvantní radioterapií (n = 286), v druhém rameni (n = 287) byli pacienti léčeni konkomitantní chemoradioterapií (temozolomid) a po ukončení ozařování ještě adjuvantní chemoterapií temozolomidem. Dosažené léčebné výsledky studie – celková doba přežití (OS) a doba do progrese onemocnění (PFS) – jsou uvedeny v grafu 1.
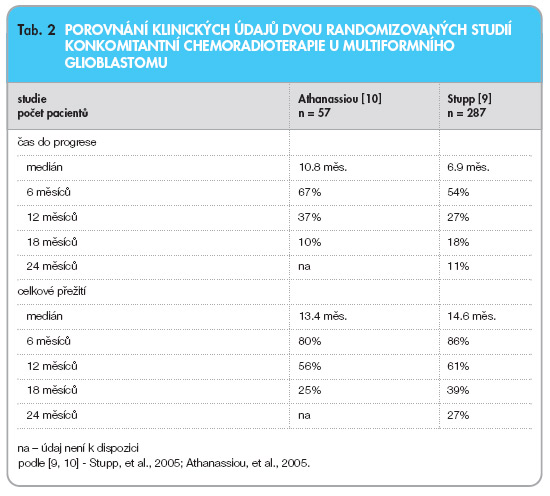
Adjuvantní léčba byla z důvodu její toxicity přerušena u 8 % pacientů [9]. Obdobné léčebné schéma s aplikací temolozomidu bylo využito v další randomizované studii, do níž byl zařazen menší počet pacientů (57 vs. 53) se stejným onemocněním [10]. Také tato studie prokázala signifikantní zlepšení léčebných výsledků ve skupině pacientů léčených konkomitantní chemoradioterapií (tab. 2).
Úloha enzymu MGMT
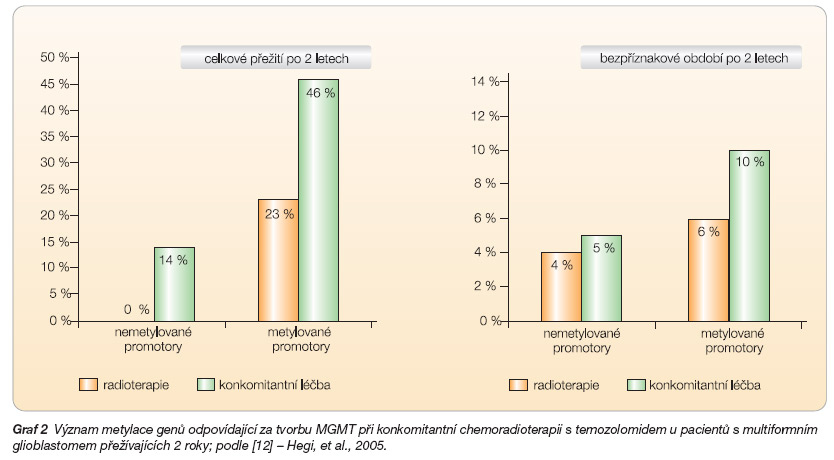
V současné době probíhají klinické studie, které stanovují prognózu a predikci léčebné odpovědi daného pacienta na základě hodnocení hladiny DNA reparačního enzymu MGMT – methyl-guanin-metyltransferázy. V normálních tkáních působí MGMT jako supresor mutací a karcinogeneze. Nádory s vysokou aktivitou MGMT jsou nádory chemorezistentní především vůči cytostatikům s alkylačním účinkem. Hladinu MGMT lze tedy považovat za prognostický indikátor, který poskytuje náhled na pravděpodobnost přežití pacienta v závislosti na daném indikátoru. Zároveň se MGMT zařazuje mezi indikátory predikce, který odhaduje pravděpodobnou odpověď pacienta na léčbu opět v závislosti na daném ukazateli [11, 12]. Metylace MGMT promotoru u gliomů s vysokým stupněm malignity je příznivým prognostickým faktorem bez ohledu na léčbu. Nádory s metylovaným MGMT promotorem odpovídají lépe jak na radioterapii samotnou, tak na kombinovanou léčbu temozolomidem + radioterapií. Aktivitu MGMT lze stanovit testem PCR (polymerázová řetězová reakce), který určuje stav metylace promotorové sekvence MGMT genu. Test není zatím komerčně dostupný a vzhledem k omezenému počtu provedených studií není dostatečně validní. Metylace MGMT promotoru by měla být v budoucích klinických studiích zvažována jako jeden ze stratifikačních parametrů, podle kterého by se určovala indikace léčby temozolomidem [13, 14]. Vliv metylace MGMT na celkové přežití (overall survival, OS) a bezpříznakové období (progression free survival, PFS) jsou zatím hodnoceny na relativně malém počtu pacientů, výsledky jsou však slibné (soubor 206 pacientů, medián OS u nemetylované skupiny byl 12,2 měsíců, u skupiny s metylací 18,2 měsíců; riziko úmrtí sníženo o 55 %). Viz graf 2 [12].
Mezi karcinomy, u kterých byla zjištěna vyšší míra metylace MGMT, patří vysoce maligní gliomy (anaplastický astrocytom, glioblastom multiformní, anaplastický oligodendrogliom), nemalobuněčné karcinomy plic (NSCLC), karcinomy tlustého střeva, lymfomy a gliomy s nízkou malignitou (oligodendrogliom, oligoastrocytom). U pacientů s uvedenými nádory lze předpokládat v klinických studiích využití temozolomidu [13–15].
V roce 2006 byla zahájena randomizovaná studie RTOG 0525/EORTC, která sleduje léčebné výsledky u pacientů s nově diagnostikovaným inoperabilním multiformním glioblastomem při aplikaci chemoradioterapie s temozolomidem. Jedním ze stratifikujících faktorů je hladina MGMT. Dvě skupiny pacientů jsou léčeny 6–12 měsíců různými schématy podání temozolomidu (200 mg/m2 den 1–5, interval 4 týdny vs. 100 mg/m2 den 1–21, interval 4 týdny). Další probíhající randomizovaná studie fáze III u pacientů s gliomy s nízkou malignitou, ale s vysokým rizikem lokálního relapsu (LGG Intergroup EORTC 22033: EORTC, NCIC, TROG) sleduje u dvou skupin pacientů efekt adjuvantní chemoterapie (temozolomid, 75 mg/m2 den 1–21, pauza 7 dnů, 6–12 měsíců) nebo adjuvantní radioterapie (28krát 1,8 Gy) [7].
Temozolomid je standardně aplikován v monoterapii. Nicméně se v poslední době v odborném tisku objevily prospektivní studie s nízkými počty pacientů, ve kterých je temozolomid aplikován v kombinaci s jinými systémovými protinádorovými léčivy. Kombinace preparátů však znamená zvýšené riziko nežádoucích účinků, především hematologických. V klinické fázi II je např. studie využívající v léčbě HGG kombinaci radioterapie, temozolomidu a irinotekanu – léčba je provázena výrazným zvýšením vedlejších účinků; zlepšení léčebných výsledků proti monoterapii s temozolomidem není popisováno [16]. Stejná kombinace cytostatik v léčbě relapsu neuroblastomu také neznamená zlepšení léčebných výsledků [17]. Také kombinace temozolomidu s interferonem b v léčbě gliomů a s thalidomidem v léčbě mozkových metastáz maligního melanomu výrazně nezlepšily léčebné výsledky [18, 19].
Zařazení do současné palety léčiv
V České republice je v současné době použití temozolomidu schváleno Českou onkologickou společností v léčbě vysoce maligních gliomů a v léčbě mozkových metastáz u maligního melanomu. Současná (konkomitantní) chemoradioterapie je indikována u pacientů s resekovaným high-grade gliomem (HGG) jako adjuvantní léčba, dále je temozolomid indikován v adjuvantním podání u inoperabilních HGG po ukončení kurativní radioterapie u pacientů v celkově únosném stavu (Karnofsky index, KI min. 70 %). V rámci klinické studie je temozolomid aplikován dětským pacientům konkomitantně s radioterapií při léčbě inoperabilních mozkových nádorů (metronomické podání 90 mg/m2 den 1–42) [20].
Po potvrzení randomizovanými klinickými studiemi lze očekávat v blízké budoucnosti využití aplikace temozolomidu v chemoradioterapii mozkových metastáz nemalobuněčných bronchogenních karcinomů a metastáz karcinomu prsu [21, 22].
Indikace
Temozolomid je určen k léčbě pacientů s nově diagnostikovaným multiformním glioblastomem v kombinaci s radioterapií a následně jako monoterapeutická léčba. Dále u pacientů s maligním gliomem, jako je multiformní glioblastom nebo anaplastický astrocytom, u nichž se po standardní léčbě projevují recidivy nebo progrese.
Systémová léčba maligních onkologických onemocnění v ČR, tedy i léčba temozolomidem, je určena standardy České onkologické společnosti (ČOS ČLS JEP: Zásady cytostatické léčby maligních onkologických onemocnění). Podle tohoto doporučení je temozolomid indikován i v paliativní léčbě mozkových metastáz maligního melanomu [4, 6].
Kontraindikace
Temozolomid je kontraindikován v léčbě pacientů s přecitlivělostí na jeho jednotlivé složky nebo na dakarbazin (DTIC) v anamnéze. Dále je kontraindikován u pacientů s těžkou myelosupresí a u žen v průběhu těhotenství a kojení [1].
Nežádoucí účinky
Primární cíle toxických účinků při studii toxicity u potkanů a psů tvořila kostní dřeň, lymfatický systém, testes, gastrointestinální ústrojí současně. Při vyšších dávkách, které byly pro 60–100 % testovaných potkanů a psů letální, docházelo i k degeneraci retiny. Většina toxických účinků byla reverzibilní, s výjimkou nežádoucích účinků na mužský reprodukční systém a degeneraci retiny. Vzhledem k tomu, že dávky podmiňující retinální degeneraci se pohybovaly v rozmezí dávek letálních a v klinických studiích nebyl žádný srovnatelný účinek pozorován, nepřikládá se tomuto nálezu klinická významnost.
Temozolomid je embryotoxická, teratogenní a genotoxická alkylační látka. Jeho toxické účinky jsou vyšší u potkanů a psů než u člověka a klinická dávka u člověka se blíží minimální letální dávce u potkanů a psů. Za citlivé ukazatele toxicity se považují poklesy počtu leukocytů a trombocytů v závislosti na velikosti dávky. Ve studii u potkanů, v níž bylo aplikováno šest cyklů terapie, bylo zjištěno několik druhů novotvarů, včetně karcinomu mléčné žlázy, kožního keratoakantomu a adenomu bazálních buněk, zatímco ve studiích u psů žádné nádorové ani prenádorové změny pozorovány nebyly. Výsledky aberačních testů s chromozomy Ames/salmonella a lymfocytů z lidské periferní krve prokázaly pozitivní mutagenní reakci.
U pacientů, kterým byl adjuvantně podáván temozolomid celkem 42 dní současně (konkomitantně) s radioterapií, bylo v pilotní studii zjištěno zvýšené riziko vzniku pneumonie způsobené Pneumocystis carinii. Proto je nutná profylaxe pneumonie způsobené Pneumocystis carinii u všech pacientů, kteří jsou léčeni konkomitantní chemoradioterapií po dobu 42denního režimu (maximálně 49 dnů) bez ohledu na počet lymfocytů. Jestliže se objeví lymfopenie, je třeba pokračovat v profylaxi, dokud se neobnoví stupeň lymfopenie ≤ ≤1.
V kombinaci s jinými myelosupresivními látkami může temozolomid zvýšit pravděpodobnost myelosuprese. Všichni pacienti, kteří dostávají temozolomid, zvláště pacienti současně dostávající steroidy, by měli být pečlivě sledováni pro riziko vzniku pneumocystické pneumonie.
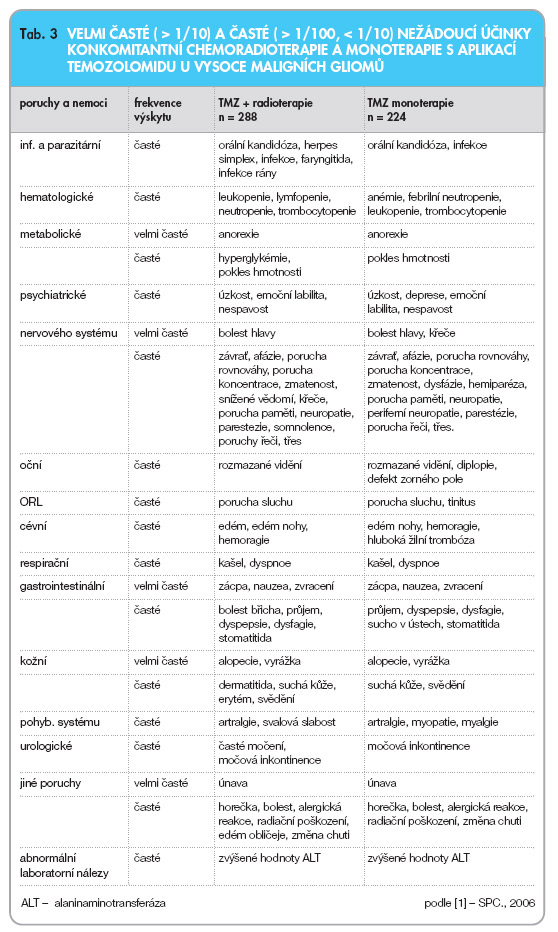
Protinádorová léčiva, zvláště pak alkylační látky, jsou spojeny s potenciálním rizikem myelodysplastického syndromu (MDS) a sekundárních malignit, včetně leukémie. U pacientů léčených temozolomidem byly hlášeny velmi vzácné případy MDS a sekundárních malignit včetně myeloidní leukémie. Velmi vzácně byla hlášena dlouhotrvající pancytopenie, která může vést k aplastické anémii. Další nežádoucí účinky jsou uvedeny v tab. 3 [1].
Schopnost řízení motorových vozidel a obsluhy strojů může být u pacientů užívajících temozolomid v důsledku únavy a ospalosti snížena [1].
Předávkování
Klinicky byly u pacientů ověřeny dávky 500, 750, 1 000, a 1250 mg/m2 (celková dávka podaná při 5denním cyklu). Toxicita limitující dávku podaného léčiva byla hematologická toxicita. U jednoho pacienta došlo k předávkování, když užil dávku 10 000 mg (celková dávka během jednoho 5denního cyklu), nežádoucí příhody hlášené v tomto případě byly pancytopenie, pyrexie, multiorgánové selhání a smrt. Byly popsány případy, kdy pacienti doporučenou dávku užívali po dobu delší než 5 dnů (až 64 dnů) s hlášenými nežádoucími příhodami včetně suprese kostní dřeně s rozvojem nebo bez rozvoje infekce, v některých případech závažné, dlouhotrvající a vedoucí ke smrti. V případě předávkování je nezbytné hematologické zhodnocení a měla by být zajištěna podpůrná léčba [1].
Lékové a jiné interakce
Podávání temozolomidu společně s potravou vedlo k poklesu cmax o 33 % a ke zmenšení plochy pod křivkou plazmatické koncentrace (AUC) o 9 %. Protože nelze vyloučit, že změna cmax může být klinicky významná, neměl by se temozolomid podávat současně s jídlem.
Podávání temozolomidu spolu s ranitidinem nemělo za následek žádné změny rozsahu absorpce temozolomidu nebo expozice MTIC.
Výsledky analýzy farmakokinetiky u pacientů zařazených do II. fáze klinických studií prokazují, že clearance temozolomidu nebyla ovlivněna současným podáním dexametazonu, prochlorperazinu, fenytoinu, karbamazepinu, ondansetronu, antagonistů receptorů H2 nebo fenobarbitalu. Současné podávání kyseliny valproové bylo spojeno s malým, nicméně statisticky významným poklesem clearance temozolomidu.
Dosud nebyly provedeny žádné studie, které by hodnotily účinek temozolomidu na metabolismus nebo eliminaci jiných léčiv. Vzhledem k tomu, že temozolomid neprochází enzymatickou přeměnou v játrech a na plazmatické bílkoviny se váže jen v malé míře, je málo pravděpodobné, že by ovlivňoval farmakokinetiku jiných léčiv [1].
Těhotenství a kojení
Nejsou k dispozici dostatečné údaje o použití temozolomidu u těhotných žen. Studie na zvířatech prokázaly teratogenní a/nebo toxické účinky na plod. Z tohoto důvodu nesmí být temozolomid za normálních okolností těhotným ženám podáván. Pokud se přece jen zvažuje nutnost podat přípravek ženě v průběhu těhotenství, je třeba pacientku seznámit s potenciálním rizikem pro plod. Ženám ve fertilním věku je nutno v průběhu užívání temozolomidu doporučit, aby se vyhnuly otěhotnění. Zatím není známo, zda se temozolomid vylučuje do mateřského mléka; proto kojícím ženám nesmí být temozolomid podáván [1].
Dávkování
Temozolomid smí být předepisován výhradně lékařem se zkušenostmi s onkologickou léčbou mozkových nádorů a s podáváním cytostatik. Přípravek by měl být podáván nalačno a polykán vcelku. Před podáním nebo po podání přípravku mohou být podávána antiemetika. Pokud se po podání dávky temozolomidu dostaví zvracení, neměla by být další dávka podána tentýž den. Objeví-li se hematologická či nehematologická toxicita, je aplikace chemoterapie přerušena nebo ukončena [1].
Vysoce maligní gliomy
Adjuvantní chemoradioterapie
Pooperační chemoradioterapie po neurochirurgickém odstranění vysoce maligních (high-grade) gliomů prokázala v řadě studií výrazný přínos v celkovém přežití. U pacientů v dobrém celkovém stavu (KI ≥ 70 %) po radikální nebo neradikální operaci lze zvážit indikaci konkomitantní chemoradioterapie s temozolomidem: temozolomid 75 mg/m2, den 1–42, p.o., po celou dobu radioterapie (i přes víkendy). V případě konkomitantní chemoradioterapie je ozařování provedeno standardní frakcionací (5 x 2,0 Gy/týden, celková dávka 60 Gy) [4, 6].
Adjuvantní chemoterapie
Zajišťovací léčba temozolomidem v monoterapii je indikována po ukončení konkomitantní chemoradioterapie (ve 4. týdnu po ukončení ozařování): temozolomid 150–200 mg/m2, p.o., den 1–5, interval 28 dní, celkem 4–6 cyklů nebo do progrese onemocnění (nižší dávkování se volí u pacientů po aplikaci konkomitantní chemoradioterapie). Dále je adjuvantní podání přípravku zvažováno po ukončení kurativní radioterapie v léčbě pacientů s verifikovaným inoperabilním vysoce maligním gliomem [4, 6].
Kurativní chemoradioterapie
U biopticky verifikovaného inoperabilního maligního gliomu 3.–4. stupně u pacientů ve výborném stavu lze zvážit aplikaci konkomitantní chemoradioterapie: ozáření na oblast tumoru v dávce 60 Gy (5 x 2,0 Gy/týden) s aplikací temozolomidu (zatím není považováno za standardní přístup) v dávce 75 mg/m2, den 1–42, p.o. V těchto případech je standardním postupem provedení kurativní radioterapie a po jejím ukončení je eventuálně provedena adjuvantní aplikace temozolomidu v dávce 200 mg/m2, p.o., den 1–5, interval 28 dní, celkem 4–6 cyklů nebo do progrese onemocnění [4, 6].
Paliativní chemoterapie
U pacientů v celkově dobrém stavu (KI ≥ 60 %) s lokální recidivou po předchozí komplexní onkologické léčbě (operace, chemoradioterapie) lze zvážit záchrannou (salvage) léčbu recidiv: temozolomid 150–200 mg/m2, p.o., den 1–5, interval 28 dní, celkem 4–6 cyklů nebo do progrese onemocnění (nižší dávkování se volí u pacientů po aplikaci konkomitantní chemoradioterapie) [4, 6].
Jiné nádory
Maligní melanom
Použití temozolomidu je podle standardů České onkologické společnosti (ČOS ČLS JEP: Zásady cytostatické léčby maligních onkologických onemocnění) schváleno pro paliativní strategii v léčbě mozkových metastáz. Dávkování je obdobné jako v případě maligních gliomů [4].
Balení
Viz tab. 4.
Tvrdé tobolky mají neprůsvitné bílé tělo, neprůsvitné žluté víčko a jsou potištěny černým inkoustem. Tento léčivý přípravek obsahuje laktózu; pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, Lappovým deficitem laktázy nebo glukózo-galaktózovou malabsorpcí by proto neměli tento přípravek užívat [1].
Seznam použité literatury
- [1] Souhrn údajů o přípravku. www.schering-plough.cz, 2006.
- [2] Tolcher AW, Gerson SL, Wedge SR, et al. Marked inactivation of O6-alkylquanine-DNA alkyltrans-ferase activity with protracted temozolomide schedules. Br J Cancer 2003; 88: 1004–1011.
- [3] Gerson SL. MGMT: Its role in cancer aetiology and cancer therapeutics. Nat Rev Cancer 2004; 4: 296–307.
- [4] Česká onkologická společnost ČLS JEP: Zásady cytostatické léčby maligních onkologických onemocnění. Praha, 2006.
- [5] Šlampa P, Soumarová R, Kocáková I, et al. Konkomitantní chemoradioterapie solidních nádorů. Praha, Galén 2005; 149–153.
- [6] Šlampa P, et al. Radiační onkologie v praxi. Druhé aktualizované vydání. MOÚ 2007; 171–191.
- [7] Brandes AA. When to treat ? Perspectives in central nervous system malignancies. Presentation Summaries. Praha 2005; 31–38.
- [8] Norden AD, Wen PY. Glioma therapy in adults. Neurologist 2006; 6: 279–292.
- [9] Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 10: 987–996.
- [10] Athanassiou H, Synodinou M, Maragoudakis E, et al. Randomized phase II study of temozolomide and radiotherapy compared with radiothe rapy alone in newly dignosed glioblastoma multiforme. J Clin Oncol 2005; 10: 2372–2377.
- [11] Hegi ME, Diserens AC, Godard S, et al. Clinical trial substantiates the predictive value of O-6-methylguanune-DNA methyltransferase promoter methylation in glioblastomapatients treated with temozolomide. Clin Cancer Res 2004; 10: 1871–1874.
- [12] Hegi ME, Diserens AC, Gorlia, et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med 2005; 10: 997–1003.
- [13] Briegert M, Kaina B. Human monocytes, but not dendritic cells derived from them, are defective in base excision repair and hypersensitive to methylating agents. Cancer Res 2007; 1: 26–31.
- [14] Alvino E, Castiglia D, Caporali S, et al. A single cycle of treatment with temozolomide, alone or combined with O(6)-benzylguanine, induces strong chemoresistance in melanoma cell clones in vitro: role of O(6)-methylguanine-DNA methyl-transferase and the mismatch repair systém. Int J Oncol 2006; 4: 785–797.
- [15] Brandes AA, Tosoni A, Cavallo G, et al. Correlation between O6-methylguanine DNA methyltransferase promoter methylation status, 1p and 19q deletions, and response to temozolomide in anaplastic and reccurent oligodendroglioma: a prospective GICNO study. J Clin Oncol 2006; 29: 4746–4753.
- [16] Fountzilas G, Karkavelas G, Kalogera-Fountzila A, et al. Post-operative combined radiation and chemotherapy with temozolomide and irinotecan in patients with high-grade astrocytic tumors. A phase II study with biomarker evalution. Anticancer Res 2006; 6C: 4675–4686.
- [17] Kushner BH, Kramer K, Modak S, et al. Irinotecan plus temozolomide for relapsed or refractory neuroblastoma. J Clin Oncol 2006; 33: 5271–5276.
- [18] Park JA, Joe YA, Kim TG, et al. Potentiation of antiglioma effect with combined temozolomide and interferon-beta. Oncol Rep 2006; 6: 1253–1260.
- [19] Krown SE, Niedzwiecki D, Hwu WJ, et al. Phase II study of temozolomide and thalidomide in patients with metastatic melanoma in the brain: high rate of thromboembolic events. Cancer 2006; 15: 1883–1890.
- [20] Štěrba J, Pavelka Z, Šlampa P. Concomitant radio-therapy and metronomic temozolomide in pediatric high-risk brain tumors. Neoplasma 2002; 2: 117–120.
- [21] Rivera E, Meyers C, Groves M, et al. Phase I study of capecitabine in combination with temzolomide in the treatment of patients with brain metastases from breast carcinoma. Cancer 2006; 15: 1348–1354.
- [22] Cortot AB, Gerinieri L, Robinet G, et al. Phase II trial of temzolomide and cisplatin followed by whole brain radiotherapy in NSCLC patients with brain metastases: a GLOT-GFPC study. Ann Oncol 2006; 9: 1412–1417.